专题1《有机化学的发展及研究思路》单元检测题(含解析) 2023-2024学年高二下学期化学苏科版(2019)选择性必修3
文档属性
| 名称 | 专题1《有机化学的发展及研究思路》单元检测题(含解析) 2023-2024学年高二下学期化学苏科版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 309.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-06 13:34:28 | ||
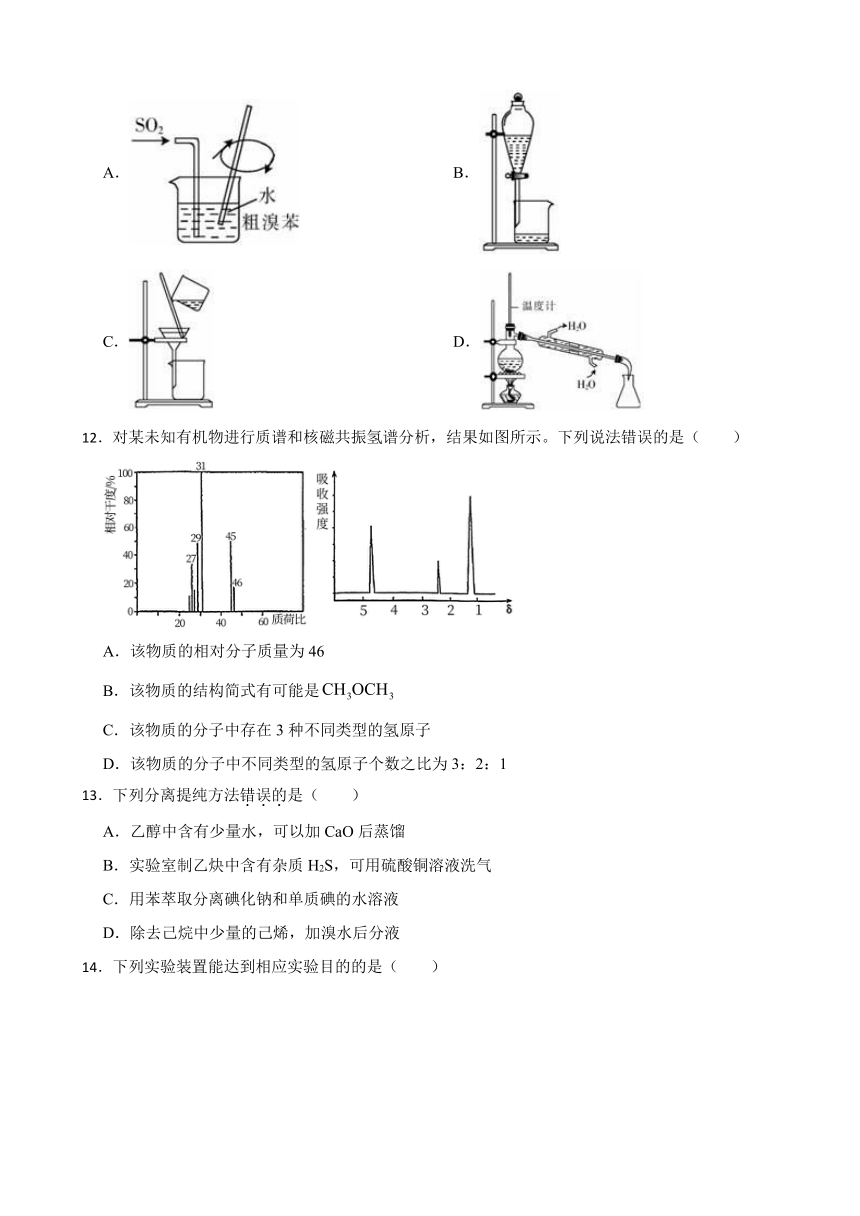
图片预览



文档简介
专题1《有机化学的发展及研究思路》单元检测题
一、单选题
1.科学家用毕生的研究不断更新着我们对科学世界的认识。下列关于科学家成就的描述与当时不相符合的是( )
A.1869年俄国化学家门捷列夫将元素按照核电荷数由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表
B.荷兰物理学家范德华首先研究出了分子间作用力,因此这种力也称为范德华力
C.1825年英国科学家法拉第首先发现了苯
D.1866年德国化学家凯库勒提出苯分子是一个由6个碳原子以单、双键相互交替结合而成的环状链式结构
2.对元素周期表和元素周期律的发现有突出贡献的科学家是( )
A.拉瓦锡 B.门捷列夫 C.阿伏加德罗 D.道尔顿
3.下列分离物质的方法中,利用了物质的沸点的是( )
A.蒸馏 B.过滤 C.重结晶 D.凝固
4.下列“假说“在化学科学发展过程中曾经起到一定的作用,至今仍公认为化学原理的是( )
A.1803 年道尔顿提出的“元素的原子以其原子质量为特征”
B.1808 年盖 吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子”
C.1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“
D.1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子”
5.在物质结构研究的历史上,首先提出原子内有原子核的科学家是( )
A. B.
C. D.
6.下列有关实验操作、原理和装置不能达到实验目的的是( )
A.用装置甲除去食盐水中的泥沙
B.用装置乙灼烧海带
C.用装置丙分离酒精和水的混合物
D.用装置丁制取少量蒸馏水
7.在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色 B.整溶液变为棕黄色
C.上层为无色下层为紫红色 D.下层无色上层紫红色
8.萃取溴水中的溴单质,能用作萃取剂的是( )
A.氢氧化钠溶液 B.酒精
C.四氯化碳 D.乙酸
9.卢瑟福的α粒子散射实验的现象不能说明( )
A.原子中原子核占的体积很小
B.原子是可以再分的
C.原子中存在着带正电荷的核
D.核外电子象行星一样围绕原子核运动
10.下列物质性质与应用对应关系正确的是( )
A.氯化镁属于电解质,工业上可用电解其溶液的方法制镁
B.钠钾合金的硬度小,可用作快中子反应堆的热交换剂
C.Fe2O3是红棕色固体,可以制成红色的油漆、涂料
D.溴单质在CCl4中的溶解度大,可用CCl4萃取Br﹣
11.对实验室制得的粗溴苯[含溴苯(不溶于水,易溶于有机溶剂,沸点156.2℃)、Br2和苯(沸点80℃)]进行纯化,未涉及的装置是( )
A. B.
C. D.
12.对某未知有机物进行质谱和核磁共振氢谱分析,结果如图所示。下列说法错误的是( )
A.该物质的相对分子质量为46
B.该物质的结构简式有可能是
C.该物质的分子中存在3种不同类型的氢原子
D.该物质的分子中不同类型的氢原子个数之比为3:2:1
13.下列分离提纯方法错误的是( )
A.乙醇中含有少量水,可以加CaO后蒸馏
B.实验室制乙炔中含有杂质H2S,可用硫酸铜溶液洗气
C.用苯萃取分离碘化钠和单质碘的水溶液
D.除去己烷中少量的己烯,加溴水后分液
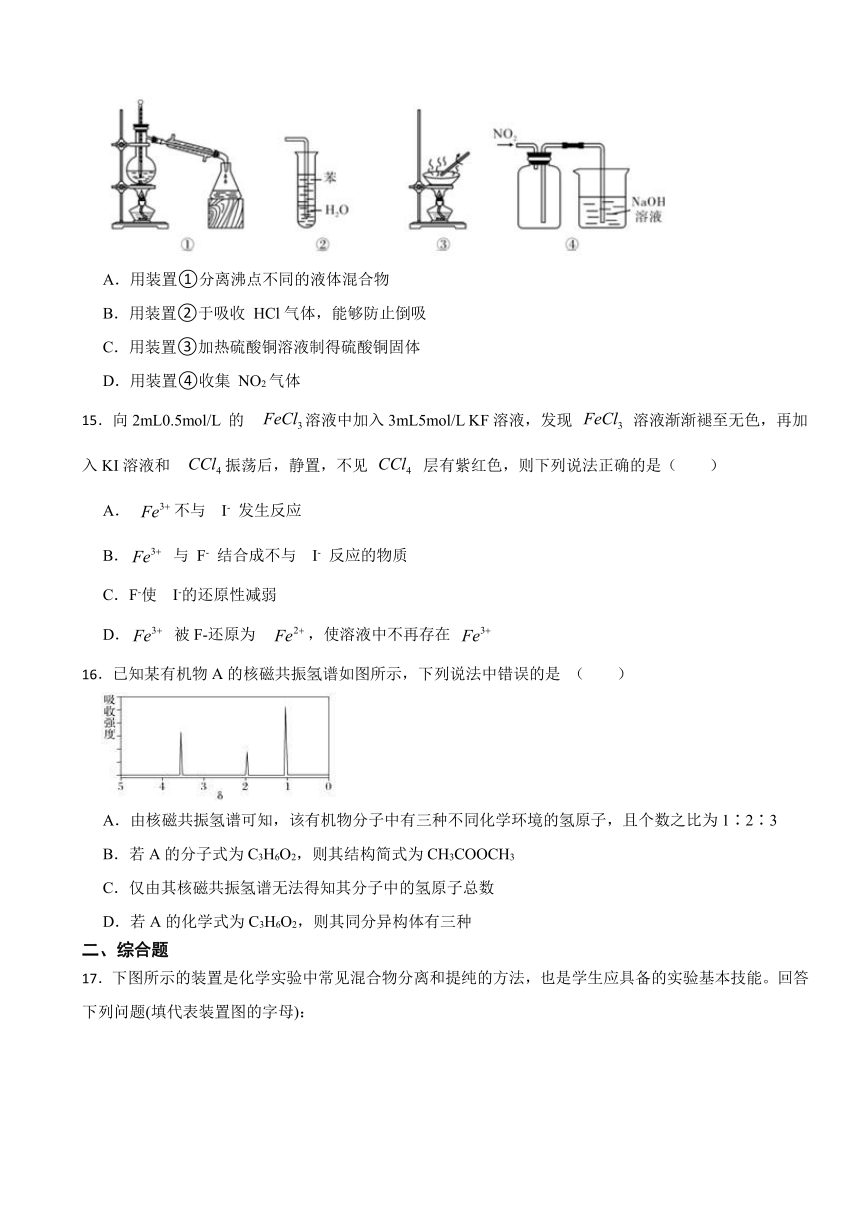
14.下列实验装置能达到相应实验目的的是( )
A.用装置①分离沸点不同的液体混合物
B.用装置②于吸收 HCl气体,能够防止倒吸
C.用装置③加热硫酸铜溶液制得硫酸铜固体
D.用装置④收集 NO2气体
15.向2mL0.5mol/L 的 溶液中加入3mL5mol/L KF溶液,发现 溶液渐渐褪至无色,再加入KI溶液和 振荡后,静置,不见 层有紫红色,则下列说法正确的是( )
A. 不与 I- 发生反应
B. 与 F- 结合成不与 I- 反应的物质
C.F-使 I-的还原性减弱
D. 被F-还原为 ,使溶液中不再存在
16.已知某有机物A的核磁共振氢谱如图所示,下列说法中错误的是 ( )
A.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1∶2∶3
B.若A的分子式为C3H6O2,则其结构简式为CH3COOCH3
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C3H6O2,则其同分异构体有三种
二、综合题
17.下图所示的装置是化学实验中常见混合物分离和提纯的方法,也是学生应具备的实验基本技能。回答下列问题(填代表装置图的字母):
(1)从氯化钾溶液中得到氯化钾固体,选择 装置。
(2)氯化钠固体中混有碘,选择 装置。
(3)河水样品中加了少量明矾,选择 装置。
(4)除去自来水中的 、 杂质离子,选择 装置。
(5)装置E在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是 。
18.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.过滤 B.蒸馏 C.结晶 D.分液 E.萃取
(1) 从溴的四氯化碳溶液中提取溴单质。
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(3) 分离花生油和水的混合液。
(4) 用乙醚提取青蒿中的青蒿素。
19.有机物M只含C、H、O三种元素。取13.6g M在足量氧气中燃烧,生成35.2g CO2和7.2g H2O。在相同条件下,M的蒸气对氢气的相对密度为68。
(1)通过计算确定M的分子式。(要求:写出解题过程)。
(2)经测定:M的红外光谱和核磁共振氢谱分别如下图所示,则M的结构简式为 。
20.混合物分离的方法在生产、生活和科学实验中有着广泛的应用,请指出下列做法中分别应用了哪些分离方法。
(1)除去豆浆中的颗粒物杂质
(2)用海水晒盐
(3)除去豆油中的水
(4)从碘水中提取碘
21.化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合下来实验常用到的仪器回答问题:
(1)填写以下仪器的名称:B D E G
(2)(2)用四氯化碳提取出溴水中Br2单子的方法叫做: ,将Br2的四氯化碳溶液和水分离开的操作叫做: ,下列是进行该操作的步骤,正确的是顺序是: .
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层;
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
(3)已知Br2的沸点是58.5℃,四氯化碳沸点是78℃.将Br2的四氯化碳溶液分离开的方法是 .需要用到的玻璃仪器有(填字母)
答案解析部分
1.【答案】A
【解析】【解答】A.1869年俄国化学家门捷列夫将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表,故A符合题意;
B.荷兰物理学家范德华首先研究出了分子间作用力,因此这种力也称为范德华力,故B不符合题意;
C.1825年英国科学家法拉第首先发现了苯,故C不符合题意;
D.1866年德国化学家凯库勒提出苯分子是一个由6个碳原子以单、双键相互交替结合而成的环状链式结构,故D不符合题意;
故答案为:A。
【分析】元素周期表是由门捷列夫按照相对原子质量的大小依次进行排列的不是按照质子数进行排列的。其它均正确
2.【答案】B
【解析】【解答】A.拉瓦锡用定量化学实验阐述了燃烧的氧化学说,确定了空气的组成,A不符合题意;
B.俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循,B符合题意;
C.意大利科学家阿伏加德罗提出分子概念,C不符合题意;
D.英国化学家道尔顿提出近代原子学说,D不符合题意,
故答案为:B.
【分析】门捷列夫发现元素周期律并制作了元素周期表.
3.【答案】A
【解析】【解答】A. 蒸馏是根据混合物各组分的沸点不同来分离互溶的液体的,A符合题意;
B. 过滤是利用溶解性不同来分离不溶于液体的固体的,B不符合题意;
C. 重结晶是利用物质溶解度随温度的变化来进行分离提纯的,C不符合题意;
D. 凝固是利用物质熔点或溶解度来进行的分离提纯,D不符合题意;
故答案为:A。
【分析】A.蒸馏是用来分离沸点不同的液体混合物的操作;
B.根据过滤是利用溶质的粒子大小大于滤纸的缝隙,而溶剂的粒子大小小于滤纸的缝隙;
C.重结晶法是利用溶解度不同进行分离混合物中各组分;
D.根据凝固的原理进行解答.
4.【答案】D
【解析】【解答】A.因质子数决定元素的种类,则每一元素的原子以质子数为特征,则道尔顿提出的“以其原子质量为其特征”不科学,故A错误;
B.在同温同压下,相同体积的不同气体含有相同数目的分子,相同的分子数不一定具有相同的原子数,如氧气和臭氧等,则盖 吕萨克提出的理论不科学,故B错误;
C.因原子不带电,带相反电荷的离子可构成化合物,则贝采里乌斯提出的理论不科学,故C错误;
D.阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子”与电解质的电离是相同的,即该理论科学,故D正确.
故选D.
【分析】A.根据原子的构成可知,质子数决定元素的种类;
B.在同温同压下,相同体积的不同气体含有相同数目的分子;
C.根据原子不带电,离子化合物是由离子构成的来分析;
D.根据电解质的电离来分析.
5.【答案】C
【解析】【解答】A.汤姆生最早提出了电子学说,A不符合题意;
B.道尔顿最早提出了原子学说,B不符合题意;
C.卢瑟福最早提出了原子核式结构模型 ,C符合题意;
D.波尔用量子观点解释了氢原子光谱,D不符合题意;
故答案为:C。
【分析】A.汤姆生发现了电子;
B.道尔顿最早提出了原子学说;
C.卢瑟福做了α射线轰击金箔的实验;
D.波尔用量子观点解释了氢原子光谱。
6.【答案】C
【解析】【解答】A.过滤分离固液的操作,用装置甲能除去食盐水中的泥沙,故A不符合题意;
B.灼烧海带使用酒精灯、坩埚、三脚架、泥三角,故B不符合题意;
C.酒精和水互溶,不能分液分离,故C符合题意;
D.可以使用蒸馏的方法制取蒸馏水,故D不符合题意;
故答案为:C。
【分析】A.过滤用于分离液体和固体混合物;
B.灼烧在坩埚中进行,同时还需要使用三脚架、泥三角和酒精灯;
C.酒精和水互溶,不能通过分液进行分离;
D.可采用蒸馏的方式制取蒸馏水。
7.【答案】C
【解析】【解答】解:碘易溶于CCl4,溶液呈紫红色,由于CCl4密度比水大,则层为无色下层为紫红色,
故选C.
【分析】碘易溶于CCl4,溶液呈紫红色,密度比水大.
8.【答案】C
【解析】【解答】A. 氢氧化钠溶液与溴单质会发生反应,且氢氧化钠溶液与原溶剂水互溶,故不能萃取,故A不符合;
B. 酒精与水互溶,故不能萃取,故B不符合;
C. 四氯化碳与水不互溶,不与溴单质反应,且溴单质在四氯化碳中的溶解度大于在水中的溶解度,故可以用四氯化碳萃取溴水中的溴单质,故C符合;
D. 乙酸与水互溶,故不能萃取,故D不符合;
【分析】利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来的方法叫做萃取。萃取的要求:①萃取剂和原溶剂互不相溶;②萃取剂和溶质互不发生反应;③溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度;据此分析解答。
9.【答案】D
【解析】【分析】答案:D
卢瑟福的α粒子散射实验的现象说明:
1、核很小,“α粒子”能与核相互作用的机会很少,所以运动方向不变。
2、少数α粒子,靠近核,与核“相斥”(都带正电),改变运动方向。
3、极少数α粒子,有“碰到”核的机会,所以,会被弹回来。
D选项错误。
10.【答案】C
【解析】【解答】解:A、镁是活泼金属,工业是采用电解熔融氯化镁的方法冶炼,故A错误;
B、钠钾合金熔点低,通常状况下呈液态,可作原子反应堆的导热剂,与硬度无关,故B错误;
C、Fe2O3是红棕色固体,可以制成红色的油漆、涂料,故C正确;
D、溴易溶于四氯化碳,可用萃取的方法分离溴水中的溴单质,不是溴离子,故D错误,故选C.
【分析】A、活泼金属采用电解其熔融盐的方法冶炼;
B、根据钠钾合金熔点低,可作原子反应堆的导热剂回答;
C、氧化铁为红棕色固体,氧化铁矿俗称赤铁矿;
D、溴易溶于四氯化碳,可用萃取的方法分离.
11.【答案】C
【解析】【解答】A.除去Br2可以用SO2,原理是:Br2+ SO2+2H2O = H2SO4+2HBr,故A符合题意;
B.苯和溴苯的混合液与无机溶液互不相溶,分液可得苯和溴苯的混合液,故B符合题意;
C.由分析可知,不涉及到过滤操作,故C不符合题意;
D. 溴苯的沸点是156.2℃、苯的沸点是80℃,分离出溴苯用蒸馏,故D符合题意;
故答案为:C。
【分析】思路:除溴(利用SO2的还原性)à分离出苯和溴苯的混合液(分液)à分离出溴苯(蒸馏)。
12.【答案】B
【解析】【解答】A.由图1可知,最大质荷比是46,该物质的相对分子质量为46,A不符合题意;
B.结合相对分子质量和3种不同环境的H原子可知,该物质的结构简式有可能是,B符合题意;
C.由2图含有3组峰可知,该物质的分子中存在3种不同类型的氢原子,C不符合题意;
D.根据图2的峰面积之比可知,该物质的分子中不同类型的氢原子个数之比为3:2:1,D不符合题意;
故答案为:B。
【分析】由质荷比可知其相对分子质量,再由吸收峰的个数可得氢原子的种类数目,由吸收峰的面积比可知氢原子的个数比进而分析解答。
13.【答案】D
【解析】【解答】A.CaO与水反应生成氢氧化钙,可增大与乙醇的沸点差异,然后蒸馏分离,故A不符合题意;
B.H2S与硫酸铜溶液反应生成CuS沉淀和硫酸,所以可用硫酸铜溶液洗气除杂,故B不符合题意;
C.碘不易溶于水、易溶于苯,可用苯萃取分离碘化钠和单质碘的水溶液,故C不符合题意;
D.己烯与溴水发生加成反应的生成物易溶于己烷,会引入新杂质,不能除杂,应蒸馏分离,故D符合题意;
故答案为:D。
【分析】A.加入CaO可增大与乙醇的沸点差异;
B.H2S与硫酸铜溶液反应生成CuS沉淀和硫酸;
C.碘在有机溶剂中的溶解度大于在水中的溶解度。
14.【答案】C
【解析】【解答】A.用装置①分离沸点不同的液体混合物时,温度计的水银球部位要与蒸馏烧瓶的支管口保持水平,测量蒸气温度,A不符合题意;
B.装置②中导管口直接伸入水中,会引起倒吸,B不符合题意;
C.硫酸铜溶液通过蒸发结晶可得硫酸铜固体,C符合题意;
D.NO2的密度比空气大,应该用向上排空气法收集,D不符合题意。
故答案为:C。
【分析】A.温度计位置不对
B.氯化氢易溶于水,应该用倒置的漏斗进行防止倒吸
C.硫酸是难挥发性酸,故可以通过加热制取硫酸铜固体
D.短管和长管位置弄反
15.【答案】D
【解析】【解答】 与 F- 易形成络合物.
【分析】本题考查氧化还原反应的应用、分液和萃取的操作等,题目难度不大,熟练掌握化学物质的性质是解题的关键 。
16.【答案】B
【解析】【解答】A.由核磁共振氢谱中含有三组峰可知,该有机物分子中含有三种不同化学环境的氢原子;图示中峰的面积比为1:2:3,故该有机物中不同化学环境的氢原子的个数比为1:2:3,A不符合题意;
B.该结构简式CH3COOCH3中,由对称性可知,其中含有两种不同化学环境的氢原子,且其个数比为1:1,B符合题意;
C.核磁共振氢谱中峰面积比等于请原子个数比,无法得出有机物中含有多少个氢原子,故仅由核磁共振氢谱无法确定有机物分子中氢原子的总数,C不符合题意;
D.符合A的条件的同分异构体的结构简式为:CH3CH2COOH、CH3CH2OCOH、CH3COCH2OH,D不符合题意;
故答案为:B
【分析】此题是对核磁共振氢谱的考查,由核磁共振氢谱可确定有机物中不同环境的氢原子的种类同时,核磁共振氢谱峰面积比即为氢原子个数比。据此结合选项进行分析。
17.【答案】(1)B
(2)F
(3)C
(4)A
(5)打开分液漏斗上端的玻璃塞
【解析】【解答】(1)从氯化钾溶液中得到氯化钾固体,只需把溶剂蒸发出去就行,选蒸发装置,答案为B;
(2)氯化钠固体中混有碘,因为碘易升华,采用加热使碘升华后再凝华,进行分离,答案为F;
(3)河水样品中加了少量明矾,因为明矾能水解生成氢氧化铝胶体,能净化河水中的杂质,形成聚沉,所以,用过滤装置进行分离,答案为C;
(4)除去自来水中的 、 杂质离子,通过蒸馏得到蒸馏水,而除去 、 杂质离子,答案为A;
(5)装置E是分液漏斗,若不把上口打开,漏斗中液体无法顺利滴下,在分液时为使液体顺利滴下,除打开活塞外,还必须打开分液漏斗上口的玻璃塞,答案为打开分液漏斗上口的玻璃塞。
【分析】(1) KCl为可溶性固体;
(2)加热碘升华,氯化钠不变;
(3)明矾能水解生成氢氧化铝胶体,能净化河水中的杂质,聚沉后过滤可分离;
(4)自来水中水的沸点较低,可蒸馏分离;
(5)打开分液漏斗的上口的塞子及活塞,可平衡气压。
18.【答案】(1)B
(2)C
(3)D
(4)E
【解析】【解答】(1)溴与四氯化碳互溶,但沸点不同,可蒸馏分离,故答案为:B;
(2)二者溶解度受温度影响不同,降温结晶可以获取纯净的硝酸钾,故答案为:C;
(3)花生油和水不互溶,会分层,可分液分离,故答案为:D;
(4)青蒿素更易溶于乙醚,乙醚可萃取青蒿素,为萃取法分离,故答案为:E。
【分析】A、过滤用于分离固液混合物;B、蒸馏是用于分离互溶但沸点不同的液体;C、结晶是从溶液中获得可溶性溶质的操作;D、分液是用于分离不互溶的两种液体;E、萃取是利用溶质在不同溶剂中的溶解度差异进行分离的操作。
19.【答案】(1)解:由M的蒸气对氢气的相对密度为68可知M的相对分子质量为:2×68=136,13.6g M的物质的量为n(M)= =0.1mol,由原子个数守恒可知,n(C)=n(CO2)= =0.8mol,n(H)=2n(H2O)=2× =0.8mol,则n(O)= =0.2mol,由n(M):n(C):n(H):n(O)=0.1mol:0.8mol:0.8mol:0.2mol=1:8:8:2,即1mol M含有C、H、O的物质的量分别为8mol、8 mol和2mol,M的分子式为C8H8O2,故答案为C8H8O2;
(2)
【解析】【解答】(2)由M的红外光谱可知,M分子中含有苯环、甲基和酯基,由核磁共振氢谱可知M分子中有4类氢原子,则M的结构简式为 ,故答案为 。
【分析】
(1)通过原子个数守恒确定分子式;
(2) 红外光谱和核磁共振氢谱确定化学键和官能团。
20.【答案】(1)过滤
(2)蒸发
(3)分液
(4)萃取和分液
【解析】【解答】(1)豆渣不能透过滤纸,可用过滤的方法分离;
(2)用海水晒盐,分离固体溶质和溶剂,用蒸发的方法分离;
(3)油和水互不相溶,可用分液的方法分离;
(4)碘易溶于有机溶剂,可用萃取和分液的方法分离。
【分析】(1)过滤是除去不溶性杂质的方法;
(2)根据蒸发操作的特点解答;
(3)用分液的方法分离互不相容的液体;
(4)根据萃取、分液的特点分析解答。
21.【答案】(1)锥形瓶;分液漏斗;蒸馏烧瓶;牛角管
(2)萃取;分液;⑤①③④②
(3)蒸馏;BEGHJK.
【解析】【解答】(1)由仪器的图形可知,B为锥形瓶,D为分液漏斗,E为蒸馏烧瓶,G为牛角管,
故答案为:锥形瓶;分液漏斗;蒸馏烧瓶;牛角管;
(2)溴易溶于四氯化碳,可用萃取的方法分离,利用分液的方法可分离互不相溶的液体,分液时应先检查是否漏水,将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置、分层,将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔,分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液,从分液漏斗上口倒出上层水溶液,顺序为⑤①③④②,
故答案为:萃取;分液;⑤①③④②;
【分析】(1)根据仪器的构造以及形状可判断名称;
(3)可用蒸馏的方法分离沸点不同的液体混合物,需要用到的仪器有BEGHJK,
故答案为:蒸馏;BEGHJK.
(2)溴易溶于四氯化碳,可用萃取的方法分离;利用分液的方法可分离互不相溶的液体,分液时应先检查是否漏水,将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置、分层,将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔,分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液,从分液漏斗上口倒出上层水溶液;
(3)可用蒸馏的方法分离沸点不同的液体混合物.
一、单选题
1.科学家用毕生的研究不断更新着我们对科学世界的认识。下列关于科学家成就的描述与当时不相符合的是( )
A.1869年俄国化学家门捷列夫将元素按照核电荷数由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表
B.荷兰物理学家范德华首先研究出了分子间作用力,因此这种力也称为范德华力
C.1825年英国科学家法拉第首先发现了苯
D.1866年德国化学家凯库勒提出苯分子是一个由6个碳原子以单、双键相互交替结合而成的环状链式结构
2.对元素周期表和元素周期律的发现有突出贡献的科学家是( )
A.拉瓦锡 B.门捷列夫 C.阿伏加德罗 D.道尔顿
3.下列分离物质的方法中,利用了物质的沸点的是( )
A.蒸馏 B.过滤 C.重结晶 D.凝固
4.下列“假说“在化学科学发展过程中曾经起到一定的作用,至今仍公认为化学原理的是( )
A.1803 年道尔顿提出的“元素的原子以其原子质量为特征”
B.1808 年盖 吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子”
C.1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“
D.1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子”
5.在物质结构研究的历史上,首先提出原子内有原子核的科学家是( )
A. B.
C. D.
6.下列有关实验操作、原理和装置不能达到实验目的的是( )
A.用装置甲除去食盐水中的泥沙
B.用装置乙灼烧海带
C.用装置丙分离酒精和水的混合物
D.用装置丁制取少量蒸馏水
7.在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色 B.整溶液变为棕黄色
C.上层为无色下层为紫红色 D.下层无色上层紫红色
8.萃取溴水中的溴单质,能用作萃取剂的是( )
A.氢氧化钠溶液 B.酒精
C.四氯化碳 D.乙酸
9.卢瑟福的α粒子散射实验的现象不能说明( )
A.原子中原子核占的体积很小
B.原子是可以再分的
C.原子中存在着带正电荷的核
D.核外电子象行星一样围绕原子核运动
10.下列物质性质与应用对应关系正确的是( )
A.氯化镁属于电解质,工业上可用电解其溶液的方法制镁
B.钠钾合金的硬度小,可用作快中子反应堆的热交换剂
C.Fe2O3是红棕色固体,可以制成红色的油漆、涂料
D.溴单质在CCl4中的溶解度大,可用CCl4萃取Br﹣
11.对实验室制得的粗溴苯[含溴苯(不溶于水,易溶于有机溶剂,沸点156.2℃)、Br2和苯(沸点80℃)]进行纯化,未涉及的装置是( )
A. B.
C. D.
12.对某未知有机物进行质谱和核磁共振氢谱分析,结果如图所示。下列说法错误的是( )
A.该物质的相对分子质量为46
B.该物质的结构简式有可能是
C.该物质的分子中存在3种不同类型的氢原子
D.该物质的分子中不同类型的氢原子个数之比为3:2:1
13.下列分离提纯方法错误的是( )
A.乙醇中含有少量水,可以加CaO后蒸馏
B.实验室制乙炔中含有杂质H2S,可用硫酸铜溶液洗气
C.用苯萃取分离碘化钠和单质碘的水溶液
D.除去己烷中少量的己烯,加溴水后分液
14.下列实验装置能达到相应实验目的的是( )
A.用装置①分离沸点不同的液体混合物
B.用装置②于吸收 HCl气体,能够防止倒吸
C.用装置③加热硫酸铜溶液制得硫酸铜固体
D.用装置④收集 NO2气体
15.向2mL0.5mol/L 的 溶液中加入3mL5mol/L KF溶液,发现 溶液渐渐褪至无色,再加入KI溶液和 振荡后,静置,不见 层有紫红色,则下列说法正确的是( )
A. 不与 I- 发生反应
B. 与 F- 结合成不与 I- 反应的物质
C.F-使 I-的还原性减弱
D. 被F-还原为 ,使溶液中不再存在
16.已知某有机物A的核磁共振氢谱如图所示,下列说法中错误的是 ( )
A.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1∶2∶3
B.若A的分子式为C3H6O2,则其结构简式为CH3COOCH3
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C3H6O2,则其同分异构体有三种
二、综合题
17.下图所示的装置是化学实验中常见混合物分离和提纯的方法,也是学生应具备的实验基本技能。回答下列问题(填代表装置图的字母):
(1)从氯化钾溶液中得到氯化钾固体,选择 装置。
(2)氯化钠固体中混有碘,选择 装置。
(3)河水样品中加了少量明矾,选择 装置。
(4)除去自来水中的 、 杂质离子,选择 装置。
(5)装置E在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是 。
18.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.过滤 B.蒸馏 C.结晶 D.分液 E.萃取
(1) 从溴的四氯化碳溶液中提取溴单质。
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(3) 分离花生油和水的混合液。
(4) 用乙醚提取青蒿中的青蒿素。
19.有机物M只含C、H、O三种元素。取13.6g M在足量氧气中燃烧,生成35.2g CO2和7.2g H2O。在相同条件下,M的蒸气对氢气的相对密度为68。
(1)通过计算确定M的分子式。(要求:写出解题过程)。
(2)经测定:M的红外光谱和核磁共振氢谱分别如下图所示,则M的结构简式为 。
20.混合物分离的方法在生产、生活和科学实验中有着广泛的应用,请指出下列做法中分别应用了哪些分离方法。
(1)除去豆浆中的颗粒物杂质
(2)用海水晒盐
(3)除去豆油中的水
(4)从碘水中提取碘
21.化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合下来实验常用到的仪器回答问题:
(1)填写以下仪器的名称:B D E G
(2)(2)用四氯化碳提取出溴水中Br2单子的方法叫做: ,将Br2的四氯化碳溶液和水分离开的操作叫做: ,下列是进行该操作的步骤,正确的是顺序是: .
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层;
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
(3)已知Br2的沸点是58.5℃,四氯化碳沸点是78℃.将Br2的四氯化碳溶液分离开的方法是 .需要用到的玻璃仪器有(填字母)
答案解析部分
1.【答案】A
【解析】【解答】A.1869年俄国化学家门捷列夫将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表,故A符合题意;
B.荷兰物理学家范德华首先研究出了分子间作用力,因此这种力也称为范德华力,故B不符合题意;
C.1825年英国科学家法拉第首先发现了苯,故C不符合题意;
D.1866年德国化学家凯库勒提出苯分子是一个由6个碳原子以单、双键相互交替结合而成的环状链式结构,故D不符合题意;
故答案为:A。
【分析】元素周期表是由门捷列夫按照相对原子质量的大小依次进行排列的不是按照质子数进行排列的。其它均正确
2.【答案】B
【解析】【解答】A.拉瓦锡用定量化学实验阐述了燃烧的氧化学说,确定了空气的组成,A不符合题意;
B.俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循,B符合题意;
C.意大利科学家阿伏加德罗提出分子概念,C不符合题意;
D.英国化学家道尔顿提出近代原子学说,D不符合题意,
故答案为:B.
【分析】门捷列夫发现元素周期律并制作了元素周期表.
3.【答案】A
【解析】【解答】A. 蒸馏是根据混合物各组分的沸点不同来分离互溶的液体的,A符合题意;
B. 过滤是利用溶解性不同来分离不溶于液体的固体的,B不符合题意;
C. 重结晶是利用物质溶解度随温度的变化来进行分离提纯的,C不符合题意;
D. 凝固是利用物质熔点或溶解度来进行的分离提纯,D不符合题意;
故答案为:A。
【分析】A.蒸馏是用来分离沸点不同的液体混合物的操作;
B.根据过滤是利用溶质的粒子大小大于滤纸的缝隙,而溶剂的粒子大小小于滤纸的缝隙;
C.重结晶法是利用溶解度不同进行分离混合物中各组分;
D.根据凝固的原理进行解答.
4.【答案】D
【解析】【解答】A.因质子数决定元素的种类,则每一元素的原子以质子数为特征,则道尔顿提出的“以其原子质量为其特征”不科学,故A错误;
B.在同温同压下,相同体积的不同气体含有相同数目的分子,相同的分子数不一定具有相同的原子数,如氧气和臭氧等,则盖 吕萨克提出的理论不科学,故B错误;
C.因原子不带电,带相反电荷的离子可构成化合物,则贝采里乌斯提出的理论不科学,故C错误;
D.阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子”与电解质的电离是相同的,即该理论科学,故D正确.
故选D.
【分析】A.根据原子的构成可知,质子数决定元素的种类;
B.在同温同压下,相同体积的不同气体含有相同数目的分子;
C.根据原子不带电,离子化合物是由离子构成的来分析;
D.根据电解质的电离来分析.
5.【答案】C
【解析】【解答】A.汤姆生最早提出了电子学说,A不符合题意;
B.道尔顿最早提出了原子学说,B不符合题意;
C.卢瑟福最早提出了原子核式结构模型 ,C符合题意;
D.波尔用量子观点解释了氢原子光谱,D不符合题意;
故答案为:C。
【分析】A.汤姆生发现了电子;
B.道尔顿最早提出了原子学说;
C.卢瑟福做了α射线轰击金箔的实验;
D.波尔用量子观点解释了氢原子光谱。
6.【答案】C
【解析】【解答】A.过滤分离固液的操作,用装置甲能除去食盐水中的泥沙,故A不符合题意;
B.灼烧海带使用酒精灯、坩埚、三脚架、泥三角,故B不符合题意;
C.酒精和水互溶,不能分液分离,故C符合题意;
D.可以使用蒸馏的方法制取蒸馏水,故D不符合题意;
故答案为:C。
【分析】A.过滤用于分离液体和固体混合物;
B.灼烧在坩埚中进行,同时还需要使用三脚架、泥三角和酒精灯;
C.酒精和水互溶,不能通过分液进行分离;
D.可采用蒸馏的方式制取蒸馏水。
7.【答案】C
【解析】【解答】解:碘易溶于CCl4,溶液呈紫红色,由于CCl4密度比水大,则层为无色下层为紫红色,
故选C.
【分析】碘易溶于CCl4,溶液呈紫红色,密度比水大.
8.【答案】C
【解析】【解答】A. 氢氧化钠溶液与溴单质会发生反应,且氢氧化钠溶液与原溶剂水互溶,故不能萃取,故A不符合;
B. 酒精与水互溶,故不能萃取,故B不符合;
C. 四氯化碳与水不互溶,不与溴单质反应,且溴单质在四氯化碳中的溶解度大于在水中的溶解度,故可以用四氯化碳萃取溴水中的溴单质,故C符合;
D. 乙酸与水互溶,故不能萃取,故D不符合;
【分析】利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来的方法叫做萃取。萃取的要求:①萃取剂和原溶剂互不相溶;②萃取剂和溶质互不发生反应;③溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度;据此分析解答。
9.【答案】D
【解析】【分析】答案:D
卢瑟福的α粒子散射实验的现象说明:
1、核很小,“α粒子”能与核相互作用的机会很少,所以运动方向不变。
2、少数α粒子,靠近核,与核“相斥”(都带正电),改变运动方向。
3、极少数α粒子,有“碰到”核的机会,所以,会被弹回来。
D选项错误。
10.【答案】C
【解析】【解答】解:A、镁是活泼金属,工业是采用电解熔融氯化镁的方法冶炼,故A错误;
B、钠钾合金熔点低,通常状况下呈液态,可作原子反应堆的导热剂,与硬度无关,故B错误;
C、Fe2O3是红棕色固体,可以制成红色的油漆、涂料,故C正确;
D、溴易溶于四氯化碳,可用萃取的方法分离溴水中的溴单质,不是溴离子,故D错误,故选C.
【分析】A、活泼金属采用电解其熔融盐的方法冶炼;
B、根据钠钾合金熔点低,可作原子反应堆的导热剂回答;
C、氧化铁为红棕色固体,氧化铁矿俗称赤铁矿;
D、溴易溶于四氯化碳,可用萃取的方法分离.
11.【答案】C
【解析】【解答】A.除去Br2可以用SO2,原理是:Br2+ SO2+2H2O = H2SO4+2HBr,故A符合题意;
B.苯和溴苯的混合液与无机溶液互不相溶,分液可得苯和溴苯的混合液,故B符合题意;
C.由分析可知,不涉及到过滤操作,故C不符合题意;
D. 溴苯的沸点是156.2℃、苯的沸点是80℃,分离出溴苯用蒸馏,故D符合题意;
故答案为:C。
【分析】思路:除溴(利用SO2的还原性)à分离出苯和溴苯的混合液(分液)à分离出溴苯(蒸馏)。
12.【答案】B
【解析】【解答】A.由图1可知,最大质荷比是46,该物质的相对分子质量为46,A不符合题意;
B.结合相对分子质量和3种不同环境的H原子可知,该物质的结构简式有可能是,B符合题意;
C.由2图含有3组峰可知,该物质的分子中存在3种不同类型的氢原子,C不符合题意;
D.根据图2的峰面积之比可知,该物质的分子中不同类型的氢原子个数之比为3:2:1,D不符合题意;
故答案为:B。
【分析】由质荷比可知其相对分子质量,再由吸收峰的个数可得氢原子的种类数目,由吸收峰的面积比可知氢原子的个数比进而分析解答。
13.【答案】D
【解析】【解答】A.CaO与水反应生成氢氧化钙,可增大与乙醇的沸点差异,然后蒸馏分离,故A不符合题意;
B.H2S与硫酸铜溶液反应生成CuS沉淀和硫酸,所以可用硫酸铜溶液洗气除杂,故B不符合题意;
C.碘不易溶于水、易溶于苯,可用苯萃取分离碘化钠和单质碘的水溶液,故C不符合题意;
D.己烯与溴水发生加成反应的生成物易溶于己烷,会引入新杂质,不能除杂,应蒸馏分离,故D符合题意;
故答案为:D。
【分析】A.加入CaO可增大与乙醇的沸点差异;
B.H2S与硫酸铜溶液反应生成CuS沉淀和硫酸;
C.碘在有机溶剂中的溶解度大于在水中的溶解度。
14.【答案】C
【解析】【解答】A.用装置①分离沸点不同的液体混合物时,温度计的水银球部位要与蒸馏烧瓶的支管口保持水平,测量蒸气温度,A不符合题意;
B.装置②中导管口直接伸入水中,会引起倒吸,B不符合题意;
C.硫酸铜溶液通过蒸发结晶可得硫酸铜固体,C符合题意;
D.NO2的密度比空气大,应该用向上排空气法收集,D不符合题意。
故答案为:C。
【分析】A.温度计位置不对
B.氯化氢易溶于水,应该用倒置的漏斗进行防止倒吸
C.硫酸是难挥发性酸,故可以通过加热制取硫酸铜固体
D.短管和长管位置弄反
15.【答案】D
【解析】【解答】 与 F- 易形成络合物.
【分析】本题考查氧化还原反应的应用、分液和萃取的操作等,题目难度不大,熟练掌握化学物质的性质是解题的关键 。
16.【答案】B
【解析】【解答】A.由核磁共振氢谱中含有三组峰可知,该有机物分子中含有三种不同化学环境的氢原子;图示中峰的面积比为1:2:3,故该有机物中不同化学环境的氢原子的个数比为1:2:3,A不符合题意;
B.该结构简式CH3COOCH3中,由对称性可知,其中含有两种不同化学环境的氢原子,且其个数比为1:1,B符合题意;
C.核磁共振氢谱中峰面积比等于请原子个数比,无法得出有机物中含有多少个氢原子,故仅由核磁共振氢谱无法确定有机物分子中氢原子的总数,C不符合题意;
D.符合A的条件的同分异构体的结构简式为:CH3CH2COOH、CH3CH2OCOH、CH3COCH2OH,D不符合题意;
故答案为:B
【分析】此题是对核磁共振氢谱的考查,由核磁共振氢谱可确定有机物中不同环境的氢原子的种类同时,核磁共振氢谱峰面积比即为氢原子个数比。据此结合选项进行分析。
17.【答案】(1)B
(2)F
(3)C
(4)A
(5)打开分液漏斗上端的玻璃塞
【解析】【解答】(1)从氯化钾溶液中得到氯化钾固体,只需把溶剂蒸发出去就行,选蒸发装置,答案为B;
(2)氯化钠固体中混有碘,因为碘易升华,采用加热使碘升华后再凝华,进行分离,答案为F;
(3)河水样品中加了少量明矾,因为明矾能水解生成氢氧化铝胶体,能净化河水中的杂质,形成聚沉,所以,用过滤装置进行分离,答案为C;
(4)除去自来水中的 、 杂质离子,通过蒸馏得到蒸馏水,而除去 、 杂质离子,答案为A;
(5)装置E是分液漏斗,若不把上口打开,漏斗中液体无法顺利滴下,在分液时为使液体顺利滴下,除打开活塞外,还必须打开分液漏斗上口的玻璃塞,答案为打开分液漏斗上口的玻璃塞。
【分析】(1) KCl为可溶性固体;
(2)加热碘升华,氯化钠不变;
(3)明矾能水解生成氢氧化铝胶体,能净化河水中的杂质,聚沉后过滤可分离;
(4)自来水中水的沸点较低,可蒸馏分离;
(5)打开分液漏斗的上口的塞子及活塞,可平衡气压。
18.【答案】(1)B
(2)C
(3)D
(4)E
【解析】【解答】(1)溴与四氯化碳互溶,但沸点不同,可蒸馏分离,故答案为:B;
(2)二者溶解度受温度影响不同,降温结晶可以获取纯净的硝酸钾,故答案为:C;
(3)花生油和水不互溶,会分层,可分液分离,故答案为:D;
(4)青蒿素更易溶于乙醚,乙醚可萃取青蒿素,为萃取法分离,故答案为:E。
【分析】A、过滤用于分离固液混合物;B、蒸馏是用于分离互溶但沸点不同的液体;C、结晶是从溶液中获得可溶性溶质的操作;D、分液是用于分离不互溶的两种液体;E、萃取是利用溶质在不同溶剂中的溶解度差异进行分离的操作。
19.【答案】(1)解:由M的蒸气对氢气的相对密度为68可知M的相对分子质量为:2×68=136,13.6g M的物质的量为n(M)= =0.1mol,由原子个数守恒可知,n(C)=n(CO2)= =0.8mol,n(H)=2n(H2O)=2× =0.8mol,则n(O)= =0.2mol,由n(M):n(C):n(H):n(O)=0.1mol:0.8mol:0.8mol:0.2mol=1:8:8:2,即1mol M含有C、H、O的物质的量分别为8mol、8 mol和2mol,M的分子式为C8H8O2,故答案为C8H8O2;
(2)
【解析】【解答】(2)由M的红外光谱可知,M分子中含有苯环、甲基和酯基,由核磁共振氢谱可知M分子中有4类氢原子,则M的结构简式为 ,故答案为 。
【分析】
(1)通过原子个数守恒确定分子式;
(2) 红外光谱和核磁共振氢谱确定化学键和官能团。
20.【答案】(1)过滤
(2)蒸发
(3)分液
(4)萃取和分液
【解析】【解答】(1)豆渣不能透过滤纸,可用过滤的方法分离;
(2)用海水晒盐,分离固体溶质和溶剂,用蒸发的方法分离;
(3)油和水互不相溶,可用分液的方法分离;
(4)碘易溶于有机溶剂,可用萃取和分液的方法分离。
【分析】(1)过滤是除去不溶性杂质的方法;
(2)根据蒸发操作的特点解答;
(3)用分液的方法分离互不相容的液体;
(4)根据萃取、分液的特点分析解答。
21.【答案】(1)锥形瓶;分液漏斗;蒸馏烧瓶;牛角管
(2)萃取;分液;⑤①③④②
(3)蒸馏;BEGHJK.
【解析】【解答】(1)由仪器的图形可知,B为锥形瓶,D为分液漏斗,E为蒸馏烧瓶,G为牛角管,
故答案为:锥形瓶;分液漏斗;蒸馏烧瓶;牛角管;
(2)溴易溶于四氯化碳,可用萃取的方法分离,利用分液的方法可分离互不相溶的液体,分液时应先检查是否漏水,将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置、分层,将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔,分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液,从分液漏斗上口倒出上层水溶液,顺序为⑤①③④②,
故答案为:萃取;分液;⑤①③④②;
【分析】(1)根据仪器的构造以及形状可判断名称;
(3)可用蒸馏的方法分离沸点不同的液体混合物,需要用到的仪器有BEGHJK,
故答案为:蒸馏;BEGHJK.
(2)溴易溶于四氯化碳,可用萃取的方法分离;利用分液的方法可分离互不相溶的液体,分液时应先检查是否漏水,将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置、分层,将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔,分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液,从分液漏斗上口倒出上层水溶液;
(3)可用蒸馏的方法分离沸点不同的液体混合物.
