2023—2024学年鲁教版化学九年级上册第五单元 定量研究化学反应 期末评估题(含答案)
文档属性
| 名称 | 2023—2024学年鲁教版化学九年级上册第五单元 定量研究化学反应 期末评估题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 317.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-06 17:49:20 | ||
图片预览




文档简介
2023—2024学年鲁教版化学九年级上册第5单元 定量研究化学反应 期末评估题含答案
鲁教版第5单元 定量研究化学反应
一、选择题。(16题)
1、化学是以实验为基础的学科,当您走进化学实验室时,会发现有些药品装在棕色瓶中这是因为这些药品见光,在紫外线作用下容易分解,您预测硝酸银见光分解不可能得到的产物是( )
A.N2 B.NO C.NO2 D.NH3
2、密闭容器中有甲、乙两种物质各10g,加热一段时间后测得容器中各物质的质量如表所示
物质 甲 乙 丙 丁
反应后质量/g 1.6 X 0.9 2.2
下列选项正确的是( )
A. 该反应为化合反应 B. X=5.3
C. 该反应中甲和乙的质量比为84:53 D. 丙、丁一定是单质
3、小明从中获得以下信息:①该反应中反应物是一氧化碳和氧气;②该反应发生的条件是点燃;③反应前后元素种类和原子个数保持不变;④反应前后分子总数保持不变;⑤参加反应的一氧化碳和氧气的质量比为7:8。其中正确的信息是( )
A.①②③ B.①②④⑤ C.④⑤ D.①②③⑤
4、在一个密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下,下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 20 10 20 20
反应后质量/g 2 待测 32 26
A.待测质量一定为10g B.反应中甲、丁的质量比为1:1
C.乙可能是催化剂 D.反应可以表示为甲→丙+丁
5、21世纪初某年6月5日是第47个世界环境日,今年环境日中国主题是“美丽中国,我是行动者”。下列做法不符合这一理念的是( )
A.合理开发清洁能源 B.全面关停有污染的化工企业
C.鼓励使用公共交通出行 D.对市容进行整治、绿化
6、下列能用质量守恒定律解释的是( )
A.水加热变成水蒸气质量不变
B.蜡烛受热熔化,冷却后质量不变
C.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
D.根据质量守恒定律,1L氢气和1L氧气反应能生成2L水
7、铜可以和浓硝酸反应,反应的化学方程式为:
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2X,其中X的化学式为( )
A. NO2 B. NO C. N2O3 D. N2
8、如图是某个反应过程的微观示意图。该反应的化学方程式为( )
A. B.
C. D.
9、3克镁在足量的氧气中完全燃烧,可得到氧化镁的质量.( )
A.10g B.6g C.5g D.12g
10、古语道“人要实,火要虚”。从燃烧条件分析,“火要虚”的实质是( )
A.提高可燃物的着火点 B.增加可燃物与空气的接触面积
C.增大空气中氧气的含量 D.提高可燃物的热值
11、AgNO3见光分解产生一种有刺激性气味的气体,该气体可能是( )
A.NO2 B.NH3 C.N2 D.SO2
12、在化学方程式5O2+X 3CO2+4H2O中,X的化学式为( )
A. C3H7OH B. CH4 C. C2H6 D. C3H8
13、下列化学方程式书写正确的是( )
A. B.
C. D.
14、在反应X+2Y=R+2M中,已知R和M的相对分子质量之比为22:9,当1.6gX与Y完全反应后生成4.4gR,则在此反应中Y和M的质量比是( )
A.16:9 B.23:9 C.32:9 D.46:9
15、酸雨、温室效应和臭氧层空洞是当今三大环境问题,其中形成温室效应的主要物质是( )
A.二氧化碳 B.二氧化硫 C.一氧化碳 D.氧气
16、汽车尾气中的氮氧化合物和一氧化碳对空气会造成污染,通常采用催化净化装置将其转化成无毒物质再排放。其主要反应原理为2NO+2COX+2CO2,请推测X的化学式( )
A.O2 B.N2 C.H2O D.NO2
二、填空题。
17、用符号或化学式表示:
(1)铝离子_____;
(2)两个铵根离子_____;
(3)钡的氧化物_____;
(4)氖气_____;
(5)氧化铁中铁元素的化合价为+3价_____;
(6)在空气中燃烧产生白烟的非金属单质_____;
(7)高粱玉米和薯类经发酵蒸馏可得到的绿色燃料是_____。
18、比较和分类是重要的学习方法。
(1)17中元帅实验小组同学想用氯化钠和水配制50g溶质质量分数为5%的氯化钠溶液,他们分析到在实验过程中会出现以下一些情况:请根据最终导致溶质质量分数偏大或偏小的情况进行分类:
①你的分类依据:_______;
②包含的选项______(填字母)a.称量固体质量,物品和砝码放颠倒了;b.固体氯化钠中含有杂质;c.量取水时,俯视量筒;d.实验前烧杯中有水;e.实验前量筒中有水;f.细口瓶中有水;g.称量固体前,未调节平衡,指针指向右,称量后,指针指向分度盘的中间
(2)我们学习过铁和稀硫酸的反应: ,高中以后还将学习铁和浓硫酸在加热条件下反应: ,请仿照上述反应写出铜和浓硫酸反应的化学方程式_________ ,反应前后硫元素的化合价为______。
19、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+BA2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 B的用量 A2B的质量
甲 7.0g 1.0g 5.0g
乙 4.0g 4.0g 5.0g
丙 ag bg 3.0g
20、(1)天然气的化学式为: ,其燃烧的化学方程式为: ;
(2)氢气是最清洁的能源,用化学方程式表示: 。
21、化学就在我们身边,请运用所学知识,写出下列化学方程式。
(1)无人机的动力来源是锂系电池,锂系电池分为锂电池和锂离子电池,锂电池在工作时是锂与二氧化锰反应生成亚锰酸锂(LiMnO2),该反应的化学方程式为____________。
(2)体育课上,剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,乳酸与吸入的氧气反应生成二氧化碳和水酸痛感消失,该反应的化学方程式为________。
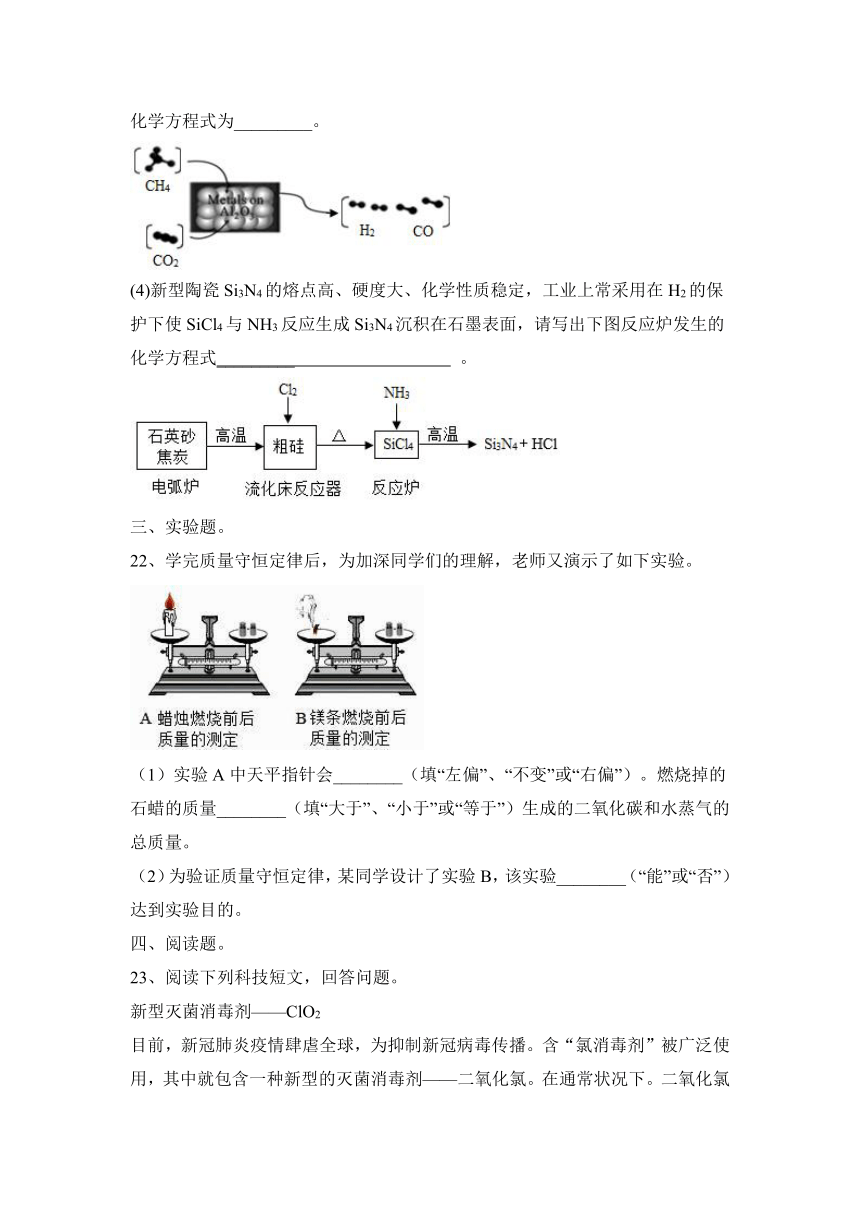
(3)将甲烷、二氧化碳在催化剂作用下制取合成气,不但可以减少温室气体的排放,还可以得到在化工生产中有看重要用途的合成气,反应原理如图,该反应的化学方程式为_________。
(4)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定,工业上常采用在H2的保护下使SiCl4与NH3反应生成Si3N4沉积在石墨表面,请写出下图反应炉发生的化学方程式_________ 。
三、实验题。
22、学完质量守恒定律后,为加深同学们的理解,老师又演示了如下实验。
(1)实验A中天平指针会________(填“左偏”、“不变”或“右偏”)。燃烧掉的石蜡的质量________(填“大于”、“小于”或“等于”)生成的二氧化碳和水蒸气的总质量。
(2)为验证质量守恒定律,某同学设计了实验B,该实验________(“能”或“否”)达到实验目的。
四、阅读题。
23、阅读下列科技短文,回答问题。
新型灭菌消毒剂——ClO2
目前,新冠肺炎疫情肆虐全球,为抑制新冠病毒传播。含“氯消毒剂”被广泛使用,其中就包含一种新型的灭菌消毒剂——二氧化氯。在通常状况下。二氧化氯是一种有刺激性气味的黄绿色气体,熔点-59℃,沸点11℃.在常温下,1L水中大约溶解2.9g ClO2。受热或者见光分解,具有强氧化性和很强的腐蚀性。含有2%的ClO2和0.085% Na2CO3的水溶液无色,无臭,无腐蚀,常温下稳定,不易分解,该溶液用于杀菌,消毒的同时,还有除臭,防霉,保鲜等作用,是特性优良,高效安全的消毒剂。我国从2000年起就逐渐用ClO2取代氯气(Cl)对饮用水进行消毒。
(1)ClO2的名称是 ,其中氯元素的化合价是 。
(2)下列消毒剂中,不属于“含氯消毒剂”的是 。
A.84消毒液(含NaClO) B.双氧水
C.氯气 D.过氧乙酸(C2H4O3)
(3)ClO2的化学性质有 。(答一点即可)
(4)ClO2遇热水生成次氯酸(HClO)和两种气态单质。完成该反应的化学方程式: 8ClO2+2H2O 。
五、计算题。
24、工业上利用煅烧石灰石(主要成分为CaCO3)的方法生产生石灰(主要成分为CaO),同时得到CO2。请计算:
(1)CO2的化学式量为 。
(2)煅烧1 000 t含杂质20%(杂质不分解)的石灰石,能生产多少CaO
2023—2024学年鲁教版化学九年级上册第5单元 定量研究化学反应 期末评估题含答案
鲁教版第5单元 定量研究化学反应
一、选择题。(16题)
1、化学是以实验为基础的学科,当您走进化学实验室时,会发现有些药品装在棕色瓶中这是因为这些药品见光,在紫外线作用下容易分解,您预测硝酸银见光分解不可能得到的产物是( )
A.N2 B.NO C.NO2 D.NH3
【答案】D
2、密闭容器中有甲、乙两种物质各10g,加热一段时间后测得容器中各物质的质量如表所示
物质 甲 乙 丙 丁
反应后质量/g 1.6 X 0.9 2.2
下列选项正确的是( )
A. 该反应为化合反应 B. X=5.3
C. 该反应中甲和乙的质量比为84:53 D. 丙、丁一定是单质
【答案】C
3、小明从中获得以下信息:①该反应中反应物是一氧化碳和氧气;②该反应发生的条件是点燃;③反应前后元素种类和原子个数保持不变;④反应前后分子总数保持不变;⑤参加反应的一氧化碳和氧气的质量比为7:8。其中正确的信息是( )
A.①②③ B.①②④⑤ C.④⑤ D.①②③⑤
【答案】A
4、在一个密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下,下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 20 10 20 20
反应后质量/g 2 待测 32 26
A.待测质量一定为10g B.反应中甲、丁的质量比为1:1
C.乙可能是催化剂 D.反应可以表示为甲→丙+丁
【答案】B
5、21世纪初某年6月5日是第47个世界环境日,今年环境日中国主题是“美丽中国,我是行动者”。下列做法不符合这一理念的是( )
A.合理开发清洁能源 B.全面关停有污染的化工企业
C.鼓励使用公共交通出行 D.对市容进行整治、绿化
【答案】B
6、下列能用质量守恒定律解释的是( )
A.水加热变成水蒸气质量不变
B.蜡烛受热熔化,冷却后质量不变
C.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
D.根据质量守恒定律,1L氢气和1L氧气反应能生成2L水
【答案】C
7、铜可以和浓硝酸反应,反应的化学方程式为:
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2X,其中X的化学式为( )
A. NO2 B. NO C. N2O3 D. N2
【答案】A
8、如图是某个反应过程的微观示意图。该反应的化学方程式为( )
A. B.
C. D.
【答案】D
9、3克镁在足量的氧气中完全燃烧,可得到氧化镁的质量.( )
A.10g B.6g C.5g D.12g
【答案】C
10、古语道“人要实,火要虚”。从燃烧条件分析,“火要虚”的实质是( )
A.提高可燃物的着火点 B.增加可燃物与空气的接触面积
C.增大空气中氧气的含量 D.提高可燃物的热值
【答案】B
11、AgNO3见光分解产生一种有刺激性气味的气体,该气体可能是( )
A.NO2 B.NH3 C.N2 D.SO2
【答案】A
12、在化学方程式5O2+X 3CO2+4H2O中,X的化学式为( )
A. C3H7OH B. CH4 C. C2H6 D. C3H8
【答案】D
13、下列化学方程式书写正确的是( )
A. B.
C. D.
【答案】C
14、在反应X+2Y=R+2M中,已知R和M的相对分子质量之比为22:9,当1.6gX与Y完全反应后生成4.4gR,则在此反应中Y和M的质量比是( )
A.16:9 B.23:9 C.32:9 D.46:9
【答案】A
15、酸雨、温室效应和臭氧层空洞是当今三大环境问题,其中形成温室效应的主要物质是( )
A.二氧化碳 B.二氧化硫 C.一氧化碳 D.氧气
【答案】A
16、汽车尾气中的氮氧化合物和一氧化碳对空气会造成污染,通常采用催化净化装置将其转化成无毒物质再排放。其主要反应原理为2NO+2COX+2CO2,请推测X的化学式( )
A.O2 B.N2 C.H2O D.NO2
【答案】B
二、填空题。
17、用符号或化学式表示:
(1)铝离子_____;
(2)两个铵根离子_____;
(3)钡的氧化物_____;
(4)氖气_____;
(5)氧化铁中铁元素的化合价为+3价_____;
(6)在空气中燃烧产生白烟的非金属单质_____;
(7)高粱玉米和薯类经发酵蒸馏可得到的绿色燃料是_____。
【答案】Al3+; 2NH4+; BaO; Ne; P; C2H5OH。
18、比较和分类是重要的学习方法。
(1)17中元帅实验小组同学想用氯化钠和水配制50g溶质质量分数为5%的氯化钠溶液,他们分析到在实验过程中会出现以下一些情况:请根据最终导致溶质质量分数偏大或偏小的情况进行分类:
①你的分类依据:_______;
②包含的选项______(填字母)a.称量固体质量,物品和砝码放颠倒了;b.固体氯化钠中含有杂质;c.量取水时,俯视量筒;d.实验前烧杯中有水;e.实验前量筒中有水;f.细口瓶中有水;g.称量固体前,未调节平衡,指针指向右,称量后,指针指向分度盘的中间
(2)我们学习过铁和稀硫酸的反应: ,高中以后还将学习铁和浓硫酸在加热条件下反应: ,请仿照上述反应写出铜和浓硫酸反应的化学方程式_________ ,反应前后硫元素的化合价为______。
【答案】(1) 溶质质量分数偏小(或溶质质量分数偏大) abdf(或cg)
(2) +6价,+4价
19、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+BA2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 B的用量 A2B的质量
甲 7.0g 1.0g 5.0g
乙 4.0g 4.0g 5.0g
丙 ag bg 3.0g
【答案】3:7或37:3。
20、(1)天然气的化学式为: ,其燃烧的化学方程式为: ;
(2)氢气是最清洁的能源,用化学方程式表示: 。
【答案】(1)CH4;CH4 +2O2 CO2 +2H2O;
(2)2H2 + O22H2O
21、化学就在我们身边,请运用所学知识,写出下列化学方程式。
(1)无人机的动力来源是锂系电池,锂系电池分为锂电池和锂离子电池,锂电池在工作时是锂与二氧化锰反应生成亚锰酸锂(LiMnO2),该反应的化学方程式为____________。
(2)体育课上,剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,乳酸与吸入的氧气反应生成二氧化碳和水酸痛感消失,该反应的化学方程式为________。
(3)将甲烷、二氧化碳在催化剂作用下制取合成气,不但可以减少温室气体的排放,还可以得到在化工生产中有看重要用途的合成气,反应原理如图,该反应的化学方程式为_________。
(4)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定,工业上常采用在H2的保护下使SiCl4与NH3反应生成Si3N4沉积在石墨表面,请写出下图反应炉发生的化学方程式_________ 。
【答案】(1)
(2)
(3)
(4)
三、实验题。
22、学完质量守恒定律后,为加深同学们的理解,老师又演示了如下实验。
(1)实验A中天平指针会________(填“左偏”、“不变”或“右偏”)。燃烧掉的石蜡的质量________(填“大于”、“小于”或“等于”)生成的二氧化碳和水蒸气的总质量。
(2)为验证质量守恒定律,某同学设计了实验B,该实验________(“能”或“否”)达到实验目的。
【答案】(1)右;偏小于 (2)否
四、阅读题。
23、阅读下列科技短文,回答问题。
新型灭菌消毒剂——ClO2
目前,新冠肺炎疫情肆虐全球,为抑制新冠病毒传播。含“氯消毒剂”被广泛使用,其中就包含一种新型的灭菌消毒剂——二氧化氯。在通常状况下。二氧化氯是一种有刺激性气味的黄绿色气体,熔点-59℃,沸点11℃.在常温下,1L水中大约溶解2.9g ClO2。受热或者见光分解,具有强氧化性和很强的腐蚀性。含有2%的ClO2和0.085% Na2CO3的水溶液无色,无臭,无腐蚀,常温下稳定,不易分解,该溶液用于杀菌,消毒的同时,还有除臭,防霉,保鲜等作用,是特性优良,高效安全的消毒剂。我国从2000年起就逐渐用ClO2取代氯气(Cl)对饮用水进行消毒。
(1)ClO2的名称是 ,其中氯元素的化合价是 。
(2)下列消毒剂中,不属于“含氯消毒剂”的是 。
A.84消毒液(含NaClO) B.双氧水
C.氯气 D.过氧乙酸(C2H4O3)
(3)ClO2的化学性质有 。(答一点即可)
(4)ClO2遇热水生成次氯酸(HClO)和两种气态单质。完成该反应的化学方程式: 8ClO2+2H2O 。
【答案】(1)二氧化氯;+4; (2)BD;
(3)ClO2受热或见光易分解; (4)4HClO+2Cl2+7O2。
五、计算题。
24、工业上利用煅烧石灰石(主要成分为CaCO3)的方法生产生石灰(主要成分为CaO),同时得到CO2。请计算:
(1)CO2的化学式量为 。
(2)煅烧1 000 t含杂质20%(杂质不分解)的石灰石,能生产多少CaO
【答案】(1)44; (2)448 t。
鲁教版第5单元 定量研究化学反应
一、选择题。(16题)
1、化学是以实验为基础的学科,当您走进化学实验室时,会发现有些药品装在棕色瓶中这是因为这些药品见光,在紫外线作用下容易分解,您预测硝酸银见光分解不可能得到的产物是( )
A.N2 B.NO C.NO2 D.NH3
2、密闭容器中有甲、乙两种物质各10g,加热一段时间后测得容器中各物质的质量如表所示
物质 甲 乙 丙 丁
反应后质量/g 1.6 X 0.9 2.2
下列选项正确的是( )
A. 该反应为化合反应 B. X=5.3
C. 该反应中甲和乙的质量比为84:53 D. 丙、丁一定是单质
3、小明从中获得以下信息:①该反应中反应物是一氧化碳和氧气;②该反应发生的条件是点燃;③反应前后元素种类和原子个数保持不变;④反应前后分子总数保持不变;⑤参加反应的一氧化碳和氧气的质量比为7:8。其中正确的信息是( )
A.①②③ B.①②④⑤ C.④⑤ D.①②③⑤
4、在一个密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下,下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 20 10 20 20
反应后质量/g 2 待测 32 26
A.待测质量一定为10g B.反应中甲、丁的质量比为1:1
C.乙可能是催化剂 D.反应可以表示为甲→丙+丁
5、21世纪初某年6月5日是第47个世界环境日,今年环境日中国主题是“美丽中国,我是行动者”。下列做法不符合这一理念的是( )
A.合理开发清洁能源 B.全面关停有污染的化工企业
C.鼓励使用公共交通出行 D.对市容进行整治、绿化
6、下列能用质量守恒定律解释的是( )
A.水加热变成水蒸气质量不变
B.蜡烛受热熔化,冷却后质量不变
C.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
D.根据质量守恒定律,1L氢气和1L氧气反应能生成2L水
7、铜可以和浓硝酸反应,反应的化学方程式为:
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2X,其中X的化学式为( )
A. NO2 B. NO C. N2O3 D. N2
8、如图是某个反应过程的微观示意图。该反应的化学方程式为( )
A. B.
C. D.
9、3克镁在足量的氧气中完全燃烧,可得到氧化镁的质量.( )
A.10g B.6g C.5g D.12g
10、古语道“人要实,火要虚”。从燃烧条件分析,“火要虚”的实质是( )
A.提高可燃物的着火点 B.增加可燃物与空气的接触面积
C.增大空气中氧气的含量 D.提高可燃物的热值
11、AgNO3见光分解产生一种有刺激性气味的气体,该气体可能是( )
A.NO2 B.NH3 C.N2 D.SO2
12、在化学方程式5O2+X 3CO2+4H2O中,X的化学式为( )
A. C3H7OH B. CH4 C. C2H6 D. C3H8
13、下列化学方程式书写正确的是( )
A. B.
C. D.
14、在反应X+2Y=R+2M中,已知R和M的相对分子质量之比为22:9,当1.6gX与Y完全反应后生成4.4gR,则在此反应中Y和M的质量比是( )
A.16:9 B.23:9 C.32:9 D.46:9
15、酸雨、温室效应和臭氧层空洞是当今三大环境问题,其中形成温室效应的主要物质是( )
A.二氧化碳 B.二氧化硫 C.一氧化碳 D.氧气
16、汽车尾气中的氮氧化合物和一氧化碳对空气会造成污染,通常采用催化净化装置将其转化成无毒物质再排放。其主要反应原理为2NO+2COX+2CO2,请推测X的化学式( )
A.O2 B.N2 C.H2O D.NO2
二、填空题。
17、用符号或化学式表示:
(1)铝离子_____;
(2)两个铵根离子_____;
(3)钡的氧化物_____;
(4)氖气_____;
(5)氧化铁中铁元素的化合价为+3价_____;
(6)在空气中燃烧产生白烟的非金属单质_____;
(7)高粱玉米和薯类经发酵蒸馏可得到的绿色燃料是_____。
18、比较和分类是重要的学习方法。
(1)17中元帅实验小组同学想用氯化钠和水配制50g溶质质量分数为5%的氯化钠溶液,他们分析到在实验过程中会出现以下一些情况:请根据最终导致溶质质量分数偏大或偏小的情况进行分类:
①你的分类依据:_______;
②包含的选项______(填字母)a.称量固体质量,物品和砝码放颠倒了;b.固体氯化钠中含有杂质;c.量取水时,俯视量筒;d.实验前烧杯中有水;e.实验前量筒中有水;f.细口瓶中有水;g.称量固体前,未调节平衡,指针指向右,称量后,指针指向分度盘的中间
(2)我们学习过铁和稀硫酸的反应: ,高中以后还将学习铁和浓硫酸在加热条件下反应: ,请仿照上述反应写出铜和浓硫酸反应的化学方程式_________ ,反应前后硫元素的化合价为______。
19、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+BA2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 B的用量 A2B的质量
甲 7.0g 1.0g 5.0g
乙 4.0g 4.0g 5.0g
丙 ag bg 3.0g
20、(1)天然气的化学式为: ,其燃烧的化学方程式为: ;
(2)氢气是最清洁的能源,用化学方程式表示: 。
21、化学就在我们身边,请运用所学知识,写出下列化学方程式。
(1)无人机的动力来源是锂系电池,锂系电池分为锂电池和锂离子电池,锂电池在工作时是锂与二氧化锰反应生成亚锰酸锂(LiMnO2),该反应的化学方程式为____________。
(2)体育课上,剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,乳酸与吸入的氧气反应生成二氧化碳和水酸痛感消失,该反应的化学方程式为________。
(3)将甲烷、二氧化碳在催化剂作用下制取合成气,不但可以减少温室气体的排放,还可以得到在化工生产中有看重要用途的合成气,反应原理如图,该反应的化学方程式为_________。
(4)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定,工业上常采用在H2的保护下使SiCl4与NH3反应生成Si3N4沉积在石墨表面,请写出下图反应炉发生的化学方程式_________ 。
三、实验题。
22、学完质量守恒定律后,为加深同学们的理解,老师又演示了如下实验。
(1)实验A中天平指针会________(填“左偏”、“不变”或“右偏”)。燃烧掉的石蜡的质量________(填“大于”、“小于”或“等于”)生成的二氧化碳和水蒸气的总质量。
(2)为验证质量守恒定律,某同学设计了实验B,该实验________(“能”或“否”)达到实验目的。
四、阅读题。
23、阅读下列科技短文,回答问题。
新型灭菌消毒剂——ClO2
目前,新冠肺炎疫情肆虐全球,为抑制新冠病毒传播。含“氯消毒剂”被广泛使用,其中就包含一种新型的灭菌消毒剂——二氧化氯。在通常状况下。二氧化氯是一种有刺激性气味的黄绿色气体,熔点-59℃,沸点11℃.在常温下,1L水中大约溶解2.9g ClO2。受热或者见光分解,具有强氧化性和很强的腐蚀性。含有2%的ClO2和0.085% Na2CO3的水溶液无色,无臭,无腐蚀,常温下稳定,不易分解,该溶液用于杀菌,消毒的同时,还有除臭,防霉,保鲜等作用,是特性优良,高效安全的消毒剂。我国从2000年起就逐渐用ClO2取代氯气(Cl)对饮用水进行消毒。
(1)ClO2的名称是 ,其中氯元素的化合价是 。
(2)下列消毒剂中,不属于“含氯消毒剂”的是 。
A.84消毒液(含NaClO) B.双氧水
C.氯气 D.过氧乙酸(C2H4O3)
(3)ClO2的化学性质有 。(答一点即可)
(4)ClO2遇热水生成次氯酸(HClO)和两种气态单质。完成该反应的化学方程式: 8ClO2+2H2O 。
五、计算题。
24、工业上利用煅烧石灰石(主要成分为CaCO3)的方法生产生石灰(主要成分为CaO),同时得到CO2。请计算:
(1)CO2的化学式量为 。
(2)煅烧1 000 t含杂质20%(杂质不分解)的石灰石,能生产多少CaO
2023—2024学年鲁教版化学九年级上册第5单元 定量研究化学反应 期末评估题含答案
鲁教版第5单元 定量研究化学反应
一、选择题。(16题)
1、化学是以实验为基础的学科,当您走进化学实验室时,会发现有些药品装在棕色瓶中这是因为这些药品见光,在紫外线作用下容易分解,您预测硝酸银见光分解不可能得到的产物是( )
A.N2 B.NO C.NO2 D.NH3
【答案】D
2、密闭容器中有甲、乙两种物质各10g,加热一段时间后测得容器中各物质的质量如表所示
物质 甲 乙 丙 丁
反应后质量/g 1.6 X 0.9 2.2
下列选项正确的是( )
A. 该反应为化合反应 B. X=5.3
C. 该反应中甲和乙的质量比为84:53 D. 丙、丁一定是单质
【答案】C
3、小明从中获得以下信息:①该反应中反应物是一氧化碳和氧气;②该反应发生的条件是点燃;③反应前后元素种类和原子个数保持不变;④反应前后分子总数保持不变;⑤参加反应的一氧化碳和氧气的质量比为7:8。其中正确的信息是( )
A.①②③ B.①②④⑤ C.④⑤ D.①②③⑤
【答案】A
4、在一个密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下,下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 20 10 20 20
反应后质量/g 2 待测 32 26
A.待测质量一定为10g B.反应中甲、丁的质量比为1:1
C.乙可能是催化剂 D.反应可以表示为甲→丙+丁
【答案】B
5、21世纪初某年6月5日是第47个世界环境日,今年环境日中国主题是“美丽中国,我是行动者”。下列做法不符合这一理念的是( )
A.合理开发清洁能源 B.全面关停有污染的化工企业
C.鼓励使用公共交通出行 D.对市容进行整治、绿化
【答案】B
6、下列能用质量守恒定律解释的是( )
A.水加热变成水蒸气质量不变
B.蜡烛受热熔化,冷却后质量不变
C.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
D.根据质量守恒定律,1L氢气和1L氧气反应能生成2L水
【答案】C
7、铜可以和浓硝酸反应,反应的化学方程式为:
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2X,其中X的化学式为( )
A. NO2 B. NO C. N2O3 D. N2
【答案】A
8、如图是某个反应过程的微观示意图。该反应的化学方程式为( )
A. B.
C. D.
【答案】D
9、3克镁在足量的氧气中完全燃烧,可得到氧化镁的质量.( )
A.10g B.6g C.5g D.12g
【答案】C
10、古语道“人要实,火要虚”。从燃烧条件分析,“火要虚”的实质是( )
A.提高可燃物的着火点 B.增加可燃物与空气的接触面积
C.增大空气中氧气的含量 D.提高可燃物的热值
【答案】B
11、AgNO3见光分解产生一种有刺激性气味的气体,该气体可能是( )
A.NO2 B.NH3 C.N2 D.SO2
【答案】A
12、在化学方程式5O2+X 3CO2+4H2O中,X的化学式为( )
A. C3H7OH B. CH4 C. C2H6 D. C3H8
【答案】D
13、下列化学方程式书写正确的是( )
A. B.
C. D.
【答案】C
14、在反应X+2Y=R+2M中,已知R和M的相对分子质量之比为22:9,当1.6gX与Y完全反应后生成4.4gR,则在此反应中Y和M的质量比是( )
A.16:9 B.23:9 C.32:9 D.46:9
【答案】A
15、酸雨、温室效应和臭氧层空洞是当今三大环境问题,其中形成温室效应的主要物质是( )
A.二氧化碳 B.二氧化硫 C.一氧化碳 D.氧气
【答案】A
16、汽车尾气中的氮氧化合物和一氧化碳对空气会造成污染,通常采用催化净化装置将其转化成无毒物质再排放。其主要反应原理为2NO+2COX+2CO2,请推测X的化学式( )
A.O2 B.N2 C.H2O D.NO2
【答案】B
二、填空题。
17、用符号或化学式表示:
(1)铝离子_____;
(2)两个铵根离子_____;
(3)钡的氧化物_____;
(4)氖气_____;
(5)氧化铁中铁元素的化合价为+3价_____;
(6)在空气中燃烧产生白烟的非金属单质_____;
(7)高粱玉米和薯类经发酵蒸馏可得到的绿色燃料是_____。
【答案】Al3+; 2NH4+; BaO; Ne; P; C2H5OH。
18、比较和分类是重要的学习方法。
(1)17中元帅实验小组同学想用氯化钠和水配制50g溶质质量分数为5%的氯化钠溶液,他们分析到在实验过程中会出现以下一些情况:请根据最终导致溶质质量分数偏大或偏小的情况进行分类:
①你的分类依据:_______;
②包含的选项______(填字母)a.称量固体质量,物品和砝码放颠倒了;b.固体氯化钠中含有杂质;c.量取水时,俯视量筒;d.实验前烧杯中有水;e.实验前量筒中有水;f.细口瓶中有水;g.称量固体前,未调节平衡,指针指向右,称量后,指针指向分度盘的中间
(2)我们学习过铁和稀硫酸的反应: ,高中以后还将学习铁和浓硫酸在加热条件下反应: ,请仿照上述反应写出铜和浓硫酸反应的化学方程式_________ ,反应前后硫元素的化合价为______。
【答案】(1) 溶质质量分数偏小(或溶质质量分数偏大) abdf(或cg)
(2) +6价,+4价
19、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+BA2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 B的用量 A2B的质量
甲 7.0g 1.0g 5.0g
乙 4.0g 4.0g 5.0g
丙 ag bg 3.0g
【答案】3:7或37:3。
20、(1)天然气的化学式为: ,其燃烧的化学方程式为: ;
(2)氢气是最清洁的能源,用化学方程式表示: 。
【答案】(1)CH4;CH4 +2O2 CO2 +2H2O;
(2)2H2 + O22H2O
21、化学就在我们身边,请运用所学知识,写出下列化学方程式。
(1)无人机的动力来源是锂系电池,锂系电池分为锂电池和锂离子电池,锂电池在工作时是锂与二氧化锰反应生成亚锰酸锂(LiMnO2),该反应的化学方程式为____________。
(2)体育课上,剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,乳酸与吸入的氧气反应生成二氧化碳和水酸痛感消失,该反应的化学方程式为________。
(3)将甲烷、二氧化碳在催化剂作用下制取合成气,不但可以减少温室气体的排放,还可以得到在化工生产中有看重要用途的合成气,反应原理如图,该反应的化学方程式为_________。
(4)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定,工业上常采用在H2的保护下使SiCl4与NH3反应生成Si3N4沉积在石墨表面,请写出下图反应炉发生的化学方程式_________ 。
【答案】(1)
(2)
(3)
(4)
三、实验题。
22、学完质量守恒定律后,为加深同学们的理解,老师又演示了如下实验。
(1)实验A中天平指针会________(填“左偏”、“不变”或“右偏”)。燃烧掉的石蜡的质量________(填“大于”、“小于”或“等于”)生成的二氧化碳和水蒸气的总质量。
(2)为验证质量守恒定律,某同学设计了实验B,该实验________(“能”或“否”)达到实验目的。
【答案】(1)右;偏小于 (2)否
四、阅读题。
23、阅读下列科技短文,回答问题。
新型灭菌消毒剂——ClO2
目前,新冠肺炎疫情肆虐全球,为抑制新冠病毒传播。含“氯消毒剂”被广泛使用,其中就包含一种新型的灭菌消毒剂——二氧化氯。在通常状况下。二氧化氯是一种有刺激性气味的黄绿色气体,熔点-59℃,沸点11℃.在常温下,1L水中大约溶解2.9g ClO2。受热或者见光分解,具有强氧化性和很强的腐蚀性。含有2%的ClO2和0.085% Na2CO3的水溶液无色,无臭,无腐蚀,常温下稳定,不易分解,该溶液用于杀菌,消毒的同时,还有除臭,防霉,保鲜等作用,是特性优良,高效安全的消毒剂。我国从2000年起就逐渐用ClO2取代氯气(Cl)对饮用水进行消毒。
(1)ClO2的名称是 ,其中氯元素的化合价是 。
(2)下列消毒剂中,不属于“含氯消毒剂”的是 。
A.84消毒液(含NaClO) B.双氧水
C.氯气 D.过氧乙酸(C2H4O3)
(3)ClO2的化学性质有 。(答一点即可)
(4)ClO2遇热水生成次氯酸(HClO)和两种气态单质。完成该反应的化学方程式: 8ClO2+2H2O 。
【答案】(1)二氧化氯;+4; (2)BD;
(3)ClO2受热或见光易分解; (4)4HClO+2Cl2+7O2。
五、计算题。
24、工业上利用煅烧石灰石(主要成分为CaCO3)的方法生产生石灰(主要成分为CaO),同时得到CO2。请计算:
(1)CO2的化学式量为 。
(2)煅烧1 000 t含杂质20%(杂质不分解)的石灰石,能生产多少CaO
【答案】(1)44; (2)448 t。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
