第九单元金属复习题(含解析) 2023-2024学年九年级化学鲁教版下册
文档属性
| 名称 | 第九单元金属复习题(含解析) 2023-2024学年九年级化学鲁教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 858.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-06 21:38:23 | ||
图片预览




文档简介
第九单元 金属 复习题
一、选择题
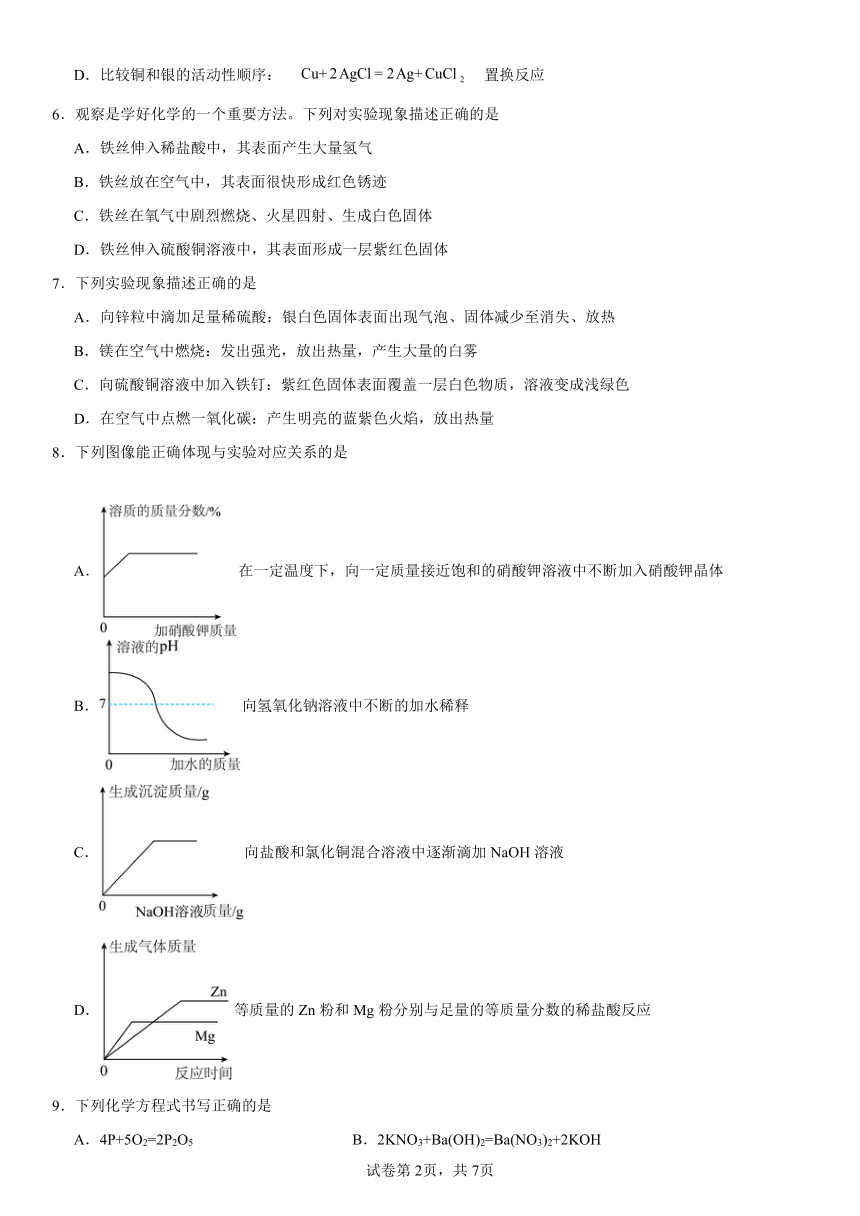
1.同学们为研究一氧化碳的性质进行了下面实验。下列关于该实验叙述正确的是
A.该实验验证了一氧化碳具有氧化性
B.丙过程中能观察到铜丝从红色变成了黑色
C.石灰水的作用是验证反应生成的二氧化碳
D.待反应结束冷却后软质塑料瓶会膨胀
2.现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会,在Y表面有银析出,而Z没有变化。根据以上实验事实,相关分析错误的是
A.三种金属可能分别是铁、铜、银
B.Y一定能从硫酸铜溶液中置换出铜
C.X与稀盐酸反应后溶液的质量一定增大
D.三种金属活动性由强到弱的顺序是X>Y>Z
3.区别下列各组物质所采用的方法不能达到目的的是
A.氮气和二氧化碳——燃着的木条 B.食醋和酱油——闻气味
C.氧气和空气——带火星的木条 D.铁片和铜片——观察颜色
4.下列物质中,不能用金属与酸反应直接制得的是
A. B. C. D.
5.下列叙述、对应的化学方程式、所属基本反应类型都正确的是
A.用稀硫酸洗去附着在试管壁上的铜: 置换反应
B.实验室制氢气: 分解反应
C.铝在空气中形成氧化膜: 化合反应
D.比较铜和银的活动性顺序: 置换反应
6.观察是学好化学的一个重要方法。下列对实验现象描述正确的是
A.铁丝伸入稀盐酸中,其表面产生大量氢气
B.铁丝放在空气中,其表面很快形成红色锈迹
C.铁丝在氧气中剧烈燃烧、火星四射、生成白色固体
D.铁丝伸入硫酸铜溶液中,其表面形成一层紫红色固体
7.下列实验现象描述正确的是
A.向锌粒中滴加足量稀硫酸:银白色固体表面出现气泡、固体减少至消失、放热
B.镁在空气中燃烧:发出强光,放出热量,产生大量的白雾
C.向硫酸铜溶液中加入铁钉:紫红色固体表面覆盖一层白色物质,溶液变成浅绿色
D.在空气中点燃一氧化碳:产生明亮的蓝紫色火焰,放出热量
8.下列图像能正确体现与实验对应关系的是
A.在一定温度下,向一定质量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B.向氢氧化钠溶液中不断的加水稀释
C.向盐酸和氯化铜混合溶液中逐渐滴加NaOH溶液
D.等质量的Zn粉和Mg粉分别与足量的等质量分数的稀盐酸反应
9.下列化学方程式书写正确的是
A.4P+5O2=2P2O5 B.2KNO3+Ba(OH)2=Ba(NO3)2+2KOH
C.2Fe+3CuSO4=Fe2(SO4)3+3Cu D.CH4+2O2CO2+2H2O
10.下列物质属于纯净物的是
A.酸奶
B.生铁
C.金刚石
D.石灰水
11.在“宏观——微观——符号”之间建立联系,是化学学科特有的思维方式。下图表示两种气体发生的化学反应的微观示意图,其中相同的球代表同种原子。下列说法正确的是
A.反应物中包含两种化合物
B.该反应属于置换反应
C.该反应有三种新物质生成
D.参加反应的反应物与生成物的分子个数比为8:9
12.某同学将铁粉和铜粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和蓝色滤液。下列判断中,不正确的是
a 滤渣中一定含有铜 b 滤液中一定含有 Cu2+ c 滤液中一定含有Fe2+d向滤渣中加稀盐酸可能有气泡 e 所得滤液质量一定比原溶液质量小
A.ad B.be C.abe D.acd
二、填空与简答
13.北宋沈括《梦溪笔谈》中记载:信州铅山有苦泉,流以为涧。挹其水熬之,则成胆矾(硫酸铜晶体),烹胆矾则成铜,熬胆矾铁釜,久之亦化为铜。
(1)“挹其水熬之,则成胆矾”,该过程属于 (选填“蒸发”或“降温”)结晶;
(2)“烹胆矾则成铜”的过程中发生的是 (选填“物理”或“化学”)变化;
(3)“熬胆矾铁釜,久之亦化为铜”,其中发生反应化学方程式为 ,该反应说明两种金属的活动性顺序为 ;
14.小明同学对金属的有关化学性质进行梳理和总结。请完成下列问题。
(1)对下图中几种金属的原子结构示意图进行分析,发现金属原子最外层电子一般都 4个(填“大于”或“小于”),在化学反应中容易 (填“得到”或“失去”)电子变成阳离子,小明同学判断D和E的化学性质相似,他的依据是 ;
A. B. C. D. E.
(2)将一锌片投入稀硫酸中,观察到的现象是 ,反应的化学方程式为 。
15.平昌冬奥会闭幕式上,熊猫木偶惊艳亮相。木偶要经受极寒考验,承受坚硬冰面的撞击,还要满足现场表演的特殊要求。最终确定用铝合金管材和碳纤维条相结合,配合LED串灯珠进行制作。
(1)铜丝线用于连接LED灯,主要是利用其 性:使用铅合金是避免钢铁锈蚀。铁生锈的条件是铁与 同时接触。金属腐蚀造成的损失巨大,下列对金属的防护措施不合理的是 (填序号)。
A齿轮表面涂油 B.将菜刀刷油漆保护
C.钢刀浸泡在盐水中 D.车圈镀铬
(2)为比较X、Y、Z三种金属活动性大小,进行如下实验。则X、Y、Z三种金属的活动性由强到弱的顺序是___________(填序号)。
A.Z>Y>X B.X>Y>Z C.Y>X>Z D.Y>Z>X
(3)近年来,我国高铁建设飞速发展,建造高铁需要大量的钢铁。图为模拟炼铁的装置,写出a中发生反应的化学方程式 ;描述b处反应的现象 。
16.化学与人类生活、生产活动息息相关。根据所学知识回答下列问题。
(1)铁常用来制作炊具。这是利用了铁的 。
(2)食用“加铁酱油”可预防贫血,其中“铁”是指 (填“元素”或“原子”)。
(3) 是理想的清洁高能燃料。(填“氢气”或"天然气”)
17.人类每年要提取数以亿吨计的金属,用于工农业生产和其他领域。
(1)汽车电路中一般用铜作导线,这是利用铜的 ;汽车车体表面喷漆不仅美观,而且可有效防止铁与 接触而生锈。
(2)炼铁的原理是利用一氧化碳和氧化铁的反应,化学方程式为 。
(3)某化工厂排出澄清的废水,其中可能含有的离子是Ba2+、Fe3+、Fe2+、Ag+、Cu2+、SO42-、Cl-、NO3-。[已知:白色的Fe(OH)2沉淀在空气中会迅速转化为红褐色的Fe(OH)3。]
①取少量废水,加入过量稀盐酸,产生白色沉淀的化学式为 。过滤,将滤液分成两份,一份加入稀硫酸,产生白色沉淀的化学式为 ;另一份加入过量NaOH溶液,产生蓝色沉淀,该过程中与OH-反应的离子是 (写离子符号)。
②某化学兴趣小组设计了一个处理该废水的实验方案,部分流程如下:
下列说法正确的是 (填字母)。
A.固体A中一定含有Ag和Cu,可能含有Fe
B.溶液B中的溶质有Ba(NO3)2、Fe(NO3)2
C.废水中含有Ba2+、Ag+、Cu2+、Fe2+、NO3
D.通过该流程可以除去废水中原有的金属离子
18.如图所示是A-F六种物质相互间的关系,用“→”表示物质间存在转化关系,用“一”表示两端的物质能发生化学反应。B、C是组成元素相同的两种液体;A、E、F是初中阶段常见的三种氧化物,F是黑色固体。回答下列问题:
(1)E物质为: (写名称)。
(2)A→B反应的化学方程式: 。
(3)D→F反应的化学方程式: 。
(4)B→D反应的基本类型是 。
19.为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 。
(3)写出步骤②所涉及的化学反应方程式 ,判断步骤②中稀硫酸是否适量依据是: 。
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂 (填标号)。
a.硫酸铜溶液 b.氯化钠溶液 c.硝酸银溶液。
写出有关化学反应方程式 。
三、科学探究题
20.学习完金属的化学性质,兴趣小组进行了如图所示的实验。
【实验一】同学们进行如图一所示的实验,验证铁、锌、铜、银四种金属活动性强弱。
(1)试管①中观察到的实验现象是铁粉表面有红色固体,溶液由 。
(2)试管③中反应的化学方程式是 。
(3)你认为通过上述图一所示的三个实验能否验证铁、锌、铜、银四种金属在溶液中的活动性强弱 (填“能”或“不能”)。
【实验二】在完成实验一的过程中,同学们将试管①②③内反应后的物质都倒入废液缸中(如图二)。小组同学对废液缸中混合物的成分产生了探究兴趣。待混合物充分反应后,过滤,得到滤渣和浅绿色滤液。
(4)小明将铁丝放入浅绿色滤液中,一段时间后,铁丝表面没有发生变化。由此判断滤液中一定含有的溶质是 (填化学式)。
(5)探究滤渣的成分
【提出问题】滤渣的成分是什么?
【作出猜想】小明的猜想:银、铜、铁、锌
你的猜想:猜想I ; 猜想II:银、铜、铁
【分析思考】同学们认为小明的猜想不正确,结合上述的实验现象分析,小明的猜想不正确的原因是 。(请用方程式解释)
【进行实验】实验证明猜想II正确,请你完成下列实验方案。
实验步骤 实验现象 结论
取少量滤渣样品,加入稀盐酸。 有气泡,溶液变成浅绿色。 猜想 正确
【拓展应用】
为继续研究金属的化学性质,学习小组同学向一定质量的硝酸银和硝酸铜的混合溶液中加入锌粉,溶液质量与加入锌的质量关系如图所示。那么,在b点时,溶液中存在的金属阳离子是 (写离子符号);d点的固体的成分为 (写名称)。
四、计算题
21.将10g不纯的锌粒(杂质不溶于水也不溶于酸)投入到100g稀硫酸中,恰好完全反应,得到了0.2g气体。试计算:
(1)锌粒中纯锌的质量;
(2)反应后所得溶液中溶质的质量分数。(结果保留0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】甲中铜加热和空气中氧气反应生成氧化铜,乙、丙中氧化铜和一氧化碳反应生成铜和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水。
【详解】A、乙中氧化铜和一氧化碳反应生成铜和二氧化碳,一氧化碳在反应过程中得到氧元素,验证了一氧化碳具有还原性,故错误;
B、丙过程中氧化铜和一氧化碳反应生成铜和二氧化碳,能观察到黑色的氧化铜丝变成了红色的铜,故错误;
C、二氧化碳能使澄清石灰水变浑浊,装置中石灰水的作用是检验生成的二氧化碳,故正确;
D、待反应结束冷却后,由于消耗了一氧化碳,生成的二氧化碳又被澄清石灰水吸收,导致瓶内气压降低,软质塑料瓶会变扁,故错误。
故选:C。
2.B
【分析】把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应,说明金属活动性X>(H)>Y;把Y和Z分别放入硝酸银溶液中,过一会,在Y表面有银析出,而Z没有变化,说明金属活动性Y>Ag≥Z。
【详解】A、由以上分析可知,金属活动性:X>(H)>Y>Ag≥Z,故三种金属可能分别是铁、铜、银,A正确;
B、金属活动性:(H)>Y>Ag,(H)>Cu>Ag,无法判断Y与Cu 的金属活动性强弱,故Y不一定能从硫酸铜溶液中置换出铜,B错误;
C、金属活动性X>(H),金属X与稀盐酸反应生成氢气,因为金属的质量一定大于生成的氢气的质量,故反应后溶液的质量一定增大,C正确;
D、由以上分析可知,三种金属活动性由强到弱的顺序是X>Y>Z,D正确;
故选B。
3.A
【详解】A、氮气和二氧化碳都不支持燃烧,都能使燃着的木条熄灭,所以A方法不能达到目的;
B、有酸味的是食醋,所以B方法能达到目的;
C、氧气能使带火星木条复燃,所以C方法能达到目的;
D、铜片呈紫红色,铁片呈银白色,所以D方法能达到目的。
故选A。
4.C
【详解】A、在金属活动性顺序中,锌位于氢元素前面,能和硫酸反应生成硫酸锌和氢气,该选项不符合题意;
B、在金属活动性顺序中,镁位于氢元素前面,能和盐酸反应生成氯化镁和氢气,该选项不符合题意;
C、在金属活动性顺序中,铁位于氢元素前面,但铁和盐酸反应生成FeCl2,而不是FeCl3,该选项符合题意;
D、在金属活动性顺序中,铝位于氢元素前面,能和硫酸反应生成硫酸铝和氢气,该选项不符合题意。
故选C。
5.C
【详解】A、在金属活动性顺序中,铜位于氢元素后面,则不能与硫酸反应,该选项不正确;
B、电解水不仅生成氢气,还生成氧气,不能用作实验室制取氢气,且方程式中,氢气没有标箭头,该选项不正确;
C、铝在空气中能与氧气反应生成一层致密的氧化铝薄膜,反应方程式正确,且该反应为多种物质生成一种物质的反应,属于化合反应,该选项正确;
D、氯化银为沉淀,铜不能与氯化银反应,该选项不正确。
故选C。
6.D
【详解】A. 金属活动性顺序中,排在氢前面的金属能与稀盐酸反应生成氢气,所以铁丝伸入稀盐酸中,其表面产生大量气泡,经检验该气泡是氢气,此选项错误;
B. 铁丝生锈是缓慢氧化,所以将铁丝放在空气中,其表面不会很快形成红色锈迹,此选项错误;
C. 铁丝在氧气中剧烈燃烧、火星四射、生成黑色固体,此选项错误;
D. 金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,则将铁丝伸入硫酸铜溶液中,其表面形成一层紫红色固体,此选项正确。
故选D。
7.A
【分析】A、根据锌的金属活动性比氢强,进行分析判断;
B、根据镁在空气中燃烧的现象,进行分析判断;
C、根据铁的金属活动性比铜强,进行分析判断;
D、根据一氧化碳燃烧的现象,进行分析判断。
【详解】A、锌的金属活动性比氢强,能与稀硫酸反应,向锌粒中滴加足量稀硫酸,银白色固体表面出现气泡、固体减少至消失、放热,故A选项说法正确。
B、镁在空气中燃烧,发出强光,放出热量,产生大量的白烟,而不是白雾,故B选项说法错误。
C、铁的金属活动性比铜强,向硫酸铜溶液中加入铁钉,银白色固体表面覆盖一层紫红色物质,溶液变成浅绿色,故C选项说法错误。
D、在空气中点燃一氧化碳,产生淡蓝色火焰,放出热量,故D选项说法错误。
故选A。
【点睛】掌握金属的化学性质、常见物质燃烧的现象是正确解答本题的关键。
8.A
【详解】A、在一定温度下,向一定质量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体,则溶液达到饱和后溶质质量分数不变,正确;
B、向氢氧化钠溶液加水时溶液的碱性变弱,但是不可能成中性,更不可能成酸性,错误;
C、氢氧化钠先与盐酸反应,开始不产生沉淀,后于氯化铜反应生成沉淀,错误;
D、等质量的Zn粉和Mg粉分别与足量的等质量分数的稀盐酸反应,镁反应的快,且生成的氢气质量大,错误。
故选:A。
9.D
【详解】A、磷与氧气点燃后生成五氧化二磷,化学方程式为,故错误;
B、硝酸钾与氢氧化钡不能反应,因为生成物没有沉淀或气体或水,不符合复分解反应的条件,故错误;
C、铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe+CuSO4=FeSO4+Cu,故错误;
D、甲烷与氧气点燃后生成二氧化碳和水,化学方程式为CH4+2O2 CO2+2H2O,故正确;
故选D。
10.C
【分析】纯净物:由一种物质组成的物质
混合物:由多种物质组成的物质
【详解】A、酸奶中含有牛奶、乳酸菌、食品添加剂等物质,属于混合物。A错误;
B、生铁指的是铁、碳的合金,属于混合物。B错误;
C、金刚石指的是由碳元素组成的单质,属于纯净物。C正确;
D、石灰水是氢氧化钙的水溶液,包括氢氧化钙和水,属于混合物。D错误。
故选C。
11.B
【详解】试题分析:A、化合物分子由不同中原子构成,单质分子由同种原子构成,故根据微观示意图,反应物中只有一种化合物,还有一种是单质,错误,B、通过微观示意图可看出:反应前是一种单质和一种化合物,反应后也是一种单质和一种化合物,故该反应是置换反应,正确,C、反应后只生成两种物质,其中一种的过量的反应物,错误,D、根据化学反应的微观示意图,参加反应的反应物与生成物的分子个数比为7:8,错误,故选B
考点:微观示意图,化学反应基本类型
12.A
【分析】金属活动性顺序中,排在前面的金属能把后面的金属从其盐溶液中置换出来,已知三种金属的活动性顺序是铁>H>铜>银,将铁粉和铜粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和蓝色滤液,滤液呈蓝色,说明滤液中一定含有硝酸铜,铜与硝酸银反应能生成硝酸铜和银,故滤渣中一定含有银;滤液中含有硝酸铜,故此时滤渣中则一定不含能与硝酸铜反应的铁,故向滤渣中加稀盐酸不可能由气泡,同时说明滤液中一定含有Fe2+。该过程中可能发生的反应即相应的质量关系如下:
以上可能发生的三个化学反应中,每个反应后溶质的质量都比反应前变小了,故所得滤液质量一定比原溶液质量小。
【详解】根据上述分析可知,滤液中一定含有Cu2+和Fe2+,滤渣中一定不含铁,且所得滤液质量一定比原溶液质量小。故不正确的判断是ad,应选A。
13.(1)蒸发
(2)化学
(3) Fe>Cu
【详解】(1)“挹其水熬之,则成胆矾”,该过程需要加热,故属于蒸发;
(2)胆矾的化学式是CuSO4 5H2O,“烹胆矾则成铜”的过程中,有其他物质生成,故发生的是化学变化;
(3)“熬胆矾铁釜,久之亦化为铜”,其中发生的反应为铁和硫酸铜反应生成了铜和硫酸亚铁,故化学方程式为;
该反应能发生,说明两种金属的活动性顺序为Fe>Cu;
14.(1) 小于 失去 两种原子的最外层电子数相同
(2) 锌片表面产生气体,锌片减少(或消失)
【详解】(1)金属原子最外层电子一般都小于4个,在化学反应中容易失去电子变成阳离子;元素的性质是由原子的最外层电子数决定的,小明判断D和E的化学性质相似,依据是两种原子的最外层电子数相同;
(2)锌和稀硫酸反应生成硫酸锌和氢气,则现象是锌片表面产生气体,锌片减少(或消失),反应的方程式是。
15.(1) 导电 氧气和水 BC
(2)B
(3) 澄清石灰水变浑浊
【详解】(1)铜丝线用于连接LED灯,主要是利用铜丝具有良好的导电性,铁生锈实际上是铁与空气中的氧气和水等发生化学反应的过程;
A、齿轮表面涂油,可以阻断与氧气和水的接触,能防止铁生锈,故选项防护措施合理;
B、将菜刀刷油漆保护,能防止铁生锈,但不符合生活实际,故防护措施不合理;
C、钢刀浸泡在盐水中不但不能控制生锈的条件,反而能够加速生锈的过程,故防护措施不合理;
D、车圈镀铬能起到保护金属的作用,能起到防锈的作用,故选项防护措施合理;
故填:导电;氧气和水;BC;
(2)将X加入稀硫酸中,产生氢气,说明活动性X>H;
将Y加入稀硫酸中,无明显现象,说明活动性H>Y;
将Y加入硝酸银溶液中,有银析出,说明活动性Y>Ag;
将Z加入硝酸银溶液中,无明显现象,说明活动性Ag>Z;
综上所述,金属活动性为:X>Y>Z,故选B;
(3)a中一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,由于一氧化碳和氧化铁反应产生二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以b处的现象是澄清石灰水变浑浊,故填:澄清石灰水变浑浊。
16.(1)导热
(2)元素
(3)氢气
【详解】(1)铁可作炊具,是因为铁具有良好的导热性。
(2)物质都是由元素组成,“加铁酱油”中的铁是指元素。
(3)氢气燃烧只生成水,且热值高,为最理性的清洁高能燃料。
17.(1) 导电性 氧气、水蒸气(或)
(2)
(3) BD
【详解】(1)铜作导线利用金属铜的导电性;和水同时接触,故填导电性。
(2)根据铁生锈的条件可知防止金属铁与氧气,故填氧气、水蒸气(或)。
(3)①取少量废水,加入过量稀盐酸,产生白色沉淀说明废水中含有氯离子,故产生的白色沉淀的化学式为,故①填;加入稀硫酸,产生白色沉淀说明废水中含有钡离子,白色沉淀的化学式为,故②填;加入过量NaOH溶液,产生蓝色沉淀,该过程中与OH-反应的离子是和前一步过量的 ,故③填;
②根据废水中的离子能稳定存在,废水中含有的离子为铜离子、钡离子、银离子,所以废水中的阴离子只能为硝酸根离子;依据实验方案产生红褐色沉淀,故加入的X物质为金属铁;A、金属X是过量的,故故固体A中一定含有,A错,不符合题意;
B、因为B加氢氧化钠变为白色沉淀后变为红褐色沉淀,故其含有硝酸亚铁,废水职工含有钡离子和硝酸根离子,故溶液B中的溶质有,故B正确,符合题意;
C、废水中含有,亚铁离子不存在,C错,不符合题意;
D、铁和铜离子、银离子发生反应,长城的亚铁离子变成沉淀,故可以通过该流程可以除去废水中原有的金属离子,D正确,符合题意。
故选BD
18. 一氧化碳 分解反应
【分析】B、C是组成元素相同的两种液体;且C能转化为B和D,可推出C为过氧化氢,B为水,D为氧气,A、E、F是初中阶段常见的三种氧化物,F是黑色固体,且氧气能转化为F,氧气能与E反应,E能与F反应,可推出E为一氧化碳,F为氧化铜,氧化铜能转化为A,A能转化为水,可推出A为二氧化碳,代入验证,符合题意。
【详解】(1)由分析可知,E为一氧化碳;
(2)A为二氧化碳,B为水,二氧化碳可与氢氧化钠反应生成碳酸钠和水,该反应的化学方程式为:;
(3)D为氧气,F为氧化铜,铜可与氧气在加热的条件下反应生成氧化铜,该反应的化学方程式为:;
(4)B为水,D为氧气,,该反应符合“一变多”的特点,属于分解反应。
19. Fe或铁) Cu(或铜) 过滤 根据操作②中不再产生气泡为依据(合理即可) a
【详解】(1)铁可以被磁铁吸引,铜和镁不能,操作①中被磁铁吸引的金属A是铁;金属B不能与稀硫酸反应,则金属B是铜;
(2)操作将固体与液体分离,a的名称是:过滤;
(3)步骤②中镁与稀硫酸反应产生硫酸镁和氢气的化学反应方程式:Mg+H2SO4=MgSO4+H2↑,判断步骤②中稀硫酸是否适量依据是:根据操作②中刚好不再产生气泡,则硫酸巧合完全反应;
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂
a.硫酸铜溶液,镁与硫酸铜反应恰好产生硫酸镁和铜;故选项正确;
b.氯化钠溶液,引入新的杂质;故选项错误;
c.硝酸银溶液,引入新的杂质;故选项错误;故选a。
镁与硫酸铜反应恰好产生硫酸镁和铜的化学方程式:Mg+CuSO4=MgSO4+Cu。
20.(1)蓝色变为浅绿色
(2)Cu+2AgNO3=Cu(NO3)2+2Ag
(3)能
(4)Fe(NO3)2、Zn(NO3)2
(5) 银、铜 Zn+Fe(NO3)2=Zn(NO3)2+Fe II Zn2+、Cu2+ 锌、铜、银
【详解】(1)铁和硝酸铜反应生成硝酸亚铁和铜,含有铜离子的溶液中为蓝色,含有亚铁离子的溶液中为浅绿色,故溶液由蓝色变为浅绿色;
(2)铜和硝酸银反应生成硝酸铜和银,化学反应方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)图①可知证明铁比铜活泼,图②可以证明锌比铁活泼,图③可证明铜比银活泼,故四种金属活动性强弱是:锌>铁>铜>银,故所示的三个实验能验证铁、锌、铜、银四种金属在溶液中的活动性强弱;
(4)待混合物充分反应后,过滤,得到滤渣和浅绿色滤液,说明溶液中含有亚铁离子,将铁丝放入浅绿色滤液中,一段时间后,铁丝表面没有发生变化,说明溶液中不含硝酸铜和硝酸银,因为锌活动性最强,滤液中一定含有的溶质是硝酸亚铁和硝酸锌,化学式为:Fe(NO3)2、Zn(NO3)2;
(5)[作出猜想]
因将铁丝放入溶液中没有变化,说明溶液中不含硝酸铜和硝酸银,故滤渣一定有铜和银,铁有可能有剩余,故猜想I为:铜、银;
[分析思考]
因为溶液中含有硝酸亚铁,锌能和硝酸亚铁反应,故不可能存在锌,故小明的猜想不正确的原因是锌和硝酸亚铁会反应生成硝酸锌和铁,化学反应方程式为:Zn+Fe(NO3)2=Zn(NO3)2+Fe;
[进行实验]
加稀盐酸有气泡产生,溶液变成浅绿色,说明有金属铁,故滤渣成分为银、铁、铜,故猜想II正确;
[拓展应用]
硝酸银和硝酸铜的混合溶液中加入锌粉,锌先和硝酸银反应生成硝酸锌和银,化学反应方程式为:Zn+2AgNO3=Zn(NO3)2+2Ag,反应中硝酸银和硝酸锌质量比为:340:189,溶液溶质由硝酸银变为硝酸锌,故溶质质量变小,故b点时锌把硝酸银反应完全,故溶液中存在溶质为硝酸铜和硝酸锌,故存在的金属阳离子为铜离子和锌离子,离子符号为:Cu2+、Zn2+;
b点至c点是锌和硝酸铜反应,c点时把硝酸铜反应完全,故d点时固体有生成的铜和银,以及过量的锌三种金属固体。
21.(1)解:设锌粒中纯锌的质量是x,
,,
答:锌粒中纯锌的质量是6.5g。
(2)解:反应中硫酸恰好完全反应,所得溶液中溶质为硫酸锌,设反应后所得溶液中溶质的质量是y,
,,
设反应前硫酸的质量为z,
,,
则硫酸溶液中水的质量为100g-9.8g=90.2g,反应过程中水不参加反应,反应后水的质量仍为90.2g,故硫酸锌溶液的溶质质量分数为
,
答:反应后所得溶液中溶质的质量分数为15.1%。
【详解】(1)见答案;
(2)见答案;
答案第1页,共2页
答案第1页,共2页
一、选择题
1.同学们为研究一氧化碳的性质进行了下面实验。下列关于该实验叙述正确的是
A.该实验验证了一氧化碳具有氧化性
B.丙过程中能观察到铜丝从红色变成了黑色
C.石灰水的作用是验证反应生成的二氧化碳
D.待反应结束冷却后软质塑料瓶会膨胀
2.现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会,在Y表面有银析出,而Z没有变化。根据以上实验事实,相关分析错误的是
A.三种金属可能分别是铁、铜、银
B.Y一定能从硫酸铜溶液中置换出铜
C.X与稀盐酸反应后溶液的质量一定增大
D.三种金属活动性由强到弱的顺序是X>Y>Z
3.区别下列各组物质所采用的方法不能达到目的的是
A.氮气和二氧化碳——燃着的木条 B.食醋和酱油——闻气味
C.氧气和空气——带火星的木条 D.铁片和铜片——观察颜色
4.下列物质中,不能用金属与酸反应直接制得的是
A. B. C. D.
5.下列叙述、对应的化学方程式、所属基本反应类型都正确的是
A.用稀硫酸洗去附着在试管壁上的铜: 置换反应
B.实验室制氢气: 分解反应
C.铝在空气中形成氧化膜: 化合反应
D.比较铜和银的活动性顺序: 置换反应
6.观察是学好化学的一个重要方法。下列对实验现象描述正确的是
A.铁丝伸入稀盐酸中,其表面产生大量氢气
B.铁丝放在空气中,其表面很快形成红色锈迹
C.铁丝在氧气中剧烈燃烧、火星四射、生成白色固体
D.铁丝伸入硫酸铜溶液中,其表面形成一层紫红色固体
7.下列实验现象描述正确的是
A.向锌粒中滴加足量稀硫酸:银白色固体表面出现气泡、固体减少至消失、放热
B.镁在空气中燃烧:发出强光,放出热量,产生大量的白雾
C.向硫酸铜溶液中加入铁钉:紫红色固体表面覆盖一层白色物质,溶液变成浅绿色
D.在空气中点燃一氧化碳:产生明亮的蓝紫色火焰,放出热量
8.下列图像能正确体现与实验对应关系的是
A.在一定温度下,向一定质量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B.向氢氧化钠溶液中不断的加水稀释
C.向盐酸和氯化铜混合溶液中逐渐滴加NaOH溶液
D.等质量的Zn粉和Mg粉分别与足量的等质量分数的稀盐酸反应
9.下列化学方程式书写正确的是
A.4P+5O2=2P2O5 B.2KNO3+Ba(OH)2=Ba(NO3)2+2KOH
C.2Fe+3CuSO4=Fe2(SO4)3+3Cu D.CH4+2O2CO2+2H2O
10.下列物质属于纯净物的是
A.酸奶
B.生铁
C.金刚石
D.石灰水
11.在“宏观——微观——符号”之间建立联系,是化学学科特有的思维方式。下图表示两种气体发生的化学反应的微观示意图,其中相同的球代表同种原子。下列说法正确的是
A.反应物中包含两种化合物
B.该反应属于置换反应
C.该反应有三种新物质生成
D.参加反应的反应物与生成物的分子个数比为8:9
12.某同学将铁粉和铜粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和蓝色滤液。下列判断中,不正确的是
a 滤渣中一定含有铜 b 滤液中一定含有 Cu2+ c 滤液中一定含有Fe2+d向滤渣中加稀盐酸可能有气泡 e 所得滤液质量一定比原溶液质量小
A.ad B.be C.abe D.acd
二、填空与简答
13.北宋沈括《梦溪笔谈》中记载:信州铅山有苦泉,流以为涧。挹其水熬之,则成胆矾(硫酸铜晶体),烹胆矾则成铜,熬胆矾铁釜,久之亦化为铜。
(1)“挹其水熬之,则成胆矾”,该过程属于 (选填“蒸发”或“降温”)结晶;
(2)“烹胆矾则成铜”的过程中发生的是 (选填“物理”或“化学”)变化;
(3)“熬胆矾铁釜,久之亦化为铜”,其中发生反应化学方程式为 ,该反应说明两种金属的活动性顺序为 ;
14.小明同学对金属的有关化学性质进行梳理和总结。请完成下列问题。
(1)对下图中几种金属的原子结构示意图进行分析,发现金属原子最外层电子一般都 4个(填“大于”或“小于”),在化学反应中容易 (填“得到”或“失去”)电子变成阳离子,小明同学判断D和E的化学性质相似,他的依据是 ;
A. B. C. D. E.
(2)将一锌片投入稀硫酸中,观察到的现象是 ,反应的化学方程式为 。
15.平昌冬奥会闭幕式上,熊猫木偶惊艳亮相。木偶要经受极寒考验,承受坚硬冰面的撞击,还要满足现场表演的特殊要求。最终确定用铝合金管材和碳纤维条相结合,配合LED串灯珠进行制作。
(1)铜丝线用于连接LED灯,主要是利用其 性:使用铅合金是避免钢铁锈蚀。铁生锈的条件是铁与 同时接触。金属腐蚀造成的损失巨大,下列对金属的防护措施不合理的是 (填序号)。
A齿轮表面涂油 B.将菜刀刷油漆保护
C.钢刀浸泡在盐水中 D.车圈镀铬
(2)为比较X、Y、Z三种金属活动性大小,进行如下实验。则X、Y、Z三种金属的活动性由强到弱的顺序是___________(填序号)。
A.Z>Y>X B.X>Y>Z C.Y>X>Z D.Y>Z>X
(3)近年来,我国高铁建设飞速发展,建造高铁需要大量的钢铁。图为模拟炼铁的装置,写出a中发生反应的化学方程式 ;描述b处反应的现象 。
16.化学与人类生活、生产活动息息相关。根据所学知识回答下列问题。
(1)铁常用来制作炊具。这是利用了铁的 。
(2)食用“加铁酱油”可预防贫血,其中“铁”是指 (填“元素”或“原子”)。
(3) 是理想的清洁高能燃料。(填“氢气”或"天然气”)
17.人类每年要提取数以亿吨计的金属,用于工农业生产和其他领域。
(1)汽车电路中一般用铜作导线,这是利用铜的 ;汽车车体表面喷漆不仅美观,而且可有效防止铁与 接触而生锈。
(2)炼铁的原理是利用一氧化碳和氧化铁的反应,化学方程式为 。
(3)某化工厂排出澄清的废水,其中可能含有的离子是Ba2+、Fe3+、Fe2+、Ag+、Cu2+、SO42-、Cl-、NO3-。[已知:白色的Fe(OH)2沉淀在空气中会迅速转化为红褐色的Fe(OH)3。]
①取少量废水,加入过量稀盐酸,产生白色沉淀的化学式为 。过滤,将滤液分成两份,一份加入稀硫酸,产生白色沉淀的化学式为 ;另一份加入过量NaOH溶液,产生蓝色沉淀,该过程中与OH-反应的离子是 (写离子符号)。
②某化学兴趣小组设计了一个处理该废水的实验方案,部分流程如下:
下列说法正确的是 (填字母)。
A.固体A中一定含有Ag和Cu,可能含有Fe
B.溶液B中的溶质有Ba(NO3)2、Fe(NO3)2
C.废水中含有Ba2+、Ag+、Cu2+、Fe2+、NO3
D.通过该流程可以除去废水中原有的金属离子
18.如图所示是A-F六种物质相互间的关系,用“→”表示物质间存在转化关系,用“一”表示两端的物质能发生化学反应。B、C是组成元素相同的两种液体;A、E、F是初中阶段常见的三种氧化物,F是黑色固体。回答下列问题:
(1)E物质为: (写名称)。
(2)A→B反应的化学方程式: 。
(3)D→F反应的化学方程式: 。
(4)B→D反应的基本类型是 。
19.为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 。
(3)写出步骤②所涉及的化学反应方程式 ,判断步骤②中稀硫酸是否适量依据是: 。
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂 (填标号)。
a.硫酸铜溶液 b.氯化钠溶液 c.硝酸银溶液。
写出有关化学反应方程式 。
三、科学探究题
20.学习完金属的化学性质,兴趣小组进行了如图所示的实验。
【实验一】同学们进行如图一所示的实验,验证铁、锌、铜、银四种金属活动性强弱。
(1)试管①中观察到的实验现象是铁粉表面有红色固体,溶液由 。
(2)试管③中反应的化学方程式是 。
(3)你认为通过上述图一所示的三个实验能否验证铁、锌、铜、银四种金属在溶液中的活动性强弱 (填“能”或“不能”)。
【实验二】在完成实验一的过程中,同学们将试管①②③内反应后的物质都倒入废液缸中(如图二)。小组同学对废液缸中混合物的成分产生了探究兴趣。待混合物充分反应后,过滤,得到滤渣和浅绿色滤液。
(4)小明将铁丝放入浅绿色滤液中,一段时间后,铁丝表面没有发生变化。由此判断滤液中一定含有的溶质是 (填化学式)。
(5)探究滤渣的成分
【提出问题】滤渣的成分是什么?
【作出猜想】小明的猜想:银、铜、铁、锌
你的猜想:猜想I ; 猜想II:银、铜、铁
【分析思考】同学们认为小明的猜想不正确,结合上述的实验现象分析,小明的猜想不正确的原因是 。(请用方程式解释)
【进行实验】实验证明猜想II正确,请你完成下列实验方案。
实验步骤 实验现象 结论
取少量滤渣样品,加入稀盐酸。 有气泡,溶液变成浅绿色。 猜想 正确
【拓展应用】
为继续研究金属的化学性质,学习小组同学向一定质量的硝酸银和硝酸铜的混合溶液中加入锌粉,溶液质量与加入锌的质量关系如图所示。那么,在b点时,溶液中存在的金属阳离子是 (写离子符号);d点的固体的成分为 (写名称)。
四、计算题
21.将10g不纯的锌粒(杂质不溶于水也不溶于酸)投入到100g稀硫酸中,恰好完全反应,得到了0.2g气体。试计算:
(1)锌粒中纯锌的质量;
(2)反应后所得溶液中溶质的质量分数。(结果保留0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】甲中铜加热和空气中氧气反应生成氧化铜,乙、丙中氧化铜和一氧化碳反应生成铜和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水。
【详解】A、乙中氧化铜和一氧化碳反应生成铜和二氧化碳,一氧化碳在反应过程中得到氧元素,验证了一氧化碳具有还原性,故错误;
B、丙过程中氧化铜和一氧化碳反应生成铜和二氧化碳,能观察到黑色的氧化铜丝变成了红色的铜,故错误;
C、二氧化碳能使澄清石灰水变浑浊,装置中石灰水的作用是检验生成的二氧化碳,故正确;
D、待反应结束冷却后,由于消耗了一氧化碳,生成的二氧化碳又被澄清石灰水吸收,导致瓶内气压降低,软质塑料瓶会变扁,故错误。
故选:C。
2.B
【分析】把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应,说明金属活动性X>(H)>Y;把Y和Z分别放入硝酸银溶液中,过一会,在Y表面有银析出,而Z没有变化,说明金属活动性Y>Ag≥Z。
【详解】A、由以上分析可知,金属活动性:X>(H)>Y>Ag≥Z,故三种金属可能分别是铁、铜、银,A正确;
B、金属活动性:(H)>Y>Ag,(H)>Cu>Ag,无法判断Y与Cu 的金属活动性强弱,故Y不一定能从硫酸铜溶液中置换出铜,B错误;
C、金属活动性X>(H),金属X与稀盐酸反应生成氢气,因为金属的质量一定大于生成的氢气的质量,故反应后溶液的质量一定增大,C正确;
D、由以上分析可知,三种金属活动性由强到弱的顺序是X>Y>Z,D正确;
故选B。
3.A
【详解】A、氮气和二氧化碳都不支持燃烧,都能使燃着的木条熄灭,所以A方法不能达到目的;
B、有酸味的是食醋,所以B方法能达到目的;
C、氧气能使带火星木条复燃,所以C方法能达到目的;
D、铜片呈紫红色,铁片呈银白色,所以D方法能达到目的。
故选A。
4.C
【详解】A、在金属活动性顺序中,锌位于氢元素前面,能和硫酸反应生成硫酸锌和氢气,该选项不符合题意;
B、在金属活动性顺序中,镁位于氢元素前面,能和盐酸反应生成氯化镁和氢气,该选项不符合题意;
C、在金属活动性顺序中,铁位于氢元素前面,但铁和盐酸反应生成FeCl2,而不是FeCl3,该选项符合题意;
D、在金属活动性顺序中,铝位于氢元素前面,能和硫酸反应生成硫酸铝和氢气,该选项不符合题意。
故选C。
5.C
【详解】A、在金属活动性顺序中,铜位于氢元素后面,则不能与硫酸反应,该选项不正确;
B、电解水不仅生成氢气,还生成氧气,不能用作实验室制取氢气,且方程式中,氢气没有标箭头,该选项不正确;
C、铝在空气中能与氧气反应生成一层致密的氧化铝薄膜,反应方程式正确,且该反应为多种物质生成一种物质的反应,属于化合反应,该选项正确;
D、氯化银为沉淀,铜不能与氯化银反应,该选项不正确。
故选C。
6.D
【详解】A. 金属活动性顺序中,排在氢前面的金属能与稀盐酸反应生成氢气,所以铁丝伸入稀盐酸中,其表面产生大量气泡,经检验该气泡是氢气,此选项错误;
B. 铁丝生锈是缓慢氧化,所以将铁丝放在空气中,其表面不会很快形成红色锈迹,此选项错误;
C. 铁丝在氧气中剧烈燃烧、火星四射、生成黑色固体,此选项错误;
D. 金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,则将铁丝伸入硫酸铜溶液中,其表面形成一层紫红色固体,此选项正确。
故选D。
7.A
【分析】A、根据锌的金属活动性比氢强,进行分析判断;
B、根据镁在空气中燃烧的现象,进行分析判断;
C、根据铁的金属活动性比铜强,进行分析判断;
D、根据一氧化碳燃烧的现象,进行分析判断。
【详解】A、锌的金属活动性比氢强,能与稀硫酸反应,向锌粒中滴加足量稀硫酸,银白色固体表面出现气泡、固体减少至消失、放热,故A选项说法正确。
B、镁在空气中燃烧,发出强光,放出热量,产生大量的白烟,而不是白雾,故B选项说法错误。
C、铁的金属活动性比铜强,向硫酸铜溶液中加入铁钉,银白色固体表面覆盖一层紫红色物质,溶液变成浅绿色,故C选项说法错误。
D、在空气中点燃一氧化碳,产生淡蓝色火焰,放出热量,故D选项说法错误。
故选A。
【点睛】掌握金属的化学性质、常见物质燃烧的现象是正确解答本题的关键。
8.A
【详解】A、在一定温度下,向一定质量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体,则溶液达到饱和后溶质质量分数不变,正确;
B、向氢氧化钠溶液加水时溶液的碱性变弱,但是不可能成中性,更不可能成酸性,错误;
C、氢氧化钠先与盐酸反应,开始不产生沉淀,后于氯化铜反应生成沉淀,错误;
D、等质量的Zn粉和Mg粉分别与足量的等质量分数的稀盐酸反应,镁反应的快,且生成的氢气质量大,错误。
故选:A。
9.D
【详解】A、磷与氧气点燃后生成五氧化二磷,化学方程式为,故错误;
B、硝酸钾与氢氧化钡不能反应,因为生成物没有沉淀或气体或水,不符合复分解反应的条件,故错误;
C、铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe+CuSO4=FeSO4+Cu,故错误;
D、甲烷与氧气点燃后生成二氧化碳和水,化学方程式为CH4+2O2 CO2+2H2O,故正确;
故选D。
10.C
【分析】纯净物:由一种物质组成的物质
混合物:由多种物质组成的物质
【详解】A、酸奶中含有牛奶、乳酸菌、食品添加剂等物质,属于混合物。A错误;
B、生铁指的是铁、碳的合金,属于混合物。B错误;
C、金刚石指的是由碳元素组成的单质,属于纯净物。C正确;
D、石灰水是氢氧化钙的水溶液,包括氢氧化钙和水,属于混合物。D错误。
故选C。
11.B
【详解】试题分析:A、化合物分子由不同中原子构成,单质分子由同种原子构成,故根据微观示意图,反应物中只有一种化合物,还有一种是单质,错误,B、通过微观示意图可看出:反应前是一种单质和一种化合物,反应后也是一种单质和一种化合物,故该反应是置换反应,正确,C、反应后只生成两种物质,其中一种的过量的反应物,错误,D、根据化学反应的微观示意图,参加反应的反应物与生成物的分子个数比为7:8,错误,故选B
考点:微观示意图,化学反应基本类型
12.A
【分析】金属活动性顺序中,排在前面的金属能把后面的金属从其盐溶液中置换出来,已知三种金属的活动性顺序是铁>H>铜>银,将铁粉和铜粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和蓝色滤液,滤液呈蓝色,说明滤液中一定含有硝酸铜,铜与硝酸银反应能生成硝酸铜和银,故滤渣中一定含有银;滤液中含有硝酸铜,故此时滤渣中则一定不含能与硝酸铜反应的铁,故向滤渣中加稀盐酸不可能由气泡,同时说明滤液中一定含有Fe2+。该过程中可能发生的反应即相应的质量关系如下:
以上可能发生的三个化学反应中,每个反应后溶质的质量都比反应前变小了,故所得滤液质量一定比原溶液质量小。
【详解】根据上述分析可知,滤液中一定含有Cu2+和Fe2+,滤渣中一定不含铁,且所得滤液质量一定比原溶液质量小。故不正确的判断是ad,应选A。
13.(1)蒸发
(2)化学
(3) Fe>Cu
【详解】(1)“挹其水熬之,则成胆矾”,该过程需要加热,故属于蒸发;
(2)胆矾的化学式是CuSO4 5H2O,“烹胆矾则成铜”的过程中,有其他物质生成,故发生的是化学变化;
(3)“熬胆矾铁釜,久之亦化为铜”,其中发生的反应为铁和硫酸铜反应生成了铜和硫酸亚铁,故化学方程式为;
该反应能发生,说明两种金属的活动性顺序为Fe>Cu;
14.(1) 小于 失去 两种原子的最外层电子数相同
(2) 锌片表面产生气体,锌片减少(或消失)
【详解】(1)金属原子最外层电子一般都小于4个,在化学反应中容易失去电子变成阳离子;元素的性质是由原子的最外层电子数决定的,小明判断D和E的化学性质相似,依据是两种原子的最外层电子数相同;
(2)锌和稀硫酸反应生成硫酸锌和氢气,则现象是锌片表面产生气体,锌片减少(或消失),反应的方程式是。
15.(1) 导电 氧气和水 BC
(2)B
(3) 澄清石灰水变浑浊
【详解】(1)铜丝线用于连接LED灯,主要是利用铜丝具有良好的导电性,铁生锈实际上是铁与空气中的氧气和水等发生化学反应的过程;
A、齿轮表面涂油,可以阻断与氧气和水的接触,能防止铁生锈,故选项防护措施合理;
B、将菜刀刷油漆保护,能防止铁生锈,但不符合生活实际,故防护措施不合理;
C、钢刀浸泡在盐水中不但不能控制生锈的条件,反而能够加速生锈的过程,故防护措施不合理;
D、车圈镀铬能起到保护金属的作用,能起到防锈的作用,故选项防护措施合理;
故填:导电;氧气和水;BC;
(2)将X加入稀硫酸中,产生氢气,说明活动性X>H;
将Y加入稀硫酸中,无明显现象,说明活动性H>Y;
将Y加入硝酸银溶液中,有银析出,说明活动性Y>Ag;
将Z加入硝酸银溶液中,无明显现象,说明活动性Ag>Z;
综上所述,金属活动性为:X>Y>Z,故选B;
(3)a中一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,由于一氧化碳和氧化铁反应产生二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以b处的现象是澄清石灰水变浑浊,故填:澄清石灰水变浑浊。
16.(1)导热
(2)元素
(3)氢气
【详解】(1)铁可作炊具,是因为铁具有良好的导热性。
(2)物质都是由元素组成,“加铁酱油”中的铁是指元素。
(3)氢气燃烧只生成水,且热值高,为最理性的清洁高能燃料。
17.(1) 导电性 氧气、水蒸气(或)
(2)
(3) BD
【详解】(1)铜作导线利用金属铜的导电性;和水同时接触,故填导电性。
(2)根据铁生锈的条件可知防止金属铁与氧气,故填氧气、水蒸气(或)。
(3)①取少量废水,加入过量稀盐酸,产生白色沉淀说明废水中含有氯离子,故产生的白色沉淀的化学式为,故①填;加入稀硫酸,产生白色沉淀说明废水中含有钡离子,白色沉淀的化学式为,故②填;加入过量NaOH溶液,产生蓝色沉淀,该过程中与OH-反应的离子是和前一步过量的 ,故③填;
②根据废水中的离子能稳定存在,废水中含有的离子为铜离子、钡离子、银离子,所以废水中的阴离子只能为硝酸根离子;依据实验方案产生红褐色沉淀,故加入的X物质为金属铁;A、金属X是过量的,故故固体A中一定含有,A错,不符合题意;
B、因为B加氢氧化钠变为白色沉淀后变为红褐色沉淀,故其含有硝酸亚铁,废水职工含有钡离子和硝酸根离子,故溶液B中的溶质有,故B正确,符合题意;
C、废水中含有,亚铁离子不存在,C错,不符合题意;
D、铁和铜离子、银离子发生反应,长城的亚铁离子变成沉淀,故可以通过该流程可以除去废水中原有的金属离子,D正确,符合题意。
故选BD
18. 一氧化碳 分解反应
【分析】B、C是组成元素相同的两种液体;且C能转化为B和D,可推出C为过氧化氢,B为水,D为氧气,A、E、F是初中阶段常见的三种氧化物,F是黑色固体,且氧气能转化为F,氧气能与E反应,E能与F反应,可推出E为一氧化碳,F为氧化铜,氧化铜能转化为A,A能转化为水,可推出A为二氧化碳,代入验证,符合题意。
【详解】(1)由分析可知,E为一氧化碳;
(2)A为二氧化碳,B为水,二氧化碳可与氢氧化钠反应生成碳酸钠和水,该反应的化学方程式为:;
(3)D为氧气,F为氧化铜,铜可与氧气在加热的条件下反应生成氧化铜,该反应的化学方程式为:;
(4)B为水,D为氧气,,该反应符合“一变多”的特点,属于分解反应。
19. Fe或铁) Cu(或铜) 过滤 根据操作②中不再产生气泡为依据(合理即可) a
【详解】(1)铁可以被磁铁吸引,铜和镁不能,操作①中被磁铁吸引的金属A是铁;金属B不能与稀硫酸反应,则金属B是铜;
(2)操作将固体与液体分离,a的名称是:过滤;
(3)步骤②中镁与稀硫酸反应产生硫酸镁和氢气的化学反应方程式:Mg+H2SO4=MgSO4+H2↑,判断步骤②中稀硫酸是否适量依据是:根据操作②中刚好不再产生气泡,则硫酸巧合完全反应;
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂
a.硫酸铜溶液,镁与硫酸铜反应恰好产生硫酸镁和铜;故选项正确;
b.氯化钠溶液,引入新的杂质;故选项错误;
c.硝酸银溶液,引入新的杂质;故选项错误;故选a。
镁与硫酸铜反应恰好产生硫酸镁和铜的化学方程式:Mg+CuSO4=MgSO4+Cu。
20.(1)蓝色变为浅绿色
(2)Cu+2AgNO3=Cu(NO3)2+2Ag
(3)能
(4)Fe(NO3)2、Zn(NO3)2
(5) 银、铜 Zn+Fe(NO3)2=Zn(NO3)2+Fe II Zn2+、Cu2+ 锌、铜、银
【详解】(1)铁和硝酸铜反应生成硝酸亚铁和铜,含有铜离子的溶液中为蓝色,含有亚铁离子的溶液中为浅绿色,故溶液由蓝色变为浅绿色;
(2)铜和硝酸银反应生成硝酸铜和银,化学反应方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)图①可知证明铁比铜活泼,图②可以证明锌比铁活泼,图③可证明铜比银活泼,故四种金属活动性强弱是:锌>铁>铜>银,故所示的三个实验能验证铁、锌、铜、银四种金属在溶液中的活动性强弱;
(4)待混合物充分反应后,过滤,得到滤渣和浅绿色滤液,说明溶液中含有亚铁离子,将铁丝放入浅绿色滤液中,一段时间后,铁丝表面没有发生变化,说明溶液中不含硝酸铜和硝酸银,因为锌活动性最强,滤液中一定含有的溶质是硝酸亚铁和硝酸锌,化学式为:Fe(NO3)2、Zn(NO3)2;
(5)[作出猜想]
因将铁丝放入溶液中没有变化,说明溶液中不含硝酸铜和硝酸银,故滤渣一定有铜和银,铁有可能有剩余,故猜想I为:铜、银;
[分析思考]
因为溶液中含有硝酸亚铁,锌能和硝酸亚铁反应,故不可能存在锌,故小明的猜想不正确的原因是锌和硝酸亚铁会反应生成硝酸锌和铁,化学反应方程式为:Zn+Fe(NO3)2=Zn(NO3)2+Fe;
[进行实验]
加稀盐酸有气泡产生,溶液变成浅绿色,说明有金属铁,故滤渣成分为银、铁、铜,故猜想II正确;
[拓展应用]
硝酸银和硝酸铜的混合溶液中加入锌粉,锌先和硝酸银反应生成硝酸锌和银,化学反应方程式为:Zn+2AgNO3=Zn(NO3)2+2Ag,反应中硝酸银和硝酸锌质量比为:340:189,溶液溶质由硝酸银变为硝酸锌,故溶质质量变小,故b点时锌把硝酸银反应完全,故溶液中存在溶质为硝酸铜和硝酸锌,故存在的金属阳离子为铜离子和锌离子,离子符号为:Cu2+、Zn2+;
b点至c点是锌和硝酸铜反应,c点时把硝酸铜反应完全,故d点时固体有生成的铜和银,以及过量的锌三种金属固体。
21.(1)解:设锌粒中纯锌的质量是x,
,,
答:锌粒中纯锌的质量是6.5g。
(2)解:反应中硫酸恰好完全反应,所得溶液中溶质为硫酸锌,设反应后所得溶液中溶质的质量是y,
,,
设反应前硫酸的质量为z,
,,
则硫酸溶液中水的质量为100g-9.8g=90.2g,反应过程中水不参加反应,反应后水的质量仍为90.2g,故硫酸锌溶液的溶质质量分数为
,
答:反应后所得溶液中溶质的质量分数为15.1%。
【详解】(1)见答案;
(2)见答案;
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
