1.3.氧化还原反应 同步练习(含解析)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.氧化还原反应 同步练习(含解析)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 654.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 00:24:50 | ||
图片预览




文档简介
1.3.氧化还原反应基础检测题二-2023-2024学年高一上学期化学人教版(2019)必修第一册
一、单选题
1.下列转化中,需要加入还原剂才能实现的是
A.N2→NH3 B.H2O2→O2 C.CaCO3→CO2 D.HCl→Cl2
2.下列反应不是氧化还原反应
A.CO+CuO=Cu+CO2
B.HCl+AgNO3=AgCl↓+HNO3
C.Cl2+H2O=HCl+HClO
D.Br2+2KI =2KBr+I2
3.下列反应属于氧化还原反应的是
A.H2O+CaO=Ca(OH)2 B.Cu+2FeCl3=2FeCl2+CuCl2
C.NH4ClNH3↑+HCl↑ D.CaCO3+2HCl=CaCl2+H2O+CO2↑
4.下列反应中画线物质是还原剂的是
A. B.
C. D.
5.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中,下列说法不正确的是
A.氧化剂是KClO3,还原剂是HCl
B.每生成3个Cl2,转移的电子为5个
C.每消耗1个KClO3,被氧化的HCl为6个
D.该反应中HCl既表现还原性又表现酸性
6.下列物质常用作还原剂的是
A.KI B. C. D.
7.海水晒盐后精制得到;氯碱工业电解饱和溶液得到和;向海水晒盐得到的卤水中通可制溴;从海水中还能提取镁;海洋中许多藻类植物具有富集碘的能力,从海带中可以提取碘。下列有关离子方程式书写正确的是
A.电解饱和食盐水:
B.氢氧化镁与盐酸反应:
C.卤水中通入制取粗溴:
D.和在酸性条件下的反应:
8.氢化钠()可作野外生氢剂。其化学反应原理为:。该反应的氧化剂是
A. B. C. D.
9.是HClO的酸性氧化物,具有强氧化性,加热易分解,可通过如下反应制取:。下列说法不正确的是
A.还原产物是NaCl
B.氧化剂与还原剂的物质的量之比为1:1
C.完全溶于水微热,会产生黄绿色气体
D.与还原剂接触或加热能发生剧烈反应,甚至爆炸
10.如图是某化学反应的微观示意图。下列有关说法正确的是
A.该反应是复分解反应
B.反应方程式为NH3+O2H2O+N2
C.生成物丙、丁的质量比为9:14
D.反应前后只有一种元素的化合价不变
11.氧化还原反应广泛地存在于生产和生活之中。下列过程中不涉及氧化还原反应的是( )
A.燃放鞭炮 B.食物腐败
C.金属冶炼 D.明矾净水
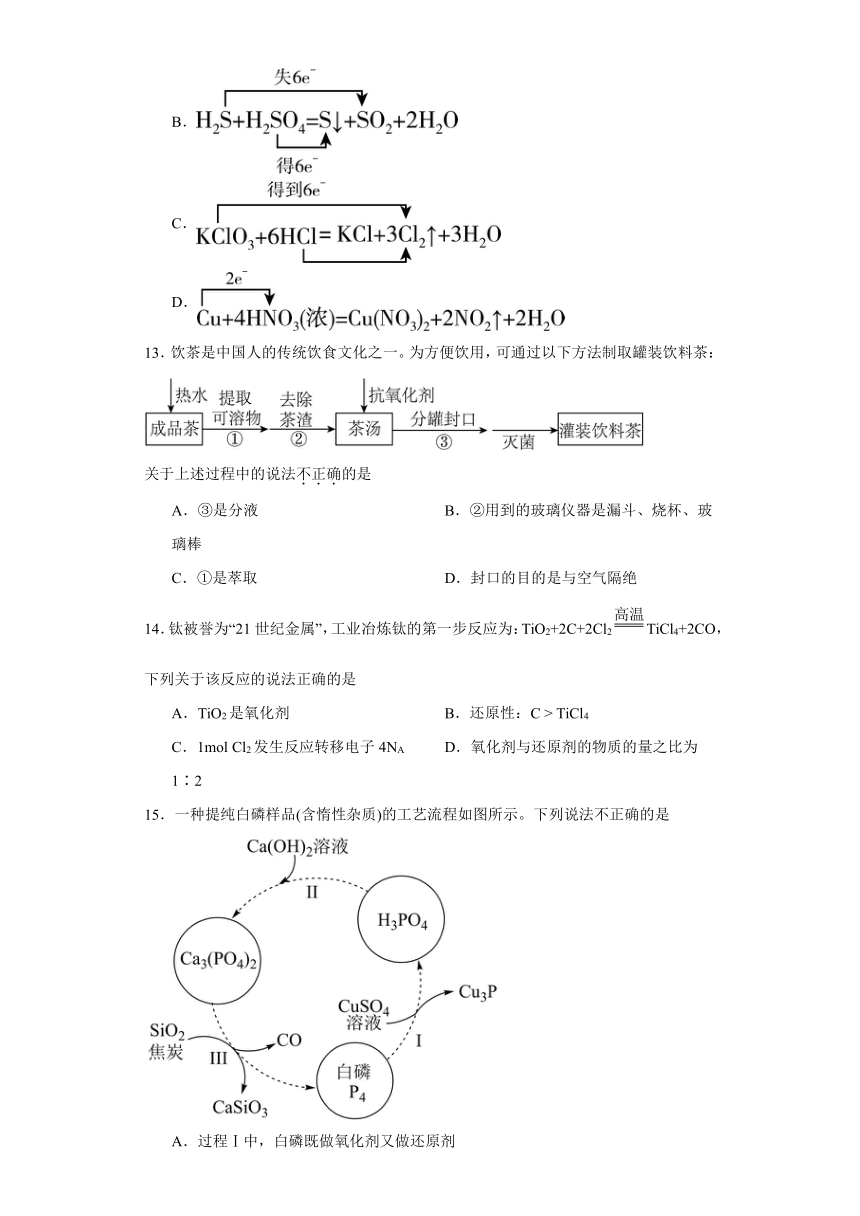
12.下列化学反应中电子转移方向、数目表示正确的是
A.
B.
C.
D.
13.饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶:
关于上述过程中的说法不正确的是
A.③是分液 B.②用到的玻璃仪器是漏斗、烧杯、玻璃棒
C.①是萃取 D.封口的目的是与空气隔绝
14.钛被誉为“21世纪金属”,工业冶炼钛的第一步反应为:TiO2+2C+2Cl2TiCl4+2CO,下列关于该反应的说法正确的是
A.TiO2是氧化剂 B.还原性:C > TiCl4
C.1mol Cl2发生反应转移电子4NA D.氧化剂与还原剂的物质的量之比为1∶2
15.一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法不正确的是
A.过程Ⅰ中,白磷既做氧化剂又做还原剂
B.过程Ⅱ中,发生复分解反应
C.过程Ⅲ中,反应的化学方程式为:
D.理论上,通过本提纯工艺不会产生白磷损失
16.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1Na2SO4溶液:Ba2+、OH-、NO3-、Cl-
B.0.1 mol·L-1KMnO4溶液:Na+、SO32-、Cl-、I-
C.0.1 mol·L-1KOH溶液:Na+、Cl-、CO32-、AlO2-
D.0.1 mol·L-1HCl溶液:K+、Mg2+、HCO3-、SO42-
17.向含0.1mol KI的溶液中滴加少量淀粉后,不断通入过量Cl2,溶液由无色变蓝色后又变无色。继续向所得无色溶液中继续通入SO2,溶液由无色变蓝色后又变无色。下列说法错误的是
A.通入Cl2后溶液显蓝色,说明元素非金属性强弱关系为:Cl>I
B.Cl2过量后,溶液中发生的反应为:
C.SO2将还原为I2,溶液pH减小
D.通入SO2至溶液呈无色,SO2转移电子数总共为0.6 NA个
18.关于反应,下列说法不正确的是
A.发生氧化反应 B.是还原产物
C.氧化剂与还原剂的物质的量之比为 D.生成3.2g时,转移1mol电子
19.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原.25.00mL0.5mol/L羟胺的酸性溶液能与50mL0.25mol/LKMnO4酸性溶液完全作用(已知MnO4﹣被还原为Mn2+)则上述反应中羟胺的氧化产物是
A.N2 B.N2O C.NO D.NO2
20.用下图表示的一些物质或概念间的从属关系中不正确的是
X Y Z
A 酸、碱、盐 电解质 化合物
B 胶体 分散系 混合物
C 置换反应 氧化还原反应 离子反应
D 碱性氧化物 金属氧化物 氧化物
A.A B.B C.C D.D
21.关于反应I:3I2+6NaOH=5NaI+NaIO3+3H2O和反应II:I2+5Cl2+6H2O=2HIO3+10HCl,下列说法正确的是
A.NaIO3和HIO3均为氧化产物
B.反应I中氧化剂与还原剂的物质的量之比为1∶5
C.两反应中I2都只发生了氧化反应
D.两反应中分别消耗2.54gI2时,转移电子数目相同
22.实验证明,以下7种物质是一个氧化还原反应的反应物和生成物:、、S、、、和,下列说法正确的是
A.这7种物质中,只有和是反应物
B.被还原的元素是S
C.发生氧化反应的物质是
D.氧化剂与还原剂的物质的量之比为2∶5
23.硝酸是一种常见的氧化性酸,它可以与很多种物质发生氧化还原反应,常用于溶解一些不易溶解的物质。与一定浓度的反应,生成、、、NO和。当产物和NO的分子数目相等时。下列说法正确的是
A.1个参加反应时有9个电子转移
B.参加反应的与的个数之比2:15
C.反应中既是氧化剂,又是还原剂
D.产物和的个数之比为1:1
24.如果反应4P + 3KOH + 3H2O =3KH2PO2+ PH3中转移0.6mol电子,消耗KOH的质量为( )
A.5.6克 B.16.8克 C.33.6克 D.100.8克
25.11.9g金属锡(Sn)跟100mL12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8 mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是( )
A.SnO2·4H2O B.Sn(NO3)4
C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
二、填空题
26. 非金属单质A经下图所示的过程可转化为含氧酸D,已知D为强酸。请回答下列问题。
ABCD
(1)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是 。
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为 ;体现D的什么性质 。
(2)氮化硅Si3N4)可由石英与焦炭在高温的氮气流中通过以下反应制备:
3SiO2+ 6C+ 2N2Si3N4 + 6CO
①请写出氮化硅中氮元素的化合价是 ,以上反应中的氧化剂是 ,还原剂是 。
②若该反应生成11.2L一氧化碳(标准状况),则生成氮化硅的质量是 ( 保留小数点后一位)。
27.完成下列问题。
(1)是一种常用的消毒剂,我国从2000年起逐步用代替氯气对饮用水进行消毒。在消毒水时,还可将水中的、等转化成和等难溶物除去,说明具有 性。
(2)工业上可以用下列反应制备:,将上述方程改写为离子方程式: ,请用双线桥法标出上述反应电子转移的方向和数目: 。
(3)工业上制备的反应原理为:。
①在参加反应的盐酸中,起酸性作用的HCl与还原剂(被氧化)作用的HCl的质量比为 。
②若有106g的氯酸钠参与反应,被氧化的盐酸为 g。(的相对分子质量为106)
28.完成下列问题
(1)Fe2O3+2Al2Fe+Al2O3
①在该反应中 (填写元素名称)元素的化合价升高,该元素的原子 电子;而 (填写元素名称)元素的化合价降低,该元素的原子被 。
②该反应中, 是氧化剂 是氧化产物。
(2)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
①写出有关反应的化学方程式:
②10.1g KNO3完全反应时,被它氧化的碳为 g。
试卷第1页,共3页
参考答案:
1.A
【分析】当加入还原剂,被还原,化合价会降低,据此分析解答。
【详解】A.N元素化合价由0价降低至-3价,被还原,A正确;
B.O元素化合价由-1升高到0价,被氧化,B错误;
C.没有化合价变化,C错误;
D.Cl元素化合价由-1价升高至0价,被氧化,D错误;
故答案选A。
2.B
【详解】A.反应CO+CuO=Cu+CO2,C、Cu元素化合价改变,属于氧化还原反应,故不选A;
B.反应HCl+AgNO3=AgCl↓+HNO3,元素化合价不变,不是氧化还原反应,故选B;
C.反应Cl2+H2O=HCl+HClO,Cl元素化合价改变,属于氧化还原反应,故不选C;
D.反应Br2+2KI =2KBr+I2,Br、I元素化合价改变,属于氧化还原反应,故不选D;
选B。
3.B
【详解】A.H2O + CaO= Ca(OH)2该反应中没有元素化合价发生该变,属于非氧化还原反应,A错误;
B.该反应中铜元素和铁元素化合价发生变化,属于氧化还原反应,B正确;
C.NH4ClNH3 + HCl该反应中没有元素化合价发生该变,属于非氧化还原反应,C错误;
D.CaCO3 + 2HCl =CaCl2 + H2O+ CO2↑该反应中没有元素化合价发生该变,属于非氧化还原反应,D错误;
答案选B。
4.B
【详解】A.中画线物质为还原产物,是生成物,故A错误;
B.中画线物质所含元素化合价升高为还原剂,故B正确;
C.中画线物质所含元素化合价降低,为氧化剂,故C错误;
D.中画线物质为生成物,故D错误;
故答案为B。
5.C
【详解】A.在KClO3+6HCl=KCl+3Cl2↑+3H2O反应中,氧化剂是KClO3,还原剂是HCl,故A正确;
B.氧化剂是KClO3,还原剂是HCl,每生成3个Cl2,转移的电子为5个,故B正确;
C.每消耗1个KClO3,被氧化的HCl为5个,故C错误;
D.该反应中HCl为还原剂,同时表现酸性,故D正确;
故答案选C。
6.A
【详解】A.I-具有较强还原性,KI常用作还原剂,A符合题意;
B.具有较强氧化性,常用作氧化剂,B不符合题意;
C.具有较强氧化性,常用作氧化剂,C不符合题意;
D.中各元素化合价均较难改变,既不常用作还原剂也不常用作氧化剂,D不符合题意;
故选A。
7.C
【详解】A.食盐水是氯化钠的水溶液,饱和的氯化钠溶液在通电条件下反应生成氢氧化钠、氢气和氯气,反应的离子方程式为:,故A错误;
B.氢氧化镁是沉淀,在离子方程式中不能拆,故B错误;
C.的氧化性比强,卤水中通入制取粗溴,该反应的离子方程式为:,故C正确;
D.和在酸性条件下生成I2,中I元素由+5价下降到0价,中I元素由-1价上升到0价,根据得失电子守恒和电荷守恒配平离子方程式为:,故D错误;
故选C。
8.B
【详解】氢化钠()可作野外生氢剂。其化学反应原理为:,NaH中氢化合价升高,失去电子,水中氢化合价降低,得到电子,因此是氧化剂,NaH是还原剂,故B符合题意。
综上所述,答案为B。
9.C
【详解】A.该反应为歧化反应,Cl2中Cl元素化合价降低指向的产物是还原产物,其还原产物是NaCl,故A正确;
B.Cl2既是氧化剂也是还原剂,2molCl2反应时,有1mol做氧化剂,另外1mol做还原剂,氧化剂与还原剂的物质的量之比为1:1,故B正确;
C.Cl2O 是HClO的酸性氧化物,Cl2O 完全溶于水微热会发生反应产生HClO,HClO不稳定受热分解生成HCl和氧气,不会产生Cl2,故C错误;
D.Cl2O是HClO的酸性氧化物,具有强氧化性,加热易分解,与还原剂接触会发生剧烈反应,甚至会爆炸,故D正确;
故本题选C。
10.D
【详解】A.一种单质与化合物反应生成另一种单质和化合物,符合置换反应的特点,该反应是置换反应,A项错误;
B.根据微观示意图,可以看出反应物为氨气和氧气,生成物为水和氮气,书写化学方程式需要配平,所以该反应的化学方程为4NH3+3O26H2O+2N2,B项错误;
C.根据B中化学方程式可以看出,丙为水,丁为氮气,两种的物质质量比=(6×18):(2×14)=27:7,C项错误;
D.根据B中化学方程式可以看出,氮元素由-3价变为0价,氧元素的化合价由0价变为-2价,氢元素反应前后化合价不变,因此只有一种元素化合价未发生变化,D项正确;
答案选D。
11.D
【详解】A. 燃放鞭炮,火药受热发生剧烈爆炸反应,存在元素的化合价变化,为氧化还原反应,故A不选;
B. 食物腐败为食物缓慢氧化的过程,为氧化还原反应,故B不选;
C. 金属冶炼中金属元素的化合价降低,为氧化还原反应,故C不选;
D. 明矾净水涉及铝离子水解生成氢氧化铝胶体及其氢氧化铝胶体的聚沉,不存在元素的化合价变化,没有发生氧化还原反应,故D选;
故选D。
12.D
【详解】A.该反应中转移电子数是2,电子转移方向和数目为 ,故A错误;
B.H2S失电子生成S,H2SO4得电子生成SO2,转移电子数是2,电子转移方向和数目为 ,故B错误;
C.该反应中转移电子数是5,有的HCl被氧化生成Cl2,电子转移方向和数目为 ,故C错误;
D.该反应中Cu失电子、HNO3得电子,转移电子数是2,电子转移方向和数目为 ,故D正确;
故选:D。
13.A
【分析】由流程可知,溶解后萃取、过滤除去茶渣,茶汤中加抗氧化剂,防止氧化,封口灭菌后制得罐装饮料茶,由此分析。
【详解】A.③中混合物不分层,分罐密封,无分液操作,故A符合题意;
B.②为分离不溶性茶渣,为过滤,用到的玻璃仪器是漏斗、烧杯、玻璃棒,故B不符合题意;
C.萃取可分离出有机成分,①是萃取,故C不符合题意;
D.茶汤中加入了抗氧化剂,说明茶叶很容易被氧化,空气中的氧气具有氧化性,故封口的目的是与空气隔绝,故D不符合题意;
答案选A。
14.B
【分析】在反应TiO2+2C+2Cl2TiCl4+2CO中,C元素由0价升高到+2价,Cl元素由0价降低到-1价。
【详解】A.反应中,TiO2中所含元素化合价未发生改变,则TiO2不是氧化剂,A不正确;
B.在该反应中,C是还原剂,TiCl4是还原产物,则还原性:C > TiCl4,B正确;
C.在反应中,Cl元素由0价降低到-1价,则1mol Cl2发生反应转移电子2NA,C不正确;
D.从反应式中可以看出,氧化剂(Cl2)与还原剂(C)的物质的量之比为2∶2=1 : 1,D不正确;
故选B。
15.D
【详解】A.过程Ⅰ中,磷元素化合价由0升高为+5、由0降低为-3,所以白磷既做氧化剂又做还原剂,故A正确;
B.过程Ⅱ中,磷酸和氢氧化钙发生反应生成磷酸钙和水,属于复分解反应,故B正确;
C.根据图示,过程Ⅲ中,磷酸钙、二氧化硅、焦炭反应生成硅酸钙、CO、白磷,反应的化学方程式为,故C正确;
D.通过本提纯工艺,有Cu3P生成,会产生白磷损失,故D错误;
选D。
16.C
【详解】A.Na2SO4电离产生的SO42-会与Ba2+形成BaSO4沉淀,不能大量共存,A错误;
B.MnO4-具有氧化性,选项中的SO32-、Cl-、I-具有还原性,SO32-、Cl-、I-与MnO4-会发生氧化还原反应,不能大量共存,B错误;
C.KOH电离产生的离子与选项离子之间不能发生任何反应,可以大量共存,C正确;
D.HCl溶液电离产生的H+与HCO3-会发生反应产生CO2、H2O,不能大量共存,D错误;
故合理选项是C。
17.D
【详解】A.氯气的氧化性强于碘离子,氯气可以和碘离子发生反应生成氯离子和碘单质,故非金属性强弱关系为:Cl>I,A项正确;
B.通入过量的氯气后,碘单质被氯气氧化成无色的碘酸根,反应方程式为,B项正确;
C.SO2将还原为I2,生成氢离子,方程式为,氢离子浓度增大,溶液pH减小,C项正确;
D.该过程中前面通入了过量的氯气,二氧化硫也能还原氯气但是不确定氯气的量,故无法计算转移电子数,D项错误;
答案选D。
18.C
【详解】A.中Fe元素化合价升高,发生氧化反应,故A正确;
B.中氧元素化合价降低得到,是还原产物,故B正确;
C.该反应中,中Fe元素化合价升高,是还原剂;中部分氧元素化合价由-1降低为-2、部分化合价由-1升高为0,既是氧化剂又是还原剂,故C错误;
D.中Fe元素化合价由+2升高为+6、中氧元素化合价由-1升高为0生成氧气,反应生成1mol氧气转移10mol电子,所以生成3.2g时转移1mol电子,故D正确;
选C。
19.D
【详解】由25.00mL 0.05mol/L的羟胺的酸性溶液与50mL 0.25mol/L的KMnO4酸性溶液完全作用可知,NH2OH失去电子数等于高锰酸钾得到电子数,NH2OH中N元素的化合价为-1,设羟胺的氧化产物中N元素的化合价为x,由电子守恒可知,25.00×0.001L×0.5mol/L×(x+1)=50.00×0.001L×0.25mol/L×(7-2),解得x=4,羟胺的氧化产物是NO2。
【点睛】
20.C
【详解】A. 酸、碱、盐属于电解质,电解质属于化合物,故A正确;
B. 胶体属于分散系,而分散系都是由两种以上的物质组成,则属于混合物,故B正确;
C. 置换反应一定是氧化还原反应,但氧化还原反应不属于离子反应,故C错误;
D. 碱性氧化物属于金属氧化物,金属氧化物属于氧化物的范畴,故D正确;
故选C。
21.A
【详解】A.反应I和反应II中,碘元素由0价升高至+5价,和均为氧化产物,A项正确;
B.反应I中,NaI是还原产物,NaIO3是氧化产物,则氧化剂与还原剂的物质的量之比为5∶1,B项错误;
C.反应I中I2既发生氧化反应,又发生还原反应,C项错误;
D.两反应中分别消耗2.54g I2(物质的量为0.01mol)时,转移电子数分别为0.0167mol、0.1mol,D项错误;
故答案为:A。
22.D
【分析】根据氧化还原反应的基本规律,KMnO4为反应物,具有强氧化性,则MnSO4为生成物,反应中KMnO4被还原,为氧化剂,则反应中H2S应为还原剂,被氧化生成S,该反应为5H2S+3H2SO4+2KMnO4=2MnSO4+5S↓+K2SO4+8H2O,以此来解答。
【详解】A.由反应知,7种物质中,有H2SO4、H2S和KMnO4三种反应物,故A错误;
B.由以上分析可知,反应中H2S应为还原剂,所以被氧化的元素是S,故B错误;
C.由以上分析可知,MnSO4为生成物,故C错误;
D.由反应方程式5H2S+3H2SO4+2KMnO4=2MnSO4+5S↓+K2SO4+8H2O知,氧化剂与还原剂的物质的量之比为2:5,故D正确;
故选:D。
23.D
【详解】A.1个参加反应时有个电子转移,选项A错误;
B.由可知,参加反应的与个数之比2:14=1:7,选项B错误;
C.Cu、S元素的化合价升高,作还原剂,选项C错误;
D.由发生的反应可知,产物与个数之比为1∶1,选项D正确;
答案选D。
24.C
【详解】反应中P元素化合价从0价部分升高到+1价,部分降低到-3价,即4molP参加反应转移3mol电子,消耗3molKOH,所以转移0.6mol电子,消耗KOH的物质的量是0.6mol,质量是0.6mol×56g/mol=33.6g,答案选C。
【点睛】准确判断出P元素的化合价变化情况是解答的关键,注意氧化还原反应的分析思路,即判价态、找变价、双线桥、分升降、写得失、算电子、定其他。其中“找变价”是非常关键的一步,特别是反应物中含有同种元素的氧化还原反应,必须弄清它们的变化情况。
25.A
【详解】11.9g金属锡的物质的量==0.1mol,l2mol/LHNO3为浓硝酸,完全反应后测得溶液中的c(H+)=8mol/L,则浓硝酸有剩余,即锡与浓硝酸反应生成NO2,二氧化氮被氢氧化钠吸收生成盐,根据钠原子和氮原子的关系知,n(Na)=n(N)=0.4mol,所以生成的二氧化氮的物质的量为0.4mol;
设金属锡被氧化后元素的化合价为x,由电子守恒可知:0.1mol×(x-0)=0.4mol×(5-4),解得x=+4;
又溶液中c(H+)=8mol/L,而c(NO3-)==8mol/L,根据溶液电中性可判断溶液中不存在Sn(NO3)4,故答案为A。
26.(1) N2;NO2 Cu+ 4HNO3=2NO2+Cu(NO3)2+2H2O 氧化性、酸性
(2) -3 N2 C 11.7
【分析】A在常温下是非金属气体单质,且C为红棕色气体,则C为NO2,与水反应生成的含氧酸D为硝酸;B与氧气反应可得NO2,则B为NO;A与氧气反应可得NO,则A为N2。
(1)
①由分析知,A为N2,C为NO2;
②D的浓溶液,即浓硝酸与铜反应可以生成硝酸铜、二氧化氮和水,其化学方程式为,生成盐的性质体现了酸性,生成二氧化氮,氮元素的化合价降低,体现了强氧化性。
(2)
①Si3N4中Si显+4价,可知N显-3价;上述反应中,N元素从0价变到-3价,C元素从0价变到+2价,所以氧化剂是N2,还原剂是C;
②若该反应生成11.2L一氧化碳(标准状况),其物质的量为0.5mol,根据方程式的系数关系知,氮化硅和一氧化碳的物质的量之比为1:6,则氮化硅的质量为:。
27.(1)氧化
(2)
(3) 1:1 36.5
【详解】(1)还可将水中的、等转化成和等难溶物除去,反应中铁、锰化合价升高发生氧化反应,说明具有氧化性;
(2)反应中氯酸钠、硫酸、硫酸氢钠为强电解质,可以拆出离子,二氧化硫、二氧化氯不能拆,离子反应为;反应中氯元素得到电子化合价由+5变为+4,二氧化硫中硫元素失去电子化合价由+4变为+6,双线桥表示为: ;
(3)①在参加反应的盐酸中,4分子HCl中有2分子失去电子发生氧化反应生成氯气,2分子HCl转化为NaCl体现酸性,故起酸性作用的HCl与还原剂(被氧化)作用的HCl的质量比为1:1;
②若有106g的氯酸钠(为1mol)参与反应,结合①分析可知,被氧化的HCl为1mol,质量为36.5g。
28.(1) 铝 失去 铁 还原
(2) 1.8
【详解】(1)1①对于反应,其中Fe元素化合价从+3价降为0价,得电子,被还原,发生还原反应;Al元素化合价从0价升高到+3价,失电子,被氧化,发生氧化反应,故填铝、失去、铁、还原;
②该反应中,中的Fe元素得到电子被还原,作氧化剂,Al失去电子被氧化,作还原剂,其对应产物为氧化产物,故填、;
(2)1①根据题意,该反应中硫元素化合价为-2价,碳元素最后生成二氧化碳,氮元素变成氮气,其反应的化学方程式为,故填;
②根据反应,设被氧化的碳的质量为xg,则,即,解得,故填1.8
一、单选题
1.下列转化中,需要加入还原剂才能实现的是
A.N2→NH3 B.H2O2→O2 C.CaCO3→CO2 D.HCl→Cl2
2.下列反应不是氧化还原反应
A.CO+CuO=Cu+CO2
B.HCl+AgNO3=AgCl↓+HNO3
C.Cl2+H2O=HCl+HClO
D.Br2+2KI =2KBr+I2
3.下列反应属于氧化还原反应的是
A.H2O+CaO=Ca(OH)2 B.Cu+2FeCl3=2FeCl2+CuCl2
C.NH4ClNH3↑+HCl↑ D.CaCO3+2HCl=CaCl2+H2O+CO2↑
4.下列反应中画线物质是还原剂的是
A. B.
C. D.
5.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中,下列说法不正确的是
A.氧化剂是KClO3,还原剂是HCl
B.每生成3个Cl2,转移的电子为5个
C.每消耗1个KClO3,被氧化的HCl为6个
D.该反应中HCl既表现还原性又表现酸性
6.下列物质常用作还原剂的是
A.KI B. C. D.
7.海水晒盐后精制得到;氯碱工业电解饱和溶液得到和;向海水晒盐得到的卤水中通可制溴;从海水中还能提取镁;海洋中许多藻类植物具有富集碘的能力,从海带中可以提取碘。下列有关离子方程式书写正确的是
A.电解饱和食盐水:
B.氢氧化镁与盐酸反应:
C.卤水中通入制取粗溴:
D.和在酸性条件下的反应:
8.氢化钠()可作野外生氢剂。其化学反应原理为:。该反应的氧化剂是
A. B. C. D.
9.是HClO的酸性氧化物,具有强氧化性,加热易分解,可通过如下反应制取:。下列说法不正确的是
A.还原产物是NaCl
B.氧化剂与还原剂的物质的量之比为1:1
C.完全溶于水微热,会产生黄绿色气体
D.与还原剂接触或加热能发生剧烈反应,甚至爆炸
10.如图是某化学反应的微观示意图。下列有关说法正确的是
A.该反应是复分解反应
B.反应方程式为NH3+O2H2O+N2
C.生成物丙、丁的质量比为9:14
D.反应前后只有一种元素的化合价不变
11.氧化还原反应广泛地存在于生产和生活之中。下列过程中不涉及氧化还原反应的是( )
A.燃放鞭炮 B.食物腐败
C.金属冶炼 D.明矾净水
12.下列化学反应中电子转移方向、数目表示正确的是
A.
B.
C.
D.
13.饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶:
关于上述过程中的说法不正确的是
A.③是分液 B.②用到的玻璃仪器是漏斗、烧杯、玻璃棒
C.①是萃取 D.封口的目的是与空气隔绝
14.钛被誉为“21世纪金属”,工业冶炼钛的第一步反应为:TiO2+2C+2Cl2TiCl4+2CO,下列关于该反应的说法正确的是
A.TiO2是氧化剂 B.还原性:C > TiCl4
C.1mol Cl2发生反应转移电子4NA D.氧化剂与还原剂的物质的量之比为1∶2
15.一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法不正确的是
A.过程Ⅰ中,白磷既做氧化剂又做还原剂
B.过程Ⅱ中,发生复分解反应
C.过程Ⅲ中,反应的化学方程式为:
D.理论上,通过本提纯工艺不会产生白磷损失
16.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1Na2SO4溶液:Ba2+、OH-、NO3-、Cl-
B.0.1 mol·L-1KMnO4溶液:Na+、SO32-、Cl-、I-
C.0.1 mol·L-1KOH溶液:Na+、Cl-、CO32-、AlO2-
D.0.1 mol·L-1HCl溶液:K+、Mg2+、HCO3-、SO42-
17.向含0.1mol KI的溶液中滴加少量淀粉后,不断通入过量Cl2,溶液由无色变蓝色后又变无色。继续向所得无色溶液中继续通入SO2,溶液由无色变蓝色后又变无色。下列说法错误的是
A.通入Cl2后溶液显蓝色,说明元素非金属性强弱关系为:Cl>I
B.Cl2过量后,溶液中发生的反应为:
C.SO2将还原为I2,溶液pH减小
D.通入SO2至溶液呈无色,SO2转移电子数总共为0.6 NA个
18.关于反应,下列说法不正确的是
A.发生氧化反应 B.是还原产物
C.氧化剂与还原剂的物质的量之比为 D.生成3.2g时,转移1mol电子
19.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原.25.00mL0.5mol/L羟胺的酸性溶液能与50mL0.25mol/LKMnO4酸性溶液完全作用(已知MnO4﹣被还原为Mn2+)则上述反应中羟胺的氧化产物是
A.N2 B.N2O C.NO D.NO2
20.用下图表示的一些物质或概念间的从属关系中不正确的是
X Y Z
A 酸、碱、盐 电解质 化合物
B 胶体 分散系 混合物
C 置换反应 氧化还原反应 离子反应
D 碱性氧化物 金属氧化物 氧化物
A.A B.B C.C D.D
21.关于反应I:3I2+6NaOH=5NaI+NaIO3+3H2O和反应II:I2+5Cl2+6H2O=2HIO3+10HCl,下列说法正确的是
A.NaIO3和HIO3均为氧化产物
B.反应I中氧化剂与还原剂的物质的量之比为1∶5
C.两反应中I2都只发生了氧化反应
D.两反应中分别消耗2.54gI2时,转移电子数目相同
22.实验证明,以下7种物质是一个氧化还原反应的反应物和生成物:、、S、、、和,下列说法正确的是
A.这7种物质中,只有和是反应物
B.被还原的元素是S
C.发生氧化反应的物质是
D.氧化剂与还原剂的物质的量之比为2∶5
23.硝酸是一种常见的氧化性酸,它可以与很多种物质发生氧化还原反应,常用于溶解一些不易溶解的物质。与一定浓度的反应,生成、、、NO和。当产物和NO的分子数目相等时。下列说法正确的是
A.1个参加反应时有9个电子转移
B.参加反应的与的个数之比2:15
C.反应中既是氧化剂,又是还原剂
D.产物和的个数之比为1:1
24.如果反应4P + 3KOH + 3H2O =3KH2PO2+ PH3中转移0.6mol电子,消耗KOH的质量为( )
A.5.6克 B.16.8克 C.33.6克 D.100.8克
25.11.9g金属锡(Sn)跟100mL12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8 mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是( )
A.SnO2·4H2O B.Sn(NO3)4
C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
二、填空题
26. 非金属单质A经下图所示的过程可转化为含氧酸D,已知D为强酸。请回答下列问题。
ABCD
(1)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是 。
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为 ;体现D的什么性质 。
(2)氮化硅Si3N4)可由石英与焦炭在高温的氮气流中通过以下反应制备:
3SiO2+ 6C+ 2N2Si3N4 + 6CO
①请写出氮化硅中氮元素的化合价是 ,以上反应中的氧化剂是 ,还原剂是 。
②若该反应生成11.2L一氧化碳(标准状况),则生成氮化硅的质量是 ( 保留小数点后一位)。
27.完成下列问题。
(1)是一种常用的消毒剂,我国从2000年起逐步用代替氯气对饮用水进行消毒。在消毒水时,还可将水中的、等转化成和等难溶物除去,说明具有 性。
(2)工业上可以用下列反应制备:,将上述方程改写为离子方程式: ,请用双线桥法标出上述反应电子转移的方向和数目: 。
(3)工业上制备的反应原理为:。
①在参加反应的盐酸中,起酸性作用的HCl与还原剂(被氧化)作用的HCl的质量比为 。
②若有106g的氯酸钠参与反应,被氧化的盐酸为 g。(的相对分子质量为106)
28.完成下列问题
(1)Fe2O3+2Al2Fe+Al2O3
①在该反应中 (填写元素名称)元素的化合价升高,该元素的原子 电子;而 (填写元素名称)元素的化合价降低,该元素的原子被 。
②该反应中, 是氧化剂 是氧化产物。
(2)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
①写出有关反应的化学方程式:
②10.1g KNO3完全反应时,被它氧化的碳为 g。
试卷第1页,共3页
参考答案:
1.A
【分析】当加入还原剂,被还原,化合价会降低,据此分析解答。
【详解】A.N元素化合价由0价降低至-3价,被还原,A正确;
B.O元素化合价由-1升高到0价,被氧化,B错误;
C.没有化合价变化,C错误;
D.Cl元素化合价由-1价升高至0价,被氧化,D错误;
故答案选A。
2.B
【详解】A.反应CO+CuO=Cu+CO2,C、Cu元素化合价改变,属于氧化还原反应,故不选A;
B.反应HCl+AgNO3=AgCl↓+HNO3,元素化合价不变,不是氧化还原反应,故选B;
C.反应Cl2+H2O=HCl+HClO,Cl元素化合价改变,属于氧化还原反应,故不选C;
D.反应Br2+2KI =2KBr+I2,Br、I元素化合价改变,属于氧化还原反应,故不选D;
选B。
3.B
【详解】A.H2O + CaO= Ca(OH)2该反应中没有元素化合价发生该变,属于非氧化还原反应,A错误;
B.该反应中铜元素和铁元素化合价发生变化,属于氧化还原反应,B正确;
C.NH4ClNH3 + HCl该反应中没有元素化合价发生该变,属于非氧化还原反应,C错误;
D.CaCO3 + 2HCl =CaCl2 + H2O+ CO2↑该反应中没有元素化合价发生该变,属于非氧化还原反应,D错误;
答案选B。
4.B
【详解】A.中画线物质为还原产物,是生成物,故A错误;
B.中画线物质所含元素化合价升高为还原剂,故B正确;
C.中画线物质所含元素化合价降低,为氧化剂,故C错误;
D.中画线物质为生成物,故D错误;
故答案为B。
5.C
【详解】A.在KClO3+6HCl=KCl+3Cl2↑+3H2O反应中,氧化剂是KClO3,还原剂是HCl,故A正确;
B.氧化剂是KClO3,还原剂是HCl,每生成3个Cl2,转移的电子为5个,故B正确;
C.每消耗1个KClO3,被氧化的HCl为5个,故C错误;
D.该反应中HCl为还原剂,同时表现酸性,故D正确;
故答案选C。
6.A
【详解】A.I-具有较强还原性,KI常用作还原剂,A符合题意;
B.具有较强氧化性,常用作氧化剂,B不符合题意;
C.具有较强氧化性,常用作氧化剂,C不符合题意;
D.中各元素化合价均较难改变,既不常用作还原剂也不常用作氧化剂,D不符合题意;
故选A。
7.C
【详解】A.食盐水是氯化钠的水溶液,饱和的氯化钠溶液在通电条件下反应生成氢氧化钠、氢气和氯气,反应的离子方程式为:,故A错误;
B.氢氧化镁是沉淀,在离子方程式中不能拆,故B错误;
C.的氧化性比强,卤水中通入制取粗溴,该反应的离子方程式为:,故C正确;
D.和在酸性条件下生成I2,中I元素由+5价下降到0价,中I元素由-1价上升到0价,根据得失电子守恒和电荷守恒配平离子方程式为:,故D错误;
故选C。
8.B
【详解】氢化钠()可作野外生氢剂。其化学反应原理为:,NaH中氢化合价升高,失去电子,水中氢化合价降低,得到电子,因此是氧化剂,NaH是还原剂,故B符合题意。
综上所述,答案为B。
9.C
【详解】A.该反应为歧化反应,Cl2中Cl元素化合价降低指向的产物是还原产物,其还原产物是NaCl,故A正确;
B.Cl2既是氧化剂也是还原剂,2molCl2反应时,有1mol做氧化剂,另外1mol做还原剂,氧化剂与还原剂的物质的量之比为1:1,故B正确;
C.Cl2O 是HClO的酸性氧化物,Cl2O 完全溶于水微热会发生反应产生HClO,HClO不稳定受热分解生成HCl和氧气,不会产生Cl2,故C错误;
D.Cl2O是HClO的酸性氧化物,具有强氧化性,加热易分解,与还原剂接触会发生剧烈反应,甚至会爆炸,故D正确;
故本题选C。
10.D
【详解】A.一种单质与化合物反应生成另一种单质和化合物,符合置换反应的特点,该反应是置换反应,A项错误;
B.根据微观示意图,可以看出反应物为氨气和氧气,生成物为水和氮气,书写化学方程式需要配平,所以该反应的化学方程为4NH3+3O26H2O+2N2,B项错误;
C.根据B中化学方程式可以看出,丙为水,丁为氮气,两种的物质质量比=(6×18):(2×14)=27:7,C项错误;
D.根据B中化学方程式可以看出,氮元素由-3价变为0价,氧元素的化合价由0价变为-2价,氢元素反应前后化合价不变,因此只有一种元素化合价未发生变化,D项正确;
答案选D。
11.D
【详解】A. 燃放鞭炮,火药受热发生剧烈爆炸反应,存在元素的化合价变化,为氧化还原反应,故A不选;
B. 食物腐败为食物缓慢氧化的过程,为氧化还原反应,故B不选;
C. 金属冶炼中金属元素的化合价降低,为氧化还原反应,故C不选;
D. 明矾净水涉及铝离子水解生成氢氧化铝胶体及其氢氧化铝胶体的聚沉,不存在元素的化合价变化,没有发生氧化还原反应,故D选;
故选D。
12.D
【详解】A.该反应中转移电子数是2,电子转移方向和数目为 ,故A错误;
B.H2S失电子生成S,H2SO4得电子生成SO2,转移电子数是2,电子转移方向和数目为 ,故B错误;
C.该反应中转移电子数是5,有的HCl被氧化生成Cl2,电子转移方向和数目为 ,故C错误;
D.该反应中Cu失电子、HNO3得电子,转移电子数是2,电子转移方向和数目为 ,故D正确;
故选:D。
13.A
【分析】由流程可知,溶解后萃取、过滤除去茶渣,茶汤中加抗氧化剂,防止氧化,封口灭菌后制得罐装饮料茶,由此分析。
【详解】A.③中混合物不分层,分罐密封,无分液操作,故A符合题意;
B.②为分离不溶性茶渣,为过滤,用到的玻璃仪器是漏斗、烧杯、玻璃棒,故B不符合题意;
C.萃取可分离出有机成分,①是萃取,故C不符合题意;
D.茶汤中加入了抗氧化剂,说明茶叶很容易被氧化,空气中的氧气具有氧化性,故封口的目的是与空气隔绝,故D不符合题意;
答案选A。
14.B
【分析】在反应TiO2+2C+2Cl2TiCl4+2CO中,C元素由0价升高到+2价,Cl元素由0价降低到-1价。
【详解】A.反应中,TiO2中所含元素化合价未发生改变,则TiO2不是氧化剂,A不正确;
B.在该反应中,C是还原剂,TiCl4是还原产物,则还原性:C > TiCl4,B正确;
C.在反应中,Cl元素由0价降低到-1价,则1mol Cl2发生反应转移电子2NA,C不正确;
D.从反应式中可以看出,氧化剂(Cl2)与还原剂(C)的物质的量之比为2∶2=1 : 1,D不正确;
故选B。
15.D
【详解】A.过程Ⅰ中,磷元素化合价由0升高为+5、由0降低为-3,所以白磷既做氧化剂又做还原剂,故A正确;
B.过程Ⅱ中,磷酸和氢氧化钙发生反应生成磷酸钙和水,属于复分解反应,故B正确;
C.根据图示,过程Ⅲ中,磷酸钙、二氧化硅、焦炭反应生成硅酸钙、CO、白磷,反应的化学方程式为,故C正确;
D.通过本提纯工艺,有Cu3P生成,会产生白磷损失,故D错误;
选D。
16.C
【详解】A.Na2SO4电离产生的SO42-会与Ba2+形成BaSO4沉淀,不能大量共存,A错误;
B.MnO4-具有氧化性,选项中的SO32-、Cl-、I-具有还原性,SO32-、Cl-、I-与MnO4-会发生氧化还原反应,不能大量共存,B错误;
C.KOH电离产生的离子与选项离子之间不能发生任何反应,可以大量共存,C正确;
D.HCl溶液电离产生的H+与HCO3-会发生反应产生CO2、H2O,不能大量共存,D错误;
故合理选项是C。
17.D
【详解】A.氯气的氧化性强于碘离子,氯气可以和碘离子发生反应生成氯离子和碘单质,故非金属性强弱关系为:Cl>I,A项正确;
B.通入过量的氯气后,碘单质被氯气氧化成无色的碘酸根,反应方程式为,B项正确;
C.SO2将还原为I2,生成氢离子,方程式为,氢离子浓度增大,溶液pH减小,C项正确;
D.该过程中前面通入了过量的氯气,二氧化硫也能还原氯气但是不确定氯气的量,故无法计算转移电子数,D项错误;
答案选D。
18.C
【详解】A.中Fe元素化合价升高,发生氧化反应,故A正确;
B.中氧元素化合价降低得到,是还原产物,故B正确;
C.该反应中,中Fe元素化合价升高,是还原剂;中部分氧元素化合价由-1降低为-2、部分化合价由-1升高为0,既是氧化剂又是还原剂,故C错误;
D.中Fe元素化合价由+2升高为+6、中氧元素化合价由-1升高为0生成氧气,反应生成1mol氧气转移10mol电子,所以生成3.2g时转移1mol电子,故D正确;
选C。
19.D
【详解】由25.00mL 0.05mol/L的羟胺的酸性溶液与50mL 0.25mol/L的KMnO4酸性溶液完全作用可知,NH2OH失去电子数等于高锰酸钾得到电子数,NH2OH中N元素的化合价为-1,设羟胺的氧化产物中N元素的化合价为x,由电子守恒可知,25.00×0.001L×0.5mol/L×(x+1)=50.00×0.001L×0.25mol/L×(7-2),解得x=4,羟胺的氧化产物是NO2。
【点睛】
20.C
【详解】A. 酸、碱、盐属于电解质,电解质属于化合物,故A正确;
B. 胶体属于分散系,而分散系都是由两种以上的物质组成,则属于混合物,故B正确;
C. 置换反应一定是氧化还原反应,但氧化还原反应不属于离子反应,故C错误;
D. 碱性氧化物属于金属氧化物,金属氧化物属于氧化物的范畴,故D正确;
故选C。
21.A
【详解】A.反应I和反应II中,碘元素由0价升高至+5价,和均为氧化产物,A项正确;
B.反应I中,NaI是还原产物,NaIO3是氧化产物,则氧化剂与还原剂的物质的量之比为5∶1,B项错误;
C.反应I中I2既发生氧化反应,又发生还原反应,C项错误;
D.两反应中分别消耗2.54g I2(物质的量为0.01mol)时,转移电子数分别为0.0167mol、0.1mol,D项错误;
故答案为:A。
22.D
【分析】根据氧化还原反应的基本规律,KMnO4为反应物,具有强氧化性,则MnSO4为生成物,反应中KMnO4被还原,为氧化剂,则反应中H2S应为还原剂,被氧化生成S,该反应为5H2S+3H2SO4+2KMnO4=2MnSO4+5S↓+K2SO4+8H2O,以此来解答。
【详解】A.由反应知,7种物质中,有H2SO4、H2S和KMnO4三种反应物,故A错误;
B.由以上分析可知,反应中H2S应为还原剂,所以被氧化的元素是S,故B错误;
C.由以上分析可知,MnSO4为生成物,故C错误;
D.由反应方程式5H2S+3H2SO4+2KMnO4=2MnSO4+5S↓+K2SO4+8H2O知,氧化剂与还原剂的物质的量之比为2:5,故D正确;
故选:D。
23.D
【详解】A.1个参加反应时有个电子转移,选项A错误;
B.由可知,参加反应的与个数之比2:14=1:7,选项B错误;
C.Cu、S元素的化合价升高,作还原剂,选项C错误;
D.由发生的反应可知,产物与个数之比为1∶1,选项D正确;
答案选D。
24.C
【详解】反应中P元素化合价从0价部分升高到+1价,部分降低到-3价,即4molP参加反应转移3mol电子,消耗3molKOH,所以转移0.6mol电子,消耗KOH的物质的量是0.6mol,质量是0.6mol×56g/mol=33.6g,答案选C。
【点睛】准确判断出P元素的化合价变化情况是解答的关键,注意氧化还原反应的分析思路,即判价态、找变价、双线桥、分升降、写得失、算电子、定其他。其中“找变价”是非常关键的一步,特别是反应物中含有同种元素的氧化还原反应,必须弄清它们的变化情况。
25.A
【详解】11.9g金属锡的物质的量==0.1mol,l2mol/LHNO3为浓硝酸,完全反应后测得溶液中的c(H+)=8mol/L,则浓硝酸有剩余,即锡与浓硝酸反应生成NO2,二氧化氮被氢氧化钠吸收生成盐,根据钠原子和氮原子的关系知,n(Na)=n(N)=0.4mol,所以生成的二氧化氮的物质的量为0.4mol;
设金属锡被氧化后元素的化合价为x,由电子守恒可知:0.1mol×(x-0)=0.4mol×(5-4),解得x=+4;
又溶液中c(H+)=8mol/L,而c(NO3-)==8mol/L,根据溶液电中性可判断溶液中不存在Sn(NO3)4,故答案为A。
26.(1) N2;NO2 Cu+ 4HNO3=2NO2+Cu(NO3)2+2H2O 氧化性、酸性
(2) -3 N2 C 11.7
【分析】A在常温下是非金属气体单质,且C为红棕色气体,则C为NO2,与水反应生成的含氧酸D为硝酸;B与氧气反应可得NO2,则B为NO;A与氧气反应可得NO,则A为N2。
(1)
①由分析知,A为N2,C为NO2;
②D的浓溶液,即浓硝酸与铜反应可以生成硝酸铜、二氧化氮和水,其化学方程式为,生成盐的性质体现了酸性,生成二氧化氮,氮元素的化合价降低,体现了强氧化性。
(2)
①Si3N4中Si显+4价,可知N显-3价;上述反应中,N元素从0价变到-3价,C元素从0价变到+2价,所以氧化剂是N2,还原剂是C;
②若该反应生成11.2L一氧化碳(标准状况),其物质的量为0.5mol,根据方程式的系数关系知,氮化硅和一氧化碳的物质的量之比为1:6,则氮化硅的质量为:。
27.(1)氧化
(2)
(3) 1:1 36.5
【详解】(1)还可将水中的、等转化成和等难溶物除去,反应中铁、锰化合价升高发生氧化反应,说明具有氧化性;
(2)反应中氯酸钠、硫酸、硫酸氢钠为强电解质,可以拆出离子,二氧化硫、二氧化氯不能拆,离子反应为;反应中氯元素得到电子化合价由+5变为+4,二氧化硫中硫元素失去电子化合价由+4变为+6,双线桥表示为: ;
(3)①在参加反应的盐酸中,4分子HCl中有2分子失去电子发生氧化反应生成氯气,2分子HCl转化为NaCl体现酸性,故起酸性作用的HCl与还原剂(被氧化)作用的HCl的质量比为1:1;
②若有106g的氯酸钠(为1mol)参与反应,结合①分析可知,被氧化的HCl为1mol,质量为36.5g。
28.(1) 铝 失去 铁 还原
(2) 1.8
【详解】(1)1①对于反应,其中Fe元素化合价从+3价降为0价,得电子,被还原,发生还原反应;Al元素化合价从0价升高到+3价,失电子,被氧化,发生氧化反应,故填铝、失去、铁、还原;
②该反应中,中的Fe元素得到电子被还原,作氧化剂,Al失去电子被氧化,作还原剂,其对应产物为氧化产物,故填、;
(2)1①根据题意,该反应中硫元素化合价为-2价,碳元素最后生成二氧化碳,氮元素变成氮气,其反应的化学方程式为,故填;
②根据反应,设被氧化的碳的质量为xg,则,即,解得,故填1.8
