第二章第二节 分子的空间结构2 价电子互斥 课件(20张) 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章第二节 分子的空间结构2 价电子互斥 课件(20张) 2023-2024学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 10:26:20 | ||
图片预览




文档简介
(共20张PPT)
第二节
分子的空间结构
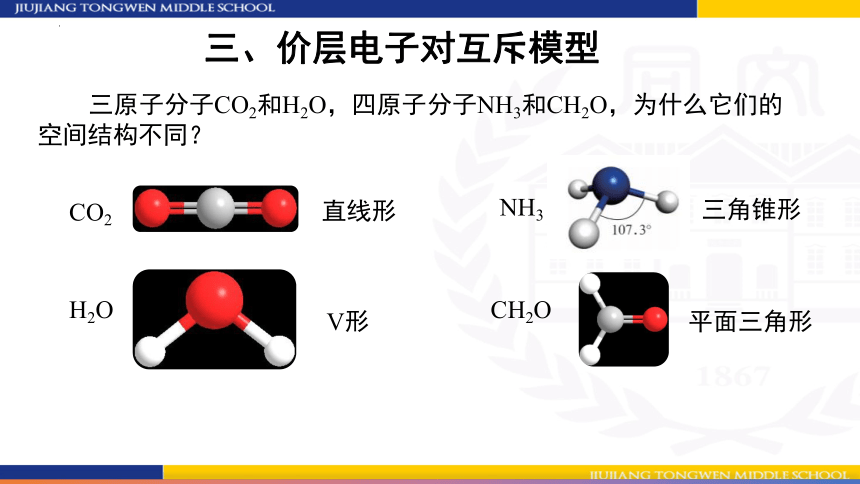
三、价层电子对互斥模型
三原子分子CO2和H2O,四原子分子NH3和CH2O,为什么它们的空间结构不同?
CO2
H2O
NH3
直线形
V形
三角锥形
CH2O
平面三角形
1.价层电子对互斥(VSEPR)模型
理论依据
→分子的空间结构,是由中心原子价层电子对之间相互排斥的结果。
→排斥力趋向于尽可能将价电子对之间远离,夹角尽可能张大,这样会使排斥力尽可能小
模拟吹气球:使气球胀大至大致相同的体积,绑紧进气口。
用不同气球数目模拟价层电子对数在空间相互排斥的结构。2、3、4 ……
2个 气球
直线形
3个气球
平面三角形
4个气球
四面体形
2对 价电子
直线形
3对 价电子
平面三角形
4对 价电子
四面体形
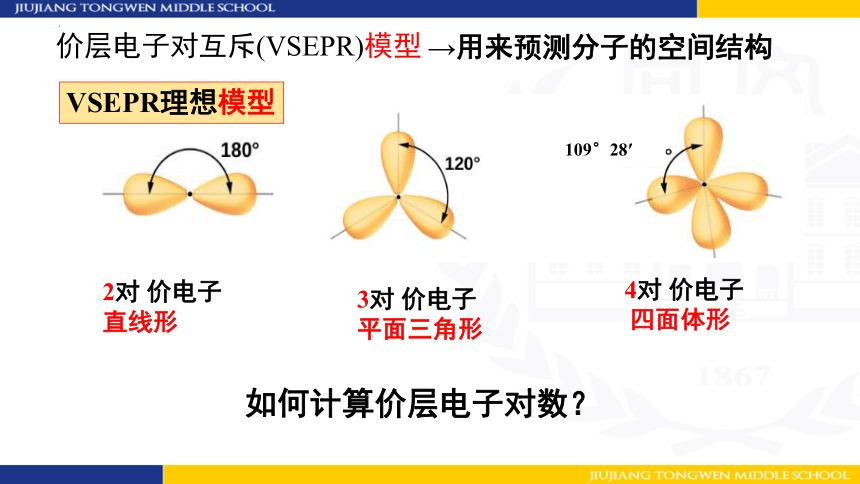
价层电子对互斥(VSEPR)模型
109°28′
→用来预测分子的空间结构
如何计算价层电子对数?
VSEPR理想模型
价层电子对:
中心原子上的σ键电子对和孤电子对。
1.价层电子对互斥(VSEPR)模型
(1) 中心原子
(ABn型分子):
成键数目最多的原子,如CO2中的C,PCl3中的P
CH2O?
HClO?
C
H—O—Cl
O
(2) σ键电子对:
除中心原子外,其余原子与中心原子均形成一个σ键,故 σ键电子对数=结合的原子数
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键电子对
2
2
3
4
4
3
2
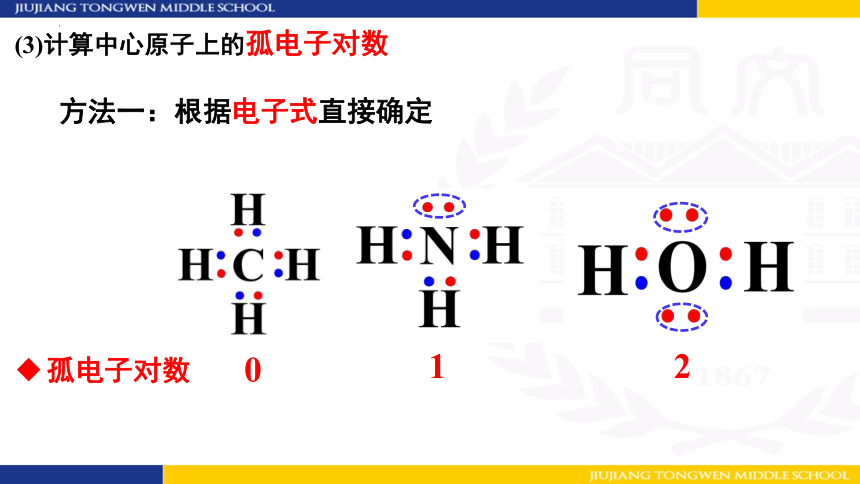
(3)计算中心原子上的孤电子对数
方法一:根据电子式直接确定
0
1
2
孤电子对数
(3)计算中心原子上的孤电子对数
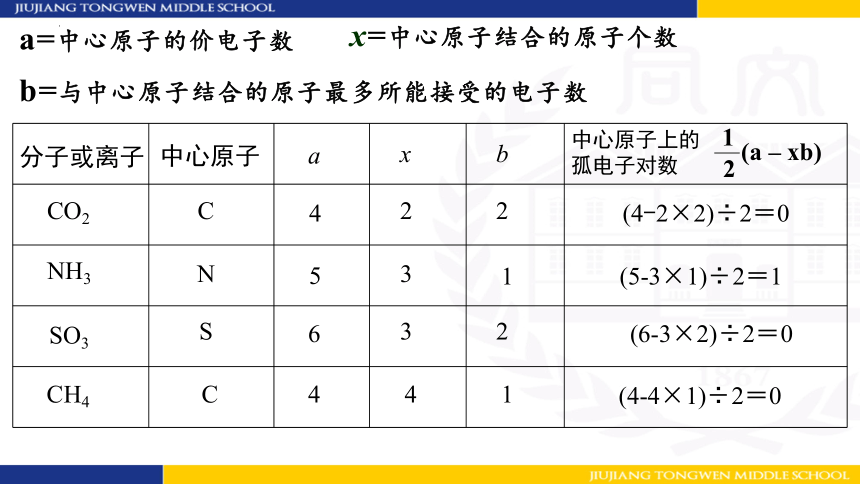
方法二:公式计算,中心原子上的孤电子对数= (a-xb)
2
1
a=中心原子的价电子数
x=中心原子结合的原子个数
b=与中心原子结合的原子最多所能接受的电子数
氧和氧族元素中的S、Se等均为2,卤族元素均为1
如:H为1,其余原子为8 -最外层电子数。
(对于主族元素等于原子的最外层电子数)
氮和氮族元素中的N、P等均为3
分子或离子
中心原子
a
x
b
中心原子上的
孤电子对数
—
2
1
(a – xb)
CO2
NH3
SO3
C
4
2
2
(4-2×2)÷2=0
N
5
3
1
(5-3×1)÷2=1
S
6
3
2
(6-3×2)÷2=0
CH4
C
4
a=中心原子的价电子数
x=中心原子结合的原子个数
b=与中心原子结合的原子最多所能接受的电子数
4
1
(4-4×1)÷2=0
(3)计算离子中心原子上的孤电子对数
阳离子:
a=中心原子的价电子数 - 离子的电荷数
—
2
1
(a – xb)
阴离子:
a=中心原子的价电子数+离子的电荷数
分子或离子 中心原子 a x b 中心原子上的孤电子对数
NH4+
CO32-
NO3-
ClO3-
SO42-
N
5-1
4
1
(5-1-4×1)÷2=0
C
4+2
3
2
(4+2-3×2)÷2=0
N
5+1
3
2
(5+1-3×2)÷2=0
Cl
7+1
3
2
(7+1-3×2)÷2=1
S
6+2
4
2
(6+2-4×2)÷2=0
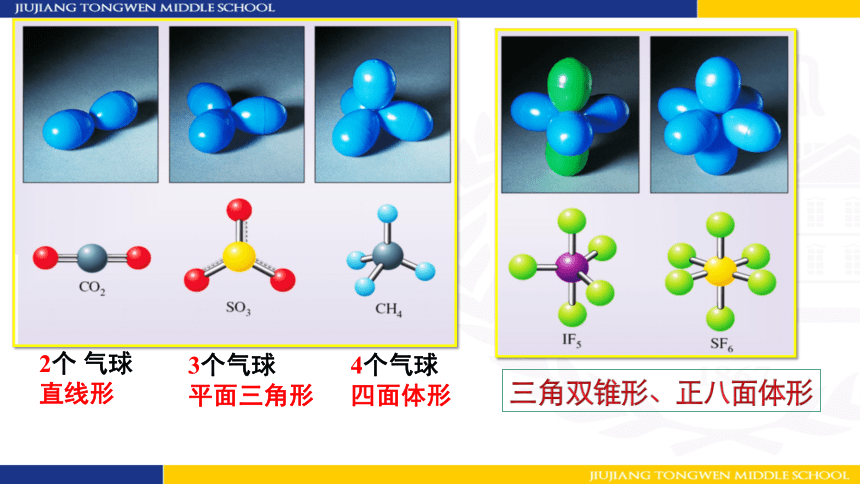
2.根据中心原子价层电子对数确定VSEPR理想模型
价层电子对 数目 2 3 4 *5 *6
VSEPR模型 直线形 平面三角形 四面体 *三角双锥体 *正八面体
价层电子对数 = σ键电子对数 + 中心原子上的孤对电子对数
(1)中心原子上无孤对电子——空间结构为理想模型
分子或离子 孤电子对数 价层电子对数 VSEPR理想模型 VSEPR理想模型名称 分子或离子的空间结构 分子或离子的空间结构名称
CO2 0
CO32- 0
SO42- 0
NH4+ 0
0+2=2
0+4=4
0+3=3
0+4=4
直线形
正四面体形
平面三角形
正四面体形
直线形
平面正三角形
正四面体形
正四面体形
(2)中心原子上有孤对电子
中心原子上的孤对电子也要占据中心原子周围的空间,并与成键电子对互相排斥。在讨论粒子空间构型时应略去孤电子对,才是该粒子的实际空间构型。
分子 或离子 孤电子 对数 价层电子 对数 VSEPR模型及名称 分子的空间
结构及名称
NH3
H2O
SO2
1
1+3=4
四面体形
三角锥形
2
2+2=4
四面体形
V形
1
1+2=3
平面三角形
V形
总结:应用VSEPR模型预测粒子空间结构的步骤
1.计算中心原子的成键电子对数=结合原子数
2.计算中心原子上的孤电子对数
= 1/2(a-xb)
3.价层电子对数=σ键电子对数+孤电子对数
4.确定VSEPR理想模型
5.略去孤电子对,确定粒子的空间结构
分子 或离子 中心原子 孤电子对数 价层电子对数 VSEPR理想模型 分子的
空间结构
练习 应用VSEPR模型预测分子的空间结构
H-C≡N
HCN
O3
(4-1×1-1×3)÷2=0
(6-2×2)÷2=1
1+2=3
0+2=2
平面三角形
V形
直线形
直线形
O(O)2
SO32-
(8-3×2)÷2=1
1+3=4
四面体形
三角锥形
实验测得NH3的键角为107°,H2O的键角为105°,为什么NH3和H2O的键角均小于109°28′?
【思考与讨论】
109°28′
排斥力较大
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,
键角减小。
109°28′
相较成键电子对,孤电子对有较大的排斥力
H2O、NH3的的孤电子对分别为2、1,分子中电子对之间的斥力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对 >成键电子-成键电子,
故H2O、NH3的键角分别是105°、107°。
注意:价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
应用价层电子对互斥模型判断下列分子或离子的空间结构,完成表格。
分子或离子 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型 分子或离子的
空间结构名称
SiF4
PCl3
PO43-
HCN
ClO2-
0 4 正四面体形 正四面体形
1 4 四面体形 三角锥形
0 4 正四面体形 正四面体形
0 2 直线形 直线形
2 4 四面体形 V形
第二节
分子的空间结构
三、价层电子对互斥模型
三原子分子CO2和H2O,四原子分子NH3和CH2O,为什么它们的空间结构不同?
CO2
H2O
NH3
直线形
V形
三角锥形
CH2O
平面三角形
1.价层电子对互斥(VSEPR)模型
理论依据
→分子的空间结构,是由中心原子价层电子对之间相互排斥的结果。
→排斥力趋向于尽可能将价电子对之间远离,夹角尽可能张大,这样会使排斥力尽可能小
模拟吹气球:使气球胀大至大致相同的体积,绑紧进气口。
用不同气球数目模拟价层电子对数在空间相互排斥的结构。2、3、4 ……
2个 气球
直线形
3个气球
平面三角形
4个气球
四面体形
2对 价电子
直线形
3对 价电子
平面三角形
4对 价电子
四面体形
价层电子对互斥(VSEPR)模型
109°28′
→用来预测分子的空间结构
如何计算价层电子对数?
VSEPR理想模型
价层电子对:
中心原子上的σ键电子对和孤电子对。
1.价层电子对互斥(VSEPR)模型
(1) 中心原子
(ABn型分子):
成键数目最多的原子,如CO2中的C,PCl3中的P
CH2O?
HClO?
C
H—O—Cl
O
(2) σ键电子对:
除中心原子外,其余原子与中心原子均形成一个σ键,故 σ键电子对数=结合的原子数
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键电子对
2
2
3
4
4
3
2
(3)计算中心原子上的孤电子对数
方法一:根据电子式直接确定
0
1
2
孤电子对数
(3)计算中心原子上的孤电子对数
方法二:公式计算,中心原子上的孤电子对数= (a-xb)
2
1
a=中心原子的价电子数
x=中心原子结合的原子个数
b=与中心原子结合的原子最多所能接受的电子数
氧和氧族元素中的S、Se等均为2,卤族元素均为1
如:H为1,其余原子为8 -最外层电子数。
(对于主族元素等于原子的最外层电子数)
氮和氮族元素中的N、P等均为3
分子或离子
中心原子
a
x
b
中心原子上的
孤电子对数
—
2
1
(a – xb)
CO2
NH3
SO3
C
4
2
2
(4-2×2)÷2=0
N
5
3
1
(5-3×1)÷2=1
S
6
3
2
(6-3×2)÷2=0
CH4
C
4
a=中心原子的价电子数
x=中心原子结合的原子个数
b=与中心原子结合的原子最多所能接受的电子数
4
1
(4-4×1)÷2=0
(3)计算离子中心原子上的孤电子对数
阳离子:
a=中心原子的价电子数 - 离子的电荷数
—
2
1
(a – xb)
阴离子:
a=中心原子的价电子数+离子的电荷数
分子或离子 中心原子 a x b 中心原子上的孤电子对数
NH4+
CO32-
NO3-
ClO3-
SO42-
N
5-1
4
1
(5-1-4×1)÷2=0
C
4+2
3
2
(4+2-3×2)÷2=0
N
5+1
3
2
(5+1-3×2)÷2=0
Cl
7+1
3
2
(7+1-3×2)÷2=1
S
6+2
4
2
(6+2-4×2)÷2=0
2.根据中心原子价层电子对数确定VSEPR理想模型
价层电子对 数目 2 3 4 *5 *6
VSEPR模型 直线形 平面三角形 四面体 *三角双锥体 *正八面体
价层电子对数 = σ键电子对数 + 中心原子上的孤对电子对数
(1)中心原子上无孤对电子——空间结构为理想模型
分子或离子 孤电子对数 价层电子对数 VSEPR理想模型 VSEPR理想模型名称 分子或离子的空间结构 分子或离子的空间结构名称
CO2 0
CO32- 0
SO42- 0
NH4+ 0
0+2=2
0+4=4
0+3=3
0+4=4
直线形
正四面体形
平面三角形
正四面体形
直线形
平面正三角形
正四面体形
正四面体形
(2)中心原子上有孤对电子
中心原子上的孤对电子也要占据中心原子周围的空间,并与成键电子对互相排斥。在讨论粒子空间构型时应略去孤电子对,才是该粒子的实际空间构型。
分子 或离子 孤电子 对数 价层电子 对数 VSEPR模型及名称 分子的空间
结构及名称
NH3
H2O
SO2
1
1+3=4
四面体形
三角锥形
2
2+2=4
四面体形
V形
1
1+2=3
平面三角形
V形
总结:应用VSEPR模型预测粒子空间结构的步骤
1.计算中心原子的成键电子对数=结合原子数
2.计算中心原子上的孤电子对数
= 1/2(a-xb)
3.价层电子对数=σ键电子对数+孤电子对数
4.确定VSEPR理想模型
5.略去孤电子对,确定粒子的空间结构
分子 或离子 中心原子 孤电子对数 价层电子对数 VSEPR理想模型 分子的
空间结构
练习 应用VSEPR模型预测分子的空间结构
H-C≡N
HCN
O3
(4-1×1-1×3)÷2=0
(6-2×2)÷2=1
1+2=3
0+2=2
平面三角形
V形
直线形
直线形
O(O)2
SO32-
(8-3×2)÷2=1
1+3=4
四面体形
三角锥形
实验测得NH3的键角为107°,H2O的键角为105°,为什么NH3和H2O的键角均小于109°28′?
【思考与讨论】
109°28′
排斥力较大
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,
键角减小。
109°28′
相较成键电子对,孤电子对有较大的排斥力
H2O、NH3的的孤电子对分别为2、1,分子中电子对之间的斥力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对 >成键电子-成键电子,
故H2O、NH3的键角分别是105°、107°。
注意:价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
应用价层电子对互斥模型判断下列分子或离子的空间结构,完成表格。
分子或离子 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型 分子或离子的
空间结构名称
SiF4
PCl3
PO43-
HCN
ClO2-
0 4 正四面体形 正四面体形
1 4 四面体形 三角锥形
0 4 正四面体形 正四面体形
0 2 直线形 直线形
2 4 四面体形 V形
