化学人教版(2019)选择性必修2 2.1.1共价键-σ键和π键(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.1.1共价键-σ键和π键(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 10:29:22 | ||
图片预览




文档简介
(共26张PPT)
第一节
共价键
化学键:
知识回顾
化学键的类型:离子键、共价键(极性键和非极性键)、金属键。
化学键的存在范围:
分子间不存在化学键。
离子键
共价键
金属键
构成离子化合物
构成共价型分子或原子团
构成金属单质和合金
组成丰富多彩
的物质世界
使离子相结合或原子相结合的强烈相互作用通称为化学键。
只存在于相邻的原子或离子之间。
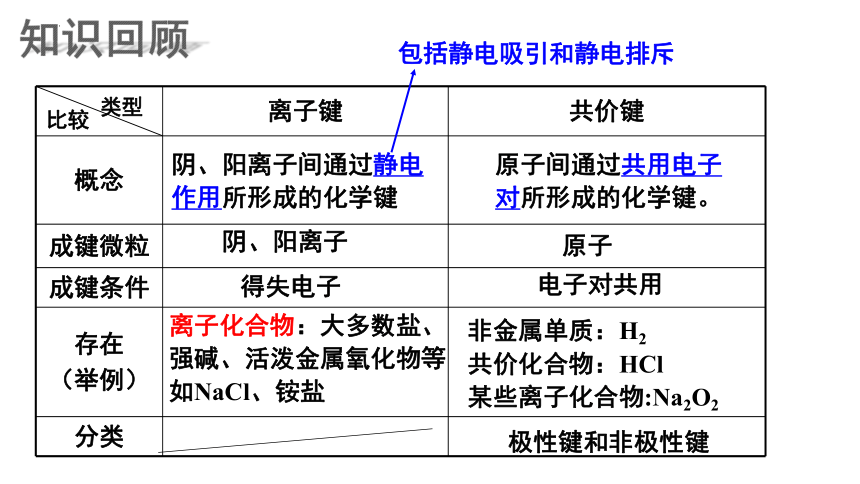
离子键 共价键
概念
成键微粒
成键条件
存在 (举例)
分类
类型
比较
阴、阳离子间通过静电
作用所形成的化学键
阴、阳离子
得失电子
离子化合物:大多数盐、强碱、活泼金属氧化物等如NaCl、铵盐
原子间通过共用电子对所形成的化学键。
原子
电子对共用
非金属单质:H2
共价化合物:HCl
某些离子化合物:Na2O2
极性键和非极性键
知识回顾
包括静电吸引和静电排斥
1.用电子式描述NaCl和HCl的形成过程:
H
H
:
:
:
:
Cl
·
:
:
:
Cl
·
+
Na
Na+
:
:
:
:
Cl
·
:
:
:
Cl
·
+
[ ]-
离子键
共价键
共用电子对
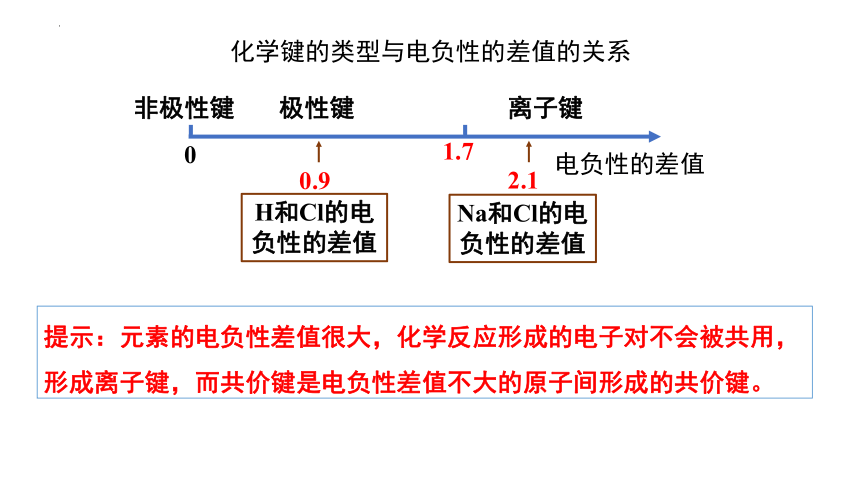
电负性的差值
0
非极性键
极性键
离子键
Na和Cl的电负性的差值
H和Cl的电负性的差值
0.9
2.1
化学键的类型与电负性的差值的关系
提示:元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。
1.7
一、共价键
1.共价键的定义
原子间通过共用电子对所形成的强烈相互作用,叫共价键。
2、共价键的本质:
共用电子对对两原子的作用力。
共价键形成的过程是成键原子相互接近,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对。
H
↑
1s1
H
↓
1s1
H2
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl2
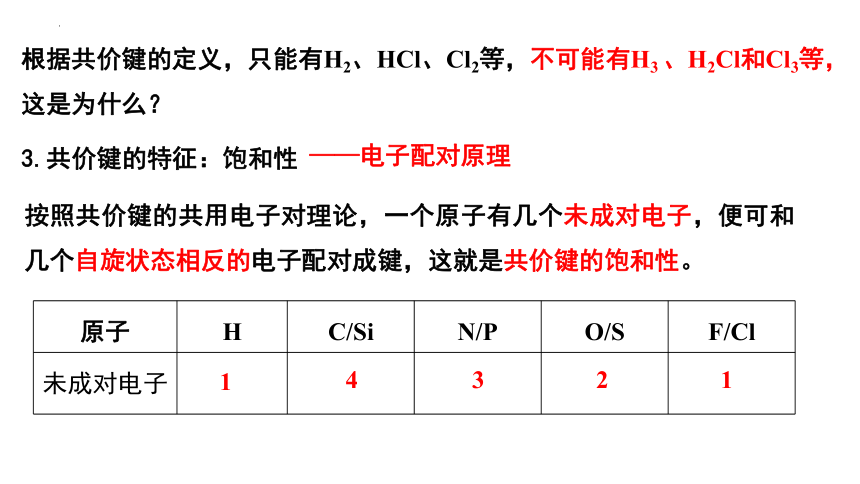
根据共价键的定义,只能有H2、HCl、Cl2等,不可能有H3 、H2Cl和Cl3等,这是为什么?
3.共价键的特征:饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的饱和性。
——电子配对原理
原子 H C/Si N/P O/S F/Cl
未成对电子
1
4
3
2
1
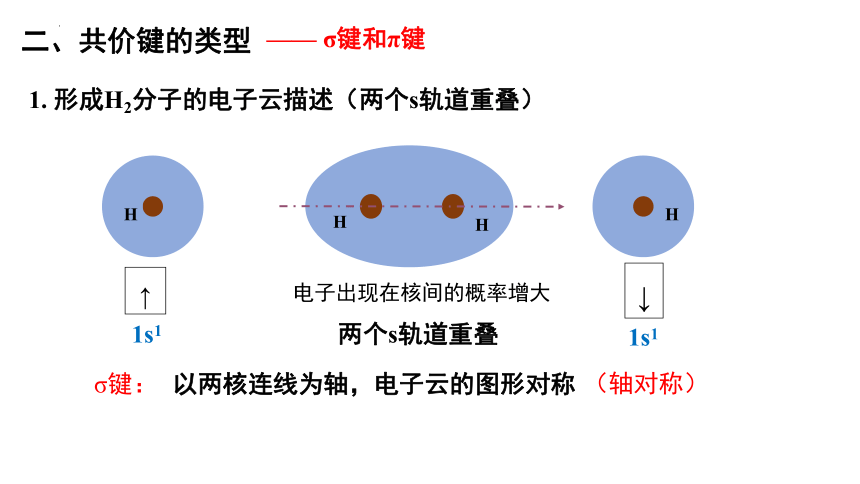
二、共价键的类型
—— σ键和π键
1. 形成H2分子的电子云描述(两个s轨道重叠)
H
H
H
H
两个s轨道重叠
↑
1s1
↓
1s1
电子出现在核间的概率增大
σ键:
以两核连线为轴,电子云的图形对称
(轴对称)
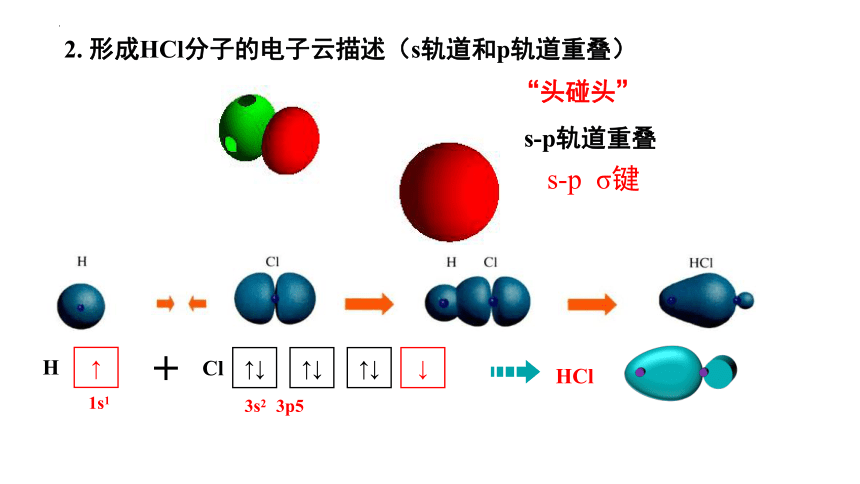
2. 形成HCl分子的电子云描述(s轨道和p轨道重叠)
“头碰头”
s-p轨道重叠
s-p σ键
H
↑
1s1
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
HCl
3. 形成Cl2分子的电子云描述(p轨道和p轨道重叠)
“头碰头”
p-p轨道重叠
p-p σ键
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl2
①特征:电子云的对称方式:
轴对称
③稳定性:形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。
②旋转:以形成σ键的两原子核的连线为轴,
任何一个原子均可以旋转,旋转时并不破坏σ键的结构。
概念:两原子在成键时,原子轨道以“头碰头”的方式重叠形成的共价键。
小结:σ键
④方向性:要使两个原子轨道重叠部分最大,原子轨道必须按一定的
方向进行重叠。(s-s σ键无方向性)
小结:σ键
s-s σ键,如:H-H
s-p σ键,如:H-Cl
p-p σ键,如:Cl-Cl
⑥种类
⑤存在:单键均为σ键,双键、三键均有σ键,
任何两个原子形成的共价键有且只有一个σ键
p轨道和p轨道除能形成σ键外,还能形成π键
——由两个原子的p轨道“肩并肩”重叠形成。
3.π键
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
π键的电子云具有镜面对称性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像;π键不能旋转;不如σ键牢固,较易断裂。
用电子式表示N2的形成过程,
并用原子轨道重叠来解释其共价键的形成过程。
N
↑
↑
↑
↑↓
2s
2px
2py
2pz
x
y
z
N的2p轨道示意图
:
:
:
:
N
:
N
+
N
·
·
·
:
N
·
·
·
:
x
y
z
x
y
z
N2中共价三键的形成过程
“头碰头”
σ键
x
y
z
x
y
z
N2中共价三键的形成过程
σ键
“头碰头”
“肩并肩”
π键
“肩并肩”
π键
N≡N
z
z
y
y
x
π
π
σ
N2中1个p-p σ键和2个p-p π键的形成过程
N≡N
↑ ↑ ↑
2P3轨道
4.判断共价键类型(按成键原子的原子轨道的重叠方式分类)
方法总结
①共价单键为 σ 键;
②共价双键中有一个σ 键、一个 π 键;
③共价三键由一个 σ 键和两个 π 键组成。
【探究】问题和预测
1)观察乙烷、乙烯、乙炔的分子结构,它们的分子中的共价键分别由几个σ键,几个π键构成?
7个 σ键
5个 σ键,1个π键
3个 σ键,2个π键
2)解释乙烯分子中的π键是如何形成的,预测乙炔分子中的π键是如何形成的
乙烯分子中σ键和π键的形成过程
乙炔分子中σ键和π键的形成过程
(1)NH3
(2)C2H4
(3)H2O2
(4)C4H10
(5)CnH2n+2
(6)CnH2n
3个σ键
5个σ键和1个π键
3个σ键
13个σ键
3n+1 个σ键
指出下列共价分子中所含的σ键和π键的数目:
3n-1 个σ键和1个π键(单烯烃)
或 3n个σ键(环烷烃)
1.下列说法对σ键和π键的认识不正确的是
A. 分子中只要含有共价键,则至少含有一个σ键
B. s-s σ键、p-p σ键与s-p σ键都是轴对称的
C. p-p σ键和p-p π键的重叠方式是相同的
D. 含有π键的分子在反应时,π键是化学反应的积极参与者
C
2.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是
A.CH4与NH3 B.C2H6与C2H4
C.H2与Cl2 D.Cl2与N2
A
3.具有下列电子排布式的原子中,不能形成π键的是
A.1s22s22p63s23p4 B.1s22s22p3
C.1s22s22p63s1 D.1s22s22p2
C
4. 丁烯二酸(HOOCCH=CHCOOH)分子结构中含有σ键、π键的个数分别是
A. 4个σ键,1个π键 B. 11个σ键,3个π键
C. 4个σ键,3个π键 D. 9个σ键,5个π键
A
5.下列物质的化学式和结构式中,从成键情况看不合理的是
A. CH3N: B.CH4S:
C. CH2SeO: D.CH4Si:
D
第一节
共价键
化学键:
知识回顾
化学键的类型:离子键、共价键(极性键和非极性键)、金属键。
化学键的存在范围:
分子间不存在化学键。
离子键
共价键
金属键
构成离子化合物
构成共价型分子或原子团
构成金属单质和合金
组成丰富多彩
的物质世界
使离子相结合或原子相结合的强烈相互作用通称为化学键。
只存在于相邻的原子或离子之间。
离子键 共价键
概念
成键微粒
成键条件
存在 (举例)
分类
类型
比较
阴、阳离子间通过静电
作用所形成的化学键
阴、阳离子
得失电子
离子化合物:大多数盐、强碱、活泼金属氧化物等如NaCl、铵盐
原子间通过共用电子对所形成的化学键。
原子
电子对共用
非金属单质:H2
共价化合物:HCl
某些离子化合物:Na2O2
极性键和非极性键
知识回顾
包括静电吸引和静电排斥
1.用电子式描述NaCl和HCl的形成过程:
H
H
:
:
:
:
Cl
·
:
:
:
Cl
·
+
Na
Na+
:
:
:
:
Cl
·
:
:
:
Cl
·
+
[ ]-
离子键
共价键
共用电子对
电负性的差值
0
非极性键
极性键
离子键
Na和Cl的电负性的差值
H和Cl的电负性的差值
0.9
2.1
化学键的类型与电负性的差值的关系
提示:元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。
1.7
一、共价键
1.共价键的定义
原子间通过共用电子对所形成的强烈相互作用,叫共价键。
2、共价键的本质:
共用电子对对两原子的作用力。
共价键形成的过程是成键原子相互接近,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对。
H
↑
1s1
H
↓
1s1
H2
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl2
根据共价键的定义,只能有H2、HCl、Cl2等,不可能有H3 、H2Cl和Cl3等,这是为什么?
3.共价键的特征:饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的饱和性。
——电子配对原理
原子 H C/Si N/P O/S F/Cl
未成对电子
1
4
3
2
1
二、共价键的类型
—— σ键和π键
1. 形成H2分子的电子云描述(两个s轨道重叠)
H
H
H
H
两个s轨道重叠
↑
1s1
↓
1s1
电子出现在核间的概率增大
σ键:
以两核连线为轴,电子云的图形对称
(轴对称)
2. 形成HCl分子的电子云描述(s轨道和p轨道重叠)
“头碰头”
s-p轨道重叠
s-p σ键
H
↑
1s1
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
HCl
3. 形成Cl2分子的电子云描述(p轨道和p轨道重叠)
“头碰头”
p-p轨道重叠
p-p σ键
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl2
①特征:电子云的对称方式:
轴对称
③稳定性:形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。
②旋转:以形成σ键的两原子核的连线为轴,
任何一个原子均可以旋转,旋转时并不破坏σ键的结构。
概念:两原子在成键时,原子轨道以“头碰头”的方式重叠形成的共价键。
小结:σ键
④方向性:要使两个原子轨道重叠部分最大,原子轨道必须按一定的
方向进行重叠。(s-s σ键无方向性)
小结:σ键
s-s σ键,如:H-H
s-p σ键,如:H-Cl
p-p σ键,如:Cl-Cl
⑥种类
⑤存在:单键均为σ键,双键、三键均有σ键,
任何两个原子形成的共价键有且只有一个σ键
p轨道和p轨道除能形成σ键外,还能形成π键
——由两个原子的p轨道“肩并肩”重叠形成。
3.π键
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
π键的电子云具有镜面对称性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像;π键不能旋转;不如σ键牢固,较易断裂。
用电子式表示N2的形成过程,
并用原子轨道重叠来解释其共价键的形成过程。
N
↑
↑
↑
↑↓
2s
2px
2py
2pz
x
y
z
N的2p轨道示意图
:
:
:
:
N
:
N
+
N
·
·
·
:
N
·
·
·
:
x
y
z
x
y
z
N2中共价三键的形成过程
“头碰头”
σ键
x
y
z
x
y
z
N2中共价三键的形成过程
σ键
“头碰头”
“肩并肩”
π键
“肩并肩”
π键
N≡N
z
z
y
y
x
π
π
σ
N2中1个p-p σ键和2个p-p π键的形成过程
N≡N
↑ ↑ ↑
2P3轨道
4.判断共价键类型(按成键原子的原子轨道的重叠方式分类)
方法总结
①共价单键为 σ 键;
②共价双键中有一个σ 键、一个 π 键;
③共价三键由一个 σ 键和两个 π 键组成。
【探究】问题和预测
1)观察乙烷、乙烯、乙炔的分子结构,它们的分子中的共价键分别由几个σ键,几个π键构成?
7个 σ键
5个 σ键,1个π键
3个 σ键,2个π键
2)解释乙烯分子中的π键是如何形成的,预测乙炔分子中的π键是如何形成的
乙烯分子中σ键和π键的形成过程
乙炔分子中σ键和π键的形成过程
(1)NH3
(2)C2H4
(3)H2O2
(4)C4H10
(5)CnH2n+2
(6)CnH2n
3个σ键
5个σ键和1个π键
3个σ键
13个σ键
3n+1 个σ键
指出下列共价分子中所含的σ键和π键的数目:
3n-1 个σ键和1个π键(单烯烃)
或 3n个σ键(环烷烃)
1.下列说法对σ键和π键的认识不正确的是
A. 分子中只要含有共价键,则至少含有一个σ键
B. s-s σ键、p-p σ键与s-p σ键都是轴对称的
C. p-p σ键和p-p π键的重叠方式是相同的
D. 含有π键的分子在反应时,π键是化学反应的积极参与者
C
2.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是
A.CH4与NH3 B.C2H6与C2H4
C.H2与Cl2 D.Cl2与N2
A
3.具有下列电子排布式的原子中,不能形成π键的是
A.1s22s22p63s23p4 B.1s22s22p3
C.1s22s22p63s1 D.1s22s22p2
C
4. 丁烯二酸(HOOCCH=CHCOOH)分子结构中含有σ键、π键的个数分别是
A. 4个σ键,1个π键 B. 11个σ键,3个π键
C. 4个σ键,3个π键 D. 9个σ键,5个π键
A
5.下列物质的化学式和结构式中,从成键情况看不合理的是
A. CH3N: B.CH4S:
C. CH2SeO: D.CH4Si:
D
