10.1-2常见的酸和碱(第2课时)(教学课件)-2023-2024学年九年级化学下册一站式课堂备课资源包(人教版)
文档属性
| 名称 | 10.1-2常见的酸和碱(第2课时)(教学课件)-2023-2024学年九年级化学下册一站式课堂备课资源包(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 11:38:40 | ||
图片预览





文档简介
(共23张PPT)
常见的酸和碱(第2课时)
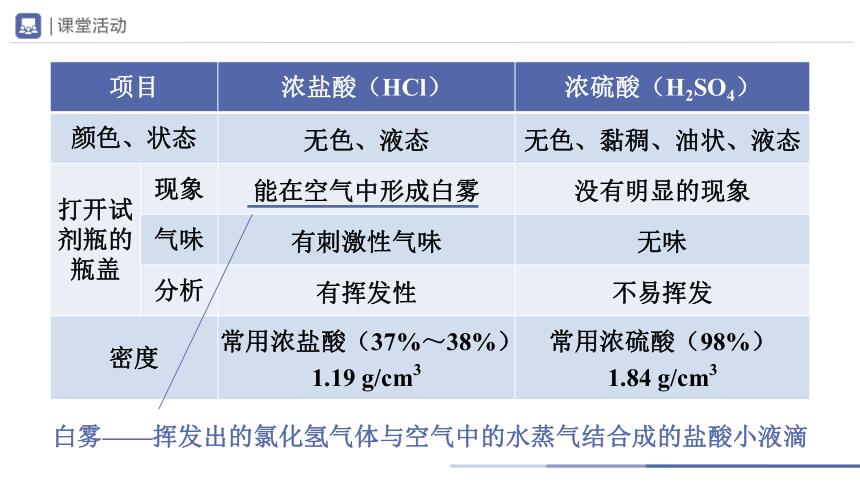
项目 浓盐酸(HCl) 浓硫酸(H2SO4)
颜色、状态
打开试剂瓶的瓶盖 现象
气味
分析
密度 常用浓盐酸(37%~38%) 1.19 g/cm3 常用浓硫酸(98%)
1.84 g/cm3
白雾——挥发出的氯化氢气体与空气中的水蒸气结合成的盐酸小液滴
无色、液态
无色、黏稠、油状、液态
能在空气中形成白雾
没有明显的现象
有刺激性气味
无味
有挥发性
不易挥发
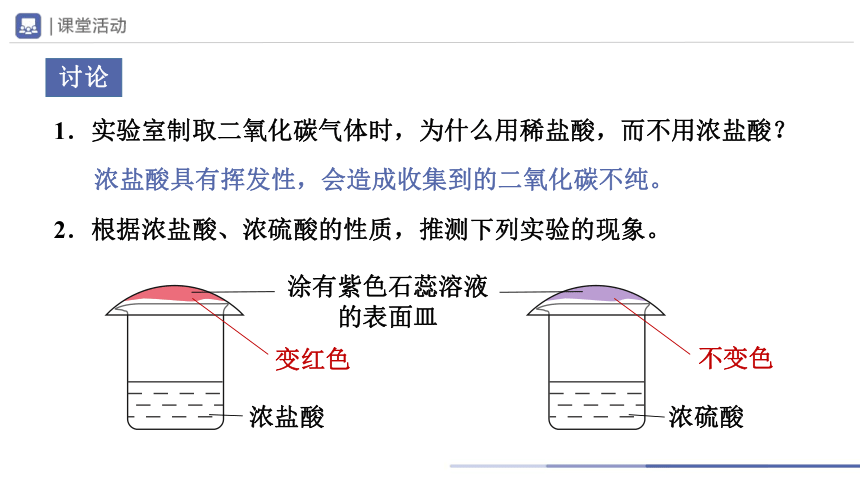
1.实验室制取二氧化碳气体时,为什么用稀盐酸,而不用浓盐酸?
浓盐酸具有挥发性,会造成收集到的二氧化碳不纯。
2.根据浓盐酸、浓硫酸的性质,推测下列实验的现象。
浓硫酸
涂有紫色石蕊溶液的表面皿
浓盐酸
讨论
变红色
不变色
实验室和化工生产中常见的酸:
生活中常见的酸:
盐酸(HCl)、硫酸( )、
硝酸( )、醋酸( )等。
食醋
(醋酸)
柠檬、柑橘等水果
(柠檬酸)
汽车用铅酸蓄电池
(硫酸)
浓硫酸具有吸水性。
培养皿 将内壁附着水雾的小烧杯倒扣在培养皿中,
静置一会儿,观察现象
盛有少量浓硫酸
空
观察与分析
现象
分析:
烧杯内壁的水汽逐渐消失
没有明显变化
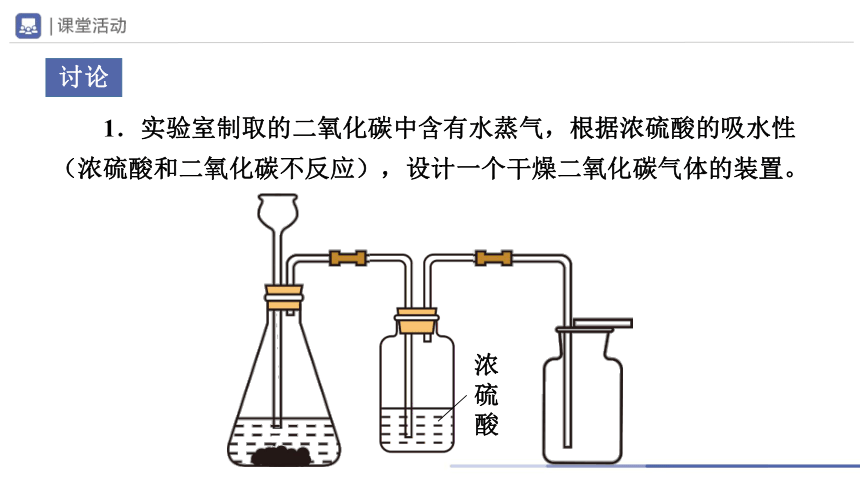
1.实验室制取的二氧化碳中含有水蒸气,根据浓硫酸的吸水性(浓硫酸和二氧化碳不反应),设计一个干燥二氧化碳气体的装置。
浓硫酸
讨论
浓盐酸和浓硫酸都必须密封保存。
溶液 溶质质量 溶剂质量 溶液质量 溶质的质量分数 是否变质
浓盐酸
浓硫酸
讨论
2.根据浓盐酸、浓硫酸的性质分析,它们是否需要密封保存?
减小 不变 减小 减小 否
不变 增大 增大 减小 否
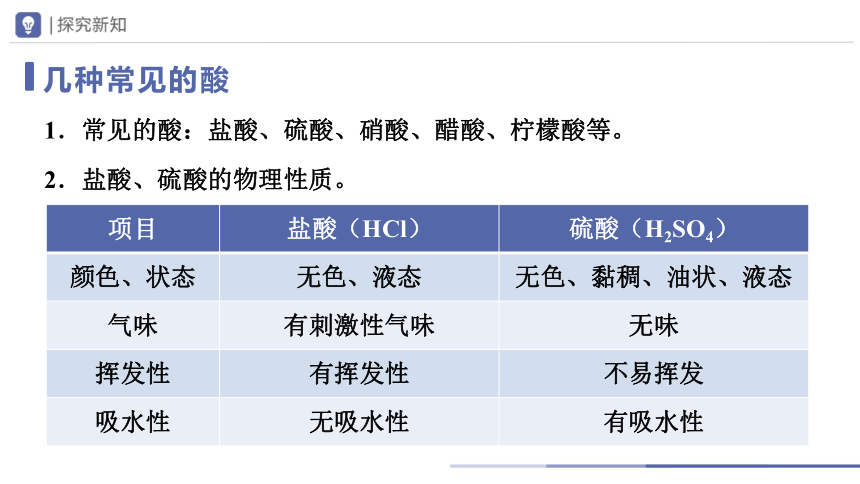
几种常见的酸
项目 盐酸(HCl) 硫酸(H2SO4)
颜色、状态 无色、液态 无色、黏稠、油状、液态
气味 有刺激性气味 无味
挥发性 有挥发性 不易挥发
吸水性 无吸水性 有吸水性
1.常见的酸:盐酸、硫酸、硝酸、醋酸、柠檬酸等。
2.盐酸、硫酸的物理性质。
注意:浓硫酸有强烈的腐蚀性!
不要将浓硫酸沾到皮肤或衣服上。如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
浓硫酸的腐蚀性
实验
实验 放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸少量浓硫酸
将浓硫酸滴到一小块布上
认识浓硫酸的腐蚀性
浓硫酸能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等
元素的化合物组成)里的水分,生成黑色的炭。
拓展:脱水作用——将物质中的氢、氧元素按水的组成比脱去。
纸上显出黑色字迹
蘸有硫酸的部位变黑
滴有硫酸的部位变黑甚至形成洞
浓硫酸
气体
吸水性——物理性质
脱水性——化学性质
(C6H10O5)n
纤维素
碳
水
C + H2O
比较
浓硫酸的吸水性与脱水性
浓硫酸
水
当水滴入浓硫酸中时,发出“呲”的声音,瓶内液体向四处飞溅。
要将浓硫酸配成稀硫酸,是向浓硫酸中加水还是向水中加浓硫酸?
浓硫酸的稀释
打开活塞,让水缓慢地滴入瓶中的浓硫酸里,观察现象。
浓硫酸
水
要将浓硫酸配成稀硫酸,是向浓硫酸中加水还是向水中加浓硫酸?
浓硫酸的稀释
将水注入浓硫酸,由于水的密度较小,水会浮在浓硫酸上面,溶解时放出的热能使水立刻沸腾,使硫酸液滴向四周飞溅,非常危险!因此严禁将水倒入浓硫酸中!
水的密度是 1.0 g/cm3,浓硫酸的密度是 1.84 g/cm3
浓硫酸溶解时放出大量的热
酸入水,沿器壁,慢慢倒,不断搅。
严禁将水注入浓硫酸中。
水
浓硫酸的稀释
浓硫酸
水
溶液 滴加紫色 石蕊溶液 滴加无色
酚酞溶液
稀盐酸
稀硫酸
实验
酚酞溶液
稀硫酸
稀盐酸
石蕊溶液
酸与指示剂作用
变红色 不变色
变红色 不变色
金属 与稀盐酸反应 与稀硫酸反应
镁
锌
铁
回顾
上述反应的生成物都是______和________________________________。
金属离子与酸根离子构成的化合物
氢气
酸与活泼金属的反应
反应物 现象 化学方程式
铁锈+ 稀盐酸
铁锈+ 稀硫酸
实验
提醒:化合物中铁的化合价为+2价时,读作“××亚铁”,溶液一般呈浅绿色;为+3价时,读作“××铁”,溶液一般呈黄色。
将生锈的铁钉投入稀盐酸、稀硫酸中
铁锈消失,铁钉变得光亮,溶液由无色变黄色
铁锈消失,铁钉变得光亮,溶液由无色变黄色
反应物 现象 化学方程式
铁锈+ 稀盐酸 铁锈消失,铁钉变得光亮,溶液由无色变黄色
铁锈+ 稀硫酸 铁锈消失,铁钉变得光亮,溶液由无色变黄色
实验
上述反应的生成物都是______和________________________________。
金属离子与酸根离子构成的化合物
水
将生锈的铁钉投入稀盐酸、稀硫酸中
酸的化学性质
1.酸能与指示剂作用,使指示剂显示不同的颜色。
石蕊溶液遇酸变红色,酚酞溶液遇酸不变色。
2.酸能与多种活泼金属反应,生成该金属的化合物和氢气。
3.与某些金属氧化物反应,生成该金属的化合物和水。
K
钾
Ca
钙
Na
钠
Mg
镁
Al
铝
Zn
锌
Fe
铁
Sn
锡
Pb
铅
(H)
(氢)
Cu
铜
Hg
汞
Ag
银
Pt
铂
Au
金
讨论
1.清除铁制品表面的锈时,将其长时间浸在足量的稀盐酸中。
2.清除烧黑的铜丝表面的氧化铜时,将其长时间浸在足量的稀硫酸中。
(1)铁锈消失,溶液变成黄色。
(2)铁制品被腐蚀,有气泡产生,溶液逐渐变成浅绿色。
黑色的氧化铜消失,溶液变成蓝色。
分析下列情境中会发生的现象,写出相关反应的化学方程式。
物质 用途
盐酸
硫酸
盐酸、硫酸的用途
重要的化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中含有盐酸,可帮助消化
重要的化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等
浓硫酸有吸水性,在实验室中常用它作干燥剂
常见的酸
个性
浓盐酸——挥发性
可用于干燥 等气体
酸入水,沿器壁,
慢慢倒,不断搅
浓硫酸
吸水性
脱水性
溶解时大量放热
共性
与指示剂作用
与多种活泼金属反应,生成氢气
与某些金属氧化物反应,生成水
可用于金属除锈
常见的酸和碱(第2课时)
项目 浓盐酸(HCl) 浓硫酸(H2SO4)
颜色、状态
打开试剂瓶的瓶盖 现象
气味
分析
密度 常用浓盐酸(37%~38%) 1.19 g/cm3 常用浓硫酸(98%)
1.84 g/cm3
白雾——挥发出的氯化氢气体与空气中的水蒸气结合成的盐酸小液滴
无色、液态
无色、黏稠、油状、液态
能在空气中形成白雾
没有明显的现象
有刺激性气味
无味
有挥发性
不易挥发
1.实验室制取二氧化碳气体时,为什么用稀盐酸,而不用浓盐酸?
浓盐酸具有挥发性,会造成收集到的二氧化碳不纯。
2.根据浓盐酸、浓硫酸的性质,推测下列实验的现象。
浓硫酸
涂有紫色石蕊溶液的表面皿
浓盐酸
讨论
变红色
不变色
实验室和化工生产中常见的酸:
生活中常见的酸:
盐酸(HCl)、硫酸( )、
硝酸( )、醋酸( )等。
食醋
(醋酸)
柠檬、柑橘等水果
(柠檬酸)
汽车用铅酸蓄电池
(硫酸)
浓硫酸具有吸水性。
培养皿 将内壁附着水雾的小烧杯倒扣在培养皿中,
静置一会儿,观察现象
盛有少量浓硫酸
空
观察与分析
现象
分析:
烧杯内壁的水汽逐渐消失
没有明显变化
1.实验室制取的二氧化碳中含有水蒸气,根据浓硫酸的吸水性(浓硫酸和二氧化碳不反应),设计一个干燥二氧化碳气体的装置。
浓硫酸
讨论
浓盐酸和浓硫酸都必须密封保存。
溶液 溶质质量 溶剂质量 溶液质量 溶质的质量分数 是否变质
浓盐酸
浓硫酸
讨论
2.根据浓盐酸、浓硫酸的性质分析,它们是否需要密封保存?
减小 不变 减小 减小 否
不变 增大 增大 减小 否
几种常见的酸
项目 盐酸(HCl) 硫酸(H2SO4)
颜色、状态 无色、液态 无色、黏稠、油状、液态
气味 有刺激性气味 无味
挥发性 有挥发性 不易挥发
吸水性 无吸水性 有吸水性
1.常见的酸:盐酸、硫酸、硝酸、醋酸、柠檬酸等。
2.盐酸、硫酸的物理性质。
注意:浓硫酸有强烈的腐蚀性!
不要将浓硫酸沾到皮肤或衣服上。如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
浓硫酸的腐蚀性
实验
实验 放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸少量浓硫酸
将浓硫酸滴到一小块布上
认识浓硫酸的腐蚀性
浓硫酸能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等
元素的化合物组成)里的水分,生成黑色的炭。
拓展:脱水作用——将物质中的氢、氧元素按水的组成比脱去。
纸上显出黑色字迹
蘸有硫酸的部位变黑
滴有硫酸的部位变黑甚至形成洞
浓硫酸
气体
吸水性——物理性质
脱水性——化学性质
(C6H10O5)n
纤维素
碳
水
C + H2O
比较
浓硫酸的吸水性与脱水性
浓硫酸
水
当水滴入浓硫酸中时,发出“呲”的声音,瓶内液体向四处飞溅。
要将浓硫酸配成稀硫酸,是向浓硫酸中加水还是向水中加浓硫酸?
浓硫酸的稀释
打开活塞,让水缓慢地滴入瓶中的浓硫酸里,观察现象。
浓硫酸
水
要将浓硫酸配成稀硫酸,是向浓硫酸中加水还是向水中加浓硫酸?
浓硫酸的稀释
将水注入浓硫酸,由于水的密度较小,水会浮在浓硫酸上面,溶解时放出的热能使水立刻沸腾,使硫酸液滴向四周飞溅,非常危险!因此严禁将水倒入浓硫酸中!
水的密度是 1.0 g/cm3,浓硫酸的密度是 1.84 g/cm3
浓硫酸溶解时放出大量的热
酸入水,沿器壁,慢慢倒,不断搅。
严禁将水注入浓硫酸中。
水
浓硫酸的稀释
浓硫酸
水
溶液 滴加紫色 石蕊溶液 滴加无色
酚酞溶液
稀盐酸
稀硫酸
实验
酚酞溶液
稀硫酸
稀盐酸
石蕊溶液
酸与指示剂作用
变红色 不变色
变红色 不变色
金属 与稀盐酸反应 与稀硫酸反应
镁
锌
铁
回顾
上述反应的生成物都是______和________________________________。
金属离子与酸根离子构成的化合物
氢气
酸与活泼金属的反应
反应物 现象 化学方程式
铁锈+ 稀盐酸
铁锈+ 稀硫酸
实验
提醒:化合物中铁的化合价为+2价时,读作“××亚铁”,溶液一般呈浅绿色;为+3价时,读作“××铁”,溶液一般呈黄色。
将生锈的铁钉投入稀盐酸、稀硫酸中
铁锈消失,铁钉变得光亮,溶液由无色变黄色
铁锈消失,铁钉变得光亮,溶液由无色变黄色
反应物 现象 化学方程式
铁锈+ 稀盐酸 铁锈消失,铁钉变得光亮,溶液由无色变黄色
铁锈+ 稀硫酸 铁锈消失,铁钉变得光亮,溶液由无色变黄色
实验
上述反应的生成物都是______和________________________________。
金属离子与酸根离子构成的化合物
水
将生锈的铁钉投入稀盐酸、稀硫酸中
酸的化学性质
1.酸能与指示剂作用,使指示剂显示不同的颜色。
石蕊溶液遇酸变红色,酚酞溶液遇酸不变色。
2.酸能与多种活泼金属反应,生成该金属的化合物和氢气。
3.与某些金属氧化物反应,生成该金属的化合物和水。
K
钾
Ca
钙
Na
钠
Mg
镁
Al
铝
Zn
锌
Fe
铁
Sn
锡
Pb
铅
(H)
(氢)
Cu
铜
Hg
汞
Ag
银
Pt
铂
Au
金
讨论
1.清除铁制品表面的锈时,将其长时间浸在足量的稀盐酸中。
2.清除烧黑的铜丝表面的氧化铜时,将其长时间浸在足量的稀硫酸中。
(1)铁锈消失,溶液变成黄色。
(2)铁制品被腐蚀,有气泡产生,溶液逐渐变成浅绿色。
黑色的氧化铜消失,溶液变成蓝色。
分析下列情境中会发生的现象,写出相关反应的化学方程式。
物质 用途
盐酸
硫酸
盐酸、硫酸的用途
重要的化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中含有盐酸,可帮助消化
重要的化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等
浓硫酸有吸水性,在实验室中常用它作干燥剂
常见的酸
个性
浓盐酸——挥发性
可用于干燥 等气体
酸入水,沿器壁,
慢慢倒,不断搅
浓硫酸
吸水性
脱水性
溶解时大量放热
共性
与指示剂作用
与多种活泼金属反应,生成氢气
与某些金属氧化物反应,生成水
可用于金属除锈
同课章节目录
