课题2 酸和碱的中和反应 第2课时 教学课件(共20张PPT)
文档属性
| 名称 | 课题2 酸和碱的中和反应 第2课时 教学课件(共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 11:45:40 | ||
图片预览






文档简介
(共20张PPT)
酸和碱的中和反应(第2课时)
日常生活中,我们在吃葡萄、柠檬、苹果、橙子等水果时,会感到它们都是酸的,但酸的程度不同。你能给葡萄、柠檬、苹果、橙子的酸性强弱排序吗?你是怎么作出判断的?
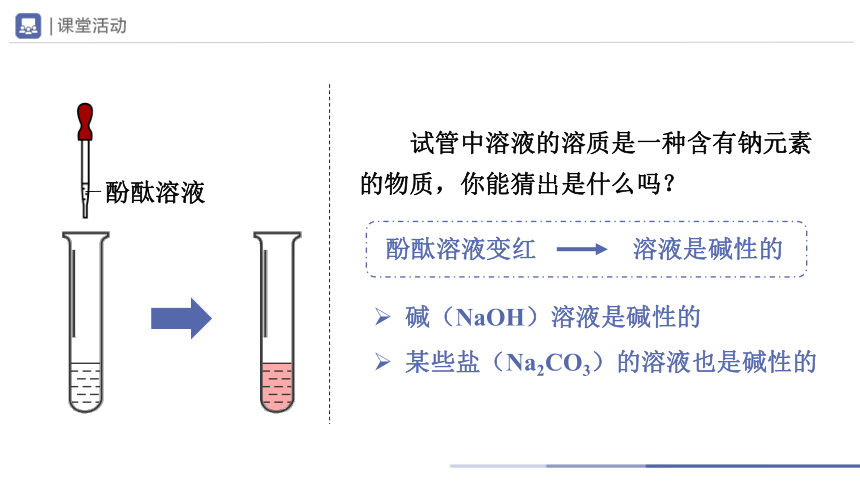
试管中溶液的溶质是一种含有钠元素的物质,你能猜出是什么吗?
酚酞溶液
碱(NaOH)溶液是碱性的
某些盐(Na2CO3)的溶液也是碱性的
酚酞溶液变红
溶液是碱性的
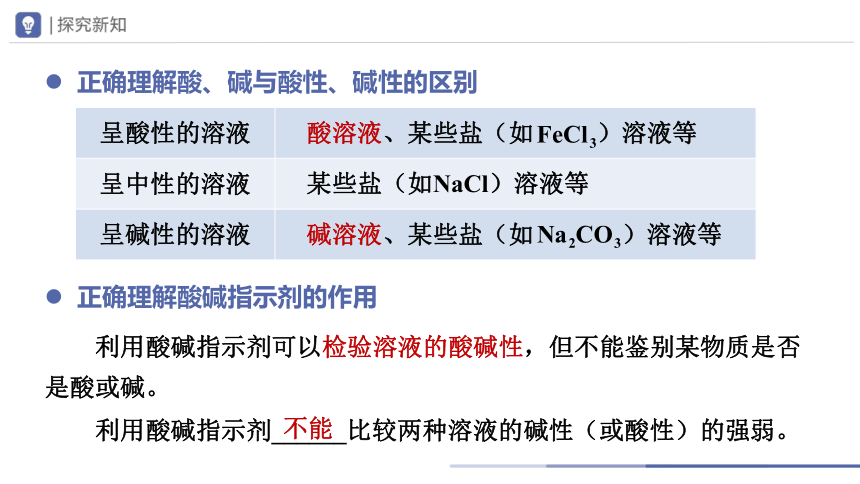
正确理解酸、碱与酸性、碱性的区别
正确理解酸碱指示剂的作用
利用酸碱指示剂可以检验溶液的酸碱性,但不能鉴别某物质是否是酸或碱。
呈酸性的溶液 酸溶液、某些盐(如 )溶液等
呈中性的溶液 某些盐(如NaCl)溶液等
呈碱性的溶液 碱溶液、某些盐(如 )溶液等
利用酸碱指示剂______比较两种溶液的碱性(或酸性)的强弱。
不能
溶液酸碱度的表示法——pH
1.溶液的酸碱性强弱程度叫溶液的酸碱度。
2.溶液的酸碱度常用pH来表示,pH的范围通常为 0~14。
(注意:pH是在常温下,对稀溶液的酸碱度进行测定。)
怎样根据溶液的pH判断溶液的酸碱性及其强弱呢?
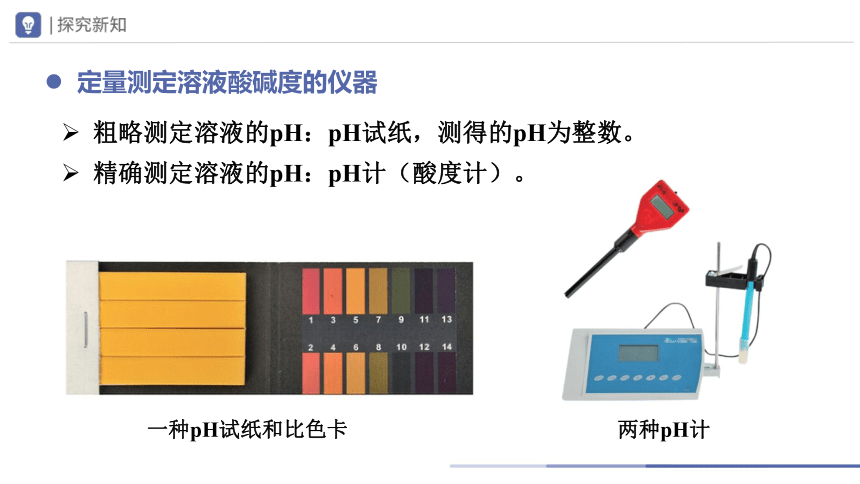
两种pH计
一种pH试纸和比色卡
粗略测定溶液的pH:pH试纸,测得的pH为整数。
精确测定溶液的pH:pH计(酸度计)。
定量测定溶液酸碱度的仪器
注意:不能用试纸直接蘸取溶液,否则会导致待测溶液被污染。
1.在白瓷板或玻璃片上放一小片干燥的pH试纸。
2.用玻璃棒蘸取待测溶液滴到pH试纸上。
使用pH试纸测定溶液pH的方法
pH=2
pH=13
甲
乙
1.在白瓷板或玻璃片上放一小片干燥的pH试纸。
2.用玻璃棒蘸取待测溶液滴到pH试纸上。
3.试纸变色后,把试纸显示的颜色与标准比色卡比较,读取相同或相近颜色的pH即为待测溶液的pH。
使用pH试纸测定溶液pH的方法
实验
探究pH与溶液酸碱性的关系
1.分别测量稀盐酸、稀硫酸、稀氢氧化钠溶液、氯化钠溶液的pH。
2.用蒸馏水稀释各溶液,使溶液浓度降低,再测一次pH。
进行实验与收集证据
提示:溶液的浓度大小影响其pH,将酸性(或碱性)溶液加水稀释后,其酸性(或碱性)减弱。
分析 稀盐酸或稀硫酸加水稀释后,其酸性减弱,pH______
稀氢氧化钠溶液加水稀释后,其碱性减弱,pH______
氯化钠溶液加水稀释后,pH______
结论 pH_____的溶液为中性
pH_____的溶液为酸性,且pH越_____,酸性越强
pH_____的溶液为碱性,且pH越_____,碱性越强
变大
变小
=7
>7
<7
小
大
实验
探究pH与溶液酸碱性的关系
分析与论证
不变
1.先用水润湿pH试纸,再测定溶液的pH,不影响测定结果。
2.小明用pH试纸测得稀盐酸的pH为2.5。
普通的pH试纸测得的pH只能精确到整数位。
测定酸性溶液,测得酸性偏弱,即pH偏大;
测定碱性溶液,测得碱性偏弱,即pH偏小;
测定中性溶液,测得的pH不变。
实验
探究pH与溶液酸碱性的关系
评估:判断下列说法的正误。
溶液酸碱度的表示法——pH
1.溶液的酸碱性强弱程度叫溶液的酸碱度。
2.溶液的酸碱度常用pH来表示,pH的范围通常为 0~14。
(注意:pH是在常温下,对稀溶液的酸碱度进行测定。)
3.测定pH最简便的方法:使用pH试纸。
注意:①试纸干燥;②不能用试纸直接蘸取溶液;③读数为整数。
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
pH=7 中性
pH<7 酸性
pH>7 碱性
酸性增强
碱性增强
实验
测定生活中一些物质的pH
溶液 pH 酸碱性
橘汁 3~4 酸性
糖水 7 中性
牛奶 6~7 偏酸性
番茄汁 4~5 酸性
肥皂水 10 碱性
苹果汁 3 酸性
溶液 pH 酸碱性
汽水 3~4 酸性
自来水 6~7 偏酸性
唾液 6~7 偏酸性
草木灰水 11 碱性
洗洁精 12~13 碱性
白醋 2~3 酸性
身边一些物质的pH
怎样调节溶液的pH?若某溶液的pH为5,根据下列要求,从①稀盐酸(pH=3)、②蒸馏水、③稀氢氧化钠溶液(pH=10)中选择合适的试剂进行调节。
将溶液的pH调节为4,可以选用______;调节为6,可以选用
______;调节为7,可以选用______;调节为8,可以选用______。
③
③
②③
①
溶液的酸碱性在实际中的意义
1.化工生产领域:许多反应都必须在一定pH的溶液里才能进行。
方法 酸性溶液 碱性溶液
加水稀释
加酸碱性相反 的溶液
加酸碱性相同、pH不同的溶液
调节溶液pH的方法
pH变大,逐渐接近7,
但不能等于、大于7
pH变小,逐渐接近7,
但不能等于、小于7
pH变大,可能小于、
等于或大于7
pH变小,可能大于、
等于或小于7
pH介于两溶液的pH之间
pH介于两溶液的pH之间
溶液的酸碱性在实际中的意义
1.化工生产领域:许多反应都必须在一定pH的溶液里才能进行。
2.农业生产领域:农作物一般适宜在pH=7或接近7的土壤中生长,调节土壤的pH是改良土壤的方法之一。
3.环境监测领域:正常雨水的pH≈5.6,酸雨的pH<5.6,监测雨水的pH,可以了解空气的污染情况。
4.人体健康领域:健康人的体液必须维持在一定的酸碱度范围内,测定人体内或排出的液体的pH,可以帮助人们了解身体的健康状况。
人体内的一些液体和排泄物 正常pH范围
血浆 7.35~7.45
唾液 6.6~7.1
胃液 0.9~1.5
乳汁 6.6~7.6
胆汁 7.1~7.3
胰液 7.5~8.0
尿液 4.7~8.4
人体体质没有酸碱性之分,正常人体内环境的酸碱度相对稳定,一般不受饮食的影响。
科学辟谣
酸碱度
含义:溶液的酸碱性强弱程度
用pH试纸可以测定溶液的酸碱度
表示方法:pH
pH<7,酸性,pH越小,酸性越强
pH>7,碱性,pH越大,碱性越强
pH=7,中性
了解溶液的酸碱性在实际中有重要的意义
调节溶液pH的方法
酸雨的pH<5.6
酸和碱的中和反应(第2课时)
日常生活中,我们在吃葡萄、柠檬、苹果、橙子等水果时,会感到它们都是酸的,但酸的程度不同。你能给葡萄、柠檬、苹果、橙子的酸性强弱排序吗?你是怎么作出判断的?
试管中溶液的溶质是一种含有钠元素的物质,你能猜出是什么吗?
酚酞溶液
碱(NaOH)溶液是碱性的
某些盐(Na2CO3)的溶液也是碱性的
酚酞溶液变红
溶液是碱性的
正确理解酸、碱与酸性、碱性的区别
正确理解酸碱指示剂的作用
利用酸碱指示剂可以检验溶液的酸碱性,但不能鉴别某物质是否是酸或碱。
呈酸性的溶液 酸溶液、某些盐(如 )溶液等
呈中性的溶液 某些盐(如NaCl)溶液等
呈碱性的溶液 碱溶液、某些盐(如 )溶液等
利用酸碱指示剂______比较两种溶液的碱性(或酸性)的强弱。
不能
溶液酸碱度的表示法——pH
1.溶液的酸碱性强弱程度叫溶液的酸碱度。
2.溶液的酸碱度常用pH来表示,pH的范围通常为 0~14。
(注意:pH是在常温下,对稀溶液的酸碱度进行测定。)
怎样根据溶液的pH判断溶液的酸碱性及其强弱呢?
两种pH计
一种pH试纸和比色卡
粗略测定溶液的pH:pH试纸,测得的pH为整数。
精确测定溶液的pH:pH计(酸度计)。
定量测定溶液酸碱度的仪器
注意:不能用试纸直接蘸取溶液,否则会导致待测溶液被污染。
1.在白瓷板或玻璃片上放一小片干燥的pH试纸。
2.用玻璃棒蘸取待测溶液滴到pH试纸上。
使用pH试纸测定溶液pH的方法
pH=2
pH=13
甲
乙
1.在白瓷板或玻璃片上放一小片干燥的pH试纸。
2.用玻璃棒蘸取待测溶液滴到pH试纸上。
3.试纸变色后,把试纸显示的颜色与标准比色卡比较,读取相同或相近颜色的pH即为待测溶液的pH。
使用pH试纸测定溶液pH的方法
实验
探究pH与溶液酸碱性的关系
1.分别测量稀盐酸、稀硫酸、稀氢氧化钠溶液、氯化钠溶液的pH。
2.用蒸馏水稀释各溶液,使溶液浓度降低,再测一次pH。
进行实验与收集证据
提示:溶液的浓度大小影响其pH,将酸性(或碱性)溶液加水稀释后,其酸性(或碱性)减弱。
分析 稀盐酸或稀硫酸加水稀释后,其酸性减弱,pH______
稀氢氧化钠溶液加水稀释后,其碱性减弱,pH______
氯化钠溶液加水稀释后,pH______
结论 pH_____的溶液为中性
pH_____的溶液为酸性,且pH越_____,酸性越强
pH_____的溶液为碱性,且pH越_____,碱性越强
变大
变小
=7
>7
<7
小
大
实验
探究pH与溶液酸碱性的关系
分析与论证
不变
1.先用水润湿pH试纸,再测定溶液的pH,不影响测定结果。
2.小明用pH试纸测得稀盐酸的pH为2.5。
普通的pH试纸测得的pH只能精确到整数位。
测定酸性溶液,测得酸性偏弱,即pH偏大;
测定碱性溶液,测得碱性偏弱,即pH偏小;
测定中性溶液,测得的pH不变。
实验
探究pH与溶液酸碱性的关系
评估:判断下列说法的正误。
溶液酸碱度的表示法——pH
1.溶液的酸碱性强弱程度叫溶液的酸碱度。
2.溶液的酸碱度常用pH来表示,pH的范围通常为 0~14。
(注意:pH是在常温下,对稀溶液的酸碱度进行测定。)
3.测定pH最简便的方法:使用pH试纸。
注意:①试纸干燥;②不能用试纸直接蘸取溶液;③读数为整数。
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
pH=7 中性
pH<7 酸性
pH>7 碱性
酸性增强
碱性增强
实验
测定生活中一些物质的pH
溶液 pH 酸碱性
橘汁 3~4 酸性
糖水 7 中性
牛奶 6~7 偏酸性
番茄汁 4~5 酸性
肥皂水 10 碱性
苹果汁 3 酸性
溶液 pH 酸碱性
汽水 3~4 酸性
自来水 6~7 偏酸性
唾液 6~7 偏酸性
草木灰水 11 碱性
洗洁精 12~13 碱性
白醋 2~3 酸性
身边一些物质的pH
怎样调节溶液的pH?若某溶液的pH为5,根据下列要求,从①稀盐酸(pH=3)、②蒸馏水、③稀氢氧化钠溶液(pH=10)中选择合适的试剂进行调节。
将溶液的pH调节为4,可以选用______;调节为6,可以选用
______;调节为7,可以选用______;调节为8,可以选用______。
③
③
②③
①
溶液的酸碱性在实际中的意义
1.化工生产领域:许多反应都必须在一定pH的溶液里才能进行。
方法 酸性溶液 碱性溶液
加水稀释
加酸碱性相反 的溶液
加酸碱性相同、pH不同的溶液
调节溶液pH的方法
pH变大,逐渐接近7,
但不能等于、大于7
pH变小,逐渐接近7,
但不能等于、小于7
pH变大,可能小于、
等于或大于7
pH变小,可能大于、
等于或小于7
pH介于两溶液的pH之间
pH介于两溶液的pH之间
溶液的酸碱性在实际中的意义
1.化工生产领域:许多反应都必须在一定pH的溶液里才能进行。
2.农业生产领域:农作物一般适宜在pH=7或接近7的土壤中生长,调节土壤的pH是改良土壤的方法之一。
3.环境监测领域:正常雨水的pH≈5.6,酸雨的pH<5.6,监测雨水的pH,可以了解空气的污染情况。
4.人体健康领域:健康人的体液必须维持在一定的酸碱度范围内,测定人体内或排出的液体的pH,可以帮助人们了解身体的健康状况。
人体内的一些液体和排泄物 正常pH范围
血浆 7.35~7.45
唾液 6.6~7.1
胃液 0.9~1.5
乳汁 6.6~7.6
胆汁 7.1~7.3
胰液 7.5~8.0
尿液 4.7~8.4
人体体质没有酸碱性之分,正常人体内环境的酸碱度相对稳定,一般不受饮食的影响。
科学辟谣
酸碱度
含义:溶液的酸碱性强弱程度
用pH试纸可以测定溶液的酸碱度
表示方法:pH
pH<7,酸性,pH越小,酸性越强
pH>7,碱性,pH越大,碱性越强
pH=7,中性
了解溶液的酸碱性在实际中有重要的意义
调节溶液pH的方法
酸雨的pH<5.6
同课章节目录
