第十单元 酸和碱 单元复习 教学课件 (共33张PPT)
文档属性
| 名称 | 第十单元 酸和碱 单元复习 教学课件 (共33张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 11:57:51 | ||
图片预览







文档简介
(共33张PPT)
第十单元 酸和碱
有两瓶没有标签的液体,分别是稀盐酸和澄清石灰水,设计实验方案,通过实验鉴别出这两瓶液体分别是什么?
检验酸碱性 酸的通性 碱的通性 其他
石蕊溶液
酚酞溶液
pH试纸
二氧化碳
锌、铁等活泼金属
铁锈等金属氧化物
氢氧化钙
碳酸钙
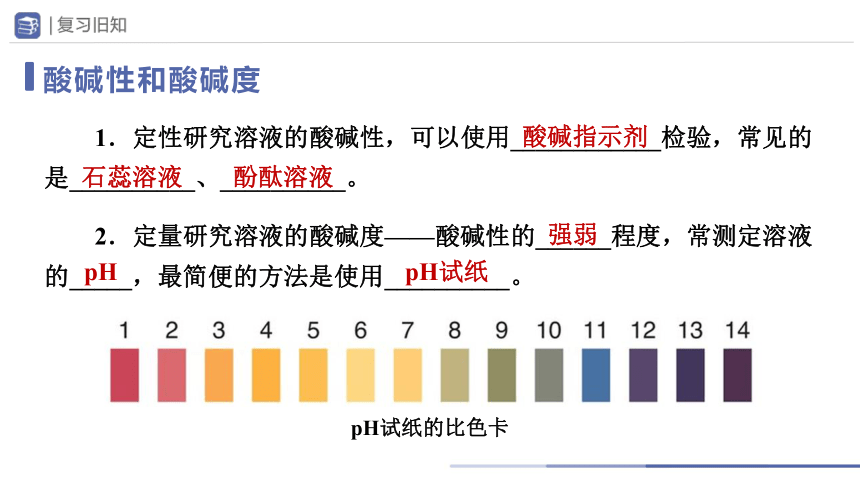
酸碱性和酸碱度
1.定性研究溶液的酸碱性,可以使用____________检验,常见的是__________、__________。
2.定量研究溶液的酸碱度——酸碱性的______程度,常测定溶液的_____,最简便的方法是使用__________。
酸碱指示剂
酚酞溶液
石蕊溶液
强弱
pH试纸
pH
pH试纸的比色卡
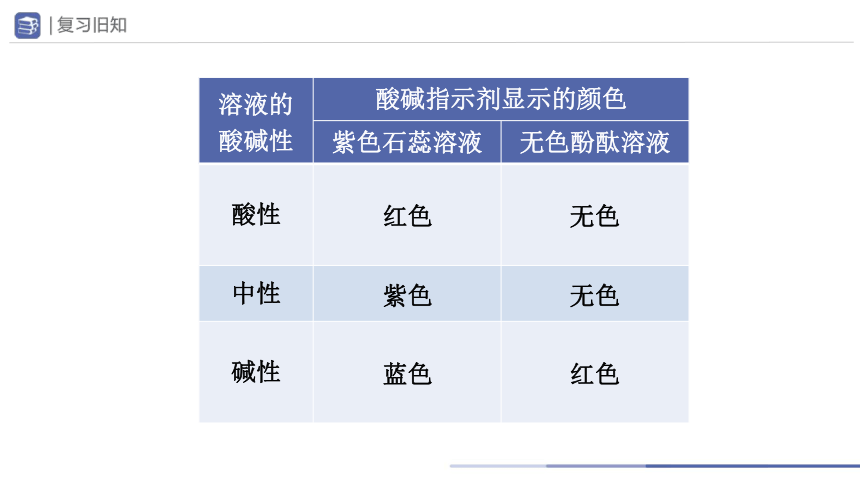
溶液的 酸碱性 酸碱指示剂显示的颜色
紫色石蕊溶液 无色酚酞溶液
酸性
中性
碱性
红色
无色
紫色
无色
蓝色
红色
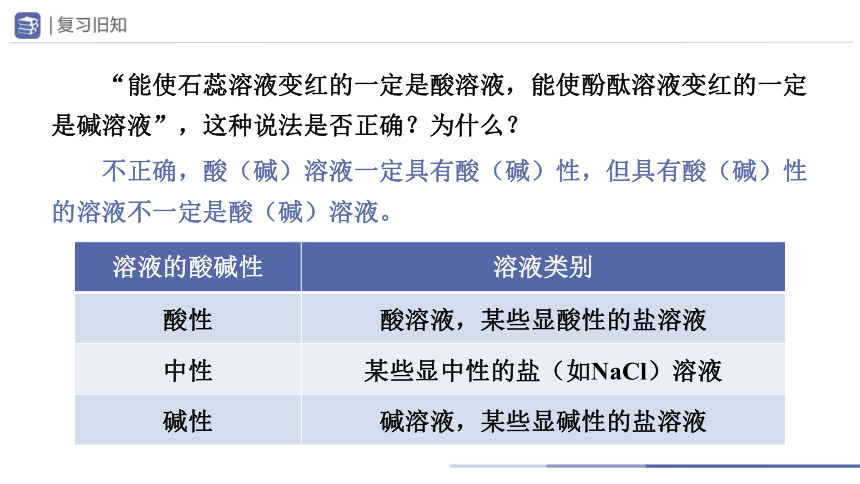
“能使石蕊溶液变红的一定是酸溶液,能使酚酞溶液变红的一定是碱溶液”,这种说法是否正确?为什么?
溶液的酸碱性 溶液类别
酸性 酸溶液,某些显酸性的盐溶液
中性 某些显中性的盐(如NaCl)溶液
碱性 碱溶液,某些显碱性的盐溶液
不正确,酸(碱)溶液一定具有酸(碱)性,但具有酸(碱)性的溶液不一定是酸(碱)溶液。
1.在白瓷板或玻璃片上放一小片______的pH试纸。
2.
3.试纸变色后,把试纸显示的颜色与标准比色卡比较,读取相同或相近颜色的pH即为待测溶液的pH(普通的pH试纸测得的pH只能精确到整数位)。
使用pH试纸的方法
用玻璃棒蘸取待测溶液滴到pH试纸上。
干燥
注意:不能用试纸直接蘸取溶液,否则会导致待测溶液被污染。
误差分析:若pH试纸被水润湿,则测酸性溶液时,pH______;测碱性溶液时,pH______;测中性溶液时,pH______。
偏大
偏小
不变
加入液体的体积/mL
0
7
pH
加入液体的体积/mL
0
7
pH
现有稀盐酸、氢氧化钠溶液、蒸馏水,根据pH的变化图像,判断对应的实验操作是向哪种液体中滴加哪种液体。
向稀盐酸中滴加氢氧化钠溶液
向氢氧化钠溶液中滴加蒸馏水
方法 酸性溶液 碱性溶液
加水稀释
加酸碱性相反 的溶液
加酸碱性相同、pH不同的溶液
pH变大,逐渐接近7,
但不能等于、大于7
pH变小,逐渐接近7,
但不能等于、小于7
pH变大,可能小于、
等于或大于7
pH变小,可能大于、
等于或小于7
pH介于两溶液的pH之间
pH介于两溶液的pH之间
调节溶液pH的方法
1.化工生产领域:许多反应都必须在一定pH的溶液里才能进行。
2.农业生产领域:农作物一般适宜在pH=7或接近7的土壤中生长,调节土壤的pH是改良土壤的方法之一。
3.环境监测领域:正常雨水的pH≈5.6,酸雨的pH<5.6,监测雨水的pH,可以了解空气的污染情况。
4.人体健康领域:健康人的体液必须维持在一定的酸碱度范围内,测定人体内或排出的液体的pH,可以帮助人们了解身体的健康状况。
溶液的酸碱度在实际中的意义
酸、碱、盐
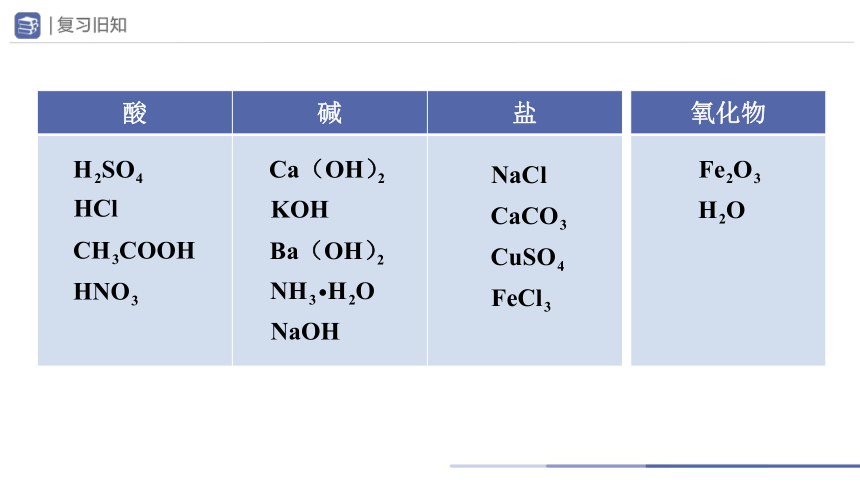
找出下列物质中的酸、碱、盐。
(1)NaCl (2) (3)
(4) (5) (6)HCl
(7) (8) (9)KOH
(10) (11) (12)
(13) (14)NaOH (15)
酸 碱 盐
氧化物
NaCl
HCl
NaOH
KOH
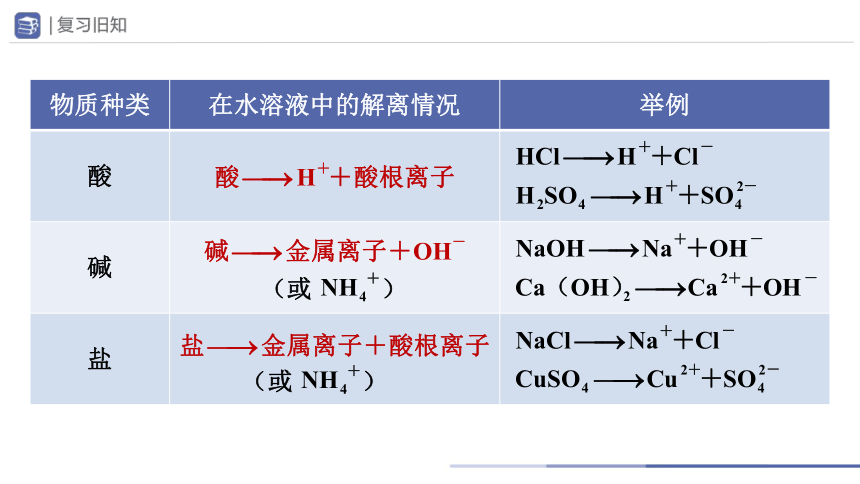
物质种类 在水溶液中的解离情况 举例
酸
碱
盐
(或 )
(或 )
常见的酸
项目 浓盐酸 浓硫酸
化学式
颜色、状态
气味
挥发性
吸水性
HCl H2SO4
无色、液态 无色、黏稠、油状、液态
有刺激性气味 无味
有挥发性 不易挥发
无吸水性 有吸水性
如果不慎将浓硫酸沾到皮肤或衣服上,应立即_____________,然后 涂上3%~5%的_________溶液。
浓硫酸有强烈的腐蚀性
浓硫酸具有强腐蚀性的原因——脱水性:浓硫酸能夺走纸张、木材、布料、皮肤里的水分,生成黑色的炭。
用大量水冲洗
碳酸氢钠
浓硫酸
气体
干燥气体——_____性
使木材、纸张等变黑——_____性
(C6H10O5)n
纤维素
碳
水
C + H2O
吸水
脱水
浓硫酸的吸水性和脱水性
水
浓硫酸的稀释
将_______沿容器壁缓慢地注入_______中,并用玻璃棒__________。
浓硫酸
水
不断搅拌
解释:水的密度比浓硫酸的密度小,水浮在浓硫酸上,浓硫酸溶于水放出大量的热,使水立刻沸腾,造成液滴向四处飞溅。
将水倒入浓硫酸的后果:
硫酸液滴向四周飞溅,容易造成伤人事故。
浓硫酸的稀释
操作 现象与分析
鉴别浓盐酸和浓硫酸
打开瓶盖,观察瓶口是否有白雾形成 瓶口有白雾形成——浓盐酸(挥发性)
瓶口没有白雾形成——浓硫酸
闻气味 刺激性气味——浓盐酸;无味——浓硫酸
敞口放在空气中一段时间,测量质量的变化 溶液质量减小——浓盐酸(挥发性)
溶液质量增大——浓硫酸(吸水性)
分别用玻璃棒蘸取少量液体,滴到白纸上 不能使纸张变黑——浓盐酸
能使纸张变黑——浓硫酸(脱水性)
项目 氢氧化钠 氢氧化钙
化学式
俗称
颜色、状态
溶解性
常见的碱
NaOH
苛性钠、火碱、烧碱 消石灰、熟石灰
白色固体 白色粉末状固体
易溶于水 微溶于水
2.__________曝露在空气中会发生______——吸收水分,表面潮湿并逐渐溶解的现象。
1.氢氧化钠在水中溶解时______热量。
放出
氢氧化钠
3.__________的水溶液俗称石灰水,当石灰水中存在较多未溶解的熟石灰时,称为石灰乳或石灰浆。
潮解
氢氧化钙
4.熟石灰可用生石灰和水制取,化学方程式为:
氢氧化钠有强烈的腐蚀性,如果不慎粘到皮肤上,要立即用大量的____冲洗,再涂上_____溶液。
氢氧化钙对皮肤、衣服等有腐蚀作用,使用时应小心。
氢氧化钠、氢氧化钙的腐蚀性
硼酸
水
物质 曝露在空气中的变化
浓盐酸
浓硫酸
氢氧化钠
氢氧化钙
(挥发性)溶质的质量分数减小
(吸水性)溶质的质量分数减小
浓盐酸、浓硫酸、氢氧化钠、氢氧化钙需要密封保存的原因:
(1)发生潮解;(2)与 反应而变质
与 反应而变质
酸、碱的化学性质
酸的
通性
与多数活泼金属反应:
与某些金属氧化物反应:
与碱发生中和反应:
与酸碱指示剂反应
石蕊溶液:紫色→红色
酚酞溶液:无色→无色
酸具有相似化学性质的原因:
酸溶液中都含有H+。
与酸发生中和反应:
与某些非金属氧化物反应:
碱的
通性
碱具有相似化学性质的原因:
与酸碱指示剂反应
石蕊溶液:紫色→蓝色
酚酞溶液:无色→红色
碱溶液中都含有OH- 。
酸、碱的化学性质
反应物 化学方程式
HCl+Zn
NaOH+HCl
活动性比氢弱的金属与酸不发生反应
中和反应的实质
盐酸与氢氧化钠反应的微观图示
有盐和水生成的反应一定是中和反应吗?
不一定。
实验能力
1.怎样证明NaOH能和HCl发生反应?
(1)利用酸碱指示剂或pH试纸检验NaOH是否消失。
(2)加入少量的稀盐酸,充分反应后再加入锌粒(或氧化铜、
碳酸钠等),若不发生反应,就证明加入的HCl由于和NaOH反应而
被消耗了。
判断没有明显现象的反应是否发生
原有物质是否消失
是否有新物质生成
实验能力
2.怎样证明NaOH能和CO2发生反应?
(1)根据二氧化碳消失导致的压强变化判断。
(2)通入足量CO2后,滴加盐酸,根据是否有气泡产生,检验是否生成了Na2CO3。
水
CO2
NaOH
溶液
CO2
常见酸、碱的应用
干燥氧气、氢气等气体
人体胃液的主要成分
金属表面除锈
改良酸性土壤
检验二氧化碳
干燥二氧化碳气体
建筑材料(砌砖、刷墙)
去除油污(如炉具清洁剂)
配制农药(波尔多液)
盐酸
硫酸
氢氧化钠
氢氧化钙
常见酸、碱的应用
氢氧化钠是重要的化工原料,广泛应用于制取肥皂,以及石油、造纸、纺织和印染等工业。
在树木上涂刷含有硫黄粉等的石灰浆,可以保护树木,防止冻伤,并防止害虫生卵。
盐酸是重要的化工产品,还可用于制造药物(如盐酸麻黄素、氯化锌)等。
硫酸是重要的化工原料,还可用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等。
中和反应在实际中的应用
农业上,改良土壤的酸碱度。如用熟石灰改良酸性土壤。
工业上,处理废水的酸性或碱性。如用熟石灰处理酸性废水,用硫酸处理碱性废水。
医学上,用氢氧化铝等碱性物质治疗胃酸过多,用肥皂水等碱性溶液处理因蚊虫叮咬时分泌的蚁酸而肿成的大包等。
溶液的酸碱性:检验酸碱性——酸碱指示剂;测定酸碱度——pH试纸
酸
盐酸——挥发性;硫酸——吸水性、脱水性、稀释方法
H++酸根离子
能与指示剂、多数活泼金属、某些金属氧化物、碱反应
碱
氢氧化钠——潮解,溶解放热;氢氧化钙——微溶、制取
金属离子+OH-
能与指示剂、某些非金属氧化物、酸反应
盐
金属离子+酸根离子
中和反应
第十单元 酸和碱
有两瓶没有标签的液体,分别是稀盐酸和澄清石灰水,设计实验方案,通过实验鉴别出这两瓶液体分别是什么?
检验酸碱性 酸的通性 碱的通性 其他
石蕊溶液
酚酞溶液
pH试纸
二氧化碳
锌、铁等活泼金属
铁锈等金属氧化物
氢氧化钙
碳酸钙
酸碱性和酸碱度
1.定性研究溶液的酸碱性,可以使用____________检验,常见的是__________、__________。
2.定量研究溶液的酸碱度——酸碱性的______程度,常测定溶液的_____,最简便的方法是使用__________。
酸碱指示剂
酚酞溶液
石蕊溶液
强弱
pH试纸
pH
pH试纸的比色卡
溶液的 酸碱性 酸碱指示剂显示的颜色
紫色石蕊溶液 无色酚酞溶液
酸性
中性
碱性
红色
无色
紫色
无色
蓝色
红色
“能使石蕊溶液变红的一定是酸溶液,能使酚酞溶液变红的一定是碱溶液”,这种说法是否正确?为什么?
溶液的酸碱性 溶液类别
酸性 酸溶液,某些显酸性的盐溶液
中性 某些显中性的盐(如NaCl)溶液
碱性 碱溶液,某些显碱性的盐溶液
不正确,酸(碱)溶液一定具有酸(碱)性,但具有酸(碱)性的溶液不一定是酸(碱)溶液。
1.在白瓷板或玻璃片上放一小片______的pH试纸。
2.
3.试纸变色后,把试纸显示的颜色与标准比色卡比较,读取相同或相近颜色的pH即为待测溶液的pH(普通的pH试纸测得的pH只能精确到整数位)。
使用pH试纸的方法
用玻璃棒蘸取待测溶液滴到pH试纸上。
干燥
注意:不能用试纸直接蘸取溶液,否则会导致待测溶液被污染。
误差分析:若pH试纸被水润湿,则测酸性溶液时,pH______;测碱性溶液时,pH______;测中性溶液时,pH______。
偏大
偏小
不变
加入液体的体积/mL
0
7
pH
加入液体的体积/mL
0
7
pH
现有稀盐酸、氢氧化钠溶液、蒸馏水,根据pH的变化图像,判断对应的实验操作是向哪种液体中滴加哪种液体。
向稀盐酸中滴加氢氧化钠溶液
向氢氧化钠溶液中滴加蒸馏水
方法 酸性溶液 碱性溶液
加水稀释
加酸碱性相反 的溶液
加酸碱性相同、pH不同的溶液
pH变大,逐渐接近7,
但不能等于、大于7
pH变小,逐渐接近7,
但不能等于、小于7
pH变大,可能小于、
等于或大于7
pH变小,可能大于、
等于或小于7
pH介于两溶液的pH之间
pH介于两溶液的pH之间
调节溶液pH的方法
1.化工生产领域:许多反应都必须在一定pH的溶液里才能进行。
2.农业生产领域:农作物一般适宜在pH=7或接近7的土壤中生长,调节土壤的pH是改良土壤的方法之一。
3.环境监测领域:正常雨水的pH≈5.6,酸雨的pH<5.6,监测雨水的pH,可以了解空气的污染情况。
4.人体健康领域:健康人的体液必须维持在一定的酸碱度范围内,测定人体内或排出的液体的pH,可以帮助人们了解身体的健康状况。
溶液的酸碱度在实际中的意义
酸、碱、盐
找出下列物质中的酸、碱、盐。
(1)NaCl (2) (3)
(4) (5) (6)HCl
(7) (8) (9)KOH
(10) (11) (12)
(13) (14)NaOH (15)
酸 碱 盐
氧化物
NaCl
HCl
NaOH
KOH
物质种类 在水溶液中的解离情况 举例
酸
碱
盐
(或 )
(或 )
常见的酸
项目 浓盐酸 浓硫酸
化学式
颜色、状态
气味
挥发性
吸水性
HCl H2SO4
无色、液态 无色、黏稠、油状、液态
有刺激性气味 无味
有挥发性 不易挥发
无吸水性 有吸水性
如果不慎将浓硫酸沾到皮肤或衣服上,应立即_____________,然后 涂上3%~5%的_________溶液。
浓硫酸有强烈的腐蚀性
浓硫酸具有强腐蚀性的原因——脱水性:浓硫酸能夺走纸张、木材、布料、皮肤里的水分,生成黑色的炭。
用大量水冲洗
碳酸氢钠
浓硫酸
气体
干燥气体——_____性
使木材、纸张等变黑——_____性
(C6H10O5)n
纤维素
碳
水
C + H2O
吸水
脱水
浓硫酸的吸水性和脱水性
水
浓硫酸的稀释
将_______沿容器壁缓慢地注入_______中,并用玻璃棒__________。
浓硫酸
水
不断搅拌
解释:水的密度比浓硫酸的密度小,水浮在浓硫酸上,浓硫酸溶于水放出大量的热,使水立刻沸腾,造成液滴向四处飞溅。
将水倒入浓硫酸的后果:
硫酸液滴向四周飞溅,容易造成伤人事故。
浓硫酸的稀释
操作 现象与分析
鉴别浓盐酸和浓硫酸
打开瓶盖,观察瓶口是否有白雾形成 瓶口有白雾形成——浓盐酸(挥发性)
瓶口没有白雾形成——浓硫酸
闻气味 刺激性气味——浓盐酸;无味——浓硫酸
敞口放在空气中一段时间,测量质量的变化 溶液质量减小——浓盐酸(挥发性)
溶液质量增大——浓硫酸(吸水性)
分别用玻璃棒蘸取少量液体,滴到白纸上 不能使纸张变黑——浓盐酸
能使纸张变黑——浓硫酸(脱水性)
项目 氢氧化钠 氢氧化钙
化学式
俗称
颜色、状态
溶解性
常见的碱
NaOH
苛性钠、火碱、烧碱 消石灰、熟石灰
白色固体 白色粉末状固体
易溶于水 微溶于水
2.__________曝露在空气中会发生______——吸收水分,表面潮湿并逐渐溶解的现象。
1.氢氧化钠在水中溶解时______热量。
放出
氢氧化钠
3.__________的水溶液俗称石灰水,当石灰水中存在较多未溶解的熟石灰时,称为石灰乳或石灰浆。
潮解
氢氧化钙
4.熟石灰可用生石灰和水制取,化学方程式为:
氢氧化钠有强烈的腐蚀性,如果不慎粘到皮肤上,要立即用大量的____冲洗,再涂上_____溶液。
氢氧化钙对皮肤、衣服等有腐蚀作用,使用时应小心。
氢氧化钠、氢氧化钙的腐蚀性
硼酸
水
物质 曝露在空气中的变化
浓盐酸
浓硫酸
氢氧化钠
氢氧化钙
(挥发性)溶质的质量分数减小
(吸水性)溶质的质量分数减小
浓盐酸、浓硫酸、氢氧化钠、氢氧化钙需要密封保存的原因:
(1)发生潮解;(2)与 反应而变质
与 反应而变质
酸、碱的化学性质
酸的
通性
与多数活泼金属反应:
与某些金属氧化物反应:
与碱发生中和反应:
与酸碱指示剂反应
石蕊溶液:紫色→红色
酚酞溶液:无色→无色
酸具有相似化学性质的原因:
酸溶液中都含有H+。
与酸发生中和反应:
与某些非金属氧化物反应:
碱的
通性
碱具有相似化学性质的原因:
与酸碱指示剂反应
石蕊溶液:紫色→蓝色
酚酞溶液:无色→红色
碱溶液中都含有OH- 。
酸、碱的化学性质
反应物 化学方程式
HCl+Zn
NaOH+HCl
活动性比氢弱的金属与酸不发生反应
中和反应的实质
盐酸与氢氧化钠反应的微观图示
有盐和水生成的反应一定是中和反应吗?
不一定。
实验能力
1.怎样证明NaOH能和HCl发生反应?
(1)利用酸碱指示剂或pH试纸检验NaOH是否消失。
(2)加入少量的稀盐酸,充分反应后再加入锌粒(或氧化铜、
碳酸钠等),若不发生反应,就证明加入的HCl由于和NaOH反应而
被消耗了。
判断没有明显现象的反应是否发生
原有物质是否消失
是否有新物质生成
实验能力
2.怎样证明NaOH能和CO2发生反应?
(1)根据二氧化碳消失导致的压强变化判断。
(2)通入足量CO2后,滴加盐酸,根据是否有气泡产生,检验是否生成了Na2CO3。
水
CO2
NaOH
溶液
CO2
常见酸、碱的应用
干燥氧气、氢气等气体
人体胃液的主要成分
金属表面除锈
改良酸性土壤
检验二氧化碳
干燥二氧化碳气体
建筑材料(砌砖、刷墙)
去除油污(如炉具清洁剂)
配制农药(波尔多液)
盐酸
硫酸
氢氧化钠
氢氧化钙
常见酸、碱的应用
氢氧化钠是重要的化工原料,广泛应用于制取肥皂,以及石油、造纸、纺织和印染等工业。
在树木上涂刷含有硫黄粉等的石灰浆,可以保护树木,防止冻伤,并防止害虫生卵。
盐酸是重要的化工产品,还可用于制造药物(如盐酸麻黄素、氯化锌)等。
硫酸是重要的化工原料,还可用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等。
中和反应在实际中的应用
农业上,改良土壤的酸碱度。如用熟石灰改良酸性土壤。
工业上,处理废水的酸性或碱性。如用熟石灰处理酸性废水,用硫酸处理碱性废水。
医学上,用氢氧化铝等碱性物质治疗胃酸过多,用肥皂水等碱性溶液处理因蚊虫叮咬时分泌的蚁酸而肿成的大包等。
溶液的酸碱性:检验酸碱性——酸碱指示剂;测定酸碱度——pH试纸
酸
盐酸——挥发性;硫酸——吸水性、脱水性、稀释方法
H++酸根离子
能与指示剂、多数活泼金属、某些金属氧化物、碱反应
碱
氢氧化钠——潮解,溶解放热;氢氧化钙——微溶、制取
金属离子+OH-
能与指示剂、某些非金属氧化物、酸反应
盐
金属离子+酸根离子
中和反应
同课章节目录
