2024届高三化学一轮专题训练—电解质溶液(含解析)
文档属性
| 名称 | 2024届高三化学一轮专题训练—电解质溶液(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 828.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 14:18:00 | ||
图片预览




文档简介
2024届高三化学一轮专题训练—电解质溶液
一、单选题
1.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.滴入酚酞变红色的溶液:K+、Ca2+、HCO、CO
B.0.1 mol·L-1 Fe2(SO4)3溶液:Cu2+、NH、NO、SO
C.pH=1的溶液:Ba2+、K+、CH3COO-、NO
D.无色透明的溶液:Cu2+、Na+、SO、NO
2.化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的基础自然科学,下列说法正确的是( )
A.金属氧化物都是碱性氧化物,非金属氧化物都是酸性氧化物
B.溶液与胶体的本质区别是是否存在丁达尔效应
C.光导纤维的主要成分为硅单质
D.氨水和氨气都不是电解质
3.下列水溶液呈碱性的盐是( )
A.CaCl2 B.Na2SO3 C.Ba(OH)2 D.HNO3
4.《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”记载。有关说法错误的是( )
A.薪柴之灰可做钾肥
B.取碱浇衣存在水解反应
C.碱浣衣与肥皂浣衣原理不同
D.上述过程涉及溶解、过滤、蒸馏操作
5.室温下,用相同浓度的溶液,分别滴定浓度均为的三种酸、和溶液,滴定曲线如图所示。下列判断错误的是 ( )
A.三种酸的电离常数关系:
B.点时,溶液中:
C.时,三种溶液中:
D.当中和达时,溶液中:
6.室温下进行下列实验,根据实验操作和现象,所得到的结论正确的是( )
选项 实验操作和现象 结论
A 乙醇钠的水溶液呈强碱性 结合 的能力强
B 将某溶液滴在 淀粉试纸上,试纸变蓝 原溶液中一定含有
C 向 和 的混合溶液中滴入硝酸酸化的 溶液,溶液变红 氧化性:
D 向盛有 一定浓度的 溶液的试管中,滴入5滴 的 溶液,产生黄色沉淀 发生了水解
A.A B.B C.C D.D
7.下列属于弱电解质的是( )
A.硫酸钡 B.二氧化硫 C.乙醇 D.乙酸
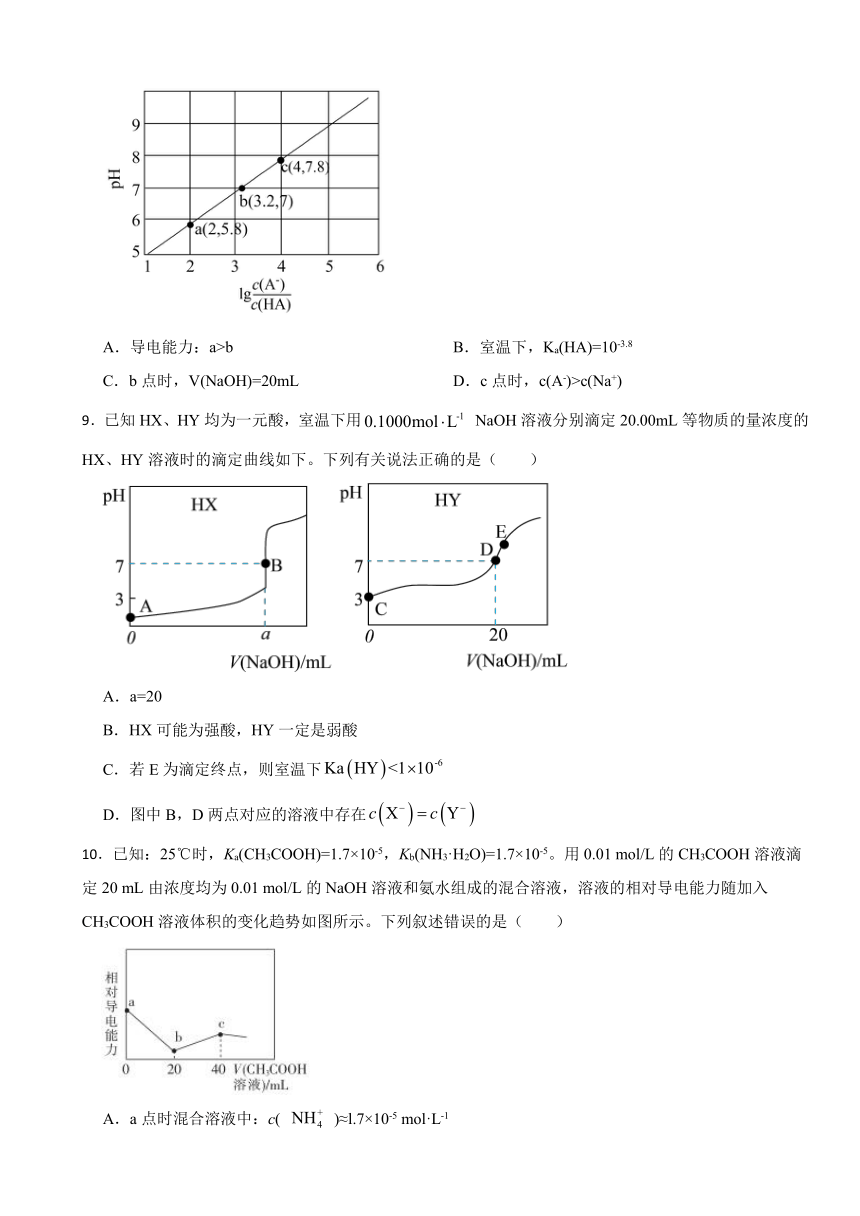
8.室温下,用0.1mol·L-1的NaOH溶液滴定20mL0.1mol·L-1HA溶液,测得混合溶液的pH与的关系如图所示。下列说法正确的是
A.导电能力:a>b B.室温下,Ka(HA)=10-3.8
C.b点时,V(NaOH)=20mL D.c点时,c(A-)>c(Na+)
9.已知HX、HY均为一元酸,室温下用 NaOH溶液分别滴定20.00mL等物质的量浓度的HX、HY溶液时的滴定曲线如下。下列有关说法正确的是( )
A.a=20
B.HX可能为强酸,HY一定是弱酸
C.若E为滴定终点,则室温下
D.图中B,D两点对应的溶液中存在
10.已知:25℃时,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。用0.01 mol/L的CH3COOH溶液滴定20 mL由浓度均为0.01 mol/L的NaOH溶液和氨水组成的混合溶液,溶液的相对导电能力随加入CH3COOH溶液体积的变化趋势如图所示。下列叙述错误的是( )
A.a点时混合溶液中:c( )≈l.7×10-5 mol·L-1
B.b点时混合溶液中:c(CH3COOH)<c( )
C.c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c( )+c(NH3·H2O)+c(Na+)
D.c点时混合溶液中:pH=7
11.下列物质熔融状态时不导电的是( )
A.MgF2 B.KCl C.H2SO4 D.NaOH
12.某试液中只可能含有K+、NH 、Fe2+、Al3+、Cl-、SO 、CO 、AlO 中的若干种离子,离子浓度均为0.1mol·L 1,某同学进行了如下实验,下列说法正确的是( )
A.无法确定原试液中是否含有Al3+、Cl-
B.原溶液中存在NH 、Fe2+、Cl-、SO
C.无法确定沉淀C的成分
D.滤液X中大量存在的阳离子有NH 、Fe2+和Ba2+
13.常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列有关说法错误的是
A.曲线M表示pH与lg的变化关系
B.NaHY溶液显酸性
C.交点d对应的pH=2.8
D.e点溶液中:c(HY-)>c(H2Y)>c(Y2-)>c(H+)>c(OH-)
14.下列说法正确的是( )
A.25℃时,测得0.1的XCl溶液pH<7,则XOH为强碱
B.同体积浓度分别为1、0.1的醋酸,含的物质的量分别为a mol、b mol,则a>10b
C.同体积同pH的盐酸与醋酸,与足量锌反应,若后者生成氢气多,则说明醋酸为弱酸
D.同物质的量浓度的盐酸与醋酸分别中和同体积同浓度的NaOH溶液,醋酸消耗的体积多
15.湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl)=]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是( )
A.AgCl溶解度随c(Cl-)增大而不断减小
B.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol L-1
C.当c(Cl-)=10-2mol L-1时,溶液中c(AgCl)>c(Ag+)>c(AgCl)
D.25℃时,AgCl+Cl-AgCl的平衡常数K=100.2
16.下列所示的实验方案正确,且能达到实验目的的是( )
选项 实验目的 实验方案
A 比较镁、铝的金属性强弱 分别在MgCl2和AlCl3溶液中滴加氨水直至过量,观察现象
B 比较Cl2、Br2的氧化性强弱 将少量氯水滴入FeBr2溶液中,观察现象
C 证明SO2具有漂白性 将SO2通入酸性高锰酸钾溶液中,溶液褪色
D 证明电离常数Ka:HSO3->HCO3- 测得同浓度的Na2CO3溶液的pH大于Na2SO3溶液
A.A B.B C.C D.D
二、综合题
17.以银锰精矿主要含、、和氧化锰矿主要含为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下,的氧化性强于。
(1)“浸锰”过程是在溶液中使矿石中的锰元素浸出,同时去除,有利于后续银的浸出;矿石中的银以的形式残留于浸锰渣中。
“浸锰”过程中,发生反应,则可推断: 填“”或“”。
在溶液中,银锰精矿中的和氧化锰矿中的发生反应,则浸锰液中主要的金属阳离子有 。
(2)“浸银”时,使用过量和的混合液作为浸出剂,将中的银以形式浸出。
将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中的作用: 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
该步反应的离子方程式有 。
一定温度下,的沉淀率随反应时间的变化如图所示。解释分钟后的沉淀率逐渐减小的原因: 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势: 。
18.三氧化二钴(Co2O3)常用于颜料、釉料及磁性材料。工业上以钴矿石(主要成分是CoO(OH)、CoCO3、CoO、Co2O3,及少量SiO2、Al2O3、Fe2O3、MnO2等)为原料制备Co2O3的工艺流程如图所示。
(1)“浸泡”过程中,为加快反应速率和提高矿石原料利用率,下列方法不可取的是____。
A.将钴矿石粉碎,搅拌 B.适当升高温度
C.适当降低溶液的pH D.使用过量的NaHSO3溶液
(2)“浸泡”时CoO(OH)参与反应的离子方程式为 。
(3)“除杂”时加入试剂①的作用是 ;若溶液中c(Co2+)=0.1mol/L,根据表中数据计算,加入试剂②调节pH范围是6~ (忽略过程中溶液体积变化)。
沉淀 Al(OH)3 Fe(OH)3 Co(OH)2 Fe(OH)2 Mn(OH)2
沉淀完全的pH 5.2 3.2 9.4 9.5 10.1
(4)“萃取”时发生反应:Co2++n(HA)2CoA2·(n-1)(HA)2+2H+,则试剂③为 。设计萃取、反萃取的目的是 。
(5)“沉钴”时的离子方程式为 ,证明Co2+已沉淀完全的实验操作和现象为 。
19.从铜电解液(主要含、Ni2+、、、、Zn2+等)中提纯得到粗硫酸镍晶体,为了进一步纯化并回收胆矾晶体,某课题小组设计了如图流程:
已知:相关离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如下:
金属离子 Cu2+ Fe2+ Fe3+ Ca2+ Zn2+ Ni2+
开始沉淀的pH 4.2 6.3 1.5 11.8 6.2 6.9
沉淀完全的uH 6.7 8.3 2.8 13.8 8.2 8.9
(1)为加快“水浸”时的浸出率,可采取的措施有 (任写一点)。
(2)为了使“溶液1”中的反应充分进行,需要通入稍过量的H2S,写出Fe3+与H2S发生反应的离子方程式: 。
(3)请结合离子方程式解释向“溶液2”中加入Ni(OH)2的原因 。
(4)“操作X”为在 (填仪器名称)中加热至 ,冷却结晶、过滤、洗涤、干燥后得到结晶水合物晶体。
(5)若“溶液3”中Ca2+的浓度为0.001mol/L,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5mol/L,则所加NiF2溶液的浓度至少为 mol/L。[已知室温下Ksp(CaF2)=4×10-11]
(6)室温下选择萃取剂P204(二乙基已基磷酸,用HR表示),其萃取原理为nHR+Mn+ MRn+nH+,试剂a为 (填化学式)。溶液pH对几种离子的萃取率的影响如图,则萃取锌时,应控制pH的范围为3~4,请解释原因: 。
20.已知酸HA和HB的电离平衡常数为、,则:
(1)反应的化学平衡常数为 。
(2)常温下的NaB溶液中 。
21.无机物及有机物在工农业生产和人类生活中都有着重要的应用。
(1)比较离子半径大小:Li+ H-(选填“>"、“<”或“=”)。
(2)LiAlH4中电负性最大的元素是 ,它与水反应生成的单质气体为 。
(3)LiCl溶液显酸性,用离子方程式说明原因 。
(4)泡沫灭火器的灭火原理: (用离子方程式说明)。
(5)如图所示,已知B可用作燃料,则A的官能团名称为 ;A生成B的有机反应类型为 。
答案解析部分
1.【答案】B
【解析】【解答】A.滴入酚酞变红的溶液为碱性溶液,碳酸氢根不能存在,碳酸根和钙离子也不能共存,A不符合题意;
B.所给离子相互之间均不反应,可以共存,B符合题意;
C.酸性溶液中醋酸根不能存在,C不符合题意;
D.铜离子为蓝色,无色溶液中不能存在,D不符合题意;
故答案为:B。
【分析】K+、Na+、NH4+和所有酸根离子共存,NO3-和所有阳离子共存,
CO32-只能和Na+、K+、NH4+共存,
OH-只能和Na+、K+、Ba2+共存,SO42-不能和Ag+、Ca2+、Pb2+、Ba2+共存,
Cl-不能和Ag+共存
H+只能和Cl-、Br-、I-、NO3-、SO42-、ClO4-共存。
2.【答案】D
【解析】【解答】A.金属氧化物中为酸性氧化物,为两性氧化物;非金属氧化物中等都不是酸性氧化物,A项不符合题意;
B.溶液与胶体的本质区别是分散质粒子直径不同,溶液中分散质粒子直径小于1nm,胶体中分散质粒子直径为1~100nm,B项不符合题意;
C.光导纤维的主要成分是SiO2,C项不符合题意;
D.电解质是在水溶液或熔融状态下,本身能够电离出离子导电的化合物,氨水是混合物,氨气本身无法电离产生离子,故二者都不是电解质,D项符合题意;
故答案为:D。
【分析】A.有的金属氧化物是酸性氧化物,如;
B.溶液与胶体的本质区别是分散质粒子直径不同;
C.光导纤维的主要成分是二氧化硅。
3.【答案】B
【解析】【解答】A.CaCl2是强酸强碱盐,其溶液显中性,A不符合题意;
B.Na2SO3是强碱弱酸盐,其溶液显碱性,B符合题意;
C.Ba(OH)2属于碱,不符合题意,C不符合题意;
D.HNO3,属于酸,不符合题意,D不符合题意;
故答案为:B。
【分析】强酸弱碱盐呈酸性,强碱弱酸盐呈碱性,强酸强碱盐呈中性。
4.【答案】D
【解析】【解答】A.薪柴之灰的主要成分是碳酸钾,碳酸钾可做钾肥,故A不符合题意;
B.薪柴之灰的主要成分是碳酸钾,碳酸钾在溶液中水解使溶液呈碱性,碱性溶液能使油污水解达到洗衣的目的,则取碱浣衣存在水解反应,故B不符合题意;
C.碱浣衣是利用了碳酸钾在溶液中水解使溶液呈碱性,碱性溶液能使油污水解达到洗衣的目的,而肥皂浣衣的原理是在洗涤的过程中,污垢中的油脂跟肥皂接触后,高级脂肪酸钠分子的烃基就插入油滴内,而易溶于水的羧基部分伸在油滴外面,插入水中。这样油滴就被肥皂分子包围起来,再经磨擦、振动,大的油滴就分散成小的油珠,最后脱离纤维织品,达到洗涤的目的,两者浣衣原理不同,故C不符合题意;
D.由题意可知,上述过程涉及溶解、过滤操作,不涉及蒸馏操作,故D符合题意;
故答案为:D。
【分析】A.薪柴之灰为碳酸钾,含钾元素;
B.碳酸钾是弱酸强碱盐,水溶液呈碱性,可用于去油污;
C.碳酸钾溶液呈碱性,促进油脂水解生成可溶性盐,肥皂是利用乳化作用进行去污除油;
D.该过程不涉及蒸馏。
5.【答案】C
【解析】【解答】A.相同物质的量浓度的一元酸的pH越小,氢离子浓度越大,说明酸的电离程度越大,该酸的酸性越强,其电离平衡常数越大,根据图知,未加NaOH溶液时,pH:HA<HB<HD,说明酸的电离程度HA>HB>HD,则KHA>KHB>KHD,故A不符合题意;
B.P点时HB被中和50%,溶液中溶质为等物质的量浓度的酸(HB)和盐(NaB),由图可知溶液呈酸性,则c(H+)>c(OH-),说明HB的电离程度大于B-的水解程度,则c(B-)>c(HB),结合物料守恒2c(Na+)=c(B-)+c(HB)可知:c(B-)>c(Na+)>c(HB),溶液中离子浓度大小为:,故B不符合题意;
C.pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒可知,HA溶液中c(Na+)=c(A-),HB溶液中c(Na+)=c(B-),HD溶液中c(Na+)=c(D-),由于HA,HB,HD的酸性并不一致,则使溶液呈中性时,三种溶液中c(Na+)并不相等,则c(A-)、c(B-)、c(D-)并不相等,故C符合题意;
D.当中和达时,溶液中存在的是NaA,由可得:,即,化简得:,刚好是NaA溶液的物料守恒等式,故D不符合题意。
故答案为:C。
【分析】A.初始点的pH值AB>D;
B.P点时中和50%,溶液显酸性,B的电离大于水解,故B->HB,H+>OH-,而2Na=B-+HB,故c(B-)>c(Na+)>c(HB);
C.ABD的酸酸性不一样,所以消耗的氢氧化钠的量不同,生成的离子也不同;
D.根据物料守恒计算。
6.【答案】A
【解析】【解答】A. 溶液中电离出的 水解生成 与 使溶液呈强碱性,则 ,所以 结合 的能力强,故A符合题意;
B.能氧化碘离子的不止氯气,其他强氧化剂如溴单质,氧气以及双氧水等都能将碘离子氧化成碘单质,从而使淀粉试纸变蓝,故B不符合题意;
C.滴加硝酸酸化的硝酸银溶液中含有硝酸,硝酸能将亚铁离子氧化成铁离子,从而使 溶液变红,所以不能得出氧化性: ,故C不符合题意;
D.向盛有 一定浓度的 溶液的试管中,滴入5滴 的 溶液,产生黄色沉淀,黄色沉淀的成分为AgI,说明 溶液含有 ,即 发生电离,而不是水解,故D不符合题意;
故答案为:A。
【分析】 A.乙醇钠的水溶液中水解显碱性;
B.溶液可能为碘或溴水;
C.硝酸可氧化亚铁离子,生成铁离子遇KSCN溶液变红;
D.滴入5滴2mol/L的KI溶液,产生黄色沉淀为AgI。
7.【答案】D
【解析】【解答】A.硫酸钡在熔融状态下能完全电离,属于强电解质,A不符合题意;
B.SO2属于非电解质,B不符合题意;
C.乙醇属于非电解质,C不符合题意;
D.乙酸在水溶液中部分电离,属于弱电解质,D符合题意;
故答案为:D。
【分析】弱电解质在水溶液或熔融状态下部分电离,注意常见的弱电解质包括弱酸、弱碱、水。
8.【答案】B
【解析】【解答】A.由电荷守恒得:,随NaOH的加入,和增大,则溶液中总离子浓度增大,溶液导电能力增大,导电能力:aB.=2时,pH=5.8,此时=100,=, Ka(HA)= ×100=10-3.8,故B符合题意;
C.HA为弱酸,当V(NaOH)=20mL时,恰好与HA完全反应生成NaA,此时溶液因水解显碱性,而b点溶液显中性,则V(NaOH)<20mL,故C不符合题意;
D.电荷守恒得:,c点溶液显碱性,则,,故D不符合题意;
故答案为:B。
【分析】A.依据电荷守恒和导电性与溶液中自由移动离子的浓度有关分析;
B.选择a点,利用 Ka(HA)= 计算;
C.依据中和产物的类型分析;
D.依据电荷守恒分析。
9.【答案】B
【解析】【解答】A.由图像可知浓度均为0.1000mol·L-1的两种一元酸,HY的pH=3,部分电离,为弱酸;HX的pH=1溶液,全部电离,为强酸;HX溶液用NaOH溶液滴定呈中性时消耗20mLNaOH,则同样滴定到中性的HY溶液消耗的NaOH溶液大于20mL,a﹥20,故A不符合题意;
B.由图可知,HY一定是弱酸,HX酸性比HY强,,所以B、D两点对应溶液的总体积不相等,和也不可能相等,故B符合题意;
C.由图像可知浓度均为0.1000mol·L-1的两种一元酸,HY的pH=3,则室温下﹥10-6,故C不符合题意;
D.由图可知,HY一定是弱酸,HX酸性比HY强,,所以B、D两点对应溶液的总体积不相等,和也不可能相等,故D不符合题意;
故答案为:B。
【分析】对于滴定图像问题要注意:1.注意图像起点、终点、滴定终点和反应终点,2.关注图像变化斜率,3.充分利用电荷守恒、质量守恒、质子守恒。
10.【答案】D
【解析】【解答】A.a点时溶液为0.01 mol/L的NaOH、NH3·H2O得到的混合溶液,NaOH是强碱,完全电离,NH3·H2O是弱碱,部分电离。由NH3·H2O的电离平衡常数Kb= 可得c( )= ,A不符合题意;
B.b点时NaOH恰好被中和,溶液为CH3COONa、NH3·H2O的混合溶液,由于醋酸是一元弱酸,NH3·H2O、CH3COOH电离平衡常数相同。CH3COONa会水解产生CH3COOH,CH3COO-的水解平衡常数Kh= <1.7×10-5=Kb,故CH3COO-的水解程度小于NH3·H2O的电离程度,因此该混合溶液中微粒浓度:c(CH3COOH)<c( ),B不符合题意;
C.c点溶液为等浓度的CH3COONa、CH3COONH4的混合溶液,根据物料守恒可得:c(CH3COO- )+c(CH3COOH)=c( )+c(NH3·H2O)+c(Na+),C不符合题意;
D.c点溶液的溶质为等浓度的醋酸钠和醋酸铵,在醋酸铵溶液中,铵根离子和醋酸根离子的水解程度相近,溶液呈中性,醋酸钠属于强碱弱酸盐,水解使溶液显碱性,可知等浓度的醋酸钠和醋酸铵混合溶液的pH>7,D符合题意;
故答案为:D。
【分析】A.根据氨水的电离常数计算公式计算即可
B.b点是恰好将氢氧化钠反应完。计算出醋酸根离子的水解平衡常数即可判断
C.c点是将氨水全部反应完全的点,根据物料守恒写出即可
D.根据各离子的水解常数即可判断即可
11.【答案】C
【解析】【解答】A.MgF2是离子晶体,熔融状态时电离出自由移动的离子,能导电,则A不符合题意;
B.KCl是离子晶体,熔融状态时电离出自由移动的离子,能导电,则B不符合题意;
C.H2SO4为分子晶体,熔融状态时不能电离出自由移动的离子,不能导电,则C符合题意;
D.NaOH是离子晶体,熔融状态时电离出自由移动的离子,能导电,则D不符合题意;
故答案为:C。
【分析】电解质熔融下导电说明是离子晶体
12.【答案】B
【解析】【解答】A.根据分析原试液中一定不含有Al3+,一定含Cl-,故A不符合题意;
B.根据分析原溶液中存在SO42 、Cl-、Fe2+、NH4+,故B符合题意;
C.根据分析溶液中不含有Al3+,因此沉淀C为碳酸钡沉淀,故C不符合题意;
D.滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Ba2+,故D不符合题意;
故答案为B。
【分析】加入过量稀硫酸后,无明显现象产生,说明原溶液中不含有CO32-、AlO2-。再加入过量Ba(NO3)2溶液,产生气体和沉淀A,则原溶液中一定含有Fe2+、SO42-。滤液X中加入过量的NaOH溶液,产生气体和沉淀B,则气体为NH3,沉淀B为Fe(OH)3,说明原溶液中含有NH4+。由于溶液中各个离子的浓度都是0.1mol·L-1,因此溶液中一定含有Cl-,一定不含有K+和Al3+。据此结合选项分析。
13.【答案】D
【解析】【解答】A.随着KOH溶液滴加,c(HY-)增大,c(H2Y)减小,继续滴加,c(HY-)减小,c(Y2-)增大,所以lg增大,用曲线N表示,lg减小,用曲线M表示,A不符合题意;
B.通过图中c点可得Ka1=10-1.3,e点可得Ka2=10-4.3,Kh2==10-12.7,Ka2>Kh2,NaHY的电离程度大于其水解程度,所以溶液显酸性,B不符合题意;
C.交点d时c(H2Y)=c(Y2-),Ka1·Ka2==10-5.6,则对应的pH=2.8,C不符合题意;
D.e点溶液中:lg>lg,c(H2Y)故答案为:D。
【分析】 二元弱酸H2Y溶液中滴加KOH溶液,反应为H2Y+KOH=KHY+H2O、KHY+KOH=K2Y+H2O,随 着 KOH 溶 液 滴 加,c(HY- )增 大,c(H2Y)减小,继续滴加,c(HY- )减小,c(Y2- )增大,则曲线M表示pH与lg的变化关系,曲线N表示pH与lg的变化关系。
14.【答案】C
【解析】【解答】A.若XOH为强碱,则XCl为强酸强碱盐,呈中性,25℃时其溶液pH=7,则A不符合题意;
B.醋酸为弱酸,在溶液中不完全电离,根据越稀越电离,0.1的醋酸电离程度大于1的醋酸,所以a<10b,故B不符合题意;
C.同体积同pH的盐酸与醋酸,与足量锌反应,若后者生成氢气多,则说明醋酸浓度大,说明醋酸不完全电离,为弱酸,故C符合题意;
D.同物质的量浓度的盐酸与醋酸分别中和同体积同浓度的NaOH溶液,因醋酸和盐酸的物质的量相同,且两者与NaOH 1:1反应,即消耗的NaOH溶液的体积相同,故D不符合题意;
故答案为:C。
【分析】A.根据强碱弱酸盐显碱性
B.越稀越电离即可判断
C.弱酸部分电离,相同pH的酸,弱酸浓度大
D.氢离子相等,消耗的碱相同
15.【答案】A
【解析】【解答】A.由图可知开始的时候氯化银的溶解度随着c(Cl-)增大而不断减小,但是当氯离子浓度增大的一定程度的时候,随着c(Cl-)增大溶液中的银离子和氯离子形成络离子,而溶解度增大,A符合题意;
B.沉淀最彻底时即银离子以氯化银的形式存在,而且氯化银最多的时候,就是沉淀最彻底时,由图可知此时c(Cl-)=10-2.54,由lg[Ksp(AgCl)]=-9.75可知,Ksp(AgCl)= 10-9.75,则此时c(Ag+)=10-7.21mol L-1,B不符合题意;
C.当c(Cl-)=10-2mol L-1时,图中横坐标为-2,由图可知,此时c(AgCl
)>c(Ag+)>c(AgCl
),C不符合题意;
D.AgCl
+Cl-AgCl
的平衡常数
,则在图中横坐标为-0.2时AgCl
与AgCl
相交,即其浓度相等,则在常数中其比值为1,此时常数K=
=100.2,D不符合题意;
故答案为:A。
【分析】A.结合图示即可判断,氯化银溶解度先减小后增大
B.结合图示,沉淀最彻底时,找出数据结合Ksp计算出银离子浓度
C.根据图示找出 当c(Cl-)=10-2mol L-1时 的浓度即可
D.找出反应时的数据即可计算出常数
16.【答案】D
【解析】【解答】A.分别在MgCl2和AlCl3溶液中滴加氨水直至过量,均生成白色沉淀,无法比较镁、铝的金属性强弱,故A不符合题意;
B.Fe2+的还原性大于Br-,将少量氯水滴入FeBr2溶液中,首先氧化Fe2+,则无法比较Cl2、Br2的氧化性强弱,故B不符合题意;
C.将SO2通入酸性高锰酸钾溶液中,溶液褪色,体现SO2的还原性,不是漂白性,故C不符合题意;
D.测得同浓度的Na2CO3溶液的pH大于Na2SO3溶液,说明CO32-的水解能力大于SO32-,则电离能力HSO3->HCO3-,即电离常数Ka:HSO3->HCO3-,故D符合题意;
故答案为D。
【分析】根据同浓度的碳酸钠溶液与亚硫酸钠溶液的pH值大小来判断CO32-与SO32-水解能力的大小,由此可以得出HSO3->HCO3-的电离能力,据此分析解答即可。
17.【答案】(1);、
(2);Cl-可以结合Ag+形成[AgCl2]-,使平衡朝正向移动,H+可以抑制Fe3+水解
(3)、;被氧气氧化为,把氧化为
(4)可将两种矿石中的锰元素同时提取到浸锰液中,得到,同时将银元素和锰元素分离开;生成的还可以用于浸银,节约氧化剂
【解析】【解答】(1)①Ag2S、MnS都可以在酸性条件下反应生成H2S,而MnS优先反应,则其溶度积更大,故答案为:>;
②FeS2中Fe为+2价,MnO2中Mn为+4价,结合已知条件“酸性条件下,MnO2的氧化性强于Fe3+”,可知MnO2可以和FeS2发生氧化还原反应生成Mn2+和Fe3+,故答案为:、;
(2)①S化合价由-2变为0,化合价升高,则Fe3+化合价降低,生成Fe2+,结合题干可知反应物含有Cl-,根据S和Fe化合价变化,结合化合价变化价态守恒,配平离子方程式,故答案为:;
②Ag2S存在电离平衡,Cl-可以结合Ag+形成[AgCl2]-,使平衡朝正向移动,Fe3+存在水解平衡,H+可以抑制Fe3+水解,故答案为:Cl-可以结合Ag+形成[AgCl2]-,使平衡朝正向移动,H+可以抑制Fe3+水解;
(3)①[AgCl2]-与Fe反应,生成Fe2+、Ag、Cl-,Fe3+和Fe反应生成Fe2+,故答案为:、;
②沉银的过程中,同时有Fe2+被氧化为Fe3+,Fe3+可以和Ag发生氧化还原,影响了Ag的沉淀,故答案为: 被氧气氧化为,把氧化为;
(4)银锰精矿和氧化锰矿都含有锰元素,可以一起转化到浸锰液中,并且可以让银和锰实现分离;同时银锰精矿中生成的铁离子还可以用于沉银,故答案为: 可将两种矿石中的锰元素同时提取到浸锰液中,得到,同时将银元素和锰元素分离开;生成的还可以用于浸银,节约氧化剂剂。
【分析】(1)①溶度积越小,则沉淀越慢转化;
②氧化还原反应的过程中,Mn化合价降低,Fe化合价升高;
(2)①根据氧化还原反应的特点,以及题干提供的各种物质化学式,以化合价升降守恒配平离子方程式;
②减少生成物浓度,平衡朝正向移动,增大生成物浓度,平衡朝正向移动;
(3)①沉银的过程中发生了两个反应,分别为[AgCl2]-与Fe反应和Fe3+和Fe反应;
②随着时间的延长,Fe2+逐渐被氧化,形成具有较强氧化性的Fe3+,Fe3+可以和大部分金属反应;
(4)通常要考虑工艺过程中,矿石的综合利用以及成本的节约。
18.【答案】(1)D
(2)
(3)将Fe2+氧化为Fe3+;7.4
(4)稀硫酸;将Co2+、Mn2+分离,并富集Co2+
(5);取少量上清液于试管中,滴加碳酸氢钠溶液,无沉淀出现,则Co2+已沉淀完全
【解析】【解答】钴矿石加硫酸和亚硫酸氢钠溶液浸泡,亚硫酸氢钠具有还原性,CoO(OH)、CoCO3、CoO、Co2O3、Al2O3、Fe2O3、MnO2转化为:Co2+、Al3+、Fe2+、Mn2+,SiO2不溶进入滤渣1;除杂时加入试剂①过氧化氢,将Fe2+氧化为Fe3+,再加试剂②氨水调pH值,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3,进入滤渣2中;加有机萃取剂萃取后将Co2+、Mn2+分离,并富集Co2+;Co2+进入有机相,根据题中所给的萃取原理,加稀硫酸可使平衡逆向移动,故加稀硫酸进行反萃取得到含Co2+的溶液,加碳酸氢钠溶液沉钴得到CoCO3,灼烧后得到Co2O3。
(1)A.搅拌、粉碎能增大接触面积,加快反应速率,A正确;
B.升高温度使反应速率加快,B正确;
C.适当降低pH值,酸性增强,氢离子浓度增大,金属氧化物与氢离子反应速率加快,C正确;
D.过量的NaHSO3溶液与氢离子在酸性条件下会生成SO2,消耗氢离子,不能加快反应速率,D不正确;
故答案为:D。
(2)NaHSO3溶液为还原剂,CoO(OH)与其在酸性条件下发生氧化还原反应,离子方程式为:;
(3)根据分析,试剂①的作用是:将Fe2+氧化为Fe3+;根据表格中所给数据,当Co2+沉淀完全时,,,当时,,,pH=7.4,故调节pH的范围是:6-7.4;
(4)根据分析,反萃取时选用的试剂③是:稀硫酸;设计反萃取的目的是:将Co2+、Mn2+分离,并富集Co2+;
(5)加碳酸氢钠溶液沉钴得到CoCO3,离子方程式为:;若Co2+已沉淀完全,继续滴加碳酸氢钠溶液无沉淀生成,故证明Co2+已沉淀完全的实验操作和现象为:取少量上清液于试管中,滴加碳酸氢钠溶液,无沉淀出现,则Co2+已沉淀完全。
【分析】
(1)依据影响反应速率和化学平衡的因素分析;
(2)NaHSO3溶液为还原剂,利用氧化还原反应原理书写;
(3)根据表中的Ksp计算分析;
(4)依据化学平衡移动原理分析;
(5)依据反应物产物书写,通过检验加入试剂的离子证明。
19.【答案】(1)搅拌
(2)2Fe3++H2S=S↓+2Fe2++2H+
(3)Fe3++3H2OFe(OH)3+3H+,加入后消耗H+,使平衡正向移动,有利于Fe3+形成Fe(OH)3沉淀而被除去
(4)蒸发皿;出现少量晶膜
(5)0.003
(6)H2SO4;pH太小,锌的萃取率低,pH太大,镍可能以的形式沉出,不利于硫酸镍晶体的生成
【解析】【解答】(1)搅拌、适当地升温均可以增大浸出率。故答案为:搅拌;
(2)Fe3+与H2S发生氧化还原反应生成S和三价铁离子,反应离子方程式为:2Fe3++H2S=S↓+2Fe2++2H+,故答案为:2Fe3++H2S=S↓+2Fe2++2H+;
(3)加入的目的是调节pH,使Fe3+水解反应Fe3++3H2OFe(OH)3+3H+正向进行,促进Fe3+的沉淀。故答案为:Fe3++3H2OFe(OH)3+3H+,加入后消耗H+,使平衡正向移动,有利于Fe3+形成Fe(OH)3沉淀而被除去;
(4)操作X是从溶液中得到晶体的操作,应在蒸发皿中进行,当加热至溶液表面出现一层晶膜时停止加热,降温冷却得到晶体,故答案为:蒸发皿;出现少量晶膜;
(5)根据Ksp(CaF2)=c(Ca2+)×c2(F-),得出c2(F-)≥4×10-6mol/L,设NiF2溶液的体积为VL,即溶液中n(F-)=2V×2×10-3=4V×10-3(mol),沉淀时消耗的F-的物质的量为V×2×10-3mol,则总共需要n(F-)=6V×10-3mol,所加的NiF2溶液的浓度至少为3×10-3mol/L。故答案为:0.003;
(6)欲使有机相中的锌转化成硫酸锌,需使萃取平衡逆向移动,为不引入新杂质应加入硫酸使反应逆行移动;由图示信息可知pH太小,锌的萃取率低;pH太大,镍可能以的形式沉出,不利于硫酸镍晶体的生成。故答案为:H2SO4;pH太小,锌的萃取率低,pH太大,镍可能以的形式沉出,不利于硫酸镍晶体的生成;
【分析】(1)依据影响反应速率的因素分析;
(2)根据反应物和生成物的化学式,利用原子守恒、得失电子守恒、电荷守恒分析;
(3)依据水解平衡移动原理分析;
(4)依据蒸发操作分析;
(5)根据Ksp计算;
(6)依据萃取平衡分析;
20.【答案】(1)
(2)
【解析】【解答】(1)该反应的平衡常数
;
(2)NaB溶液中存在水解平衡:B-+H2O
HB+OH-,
c(HB),则
,则
。
【分析】(1)根据方程式写出平衡常数公式即可计算
(2)根据B离子水解方程式计算出离子浓度
21.【答案】(1)<
(2)H(氢);H2
(3)Li+ + H2O LiOH + H+
(4)Al3++3HCO =Al(OH)3↓+3CO2↑
(5)碳碳双键;加成反应
【解析】【解答】(1) Li+和H-的核外电子排布相同,Li+的核电荷数大于H-,电子层排布相同时核电荷数越大离子半径越小,因此锂离子的半径小于氢负离子半径,故答案为:<; (2)同周期中元素的电负性从左往右逐渐增大,同主族从上往下逐渐减小,则LiAlH4中电负性最大的元素是H(氢);氢元素为-1价,则与水发生归中反应生成的单质气体为H2,故答案为:H(氢);H2;(3) LiCl为强酸弱碱盐,其溶液显酸性是因为锂离子水解,离子方程式为:Li+ + H2O LiOH + H+,故答案为:Li+ + H2O LiOH + H+;(4)泡沫灭火器所用的原料为硫酸铝和碳酸氢钠,两者反应生成氢氧化铝和二氧化碳气体,用离子方程式表示泡沫灭火器的灭火原理Al3++3HCO =Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO =Al(OH)3↓+3CO2↑;(5) A为烃,反应后生成B,B可用作燃料,可知A含有碳碳双键,B为醇,A生成B为加成反应,故答案为:碳碳双键;加成反应。
【分析】(1)核外电子层排布相同时核电荷数越大离子半径越小;
(2)一般情况下,非金属性越强,电负性越强;
(3)用Li+水解分析;
(4)用铝离子和碳酸氢根的双水解原理分析;
(5)根据框图及碳碳双键的性质分析;
一、单选题
1.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.滴入酚酞变红色的溶液:K+、Ca2+、HCO、CO
B.0.1 mol·L-1 Fe2(SO4)3溶液:Cu2+、NH、NO、SO
C.pH=1的溶液:Ba2+、K+、CH3COO-、NO
D.无色透明的溶液:Cu2+、Na+、SO、NO
2.化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的基础自然科学,下列说法正确的是( )
A.金属氧化物都是碱性氧化物,非金属氧化物都是酸性氧化物
B.溶液与胶体的本质区别是是否存在丁达尔效应
C.光导纤维的主要成分为硅单质
D.氨水和氨气都不是电解质
3.下列水溶液呈碱性的盐是( )
A.CaCl2 B.Na2SO3 C.Ba(OH)2 D.HNO3
4.《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”记载。有关说法错误的是( )
A.薪柴之灰可做钾肥
B.取碱浇衣存在水解反应
C.碱浣衣与肥皂浣衣原理不同
D.上述过程涉及溶解、过滤、蒸馏操作
5.室温下,用相同浓度的溶液,分别滴定浓度均为的三种酸、和溶液,滴定曲线如图所示。下列判断错误的是 ( )
A.三种酸的电离常数关系:
B.点时,溶液中:
C.时,三种溶液中:
D.当中和达时,溶液中:
6.室温下进行下列实验,根据实验操作和现象,所得到的结论正确的是( )
选项 实验操作和现象 结论
A 乙醇钠的水溶液呈强碱性 结合 的能力强
B 将某溶液滴在 淀粉试纸上,试纸变蓝 原溶液中一定含有
C 向 和 的混合溶液中滴入硝酸酸化的 溶液,溶液变红 氧化性:
D 向盛有 一定浓度的 溶液的试管中,滴入5滴 的 溶液,产生黄色沉淀 发生了水解
A.A B.B C.C D.D
7.下列属于弱电解质的是( )
A.硫酸钡 B.二氧化硫 C.乙醇 D.乙酸
8.室温下,用0.1mol·L-1的NaOH溶液滴定20mL0.1mol·L-1HA溶液,测得混合溶液的pH与的关系如图所示。下列说法正确的是
A.导电能力:a>b B.室温下,Ka(HA)=10-3.8
C.b点时,V(NaOH)=20mL D.c点时,c(A-)>c(Na+)
9.已知HX、HY均为一元酸,室温下用 NaOH溶液分别滴定20.00mL等物质的量浓度的HX、HY溶液时的滴定曲线如下。下列有关说法正确的是( )
A.a=20
B.HX可能为强酸,HY一定是弱酸
C.若E为滴定终点,则室温下
D.图中B,D两点对应的溶液中存在
10.已知:25℃时,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。用0.01 mol/L的CH3COOH溶液滴定20 mL由浓度均为0.01 mol/L的NaOH溶液和氨水组成的混合溶液,溶液的相对导电能力随加入CH3COOH溶液体积的变化趋势如图所示。下列叙述错误的是( )
A.a点时混合溶液中:c( )≈l.7×10-5 mol·L-1
B.b点时混合溶液中:c(CH3COOH)<c( )
C.c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c( )+c(NH3·H2O)+c(Na+)
D.c点时混合溶液中:pH=7
11.下列物质熔融状态时不导电的是( )
A.MgF2 B.KCl C.H2SO4 D.NaOH
12.某试液中只可能含有K+、NH 、Fe2+、Al3+、Cl-、SO 、CO 、AlO 中的若干种离子,离子浓度均为0.1mol·L 1,某同学进行了如下实验,下列说法正确的是( )
A.无法确定原试液中是否含有Al3+、Cl-
B.原溶液中存在NH 、Fe2+、Cl-、SO
C.无法确定沉淀C的成分
D.滤液X中大量存在的阳离子有NH 、Fe2+和Ba2+
13.常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列有关说法错误的是
A.曲线M表示pH与lg的变化关系
B.NaHY溶液显酸性
C.交点d对应的pH=2.8
D.e点溶液中:c(HY-)>c(H2Y)>c(Y2-)>c(H+)>c(OH-)
14.下列说法正确的是( )
A.25℃时,测得0.1的XCl溶液pH<7,则XOH为强碱
B.同体积浓度分别为1、0.1的醋酸,含的物质的量分别为a mol、b mol,则a>10b
C.同体积同pH的盐酸与醋酸,与足量锌反应,若后者生成氢气多,则说明醋酸为弱酸
D.同物质的量浓度的盐酸与醋酸分别中和同体积同浓度的NaOH溶液,醋酸消耗的体积多
15.湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl)=]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是( )
A.AgCl溶解度随c(Cl-)增大而不断减小
B.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol L-1
C.当c(Cl-)=10-2mol L-1时,溶液中c(AgCl)>c(Ag+)>c(AgCl)
D.25℃时,AgCl+Cl-AgCl的平衡常数K=100.2
16.下列所示的实验方案正确,且能达到实验目的的是( )
选项 实验目的 实验方案
A 比较镁、铝的金属性强弱 分别在MgCl2和AlCl3溶液中滴加氨水直至过量,观察现象
B 比较Cl2、Br2的氧化性强弱 将少量氯水滴入FeBr2溶液中,观察现象
C 证明SO2具有漂白性 将SO2通入酸性高锰酸钾溶液中,溶液褪色
D 证明电离常数Ka:HSO3->HCO3- 测得同浓度的Na2CO3溶液的pH大于Na2SO3溶液
A.A B.B C.C D.D
二、综合题
17.以银锰精矿主要含、、和氧化锰矿主要含为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下,的氧化性强于。
(1)“浸锰”过程是在溶液中使矿石中的锰元素浸出,同时去除,有利于后续银的浸出;矿石中的银以的形式残留于浸锰渣中。
“浸锰”过程中,发生反应,则可推断: 填“”或“”。
在溶液中,银锰精矿中的和氧化锰矿中的发生反应,则浸锰液中主要的金属阳离子有 。
(2)“浸银”时,使用过量和的混合液作为浸出剂,将中的银以形式浸出。
将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中的作用: 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
该步反应的离子方程式有 。
一定温度下,的沉淀率随反应时间的变化如图所示。解释分钟后的沉淀率逐渐减小的原因: 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势: 。
18.三氧化二钴(Co2O3)常用于颜料、釉料及磁性材料。工业上以钴矿石(主要成分是CoO(OH)、CoCO3、CoO、Co2O3,及少量SiO2、Al2O3、Fe2O3、MnO2等)为原料制备Co2O3的工艺流程如图所示。
(1)“浸泡”过程中,为加快反应速率和提高矿石原料利用率,下列方法不可取的是____。
A.将钴矿石粉碎,搅拌 B.适当升高温度
C.适当降低溶液的pH D.使用过量的NaHSO3溶液
(2)“浸泡”时CoO(OH)参与反应的离子方程式为 。
(3)“除杂”时加入试剂①的作用是 ;若溶液中c(Co2+)=0.1mol/L,根据表中数据计算,加入试剂②调节pH范围是6~ (忽略过程中溶液体积变化)。
沉淀 Al(OH)3 Fe(OH)3 Co(OH)2 Fe(OH)2 Mn(OH)2
沉淀完全的pH 5.2 3.2 9.4 9.5 10.1
(4)“萃取”时发生反应:Co2++n(HA)2CoA2·(n-1)(HA)2+2H+,则试剂③为 。设计萃取、反萃取的目的是 。
(5)“沉钴”时的离子方程式为 ,证明Co2+已沉淀完全的实验操作和现象为 。
19.从铜电解液(主要含、Ni2+、、、、Zn2+等)中提纯得到粗硫酸镍晶体,为了进一步纯化并回收胆矾晶体,某课题小组设计了如图流程:
已知:相关离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如下:
金属离子 Cu2+ Fe2+ Fe3+ Ca2+ Zn2+ Ni2+
开始沉淀的pH 4.2 6.3 1.5 11.8 6.2 6.9
沉淀完全的uH 6.7 8.3 2.8 13.8 8.2 8.9
(1)为加快“水浸”时的浸出率,可采取的措施有 (任写一点)。
(2)为了使“溶液1”中的反应充分进行,需要通入稍过量的H2S,写出Fe3+与H2S发生反应的离子方程式: 。
(3)请结合离子方程式解释向“溶液2”中加入Ni(OH)2的原因 。
(4)“操作X”为在 (填仪器名称)中加热至 ,冷却结晶、过滤、洗涤、干燥后得到结晶水合物晶体。
(5)若“溶液3”中Ca2+的浓度为0.001mol/L,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5mol/L,则所加NiF2溶液的浓度至少为 mol/L。[已知室温下Ksp(CaF2)=4×10-11]
(6)室温下选择萃取剂P204(二乙基已基磷酸,用HR表示),其萃取原理为nHR+Mn+ MRn+nH+,试剂a为 (填化学式)。溶液pH对几种离子的萃取率的影响如图,则萃取锌时,应控制pH的范围为3~4,请解释原因: 。
20.已知酸HA和HB的电离平衡常数为、,则:
(1)反应的化学平衡常数为 。
(2)常温下的NaB溶液中 。
21.无机物及有机物在工农业生产和人类生活中都有着重要的应用。
(1)比较离子半径大小:Li+ H-(选填“>"、“<”或“=”)。
(2)LiAlH4中电负性最大的元素是 ,它与水反应生成的单质气体为 。
(3)LiCl溶液显酸性,用离子方程式说明原因 。
(4)泡沫灭火器的灭火原理: (用离子方程式说明)。
(5)如图所示,已知B可用作燃料,则A的官能团名称为 ;A生成B的有机反应类型为 。
答案解析部分
1.【答案】B
【解析】【解答】A.滴入酚酞变红的溶液为碱性溶液,碳酸氢根不能存在,碳酸根和钙离子也不能共存,A不符合题意;
B.所给离子相互之间均不反应,可以共存,B符合题意;
C.酸性溶液中醋酸根不能存在,C不符合题意;
D.铜离子为蓝色,无色溶液中不能存在,D不符合题意;
故答案为:B。
【分析】K+、Na+、NH4+和所有酸根离子共存,NO3-和所有阳离子共存,
CO32-只能和Na+、K+、NH4+共存,
OH-只能和Na+、K+、Ba2+共存,SO42-不能和Ag+、Ca2+、Pb2+、Ba2+共存,
Cl-不能和Ag+共存
H+只能和Cl-、Br-、I-、NO3-、SO42-、ClO4-共存。
2.【答案】D
【解析】【解答】A.金属氧化物中为酸性氧化物,为两性氧化物;非金属氧化物中等都不是酸性氧化物,A项不符合题意;
B.溶液与胶体的本质区别是分散质粒子直径不同,溶液中分散质粒子直径小于1nm,胶体中分散质粒子直径为1~100nm,B项不符合题意;
C.光导纤维的主要成分是SiO2,C项不符合题意;
D.电解质是在水溶液或熔融状态下,本身能够电离出离子导电的化合物,氨水是混合物,氨气本身无法电离产生离子,故二者都不是电解质,D项符合题意;
故答案为:D。
【分析】A.有的金属氧化物是酸性氧化物,如;
B.溶液与胶体的本质区别是分散质粒子直径不同;
C.光导纤维的主要成分是二氧化硅。
3.【答案】B
【解析】【解答】A.CaCl2是强酸强碱盐,其溶液显中性,A不符合题意;
B.Na2SO3是强碱弱酸盐,其溶液显碱性,B符合题意;
C.Ba(OH)2属于碱,不符合题意,C不符合题意;
D.HNO3,属于酸,不符合题意,D不符合题意;
故答案为:B。
【分析】强酸弱碱盐呈酸性,强碱弱酸盐呈碱性,强酸强碱盐呈中性。
4.【答案】D
【解析】【解答】A.薪柴之灰的主要成分是碳酸钾,碳酸钾可做钾肥,故A不符合题意;
B.薪柴之灰的主要成分是碳酸钾,碳酸钾在溶液中水解使溶液呈碱性,碱性溶液能使油污水解达到洗衣的目的,则取碱浣衣存在水解反应,故B不符合题意;
C.碱浣衣是利用了碳酸钾在溶液中水解使溶液呈碱性,碱性溶液能使油污水解达到洗衣的目的,而肥皂浣衣的原理是在洗涤的过程中,污垢中的油脂跟肥皂接触后,高级脂肪酸钠分子的烃基就插入油滴内,而易溶于水的羧基部分伸在油滴外面,插入水中。这样油滴就被肥皂分子包围起来,再经磨擦、振动,大的油滴就分散成小的油珠,最后脱离纤维织品,达到洗涤的目的,两者浣衣原理不同,故C不符合题意;
D.由题意可知,上述过程涉及溶解、过滤操作,不涉及蒸馏操作,故D符合题意;
故答案为:D。
【分析】A.薪柴之灰为碳酸钾,含钾元素;
B.碳酸钾是弱酸强碱盐,水溶液呈碱性,可用于去油污;
C.碳酸钾溶液呈碱性,促进油脂水解生成可溶性盐,肥皂是利用乳化作用进行去污除油;
D.该过程不涉及蒸馏。
5.【答案】C
【解析】【解答】A.相同物质的量浓度的一元酸的pH越小,氢离子浓度越大,说明酸的电离程度越大,该酸的酸性越强,其电离平衡常数越大,根据图知,未加NaOH溶液时,pH:HA<HB<HD,说明酸的电离程度HA>HB>HD,则KHA>KHB>KHD,故A不符合题意;
B.P点时HB被中和50%,溶液中溶质为等物质的量浓度的酸(HB)和盐(NaB),由图可知溶液呈酸性,则c(H+)>c(OH-),说明HB的电离程度大于B-的水解程度,则c(B-)>c(HB),结合物料守恒2c(Na+)=c(B-)+c(HB)可知:c(B-)>c(Na+)>c(HB),溶液中离子浓度大小为:,故B不符合题意;
C.pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒可知,HA溶液中c(Na+)=c(A-),HB溶液中c(Na+)=c(B-),HD溶液中c(Na+)=c(D-),由于HA,HB,HD的酸性并不一致,则使溶液呈中性时,三种溶液中c(Na+)并不相等,则c(A-)、c(B-)、c(D-)并不相等,故C符合题意;
D.当中和达时,溶液中存在的是NaA,由可得:,即,化简得:,刚好是NaA溶液的物料守恒等式,故D不符合题意。
故答案为:C。
【分析】A.初始点的pH值A
B.P点时中和50%,溶液显酸性,B的电离大于水解,故B->HB,H+>OH-,而2Na=B-+HB,故c(B-)>c(Na+)>c(HB);
C.ABD的酸酸性不一样,所以消耗的氢氧化钠的量不同,生成的离子也不同;
D.根据物料守恒计算。
6.【答案】A
【解析】【解答】A. 溶液中电离出的 水解生成 与 使溶液呈强碱性,则 ,所以 结合 的能力强,故A符合题意;
B.能氧化碘离子的不止氯气,其他强氧化剂如溴单质,氧气以及双氧水等都能将碘离子氧化成碘单质,从而使淀粉试纸变蓝,故B不符合题意;
C.滴加硝酸酸化的硝酸银溶液中含有硝酸,硝酸能将亚铁离子氧化成铁离子,从而使 溶液变红,所以不能得出氧化性: ,故C不符合题意;
D.向盛有 一定浓度的 溶液的试管中,滴入5滴 的 溶液,产生黄色沉淀,黄色沉淀的成分为AgI,说明 溶液含有 ,即 发生电离,而不是水解,故D不符合题意;
故答案为:A。
【分析】 A.乙醇钠的水溶液中水解显碱性;
B.溶液可能为碘或溴水;
C.硝酸可氧化亚铁离子,生成铁离子遇KSCN溶液变红;
D.滴入5滴2mol/L的KI溶液,产生黄色沉淀为AgI。
7.【答案】D
【解析】【解答】A.硫酸钡在熔融状态下能完全电离,属于强电解质,A不符合题意;
B.SO2属于非电解质,B不符合题意;
C.乙醇属于非电解质,C不符合题意;
D.乙酸在水溶液中部分电离,属于弱电解质,D符合题意;
故答案为:D。
【分析】弱电解质在水溶液或熔融状态下部分电离,注意常见的弱电解质包括弱酸、弱碱、水。
8.【答案】B
【解析】【解答】A.由电荷守恒得:,随NaOH的加入,和增大,则溶液中总离子浓度增大,溶液导电能力增大,导电能力:a
C.HA为弱酸,当V(NaOH)=20mL时,恰好与HA完全反应生成NaA,此时溶液因水解显碱性,而b点溶液显中性,则V(NaOH)<20mL,故C不符合题意;
D.电荷守恒得:,c点溶液显碱性,则,,故D不符合题意;
故答案为:B。
【分析】A.依据电荷守恒和导电性与溶液中自由移动离子的浓度有关分析;
B.选择a点,利用 Ka(HA)= 计算;
C.依据中和产物的类型分析;
D.依据电荷守恒分析。
9.【答案】B
【解析】【解答】A.由图像可知浓度均为0.1000mol·L-1的两种一元酸,HY的pH=3,部分电离,为弱酸;HX的pH=1溶液,全部电离,为强酸;HX溶液用NaOH溶液滴定呈中性时消耗20mLNaOH,则同样滴定到中性的HY溶液消耗的NaOH溶液大于20mL,a﹥20,故A不符合题意;
B.由图可知,HY一定是弱酸,HX酸性比HY强,,所以B、D两点对应溶液的总体积不相等,和也不可能相等,故B符合题意;
C.由图像可知浓度均为0.1000mol·L-1的两种一元酸,HY的pH=3,则室温下﹥10-6,故C不符合题意;
D.由图可知,HY一定是弱酸,HX酸性比HY强,,所以B、D两点对应溶液的总体积不相等,和也不可能相等,故D不符合题意;
故答案为:B。
【分析】对于滴定图像问题要注意:1.注意图像起点、终点、滴定终点和反应终点,2.关注图像变化斜率,3.充分利用电荷守恒、质量守恒、质子守恒。
10.【答案】D
【解析】【解答】A.a点时溶液为0.01 mol/L的NaOH、NH3·H2O得到的混合溶液,NaOH是强碱,完全电离,NH3·H2O是弱碱,部分电离。由NH3·H2O的电离平衡常数Kb= 可得c( )= ,A不符合题意;
B.b点时NaOH恰好被中和,溶液为CH3COONa、NH3·H2O的混合溶液,由于醋酸是一元弱酸,NH3·H2O、CH3COOH电离平衡常数相同。CH3COONa会水解产生CH3COOH,CH3COO-的水解平衡常数Kh= <1.7×10-5=Kb,故CH3COO-的水解程度小于NH3·H2O的电离程度,因此该混合溶液中微粒浓度:c(CH3COOH)<c( ),B不符合题意;
C.c点溶液为等浓度的CH3COONa、CH3COONH4的混合溶液,根据物料守恒可得:c(CH3COO- )+c(CH3COOH)=c( )+c(NH3·H2O)+c(Na+),C不符合题意;
D.c点溶液的溶质为等浓度的醋酸钠和醋酸铵,在醋酸铵溶液中,铵根离子和醋酸根离子的水解程度相近,溶液呈中性,醋酸钠属于强碱弱酸盐,水解使溶液显碱性,可知等浓度的醋酸钠和醋酸铵混合溶液的pH>7,D符合题意;
故答案为:D。
【分析】A.根据氨水的电离常数计算公式计算即可
B.b点是恰好将氢氧化钠反应完。计算出醋酸根离子的水解平衡常数即可判断
C.c点是将氨水全部反应完全的点,根据物料守恒写出即可
D.根据各离子的水解常数即可判断即可
11.【答案】C
【解析】【解答】A.MgF2是离子晶体,熔融状态时电离出自由移动的离子,能导电,则A不符合题意;
B.KCl是离子晶体,熔融状态时电离出自由移动的离子,能导电,则B不符合题意;
C.H2SO4为分子晶体,熔融状态时不能电离出自由移动的离子,不能导电,则C符合题意;
D.NaOH是离子晶体,熔融状态时电离出自由移动的离子,能导电,则D不符合题意;
故答案为:C。
【分析】电解质熔融下导电说明是离子晶体
12.【答案】B
【解析】【解答】A.根据分析原试液中一定不含有Al3+,一定含Cl-,故A不符合题意;
B.根据分析原溶液中存在SO42 、Cl-、Fe2+、NH4+,故B符合题意;
C.根据分析溶液中不含有Al3+,因此沉淀C为碳酸钡沉淀,故C不符合题意;
D.滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Ba2+,故D不符合题意;
故答案为B。
【分析】加入过量稀硫酸后,无明显现象产生,说明原溶液中不含有CO32-、AlO2-。再加入过量Ba(NO3)2溶液,产生气体和沉淀A,则原溶液中一定含有Fe2+、SO42-。滤液X中加入过量的NaOH溶液,产生气体和沉淀B,则气体为NH3,沉淀B为Fe(OH)3,说明原溶液中含有NH4+。由于溶液中各个离子的浓度都是0.1mol·L-1,因此溶液中一定含有Cl-,一定不含有K+和Al3+。据此结合选项分析。
13.【答案】D
【解析】【解答】A.随着KOH溶液滴加,c(HY-)增大,c(H2Y)减小,继续滴加,c(HY-)减小,c(Y2-)增大,所以lg增大,用曲线N表示,lg减小,用曲线M表示,A不符合题意;
B.通过图中c点可得Ka1=10-1.3,e点可得Ka2=10-4.3,Kh2==10-12.7,Ka2>Kh2,NaHY的电离程度大于其水解程度,所以溶液显酸性,B不符合题意;
C.交点d时c(H2Y)=c(Y2-),Ka1·Ka2==10-5.6,则对应的pH=2.8,C不符合题意;
D.e点溶液中:lg>lg,c(H2Y)
【分析】 二元弱酸H2Y溶液中滴加KOH溶液,反应为H2Y+KOH=KHY+H2O、KHY+KOH=K2Y+H2O,随 着 KOH 溶 液 滴 加,c(HY- )增 大,c(H2Y)减小,继续滴加,c(HY- )减小,c(Y2- )增大,则曲线M表示pH与lg的变化关系,曲线N表示pH与lg的变化关系。
14.【答案】C
【解析】【解答】A.若XOH为强碱,则XCl为强酸强碱盐,呈中性,25℃时其溶液pH=7,则A不符合题意;
B.醋酸为弱酸,在溶液中不完全电离,根据越稀越电离,0.1的醋酸电离程度大于1的醋酸,所以a<10b,故B不符合题意;
C.同体积同pH的盐酸与醋酸,与足量锌反应,若后者生成氢气多,则说明醋酸浓度大,说明醋酸不完全电离,为弱酸,故C符合题意;
D.同物质的量浓度的盐酸与醋酸分别中和同体积同浓度的NaOH溶液,因醋酸和盐酸的物质的量相同,且两者与NaOH 1:1反应,即消耗的NaOH溶液的体积相同,故D不符合题意;
故答案为:C。
【分析】A.根据强碱弱酸盐显碱性
B.越稀越电离即可判断
C.弱酸部分电离,相同pH的酸,弱酸浓度大
D.氢离子相等,消耗的碱相同
15.【答案】A
【解析】【解答】A.由图可知开始的时候氯化银的溶解度随着c(Cl-)增大而不断减小,但是当氯离子浓度增大的一定程度的时候,随着c(Cl-)增大溶液中的银离子和氯离子形成络离子,而溶解度增大,A符合题意;
B.沉淀最彻底时即银离子以氯化银的形式存在,而且氯化银最多的时候,就是沉淀最彻底时,由图可知此时c(Cl-)=10-2.54,由lg[Ksp(AgCl)]=-9.75可知,Ksp(AgCl)= 10-9.75,则此时c(Ag+)=10-7.21mol L-1,B不符合题意;
C.当c(Cl-)=10-2mol L-1时,图中横坐标为-2,由图可知,此时c(AgCl
)>c(Ag+)>c(AgCl
),C不符合题意;
D.AgCl
+Cl-AgCl
的平衡常数
,则在图中横坐标为-0.2时AgCl
与AgCl
相交,即其浓度相等,则在常数中其比值为1,此时常数K=
=100.2,D不符合题意;
故答案为:A。
【分析】A.结合图示即可判断,氯化银溶解度先减小后增大
B.结合图示,沉淀最彻底时,找出数据结合Ksp计算出银离子浓度
C.根据图示找出 当c(Cl-)=10-2mol L-1时 的浓度即可
D.找出反应时的数据即可计算出常数
16.【答案】D
【解析】【解答】A.分别在MgCl2和AlCl3溶液中滴加氨水直至过量,均生成白色沉淀,无法比较镁、铝的金属性强弱,故A不符合题意;
B.Fe2+的还原性大于Br-,将少量氯水滴入FeBr2溶液中,首先氧化Fe2+,则无法比较Cl2、Br2的氧化性强弱,故B不符合题意;
C.将SO2通入酸性高锰酸钾溶液中,溶液褪色,体现SO2的还原性,不是漂白性,故C不符合题意;
D.测得同浓度的Na2CO3溶液的pH大于Na2SO3溶液,说明CO32-的水解能力大于SO32-,则电离能力HSO3->HCO3-,即电离常数Ka:HSO3->HCO3-,故D符合题意;
故答案为D。
【分析】根据同浓度的碳酸钠溶液与亚硫酸钠溶液的pH值大小来判断CO32-与SO32-水解能力的大小,由此可以得出HSO3->HCO3-的电离能力,据此分析解答即可。
17.【答案】(1);、
(2);Cl-可以结合Ag+形成[AgCl2]-,使平衡朝正向移动,H+可以抑制Fe3+水解
(3)、;被氧气氧化为,把氧化为
(4)可将两种矿石中的锰元素同时提取到浸锰液中,得到,同时将银元素和锰元素分离开;生成的还可以用于浸银,节约氧化剂
【解析】【解答】(1)①Ag2S、MnS都可以在酸性条件下反应生成H2S,而MnS优先反应,则其溶度积更大,故答案为:>;
②FeS2中Fe为+2价,MnO2中Mn为+4价,结合已知条件“酸性条件下,MnO2的氧化性强于Fe3+”,可知MnO2可以和FeS2发生氧化还原反应生成Mn2+和Fe3+,故答案为:、;
(2)①S化合价由-2变为0,化合价升高,则Fe3+化合价降低,生成Fe2+,结合题干可知反应物含有Cl-,根据S和Fe化合价变化,结合化合价变化价态守恒,配平离子方程式,故答案为:;
②Ag2S存在电离平衡,Cl-可以结合Ag+形成[AgCl2]-,使平衡朝正向移动,Fe3+存在水解平衡,H+可以抑制Fe3+水解,故答案为:Cl-可以结合Ag+形成[AgCl2]-,使平衡朝正向移动,H+可以抑制Fe3+水解;
(3)①[AgCl2]-与Fe反应,生成Fe2+、Ag、Cl-,Fe3+和Fe反应生成Fe2+,故答案为:、;
②沉银的过程中,同时有Fe2+被氧化为Fe3+,Fe3+可以和Ag发生氧化还原,影响了Ag的沉淀,故答案为: 被氧气氧化为,把氧化为;
(4)银锰精矿和氧化锰矿都含有锰元素,可以一起转化到浸锰液中,并且可以让银和锰实现分离;同时银锰精矿中生成的铁离子还可以用于沉银,故答案为: 可将两种矿石中的锰元素同时提取到浸锰液中,得到,同时将银元素和锰元素分离开;生成的还可以用于浸银,节约氧化剂剂。
【分析】(1)①溶度积越小,则沉淀越慢转化;
②氧化还原反应的过程中,Mn化合价降低,Fe化合价升高;
(2)①根据氧化还原反应的特点,以及题干提供的各种物质化学式,以化合价升降守恒配平离子方程式;
②减少生成物浓度,平衡朝正向移动,增大生成物浓度,平衡朝正向移动;
(3)①沉银的过程中发生了两个反应,分别为[AgCl2]-与Fe反应和Fe3+和Fe反应;
②随着时间的延长,Fe2+逐渐被氧化,形成具有较强氧化性的Fe3+,Fe3+可以和大部分金属反应;
(4)通常要考虑工艺过程中,矿石的综合利用以及成本的节约。
18.【答案】(1)D
(2)
(3)将Fe2+氧化为Fe3+;7.4
(4)稀硫酸;将Co2+、Mn2+分离,并富集Co2+
(5);取少量上清液于试管中,滴加碳酸氢钠溶液,无沉淀出现,则Co2+已沉淀完全
【解析】【解答】钴矿石加硫酸和亚硫酸氢钠溶液浸泡,亚硫酸氢钠具有还原性,CoO(OH)、CoCO3、CoO、Co2O3、Al2O3、Fe2O3、MnO2转化为:Co2+、Al3+、Fe2+、Mn2+,SiO2不溶进入滤渣1;除杂时加入试剂①过氧化氢,将Fe2+氧化为Fe3+,再加试剂②氨水调pH值,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3,进入滤渣2中;加有机萃取剂萃取后将Co2+、Mn2+分离,并富集Co2+;Co2+进入有机相,根据题中所给的萃取原理,加稀硫酸可使平衡逆向移动,故加稀硫酸进行反萃取得到含Co2+的溶液,加碳酸氢钠溶液沉钴得到CoCO3,灼烧后得到Co2O3。
(1)A.搅拌、粉碎能增大接触面积,加快反应速率,A正确;
B.升高温度使反应速率加快,B正确;
C.适当降低pH值,酸性增强,氢离子浓度增大,金属氧化物与氢离子反应速率加快,C正确;
D.过量的NaHSO3溶液与氢离子在酸性条件下会生成SO2,消耗氢离子,不能加快反应速率,D不正确;
故答案为:D。
(2)NaHSO3溶液为还原剂,CoO(OH)与其在酸性条件下发生氧化还原反应,离子方程式为:;
(3)根据分析,试剂①的作用是:将Fe2+氧化为Fe3+;根据表格中所给数据,当Co2+沉淀完全时,,,当时,,,pH=7.4,故调节pH的范围是:6-7.4;
(4)根据分析,反萃取时选用的试剂③是:稀硫酸;设计反萃取的目的是:将Co2+、Mn2+分离,并富集Co2+;
(5)加碳酸氢钠溶液沉钴得到CoCO3,离子方程式为:;若Co2+已沉淀完全,继续滴加碳酸氢钠溶液无沉淀生成,故证明Co2+已沉淀完全的实验操作和现象为:取少量上清液于试管中,滴加碳酸氢钠溶液,无沉淀出现,则Co2+已沉淀完全。
【分析】
(1)依据影响反应速率和化学平衡的因素分析;
(2)NaHSO3溶液为还原剂,利用氧化还原反应原理书写;
(3)根据表中的Ksp计算分析;
(4)依据化学平衡移动原理分析;
(5)依据反应物产物书写,通过检验加入试剂的离子证明。
19.【答案】(1)搅拌
(2)2Fe3++H2S=S↓+2Fe2++2H+
(3)Fe3++3H2OFe(OH)3+3H+,加入后消耗H+,使平衡正向移动,有利于Fe3+形成Fe(OH)3沉淀而被除去
(4)蒸发皿;出现少量晶膜
(5)0.003
(6)H2SO4;pH太小,锌的萃取率低,pH太大,镍可能以的形式沉出,不利于硫酸镍晶体的生成
【解析】【解答】(1)搅拌、适当地升温均可以增大浸出率。故答案为:搅拌;
(2)Fe3+与H2S发生氧化还原反应生成S和三价铁离子,反应离子方程式为:2Fe3++H2S=S↓+2Fe2++2H+,故答案为:2Fe3++H2S=S↓+2Fe2++2H+;
(3)加入的目的是调节pH,使Fe3+水解反应Fe3++3H2OFe(OH)3+3H+正向进行,促进Fe3+的沉淀。故答案为:Fe3++3H2OFe(OH)3+3H+,加入后消耗H+,使平衡正向移动,有利于Fe3+形成Fe(OH)3沉淀而被除去;
(4)操作X是从溶液中得到晶体的操作,应在蒸发皿中进行,当加热至溶液表面出现一层晶膜时停止加热,降温冷却得到晶体,故答案为:蒸发皿;出现少量晶膜;
(5)根据Ksp(CaF2)=c(Ca2+)×c2(F-),得出c2(F-)≥4×10-6mol/L,设NiF2溶液的体积为VL,即溶液中n(F-)=2V×2×10-3=4V×10-3(mol),沉淀时消耗的F-的物质的量为V×2×10-3mol,则总共需要n(F-)=6V×10-3mol,所加的NiF2溶液的浓度至少为3×10-3mol/L。故答案为:0.003;
(6)欲使有机相中的锌转化成硫酸锌,需使萃取平衡逆向移动,为不引入新杂质应加入硫酸使反应逆行移动;由图示信息可知pH太小,锌的萃取率低;pH太大,镍可能以的形式沉出,不利于硫酸镍晶体的生成。故答案为:H2SO4;pH太小,锌的萃取率低,pH太大,镍可能以的形式沉出,不利于硫酸镍晶体的生成;
【分析】(1)依据影响反应速率的因素分析;
(2)根据反应物和生成物的化学式,利用原子守恒、得失电子守恒、电荷守恒分析;
(3)依据水解平衡移动原理分析;
(4)依据蒸发操作分析;
(5)根据Ksp计算;
(6)依据萃取平衡分析;
20.【答案】(1)
(2)
【解析】【解答】(1)该反应的平衡常数
;
(2)NaB溶液中存在水解平衡:B-+H2O
HB+OH-,
c(HB),则
,则
。
【分析】(1)根据方程式写出平衡常数公式即可计算
(2)根据B离子水解方程式计算出离子浓度
21.【答案】(1)<
(2)H(氢);H2
(3)Li+ + H2O LiOH + H+
(4)Al3++3HCO =Al(OH)3↓+3CO2↑
(5)碳碳双键;加成反应
【解析】【解答】(1) Li+和H-的核外电子排布相同,Li+的核电荷数大于H-,电子层排布相同时核电荷数越大离子半径越小,因此锂离子的半径小于氢负离子半径,故答案为:<; (2)同周期中元素的电负性从左往右逐渐增大,同主族从上往下逐渐减小,则LiAlH4中电负性最大的元素是H(氢);氢元素为-1价,则与水发生归中反应生成的单质气体为H2,故答案为:H(氢);H2;(3) LiCl为强酸弱碱盐,其溶液显酸性是因为锂离子水解,离子方程式为:Li+ + H2O LiOH + H+,故答案为:Li+ + H2O LiOH + H+;(4)泡沫灭火器所用的原料为硫酸铝和碳酸氢钠,两者反应生成氢氧化铝和二氧化碳气体,用离子方程式表示泡沫灭火器的灭火原理Al3++3HCO =Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO =Al(OH)3↓+3CO2↑;(5) A为烃,反应后生成B,B可用作燃料,可知A含有碳碳双键,B为醇,A生成B为加成反应,故答案为:碳碳双键;加成反应。
【分析】(1)核外电子层排布相同时核电荷数越大离子半径越小;
(2)一般情况下,非金属性越强,电负性越强;
(3)用Li+水解分析;
(4)用铝离子和碳酸氢根的双水解原理分析;
(5)根据框图及碳碳双键的性质分析;
同课章节目录
