2024届高三高考化学二轮复习热点题型专练:氧化还原反应(含解析)
文档属性
| 名称 | 2024届高三高考化学二轮复习热点题型专练:氧化还原反应(含解析) |  | |
| 格式 | DOCX | ||
| 文件大小 | 618.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-09 17:59:07 | ||
图片预览


文档简介
2024届高考化学二轮复习热点题型专练:
氧化还原反应
1. (2023·武汉4月模拟)生活中处处有化学。下列过程不涉及氧化还原反应的是( )
A. 海水晒盐 B. 牛奶变质
C. 铁器生锈 D. 酿制食醋
2. (2023·汕头一模)化学品在生活、生产中应用广泛。下列物质的应用与氧化还原反应无关的是( )
A. 工业上用硫铁矿(FeS2)为原料生产发烟硫酸
B. 用Na2O2作潜水器的供氧剂
C. 用食醋可除去暖水瓶中的水垢
D. 用优质糯米为原料酿制白酒
3. (2023·惠州一模)为检验下列久置于空气中的物质是否变质,所选检验试剂(括号内)能达到实验目的的是( )
A. 新制氯水(AgNO3溶液) B. FeCl2溶液(KSCN溶液)
C. 漂白粉(Na2CO3溶液) D. Na2SO3溶液(BaCl2溶液)
4. (2023·河南重点中学联考)关于反应5NaClO2+4HCl===4ClO2+5NaCl+2H2O。下列说法正确的是 ( )
A. NaClO2中Cl元素仅被还原
B. 该反应中,HCl体现了酸性和还原性
C. 还原剂与氧化剂的质量之比为4∶1
D. 氧化产物与还原产物的物质的量之比为4∶5
5. (2023·惠州一模)关于下列转化过程分析不正确的是 ( )
A. Fe3O4中Fe元素的化合价为+2、+3
B. 该转化过程中FeO和Fe3O4均作催化剂
C. 过程Ⅱ的化学方程式为
3FeO+H2OFe3O4+H2↑
D. 该过程的总反应为2H2O===O2↑+2H2↑
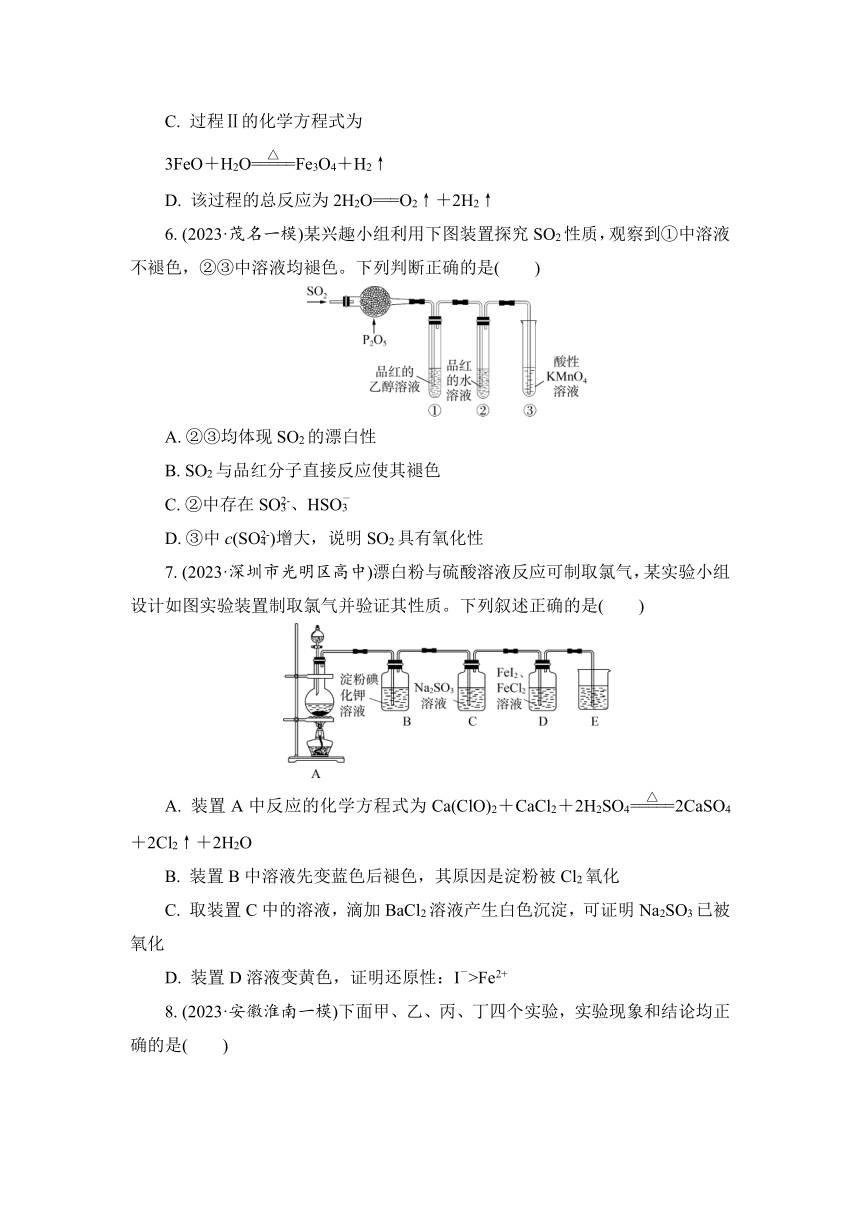
6. (2023·茂名一模)某兴趣小组利用下图装置探究SO2性质,观察到①中溶液不褪色,②③中溶液均褪色。下列判断正确的是( )
A. ②③均体现SO2的漂白性
B. SO2与品红分子直接反应使其褪色
C. ②中存在SO、HSO
D. ③中c(SO)增大,说明SO2具有氧化性
7. (2023·深圳市光明区高中)漂白粉与硫酸溶液反应可制取氯气,某实验小组设计如图实验装置制取氯气并验证其性质。下列叙述正确的是( )
A. 装置A中反应的化学方程式为Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O
B. 装置B中溶液先变蓝色后褪色,其原因是淀粉被Cl2氧化
C. 取装置C中的溶液,滴加BaCl2溶液产生白色沉淀,可证明Na2SO3已被氧化
D. 装置D溶液变黄色,证明还原性:I->Fe2+
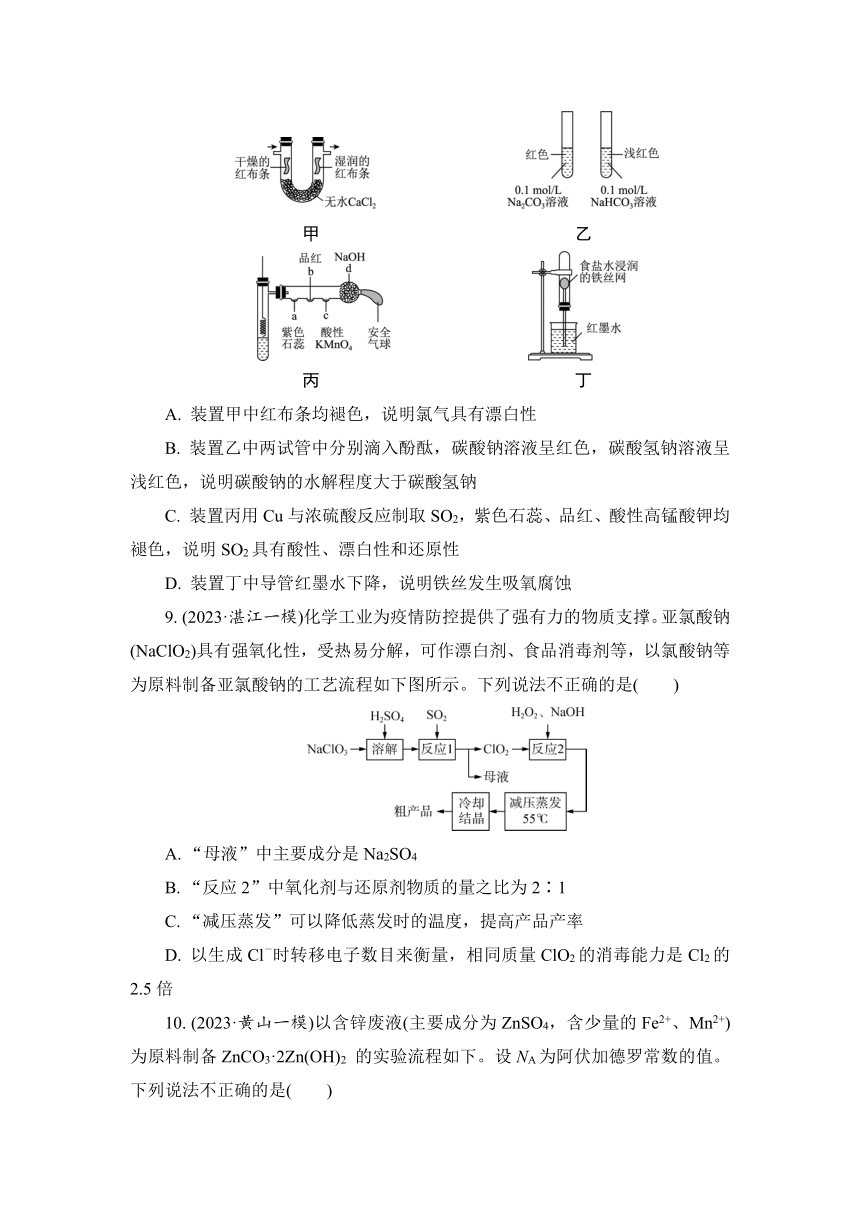
8. (2023·安徽淮南一模)下面甲、乙、丙、丁四个实验,实验现象和结论均正确的是( )
甲 乙
丙 丁
A. 装置甲中红布条均褪色,说明氯气具有漂白性
B. 装置乙中两试管中分别滴入酚酞,碳酸钠溶液呈红色,碳酸氢钠溶液呈浅红色,说明碳酸钠的水解程度大于碳酸氢钠
C. 装置丙用Cu与浓硫酸反应制取SO2,紫色石蕊、品红、酸性高锰酸钾均褪色,说明SO2具有酸性、漂白性和还原性
D. 装置丁中导管红墨水下降,说明铁丝发生吸氧腐蚀
9. (2023·湛江一模)化学工业为疫情防控提供了强有力的物质支撑。亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如下图所示。下列说法不正确的是( )
A. “母液”中主要成分是Na2SO4
B. “反应2”中氧化剂与还原剂物质的量之比为2∶1
C. “减压蒸发”可以降低蒸发时的温度,提高产品产率
D. 以生成Cl-时转移电子数目来衡量,相同质量ClO2的消毒能力是Cl2的2.5倍
10. (2023·黄山一模)以含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2 的实验流程如下。设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A. 1 mol过二硫酸钠(Na2S2O8)中含有σ键数目为9NA
B. 氧化除锰后的溶液中一定存在:Na+、Zn2+、Fe3+、SO
C. 调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质
D. 氧化除锰过程中生成MnO2的离子方程式:Mn2++S2O+2H2O===MnO2↓+2SO+4H+
11. (2023·厦门二检)从废铅膏(主要成分为PbSO4、PbO2、PbO和Pb,含少量Ba、Fe等元素)中获取高纯PbO的工艺流程如图所示。下列说法不正确的是( )
A. “煅烧”过程利用Fe2(SO4)3沸点低进行分离提纯
B. “溶浸”过程H2O2主要用于氧化Pb
C. “溶铅”过程的离子方程式为
PbSO4+2CH3COO-===(CH3COO)2Pb+SO
D. “沉铅”过程的化学方程式为
(CH3COO)2Pb+H2O+CO2===PbCO3↓+2CH3COOH
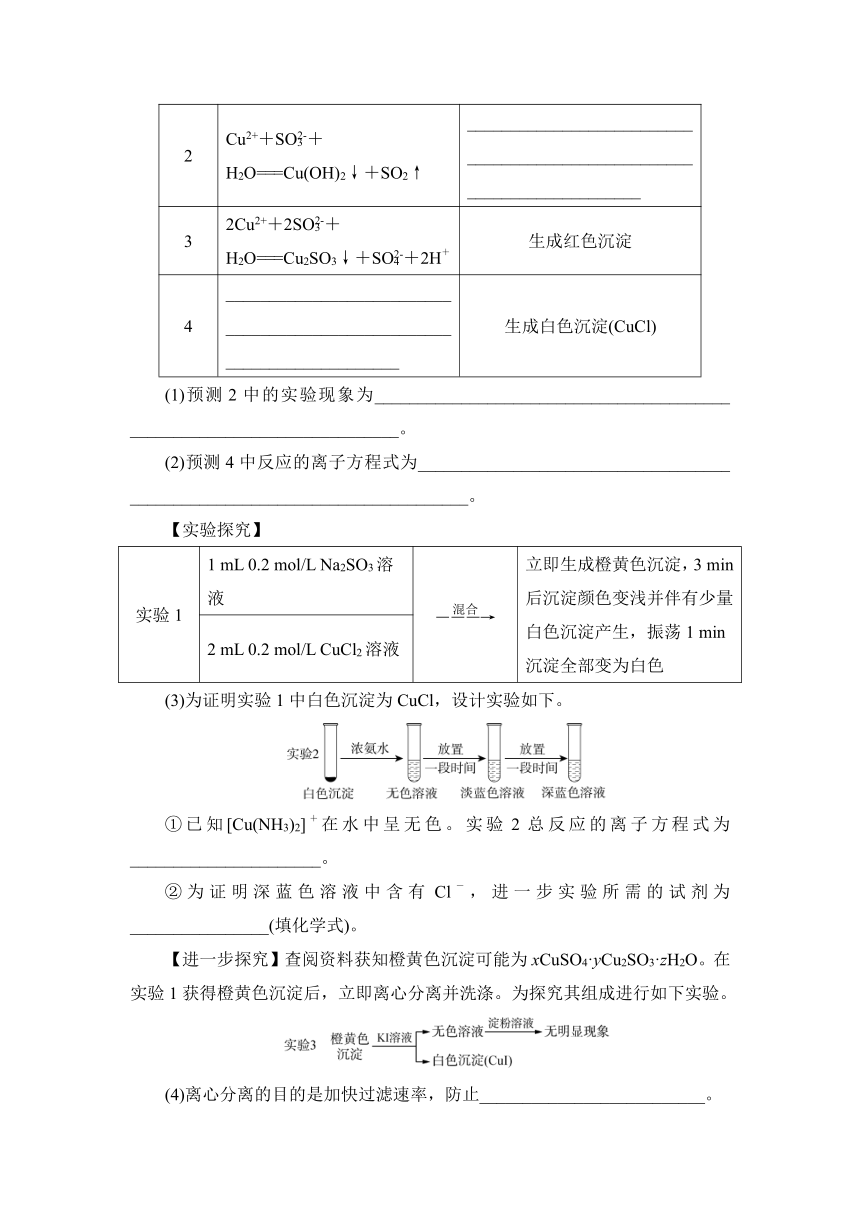
12. (2023·厦门二检)某小组探究CuCl2溶液和Na2SO3溶液的反应物,开展如下活动。
【理论预测】
预测 反应的离子方程式 实验现象
1 Cu2++SO===CuSO3↓ 生成绿色沉淀
2 Cu2++SO+H2O===Cu(OH)2↓+SO2↑ ________________________________________________________________________
3 2Cu2++2SO+H2O===Cu2SO3↓+SO+2H+ 生成红色沉淀
4 ________________________________________________________________________ 生成白色沉淀(CuCl)
(1)预测2中的实验现象为_________________________________________ _______________________________。
(2)预测4中反应的离子方程式为____________________________________ _______________________________________。
【实验探究】
实验1 1 mL 0.2 mol/L Na2SO3溶液 立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1 min沉淀全部变为白色
2 mL 0.2 mol/L CuCl2溶液
(3)为证明实验1中白色沉淀为CuCl,设计实验如下。
①已知[Cu(NH3)2]+在水中呈无色。实验2总反应的离子方程式为______________________。
②为证明深蓝色溶液中含有Cl-,进一步实验所需的试剂为________________(填化学式)。
【进一步探究】查阅资料获知橙黄色沉淀可能为xCuSO4·yCu2SO3·zH2O。在实验1获得橙黄色沉淀后,立即离心分离并洗涤。为探究其组成进行如下实验。
(4)离心分离的目的是加快过滤速率,防止__________________________。
(5)已知2Cu2++4I-===2CuI↓+I2。实验3能否证明橙黄色沉淀中含有Cu2+和SO,结合实验现象做出判断并说明理由:_______________________ ___________________。
(6)橙黄色沉淀转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性,进行如下实验(已知装置中物质氧化性与还原性强弱差异越大,电压越大)。
实验4
装置 试剂a 试剂b 电压表读数
0.2 mol/L Na2SO3 溶液 0.2 mol/L CuCl2 溶液 V1
0.2 mol/L Na2SO3 溶液 X V2
①表中X为________________。
②能证实实验结论的实验现象为________________________________________________________________________
【解释和结论】综上,Cu2+与SO发生复分解反应速率较快,发生氧化还原反应趋势更大。
13. 写出下列反应的化学(或离子)方程式。
(1)Ce2(SO4)3在空气中高温焙烧可得到CeO2和SO3,其化学方程式为________________________________________________________________________。
(2)在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,同时生成NO。写出该反应的化学方程式:____________________。
(3)向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。制备K2FeO4的化学方程式为____________________。
(4)写出酸性条件下NaHSO3与Cr2O反应的离子方程式:____________________。
(5)写出酸性条件下葡萄糖还原MnO2生成CO2的离子方程式:____________________。
(6)写出酸性条件下,MnO与H2O2反应的离子方程式:______________。
(7)在弱酸性条件下,Fe2+与NO反应得到Fe(OH)3和N2,其反应的离子方程式为__________________________。
(8)FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。以菱锰矿(主要成分为MnCO3,还含有FeCO3、CaCO3、MgCO3、SiO2、Al2O3、Fe2O3等杂质)为原料制备二氧化锰的工艺流程如图所示。
已知:草酸钙、草酸镁不溶于水。写出“氧化”时发生反应的离子方程式:______________________________________。
(9)锰的重要用途是制造锰钢。一种以高铁锰矿(含MnO2、Fe2O3及少量FeO、CaO、K2O、Na2O)为原料生产金属锰的工艺流程如图。
“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。反应的化学方程式为__________________,
被还原的物质还有______________。
氧化还原反应
1.A
2.C 【解析】FeS2高温煅烧生成氧化铁和二氧化硫,发生氧化还原反应,A不选;Na2O2与二氧化碳或水均能发生氧化还原反应,生成氧气,可作供氧剂,B不选;食醋与水垢中碳酸钙发生复分解反应生成可溶性醋酸钙,不涉及氧化还原反应,C选;糯米酿酒过程中淀粉发生水解生成葡萄糖,葡萄糖在酒化酶作用下生成酒精,发生氧化还原反应,D不选。
3.B 【解析】新制氯水中含有Cl-,无论氯水是否变质,加入AgNO3溶液,均会产生氯化银沉淀,A不能达到目的;若FeCl2溶液变质,溶液中有Fe3+,加KSCN溶液会变红色,B能达到目的;漂白粉中含有氯化钙,无论漂白粉是否变质,加入Na2CO3溶液反应均能生成碳酸钙沉淀,C不能达到目的;Na2SO3容易变质为Na2SO4,无论Na2SO3是否变质,溶液中加入BaCl2,Na2SO3、Na2SO4都能与BaCl2反应产生白色沉淀,D不能达到目的。
4.C 【解析】NaClO2中Cl元素的化合价部分由+3降低为-1,部分由+3升高为+4,NaClO2中Cl元素既被还原又被氧化,A错误;HCl中Cl元素的化合价没有变化,不表现还原性,只表现酸性,B错误;根据NaClO2中Cl元素的化合价升降总数相等,则还原剂与氧化剂的质量之比为4∶1,C正确;氧化产物与还原产物之比也为4∶1,D错误。
5.B 【解析】该转化过程中Fe3O4作催化剂,FeO是中间产物,B错误。
6.C 【解析】②中的品红的水溶液褪色体现了SO2的漂白性,③中的酸性高锰酸钾溶液褪色体现了SO2的还原性,A错误;SO2与水反应生成的H2SO3能与品红分子结合,使其褪色,无水存在时,SO2分子不能使其褪色,B错误;SO2与水反应生成的H2SO3是弱电解质,H2SO3 H++HSO、HSO H++SO,C正确;KMnO4具有强氧化性,SO2体现的是还原性,D错误。
7.A 【解析】装置B中氯气和碘离子反应生成碘单质,使淀粉溶液变蓝色,变色后溶液不会褪色,B错误;亚硫酸钠和氯化钡也会反应生成亚硫酸钡白色沉淀,C错误;反应生成的铁离子、碘溶液均为黄色,无法证明谁先被Cl2氧化,D错误。
8.B 【解析】氯气不具有漂白性,次氯酸具有漂白性,氯气遇到水生成次氯酸,所以可以观察到左侧红色布条不褪色,右侧红色布条褪色,A错误;Cu与浓硫酸反应制取SO2需要加热,C错误;铁丝发生吸氧腐蚀导致试管中压强减小,导管中红墨水液面上升,说明铁丝发生吸氧腐蚀,D错误。
9.D 【解析】“反应1”为二氧化硫通入稀硫酸酸化的氯酸钠溶液中发生的反应,根据流程图,该反应生成了二氧化氯,则同时还有硫酸钠和水生成,则母液的主要成分为硫酸钠,A正确;“反应2”发生反应为H2O2+2ClO2+2NaOH===2NaClO2+2H2O+O2,则反应中氧化剂ClO2与还原剂H2O2的物质的量之比为2∶1,B正确;由题给信息可知,温度过高,亚氯酸钠受热易分解,则采用减压蒸发可以降低蒸发时的温度,防止亚氯酸钠分解,提高产品产率,C正确;由得失电子数目守恒可知,相同质量二氧化氯与氯气的消毒能力的比值为≈2.63,则相同质量二氧化氯的消毒能力是氯气的 2.63倍,D错误。
10.C 【解析】S2O中含有1个过氧键(—O—O—),结构式为,单键均为σ键,双键中有1个σ键,1个π键,因此1 mol过二硫酸钠(Na2S2O8)中含有σ键数9NA,A正确;氧化除锰后的溶液中存在的离子为Na+、Zn2+、Fe3+、SO,B正确;溶液中Fe3+能与锌反应生成Fe2+和Zn2+,所以调节溶液pH时试剂X不能选用Zn,C错误;氧化除锰工序用 Na2S2O8把Fe2+、Mn2+氧化为Fe3+、MnO2,根据得失电子守恒和原子守恒可知,除锰发生反应的离子方程式是Mn2++S2O+2H2O===MnO2↓+2SO+4H+,D正确。
11.B 【解析】“溶浸”过程H2O2可氧化Pb,也可还原PbO2,使其转化为PbSO4,B错误。
12.(1)溶液中生成蓝色沉淀,并伴有刺激性气味气体生成 (2)2Cu2++SO+H2O+2Cl-===2CuCl↓+SO+2H+
(3)①4CuCl+O2+16NH3·H2O===4[Cu(NH3)4]2++4Cl-+4OH-+14H2O ②HNO3、AgNO3 (4)防止沉淀长时间与空气接触而被氧化 (5)能。实验中生成白色沉淀CuI,说明橙黄色沉淀中含有铜离子被碘离子还原;溶液无色,加入淀粉后无明显现象,说明橙黄色沉淀中含有亚硫酸根离子将最初生成的碘单质还原为碘离子 (6)①0.2 mol/L CuSO4溶液 ②V1>V2
【解析】(3)②氯离子和银离子生成不溶于酸的氯化银沉淀,故为了证明深蓝色溶液中含有Cl-,进一步实验所需的试剂为稀硝酸和硝酸银溶液。(4)一价铜容易被空气中氧气氧化为二价铜,故离心分离的目的是加快过滤速率,防止沉淀长时间与空气接触而被氧化。(6)①橙黄色沉淀转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性,则试剂b应该为不含氯离子的同浓度铜离子的溶液,故表中X为0.2 mol/L CuSO4溶液。②装置中物质氧化性与还原性强弱差异越大,电压越大,则能证实实验结论的实验现象为电压V1更大,故为V1>V2。
13.(1)2Ce2(SO4)3+O24CeO2+6SO3
(2)C6H12O6+6HNO33H2C2O4+6NO↑+6H2O
(3)3KClO+10KOH+2Fe(NO3)3===2K2FeO4↓+3KCl+6KNO3+5H2O
(4)3HSO+Cr2O+5H+===2Cr3++3SO+4H2O
(5)C6H12O6+12MnO2+24H+===12Mn2++6CO2↑+18H2O
(6)2MnO+5H2O2+6H+===2Mn2++5O2↑+8H2O
(7)10Fe2++2NO+24H2O===10Fe(OH)3↓+N2↑+18H+
(8)MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O
(9)MnO2+CMnO+CO↑ Fe2O3、FeO
微主题热练4 离子反应
1.C 【解析】漂白粉投入水中,次氯酸根离子水解:ClO-+H2O HClO+OH-,A错误;电路板刻蚀废液中含大量氯化亚铁,Cl2+2Fe2+===2Cl-+2Fe3+,B错误;浓盐酸和MnO2共热制Cl2:4H++2Cl-+MnO2Cl2↑+2H2O+Mn2+,D错误。
2.D 【解析】CuSO4溶液中滴加稀氨水离子方程式为Cu2++2NH3·H2O===Cu(OH)2↓+2NH,A错误;FeCl3溶液刻蚀电路铜板离子方程式为2Fe3++Cu===2Fe2++Cu2+,B错误;SiO2溶于NaOH溶液离子方程式为SiO2+2OH-===SiO+H2O,C错误。
3.B 【解析】HBr是强酸,在离子方程式中要写离子,B错误。
4.A 【解析】NaHS溶液中含硫微粒主要以HS-存在,正确的离子方程式为HS-+Hg2+===HgS↓+H+,A错误。
5.B 【解析】足量二氧化碳通入NaClO溶液生成的是HCO,离子方程式为CO2+H2O+ClO-===HClO+HCO,A错误;生成的CaSO4微溶于水不能拆,离子方程式为Ca2++ClO-+SO2+2OH-===Cl-+CaSO4↓+H2O,C错误;强碱性溶液不生成Cr2O,离子方程式为2Cr3++3ClO-+10OH-===2CrO+3Cl-+5H2O,D错误。
6.B 【解析】碱性亚硫酸钠溶液处理纸浆中的残氯,反应的离子方程式为2OH-+SO+Cl2===SO+2Cl-+H2O,B错误。
7.C 【解析】硝酸具有强氧化性,向稀硝酸中滴加Na2SO3溶液,会发生氧化还原反应:3SO+2H++2NO===2NO↑+3SO+H2O,A错误;醋酸是弱酸,离子方程式中不能拆:IO+5I-+6CH3COOH===3I2+3H2O+6CH3COO-,B错误;用碳酸氢钠溶液检验水杨酸中的羧基,羧基和碳酸氢钠反应,而酚羟基不与碳酸氢钠反应,C正确;向NaAlO2溶液中通入过量CO2,AlO+CO2+2H2O===Al(OH)3↓+HCO,D错误。
8.D 【解析】氧化亚铁溶于稀硝酸的离子方程式为3FeO+10H++NO===3Fe3++NO↑+5H2O,A错误;铁溶于盐酸:Fe+2H+===Fe2++H2↑,B错误;醋酸是弱酸,离子方程式中不能拆开,Fe2O3+6CH3COOH===2Fe3++6CH3COO-+3H2O,C错误。
9.C 【解析】钠投入氯化铜溶液中,首先钠与水反应生成氢氧化钠和氢气,氢氧化钠再和氯化铜反应生成氢氧化铜沉淀和氯化钠,A错误;氯气和水反应生成盐酸和次氯酸,盐酸能拆成离子形式,但次氯酸不能拆,B错误;硫酸溶液中加入氢氧化钡:Ba2++2OH-+2H++SO===BaSO4↓+2H2O,D错误。
10.C 【解析】能使甲基橙变为黄色的溶液可能呈碱性,Fe3+、OH-之间反应生成氢氧化铁沉淀,在碱性溶液中不能大量共存,A错误;lg =10的溶液呈酸性,H+、CH3COO-之间反应生成醋酸,不能大量共存,B错误;NH、K+、I-、Br-、Al3+、K+、SO之间不反应,在明矾溶液中能够大量共存,C正确;加入铝粉会产生H2的溶液呈酸性或强碱性,Cu2+、Mg2+都与OH-反应,H+与ClO-发生反应,不能大量共存,D错误。
11.B 【解析】Ba2+、OH-、HCO之间反应生成碳酸钡沉淀,在小苏打溶液中不能大量共存,A错误;K+、SO、Na+、NO之间不反应,在氨水中也不反应,能够大量共存,B正确;含有MnO的溶液为紫色,且H+、I-、MnO之间发生氧化还原反应,不能大量共存,C错误;新制的氯水能够氧化S2-,不能大量共存,D错误。
12.A 【解析】Fe3+和ClO-可发生双水解反应,不能大量共存,B不符合题意;亚铁离子和[Fe(CN)6]3-反应生成蓝色沉淀,不能共存,C不符合题意;氨气的水溶液显碱性,能和银离子反应,不能共存,D不符合题意。
13.B 【解析】Cu2+呈蓝色,不符合无色条件,A错误;pH=1的溶液呈酸性,这几种离子之间不反应且都不与H+反应,能大量共存,B正确;能使酚酞试液变红色的溶液呈碱性,OH-与Fe3+、Al3+反应而不能大量共存,且Fe3+、I-发生氧化还原反应生成Fe2+和I2而不能大量共存,C错误;水电离的c(H+)=1×10-11 mol/L的溶液中,水的电离被抑制,溶液呈强酸性或强碱性,HCO与H+反应生成CO2和H2O而不能大量共存,HCO与OH-反应生成CO和H2O而不能大量共存,D错误。
14.D 【解析】I-与ClO-发生氧化还原反应,不能大量共存,A不选;饱和氯水含有氯气、HClO,均具有强氧化性,能够氧化SO,不能大量共存,B不选;加入铝粉能产生氢气的溶液,为非氧化性酸或强碱性溶液,酸性环境下,NO具有强的氧化性,与Fe2+不共存,且H+与CH3COO-不能大量共存,碱性环境下,OH-与Fe2+反应,不能大量共存,C不选;c(H+)=1×10-14 mol/L的溶液中,含有大量OH-,OH-、AlO、Na+、SO、CO相互不反应,可以大量共存,D选。
15.D 【解析】未说明是标准状况,无法利用22.4 L/mol进行计算,A错误;pH=1.0的溶液中含有大量H+,酸性条件下硝酸根离子具有强氧化性,会与亚硫酸氢根离子发生氧化还原反应,B错误;过量SO2通入NaClO溶液中:SO2+ClO-+H2O===SO+Cl-+2H+,C错误
氧化还原反应
1. (2023·武汉4月模拟)生活中处处有化学。下列过程不涉及氧化还原反应的是( )
A. 海水晒盐 B. 牛奶变质
C. 铁器生锈 D. 酿制食醋
2. (2023·汕头一模)化学品在生活、生产中应用广泛。下列物质的应用与氧化还原反应无关的是( )
A. 工业上用硫铁矿(FeS2)为原料生产发烟硫酸
B. 用Na2O2作潜水器的供氧剂
C. 用食醋可除去暖水瓶中的水垢
D. 用优质糯米为原料酿制白酒
3. (2023·惠州一模)为检验下列久置于空气中的物质是否变质,所选检验试剂(括号内)能达到实验目的的是( )
A. 新制氯水(AgNO3溶液) B. FeCl2溶液(KSCN溶液)
C. 漂白粉(Na2CO3溶液) D. Na2SO3溶液(BaCl2溶液)
4. (2023·河南重点中学联考)关于反应5NaClO2+4HCl===4ClO2+5NaCl+2H2O。下列说法正确的是 ( )
A. NaClO2中Cl元素仅被还原
B. 该反应中,HCl体现了酸性和还原性
C. 还原剂与氧化剂的质量之比为4∶1
D. 氧化产物与还原产物的物质的量之比为4∶5
5. (2023·惠州一模)关于下列转化过程分析不正确的是 ( )
A. Fe3O4中Fe元素的化合价为+2、+3
B. 该转化过程中FeO和Fe3O4均作催化剂
C. 过程Ⅱ的化学方程式为
3FeO+H2OFe3O4+H2↑
D. 该过程的总反应为2H2O===O2↑+2H2↑
6. (2023·茂名一模)某兴趣小组利用下图装置探究SO2性质,观察到①中溶液不褪色,②③中溶液均褪色。下列判断正确的是( )
A. ②③均体现SO2的漂白性
B. SO2与品红分子直接反应使其褪色
C. ②中存在SO、HSO
D. ③中c(SO)增大,说明SO2具有氧化性
7. (2023·深圳市光明区高中)漂白粉与硫酸溶液反应可制取氯气,某实验小组设计如图实验装置制取氯气并验证其性质。下列叙述正确的是( )
A. 装置A中反应的化学方程式为Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O
B. 装置B中溶液先变蓝色后褪色,其原因是淀粉被Cl2氧化
C. 取装置C中的溶液,滴加BaCl2溶液产生白色沉淀,可证明Na2SO3已被氧化
D. 装置D溶液变黄色,证明还原性:I->Fe2+
8. (2023·安徽淮南一模)下面甲、乙、丙、丁四个实验,实验现象和结论均正确的是( )
甲 乙
丙 丁
A. 装置甲中红布条均褪色,说明氯气具有漂白性
B. 装置乙中两试管中分别滴入酚酞,碳酸钠溶液呈红色,碳酸氢钠溶液呈浅红色,说明碳酸钠的水解程度大于碳酸氢钠
C. 装置丙用Cu与浓硫酸反应制取SO2,紫色石蕊、品红、酸性高锰酸钾均褪色,说明SO2具有酸性、漂白性和还原性
D. 装置丁中导管红墨水下降,说明铁丝发生吸氧腐蚀
9. (2023·湛江一模)化学工业为疫情防控提供了强有力的物质支撑。亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如下图所示。下列说法不正确的是( )
A. “母液”中主要成分是Na2SO4
B. “反应2”中氧化剂与还原剂物质的量之比为2∶1
C. “减压蒸发”可以降低蒸发时的温度,提高产品产率
D. 以生成Cl-时转移电子数目来衡量,相同质量ClO2的消毒能力是Cl2的2.5倍
10. (2023·黄山一模)以含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2 的实验流程如下。设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A. 1 mol过二硫酸钠(Na2S2O8)中含有σ键数目为9NA
B. 氧化除锰后的溶液中一定存在:Na+、Zn2+、Fe3+、SO
C. 调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质
D. 氧化除锰过程中生成MnO2的离子方程式:Mn2++S2O+2H2O===MnO2↓+2SO+4H+
11. (2023·厦门二检)从废铅膏(主要成分为PbSO4、PbO2、PbO和Pb,含少量Ba、Fe等元素)中获取高纯PbO的工艺流程如图所示。下列说法不正确的是( )
A. “煅烧”过程利用Fe2(SO4)3沸点低进行分离提纯
B. “溶浸”过程H2O2主要用于氧化Pb
C. “溶铅”过程的离子方程式为
PbSO4+2CH3COO-===(CH3COO)2Pb+SO
D. “沉铅”过程的化学方程式为
(CH3COO)2Pb+H2O+CO2===PbCO3↓+2CH3COOH
12. (2023·厦门二检)某小组探究CuCl2溶液和Na2SO3溶液的反应物,开展如下活动。
【理论预测】
预测 反应的离子方程式 实验现象
1 Cu2++SO===CuSO3↓ 生成绿色沉淀
2 Cu2++SO+H2O===Cu(OH)2↓+SO2↑ ________________________________________________________________________
3 2Cu2++2SO+H2O===Cu2SO3↓+SO+2H+ 生成红色沉淀
4 ________________________________________________________________________ 生成白色沉淀(CuCl)
(1)预测2中的实验现象为_________________________________________ _______________________________。
(2)预测4中反应的离子方程式为____________________________________ _______________________________________。
【实验探究】
实验1 1 mL 0.2 mol/L Na2SO3溶液 立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1 min沉淀全部变为白色
2 mL 0.2 mol/L CuCl2溶液
(3)为证明实验1中白色沉淀为CuCl,设计实验如下。
①已知[Cu(NH3)2]+在水中呈无色。实验2总反应的离子方程式为______________________。
②为证明深蓝色溶液中含有Cl-,进一步实验所需的试剂为________________(填化学式)。
【进一步探究】查阅资料获知橙黄色沉淀可能为xCuSO4·yCu2SO3·zH2O。在实验1获得橙黄色沉淀后,立即离心分离并洗涤。为探究其组成进行如下实验。
(4)离心分离的目的是加快过滤速率,防止__________________________。
(5)已知2Cu2++4I-===2CuI↓+I2。实验3能否证明橙黄色沉淀中含有Cu2+和SO,结合实验现象做出判断并说明理由:_______________________ ___________________。
(6)橙黄色沉淀转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性,进行如下实验(已知装置中物质氧化性与还原性强弱差异越大,电压越大)。
实验4
装置 试剂a 试剂b 电压表读数
0.2 mol/L Na2SO3 溶液 0.2 mol/L CuCl2 溶液 V1
0.2 mol/L Na2SO3 溶液 X V2
①表中X为________________。
②能证实实验结论的实验现象为________________________________________________________________________
【解释和结论】综上,Cu2+与SO发生复分解反应速率较快,发生氧化还原反应趋势更大。
13. 写出下列反应的化学(或离子)方程式。
(1)Ce2(SO4)3在空气中高温焙烧可得到CeO2和SO3,其化学方程式为________________________________________________________________________。
(2)在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,同时生成NO。写出该反应的化学方程式:____________________。
(3)向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。制备K2FeO4的化学方程式为____________________。
(4)写出酸性条件下NaHSO3与Cr2O反应的离子方程式:____________________。
(5)写出酸性条件下葡萄糖还原MnO2生成CO2的离子方程式:____________________。
(6)写出酸性条件下,MnO与H2O2反应的离子方程式:______________。
(7)在弱酸性条件下,Fe2+与NO反应得到Fe(OH)3和N2,其反应的离子方程式为__________________________。
(8)FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。以菱锰矿(主要成分为MnCO3,还含有FeCO3、CaCO3、MgCO3、SiO2、Al2O3、Fe2O3等杂质)为原料制备二氧化锰的工艺流程如图所示。
已知:草酸钙、草酸镁不溶于水。写出“氧化”时发生反应的离子方程式:______________________________________。
(9)锰的重要用途是制造锰钢。一种以高铁锰矿(含MnO2、Fe2O3及少量FeO、CaO、K2O、Na2O)为原料生产金属锰的工艺流程如图。
“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。反应的化学方程式为__________________,
被还原的物质还有______________。
氧化还原反应
1.A
2.C 【解析】FeS2高温煅烧生成氧化铁和二氧化硫,发生氧化还原反应,A不选;Na2O2与二氧化碳或水均能发生氧化还原反应,生成氧气,可作供氧剂,B不选;食醋与水垢中碳酸钙发生复分解反应生成可溶性醋酸钙,不涉及氧化还原反应,C选;糯米酿酒过程中淀粉发生水解生成葡萄糖,葡萄糖在酒化酶作用下生成酒精,发生氧化还原反应,D不选。
3.B 【解析】新制氯水中含有Cl-,无论氯水是否变质,加入AgNO3溶液,均会产生氯化银沉淀,A不能达到目的;若FeCl2溶液变质,溶液中有Fe3+,加KSCN溶液会变红色,B能达到目的;漂白粉中含有氯化钙,无论漂白粉是否变质,加入Na2CO3溶液反应均能生成碳酸钙沉淀,C不能达到目的;Na2SO3容易变质为Na2SO4,无论Na2SO3是否变质,溶液中加入BaCl2,Na2SO3、Na2SO4都能与BaCl2反应产生白色沉淀,D不能达到目的。
4.C 【解析】NaClO2中Cl元素的化合价部分由+3降低为-1,部分由+3升高为+4,NaClO2中Cl元素既被还原又被氧化,A错误;HCl中Cl元素的化合价没有变化,不表现还原性,只表现酸性,B错误;根据NaClO2中Cl元素的化合价升降总数相等,则还原剂与氧化剂的质量之比为4∶1,C正确;氧化产物与还原产物之比也为4∶1,D错误。
5.B 【解析】该转化过程中Fe3O4作催化剂,FeO是中间产物,B错误。
6.C 【解析】②中的品红的水溶液褪色体现了SO2的漂白性,③中的酸性高锰酸钾溶液褪色体现了SO2的还原性,A错误;SO2与水反应生成的H2SO3能与品红分子结合,使其褪色,无水存在时,SO2分子不能使其褪色,B错误;SO2与水反应生成的H2SO3是弱电解质,H2SO3 H++HSO、HSO H++SO,C正确;KMnO4具有强氧化性,SO2体现的是还原性,D错误。
7.A 【解析】装置B中氯气和碘离子反应生成碘单质,使淀粉溶液变蓝色,变色后溶液不会褪色,B错误;亚硫酸钠和氯化钡也会反应生成亚硫酸钡白色沉淀,C错误;反应生成的铁离子、碘溶液均为黄色,无法证明谁先被Cl2氧化,D错误。
8.B 【解析】氯气不具有漂白性,次氯酸具有漂白性,氯气遇到水生成次氯酸,所以可以观察到左侧红色布条不褪色,右侧红色布条褪色,A错误;Cu与浓硫酸反应制取SO2需要加热,C错误;铁丝发生吸氧腐蚀导致试管中压强减小,导管中红墨水液面上升,说明铁丝发生吸氧腐蚀,D错误。
9.D 【解析】“反应1”为二氧化硫通入稀硫酸酸化的氯酸钠溶液中发生的反应,根据流程图,该反应生成了二氧化氯,则同时还有硫酸钠和水生成,则母液的主要成分为硫酸钠,A正确;“反应2”发生反应为H2O2+2ClO2+2NaOH===2NaClO2+2H2O+O2,则反应中氧化剂ClO2与还原剂H2O2的物质的量之比为2∶1,B正确;由题给信息可知,温度过高,亚氯酸钠受热易分解,则采用减压蒸发可以降低蒸发时的温度,防止亚氯酸钠分解,提高产品产率,C正确;由得失电子数目守恒可知,相同质量二氧化氯与氯气的消毒能力的比值为≈2.63,则相同质量二氧化氯的消毒能力是氯气的 2.63倍,D错误。
10.C 【解析】S2O中含有1个过氧键(—O—O—),结构式为,单键均为σ键,双键中有1个σ键,1个π键,因此1 mol过二硫酸钠(Na2S2O8)中含有σ键数9NA,A正确;氧化除锰后的溶液中存在的离子为Na+、Zn2+、Fe3+、SO,B正确;溶液中Fe3+能与锌反应生成Fe2+和Zn2+,所以调节溶液pH时试剂X不能选用Zn,C错误;氧化除锰工序用 Na2S2O8把Fe2+、Mn2+氧化为Fe3+、MnO2,根据得失电子守恒和原子守恒可知,除锰发生反应的离子方程式是Mn2++S2O+2H2O===MnO2↓+2SO+4H+,D正确。
11.B 【解析】“溶浸”过程H2O2可氧化Pb,也可还原PbO2,使其转化为PbSO4,B错误。
12.(1)溶液中生成蓝色沉淀,并伴有刺激性气味气体生成 (2)2Cu2++SO+H2O+2Cl-===2CuCl↓+SO+2H+
(3)①4CuCl+O2+16NH3·H2O===4[Cu(NH3)4]2++4Cl-+4OH-+14H2O ②HNO3、AgNO3 (4)防止沉淀长时间与空气接触而被氧化 (5)能。实验中生成白色沉淀CuI,说明橙黄色沉淀中含有铜离子被碘离子还原;溶液无色,加入淀粉后无明显现象,说明橙黄色沉淀中含有亚硫酸根离子将最初生成的碘单质还原为碘离子 (6)①0.2 mol/L CuSO4溶液 ②V1>V2
【解析】(3)②氯离子和银离子生成不溶于酸的氯化银沉淀,故为了证明深蓝色溶液中含有Cl-,进一步实验所需的试剂为稀硝酸和硝酸银溶液。(4)一价铜容易被空气中氧气氧化为二价铜,故离心分离的目的是加快过滤速率,防止沉淀长时间与空气接触而被氧化。(6)①橙黄色沉淀转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性,则试剂b应该为不含氯离子的同浓度铜离子的溶液,故表中X为0.2 mol/L CuSO4溶液。②装置中物质氧化性与还原性强弱差异越大,电压越大,则能证实实验结论的实验现象为电压V1更大,故为V1>V2。
13.(1)2Ce2(SO4)3+O24CeO2+6SO3
(2)C6H12O6+6HNO33H2C2O4+6NO↑+6H2O
(3)3KClO+10KOH+2Fe(NO3)3===2K2FeO4↓+3KCl+6KNO3+5H2O
(4)3HSO+Cr2O+5H+===2Cr3++3SO+4H2O
(5)C6H12O6+12MnO2+24H+===12Mn2++6CO2↑+18H2O
(6)2MnO+5H2O2+6H+===2Mn2++5O2↑+8H2O
(7)10Fe2++2NO+24H2O===10Fe(OH)3↓+N2↑+18H+
(8)MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O
(9)MnO2+CMnO+CO↑ Fe2O3、FeO
微主题热练4 离子反应
1.C 【解析】漂白粉投入水中,次氯酸根离子水解:ClO-+H2O HClO+OH-,A错误;电路板刻蚀废液中含大量氯化亚铁,Cl2+2Fe2+===2Cl-+2Fe3+,B错误;浓盐酸和MnO2共热制Cl2:4H++2Cl-+MnO2Cl2↑+2H2O+Mn2+,D错误。
2.D 【解析】CuSO4溶液中滴加稀氨水离子方程式为Cu2++2NH3·H2O===Cu(OH)2↓+2NH,A错误;FeCl3溶液刻蚀电路铜板离子方程式为2Fe3++Cu===2Fe2++Cu2+,B错误;SiO2溶于NaOH溶液离子方程式为SiO2+2OH-===SiO+H2O,C错误。
3.B 【解析】HBr是强酸,在离子方程式中要写离子,B错误。
4.A 【解析】NaHS溶液中含硫微粒主要以HS-存在,正确的离子方程式为HS-+Hg2+===HgS↓+H+,A错误。
5.B 【解析】足量二氧化碳通入NaClO溶液生成的是HCO,离子方程式为CO2+H2O+ClO-===HClO+HCO,A错误;生成的CaSO4微溶于水不能拆,离子方程式为Ca2++ClO-+SO2+2OH-===Cl-+CaSO4↓+H2O,C错误;强碱性溶液不生成Cr2O,离子方程式为2Cr3++3ClO-+10OH-===2CrO+3Cl-+5H2O,D错误。
6.B 【解析】碱性亚硫酸钠溶液处理纸浆中的残氯,反应的离子方程式为2OH-+SO+Cl2===SO+2Cl-+H2O,B错误。
7.C 【解析】硝酸具有强氧化性,向稀硝酸中滴加Na2SO3溶液,会发生氧化还原反应:3SO+2H++2NO===2NO↑+3SO+H2O,A错误;醋酸是弱酸,离子方程式中不能拆:IO+5I-+6CH3COOH===3I2+3H2O+6CH3COO-,B错误;用碳酸氢钠溶液检验水杨酸中的羧基,羧基和碳酸氢钠反应,而酚羟基不与碳酸氢钠反应,C正确;向NaAlO2溶液中通入过量CO2,AlO+CO2+2H2O===Al(OH)3↓+HCO,D错误。
8.D 【解析】氧化亚铁溶于稀硝酸的离子方程式为3FeO+10H++NO===3Fe3++NO↑+5H2O,A错误;铁溶于盐酸:Fe+2H+===Fe2++H2↑,B错误;醋酸是弱酸,离子方程式中不能拆开,Fe2O3+6CH3COOH===2Fe3++6CH3COO-+3H2O,C错误。
9.C 【解析】钠投入氯化铜溶液中,首先钠与水反应生成氢氧化钠和氢气,氢氧化钠再和氯化铜反应生成氢氧化铜沉淀和氯化钠,A错误;氯气和水反应生成盐酸和次氯酸,盐酸能拆成离子形式,但次氯酸不能拆,B错误;硫酸溶液中加入氢氧化钡:Ba2++2OH-+2H++SO===BaSO4↓+2H2O,D错误。
10.C 【解析】能使甲基橙变为黄色的溶液可能呈碱性,Fe3+、OH-之间反应生成氢氧化铁沉淀,在碱性溶液中不能大量共存,A错误;lg =10的溶液呈酸性,H+、CH3COO-之间反应生成醋酸,不能大量共存,B错误;NH、K+、I-、Br-、Al3+、K+、SO之间不反应,在明矾溶液中能够大量共存,C正确;加入铝粉会产生H2的溶液呈酸性或强碱性,Cu2+、Mg2+都与OH-反应,H+与ClO-发生反应,不能大量共存,D错误。
11.B 【解析】Ba2+、OH-、HCO之间反应生成碳酸钡沉淀,在小苏打溶液中不能大量共存,A错误;K+、SO、Na+、NO之间不反应,在氨水中也不反应,能够大量共存,B正确;含有MnO的溶液为紫色,且H+、I-、MnO之间发生氧化还原反应,不能大量共存,C错误;新制的氯水能够氧化S2-,不能大量共存,D错误。
12.A 【解析】Fe3+和ClO-可发生双水解反应,不能大量共存,B不符合题意;亚铁离子和[Fe(CN)6]3-反应生成蓝色沉淀,不能共存,C不符合题意;氨气的水溶液显碱性,能和银离子反应,不能共存,D不符合题意。
13.B 【解析】Cu2+呈蓝色,不符合无色条件,A错误;pH=1的溶液呈酸性,这几种离子之间不反应且都不与H+反应,能大量共存,B正确;能使酚酞试液变红色的溶液呈碱性,OH-与Fe3+、Al3+反应而不能大量共存,且Fe3+、I-发生氧化还原反应生成Fe2+和I2而不能大量共存,C错误;水电离的c(H+)=1×10-11 mol/L的溶液中,水的电离被抑制,溶液呈强酸性或强碱性,HCO与H+反应生成CO2和H2O而不能大量共存,HCO与OH-反应生成CO和H2O而不能大量共存,D错误。
14.D 【解析】I-与ClO-发生氧化还原反应,不能大量共存,A不选;饱和氯水含有氯气、HClO,均具有强氧化性,能够氧化SO,不能大量共存,B不选;加入铝粉能产生氢气的溶液,为非氧化性酸或强碱性溶液,酸性环境下,NO具有强的氧化性,与Fe2+不共存,且H+与CH3COO-不能大量共存,碱性环境下,OH-与Fe2+反应,不能大量共存,C不选;c(H+)=1×10-14 mol/L的溶液中,含有大量OH-,OH-、AlO、Na+、SO、CO相互不反应,可以大量共存,D选。
15.D 【解析】未说明是标准状况,无法利用22.4 L/mol进行计算,A错误;pH=1.0的溶液中含有大量H+,酸性条件下硝酸根离子具有强氧化性,会与亚硫酸氢根离子发生氧化还原反应,B错误;过量SO2通入NaClO溶液中:SO2+ClO-+H2O===SO+Cl-+2H+,C错误
同课章节目录
