化学人教版(2019)必修第一册4.3.1离子键 课件(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.1离子键 课件(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 20:46:21 | ||
图片预览





文档简介
(共19张PPT)
第四章 物质结构 元素周期律
第三节 化学键
课时1 离子键
1.通过氯化钠的形成过程,认识离子键的形成,促进“宏观辨识与微
观探析”化学核心素养的发展。
2.了解离子键和离子化合物的概念,会判断离子化合物。会用电子式表示常见离子化合物的形成过程。
核心素养学习目标
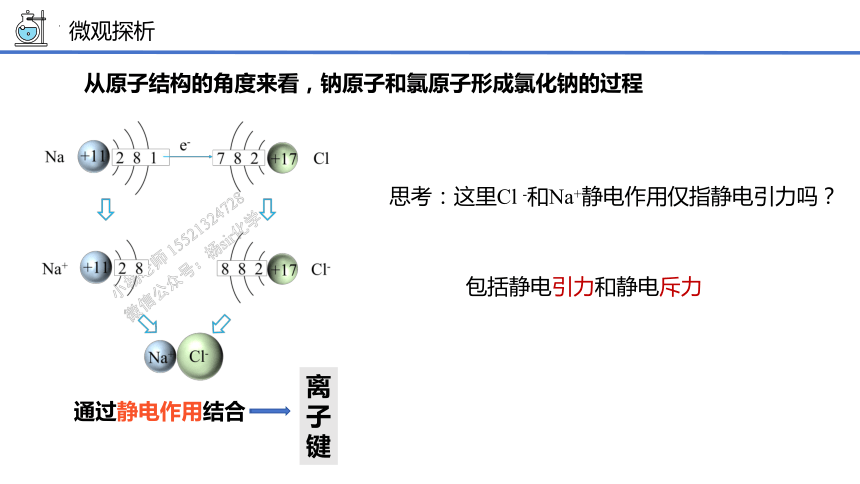
从原子结构(微观)的角度来认识是氯化钠怎样形成的?
118种元素组成的物质已超过1亿种,什么作用使这些元素的原子结合在一起的呢?
从原子结构的角度来看,钠原子和氯原子形成氯化钠的过程
离子键
通过静电作用结合
微观探析
思考:这里Cl -和Na+静电作用仅指静电引力吗?
包括静电引力和静电斥力
1. 离子键
(1)定义:带相反电荷离子之间的相互作用
Cl-
(2)成键要素
成键微粒:阳离子和阴离子
成键本质:静电作用(包括静电引力和静电斥力)
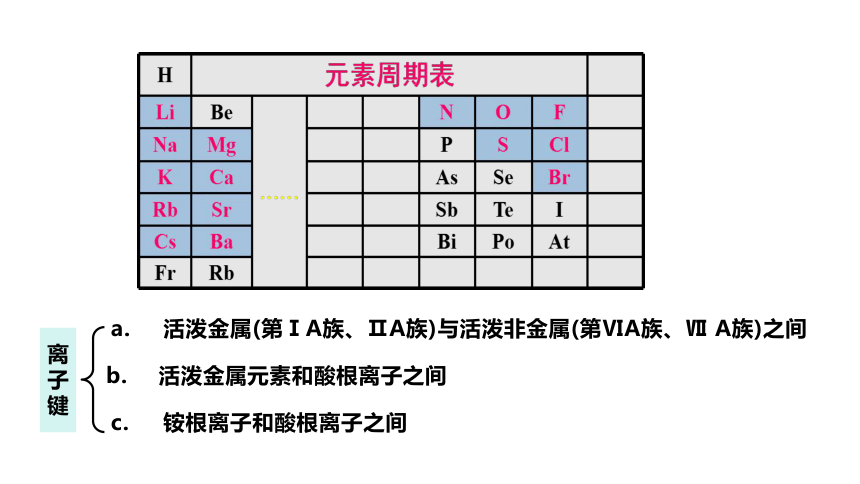
成键元素:一般是活泼金属(第ⅠA族、ⅡA族)与活泼非金属(第ⅥA族、Ⅶ A族)之间
注意:1)非金属之间也能形成离子键,如NH4Cl中与Cl-间的就是离子键。
2)并不是所有的金属与非金属化合都能形成离子键,如AlCl3中不存在离子键。
活泼金属(第ⅠA族、ⅡA族)与活泼非金属(第ⅥA族、Ⅶ A族)之间
活泼金属元素和酸根离子之间
铵根离子和酸根离子之间
离子键
2.离子化合物
(1)定义:由离子键构成的化合物。
概念学习
(2) 常见类型:
① 强碱,如:NaOH、Mg(OH)2等
② 活泼金属氧化物和金属氢化物,如:Na2O、MgO、NaH等
③ 绝大多数盐,如:NaCl、MgCl2、Na2CO3、MgSO4 、NH4Cl、NH4NO3等
(3) 性质:① 熔、沸点较高,硬度较大;
② 通常呈固态,固态不导电,熔融态能导电,溶于水后部分导电。
【例1】下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
D
【例2】下列哪些物质是离子化合物?哪些存在离子键?
Na2O MgCl2 NH4Cl HCl
Na2O2 NaOH KNO3 SO2
离子化合物一定含有离子键,含离子键的化合物一定是离子化合物。
判断关键:含活泼金属元素 或 NH4+
1.判断正误
(1)阴、阳离子之间的静电吸引形成离子键。
(2)金属元素与非金属元素形成的化合物一定为离子化合物。
(3)离子化合物中一定含有金属元素。
(4)所有氧化物均为离子化合物。
(5)第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物。
(6)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电。
×
×
×
×
×
×
2.下图形象地表示了氯化钠的形成过程。下列叙述不正确的是
A.钠原子易失去1个电子,氯原子易得到1个电子
B.钠离子与钠原子具有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
√
微观表征
3.电子式
(1)定义:在元素符号周围用“·”或“×”来表示原子的__________________的式子叫做电子式。
最外层电子(价电子)
(2)书写
a.原子的电子式(一般将原子的最外层电子写在元素符号的上、下、左、右四个位置上)
Na ·
· Mg ·
·Al·
·
·P·
··
·
Cl ·
··
··
··
·S·
··
··
Ar
··
··
··
··
·Si·
·
·
b.离子的电子式:
简单阳离子:直接用符号表示。
简单阴离子:
多核离子:
OH-、NH4+的电子式
O
-
H
画上最外层电子,而且还要用“[ ]”括上,并在右上角标出所带电荷数。
如:Na+、Li+、Mg2+、Al3+等
H
N
H
H
H
[ ]
+
3、离子化合物的电子式:
CaO
K2S
CaCl2
阴、阳离子必须是间隔的
2.用电子式表示离子化合物的形成过程
【思考讨论】有的同学用电子式表示化合物Na2S的形成过程为
2Na+S == ,这样书写是否正确并说明原因?
不正确。应书写为 ,且形成过程不用“===”,应用“ ”。
1.用电子式表示下列离子化合物的形成过程:
BaCl2:________________________________________;
MgS:________________________;
K2O:__________________________。
练习
2.下列化学用语正确的是
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
√
3.下列表示电子式的形成过程正确的是
A.
B.
C.
D.
【答案】C
4.(2020下·甘肃武威·高一校考期末)下列电子式中,正确的是( )
D.
A.
B.
C.
【答案】D
第四章 物质结构 元素周期律
第三节 化学键
课时1 离子键
1.通过氯化钠的形成过程,认识离子键的形成,促进“宏观辨识与微
观探析”化学核心素养的发展。
2.了解离子键和离子化合物的概念,会判断离子化合物。会用电子式表示常见离子化合物的形成过程。
核心素养学习目标
从原子结构(微观)的角度来认识是氯化钠怎样形成的?
118种元素组成的物质已超过1亿种,什么作用使这些元素的原子结合在一起的呢?
从原子结构的角度来看,钠原子和氯原子形成氯化钠的过程
离子键
通过静电作用结合
微观探析
思考:这里Cl -和Na+静电作用仅指静电引力吗?
包括静电引力和静电斥力
1. 离子键
(1)定义:带相反电荷离子之间的相互作用
Cl-
(2)成键要素
成键微粒:阳离子和阴离子
成键本质:静电作用(包括静电引力和静电斥力)
成键元素:一般是活泼金属(第ⅠA族、ⅡA族)与活泼非金属(第ⅥA族、Ⅶ A族)之间
注意:1)非金属之间也能形成离子键,如NH4Cl中与Cl-间的就是离子键。
2)并不是所有的金属与非金属化合都能形成离子键,如AlCl3中不存在离子键。
活泼金属(第ⅠA族、ⅡA族)与活泼非金属(第ⅥA族、Ⅶ A族)之间
活泼金属元素和酸根离子之间
铵根离子和酸根离子之间
离子键
2.离子化合物
(1)定义:由离子键构成的化合物。
概念学习
(2) 常见类型:
① 强碱,如:NaOH、Mg(OH)2等
② 活泼金属氧化物和金属氢化物,如:Na2O、MgO、NaH等
③ 绝大多数盐,如:NaCl、MgCl2、Na2CO3、MgSO4 、NH4Cl、NH4NO3等
(3) 性质:① 熔、沸点较高,硬度较大;
② 通常呈固态,固态不导电,熔融态能导电,溶于水后部分导电。
【例1】下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
D
【例2】下列哪些物质是离子化合物?哪些存在离子键?
Na2O MgCl2 NH4Cl HCl
Na2O2 NaOH KNO3 SO2
离子化合物一定含有离子键,含离子键的化合物一定是离子化合物。
判断关键:含活泼金属元素 或 NH4+
1.判断正误
(1)阴、阳离子之间的静电吸引形成离子键。
(2)金属元素与非金属元素形成的化合物一定为离子化合物。
(3)离子化合物中一定含有金属元素。
(4)所有氧化物均为离子化合物。
(5)第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物。
(6)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电。
×
×
×
×
×
×
2.下图形象地表示了氯化钠的形成过程。下列叙述不正确的是
A.钠原子易失去1个电子,氯原子易得到1个电子
B.钠离子与钠原子具有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
√
微观表征
3.电子式
(1)定义:在元素符号周围用“·”或“×”来表示原子的__________________的式子叫做电子式。
最外层电子(价电子)
(2)书写
a.原子的电子式(一般将原子的最外层电子写在元素符号的上、下、左、右四个位置上)
Na ·
· Mg ·
·Al·
·
·P·
··
·
Cl ·
··
··
··
·S·
··
··
Ar
··
··
··
··
·Si·
·
·
b.离子的电子式:
简单阳离子:直接用符号表示。
简单阴离子:
多核离子:
OH-、NH4+的电子式
O
-
H
画上最外层电子,而且还要用“[ ]”括上,并在右上角标出所带电荷数。
如:Na+、Li+、Mg2+、Al3+等
H
N
H
H
H
[ ]
+
3、离子化合物的电子式:
CaO
K2S
CaCl2
阴、阳离子必须是间隔的
2.用电子式表示离子化合物的形成过程
【思考讨论】有的同学用电子式表示化合物Na2S的形成过程为
2Na+S == ,这样书写是否正确并说明原因?
不正确。应书写为 ,且形成过程不用“===”,应用“ ”。
1.用电子式表示下列离子化合物的形成过程:
BaCl2:________________________________________;
MgS:________________________;
K2O:__________________________。
练习
2.下列化学用语正确的是
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
√
3.下列表示电子式的形成过程正确的是
A.
B.
C.
D.
【答案】C
4.(2020下·甘肃武威·高一校考期末)下列电子式中,正确的是( )
D.
A.
B.
C.
【答案】D
