7.3 溶液浓稀的表示 第1课时 课件(共17张PPT内嵌视频) 2023-2024学年科粤版化学九年级下册
文档属性
| 名称 | 7.3 溶液浓稀的表示 第1课时 课件(共17张PPT内嵌视频) 2023-2024学年科粤版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 23.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 21:56:50 | ||
图片预览






文档简介
(共17张PPT)
7.3 溶液浓稀的表示
第1课时
【思考】如何才能准确知道一定量溶液中含有多少溶质呢?
溶液是浓还是稀?
学习目标
1.明确溶液浓度的含义。
2.掌握溶液浓度的一种定量表示方式——溶质质量分数。能进行溶质质量分数的简单计算。
3.理解溶解度与溶质质量分数的区别与联系。
学习目标
新知学习
一、溶液的溶度
【实验7-7】①知道有色溶液的颜色深浅与溶液的浓稀相关
新知学习
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g
1
2
3
结论 对于有色溶液来说,__________________
浅蓝
蓝色
深蓝
20
20
20
0.1
0.5
2
20.1
20.5
22
颜色越深,浓度越大
对有颜色的溶液来说,可以根据颜色的深浅区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
新知学习
1.溶质的质量分数
溶质质量
溶液质量
溶质的质量分数= ×100%
或= ×100%
溶质质量
溶质质量+溶剂质量
(1)定义:溶质的质量与溶液的质量之比。(通常以百分数表示)
(2)计算公式
新知学习
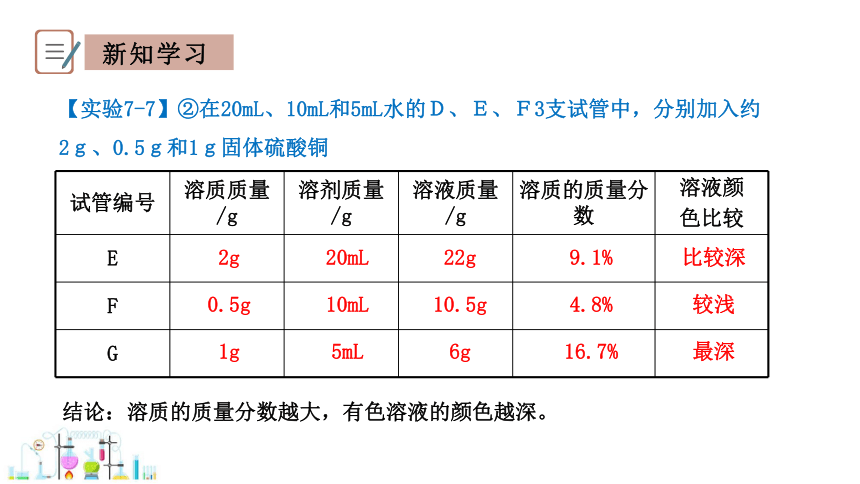
试管编号 溶质质量/g 溶剂质量/g 溶液质量/g 溶质的质量分数 溶液颜
色比较
E
F
G
9.1%
4.8%
16.7%
比较深
较浅
最深
1g
10mL
5mL
10.5g
6g
2g
0.5g
20mL
22g
【实验7-7】②在20mL、10mL和5mL水的D、E、F3支试管中,分别加入约2g、0.5g和1g固体硫酸铜
结论:溶质的质量分数越大,有色溶液的颜色越深。
新知学习
2.溶质质量分数与溶解度的区别与联系
溶解度 溶质质量分数
条件
溶剂量要求
溶液是否饱和
单位
在一定的温度下
不受外界条件的影响
100g
无要求
一定达到饱和
不一定
克(g)
是一个比值,单位为1
新知学习
溶质质量分数与溶解度的互相转化:
例:在20 C时,CuSO4的溶解度为25g,求20 C时CuSO4饱和溶液溶质的质量分数。
溶质质量
溶质质量+溶剂质量
= ×100%
溶质的质量分数
25g
100g+25g
= 100%
=20%
解:
答:20 C时溶解度为25g的CuSO4饱和溶液溶质的质量分数为20%。
一定温度下的饱和溶液中:
溶质的质量分数= ×100%
溶解度
100g+溶解度
新知学习
二、有关溶质质量分数的简单计算
1.配制一定量的某一组成的溶液,求所需溶质和溶剂的量
例:在农业生产中,常需要用质量分数为15%的氯化钠溶液来选种。现要配制80kg这种溶液,需要氯化钠和水的质量各是多少?
解:溶质质量=溶液质量×溶质的质量分数
答:需要12 kg氯化钠,68 kg的水。
=80kg×15%
=12kg
溶剂质量=溶液质量-溶质质量
=80kg-12kg
=68kg
新知学习
2.有关溶液配制的计算
计算依据:稀释前后________的质量不变。
溶质
例:配制铅蓄电池用的28%硫酸溶液460g,问需要98%的浓硫酸的体积是多少?已知98%浓硫酸的密度为1.84g/cm3。
◆浓溶液加水稀释成稀溶液
新知学习
解:设需要98%的浓硫酸的质量为x。
460g × 28%= x × 98%
x= =131.4g
则需要98%的浓硫酸的体积为: =71.4cm3
答:需要98%浓硫酸的体积是71.4cm3
460g × 28%
98%
131.4g
1.84g/cm3
新知学习
加水前溶液中溶质的质量=加水后溶液中溶质的质量
A×a% = B×b%
◆同种溶质的两种质量分数不同的溶液相混合
A×a%+B×b%= (A+B) ×c%
加水:A×a% = (A+x)×b%
蒸发水:A×a% = (A-x)×b%
◆溶液蒸发过程中也是溶质的质量不变。
蒸发前溶液中溶质的质量=蒸发后溶液中溶质的质量
◆浓溶液加水稀释成稀溶液
当堂检测
1.现有一瓶溶质质量分数为10%的食盐水,下列关于
该食盐水的说法中正确的是( )
A.m溶质∶m溶剂=1∶10
B.m溶质∶m溶液=1∶10
C.m溶质∶m溶液=1∶11
D.m溶剂∶m溶液=10∶11
B
2. 一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5 mL B.2 mL
C.3 mL D.4 mL
当堂检测
B
当堂检测
3.(1)800kg质量分数为0.5%的过氧乙酸消毒液中,过氧乙酸的质量为多少kg?
(2)要配制800kg质量分数为0.5%的过氧乙酸消毒液,需要质量分数为16%的过氧乙酸溶液的质量是多少
(1)800×0.5%=4 kg
(2)由800 ×0.5%=x ×16%
所以:x=25kg
课堂小结
一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.公式:溶质的质量分数=溶质的质量/溶液的质量×100%
二、溶质质量分数的计算
1. 有关溶质的质量分数的简单计算
2. 溶质的质量分数与溶解度的关系
一定温度下的饱和溶液中:
3. 有关溶液的稀释、浓缩和混合问题的计算
7.3 溶液浓稀的表示
第1课时
【思考】如何才能准确知道一定量溶液中含有多少溶质呢?
溶液是浓还是稀?
学习目标
1.明确溶液浓度的含义。
2.掌握溶液浓度的一种定量表示方式——溶质质量分数。能进行溶质质量分数的简单计算。
3.理解溶解度与溶质质量分数的区别与联系。
学习目标
新知学习
一、溶液的溶度
【实验7-7】①知道有色溶液的颜色深浅与溶液的浓稀相关
新知学习
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g
1
2
3
结论 对于有色溶液来说,__________________
浅蓝
蓝色
深蓝
20
20
20
0.1
0.5
2
20.1
20.5
22
颜色越深,浓度越大
对有颜色的溶液来说,可以根据颜色的深浅区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
新知学习
1.溶质的质量分数
溶质质量
溶液质量
溶质的质量分数= ×100%
或= ×100%
溶质质量
溶质质量+溶剂质量
(1)定义:溶质的质量与溶液的质量之比。(通常以百分数表示)
(2)计算公式
新知学习
试管编号 溶质质量/g 溶剂质量/g 溶液质量/g 溶质的质量分数 溶液颜
色比较
E
F
G
9.1%
4.8%
16.7%
比较深
较浅
最深
1g
10mL
5mL
10.5g
6g
2g
0.5g
20mL
22g
【实验7-7】②在20mL、10mL和5mL水的D、E、F3支试管中,分别加入约2g、0.5g和1g固体硫酸铜
结论:溶质的质量分数越大,有色溶液的颜色越深。
新知学习
2.溶质质量分数与溶解度的区别与联系
溶解度 溶质质量分数
条件
溶剂量要求
溶液是否饱和
单位
在一定的温度下
不受外界条件的影响
100g
无要求
一定达到饱和
不一定
克(g)
是一个比值,单位为1
新知学习
溶质质量分数与溶解度的互相转化:
例:在20 C时,CuSO4的溶解度为25g,求20 C时CuSO4饱和溶液溶质的质量分数。
溶质质量
溶质质量+溶剂质量
= ×100%
溶质的质量分数
25g
100g+25g
= 100%
=20%
解:
答:20 C时溶解度为25g的CuSO4饱和溶液溶质的质量分数为20%。
一定温度下的饱和溶液中:
溶质的质量分数= ×100%
溶解度
100g+溶解度
新知学习
二、有关溶质质量分数的简单计算
1.配制一定量的某一组成的溶液,求所需溶质和溶剂的量
例:在农业生产中,常需要用质量分数为15%的氯化钠溶液来选种。现要配制80kg这种溶液,需要氯化钠和水的质量各是多少?
解:溶质质量=溶液质量×溶质的质量分数
答:需要12 kg氯化钠,68 kg的水。
=80kg×15%
=12kg
溶剂质量=溶液质量-溶质质量
=80kg-12kg
=68kg
新知学习
2.有关溶液配制的计算
计算依据:稀释前后________的质量不变。
溶质
例:配制铅蓄电池用的28%硫酸溶液460g,问需要98%的浓硫酸的体积是多少?已知98%浓硫酸的密度为1.84g/cm3。
◆浓溶液加水稀释成稀溶液
新知学习
解:设需要98%的浓硫酸的质量为x。
460g × 28%= x × 98%
x= =131.4g
则需要98%的浓硫酸的体积为: =71.4cm3
答:需要98%浓硫酸的体积是71.4cm3
460g × 28%
98%
131.4g
1.84g/cm3
新知学习
加水前溶液中溶质的质量=加水后溶液中溶质的质量
A×a% = B×b%
◆同种溶质的两种质量分数不同的溶液相混合
A×a%+B×b%= (A+B) ×c%
加水:A×a% = (A+x)×b%
蒸发水:A×a% = (A-x)×b%
◆溶液蒸发过程中也是溶质的质量不变。
蒸发前溶液中溶质的质量=蒸发后溶液中溶质的质量
◆浓溶液加水稀释成稀溶液
当堂检测
1.现有一瓶溶质质量分数为10%的食盐水,下列关于
该食盐水的说法中正确的是( )
A.m溶质∶m溶剂=1∶10
B.m溶质∶m溶液=1∶10
C.m溶质∶m溶液=1∶11
D.m溶剂∶m溶液=10∶11
B
2. 一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5 mL B.2 mL
C.3 mL D.4 mL
当堂检测
B
当堂检测
3.(1)800kg质量分数为0.5%的过氧乙酸消毒液中,过氧乙酸的质量为多少kg?
(2)要配制800kg质量分数为0.5%的过氧乙酸消毒液,需要质量分数为16%的过氧乙酸溶液的质量是多少
(1)800×0.5%=4 kg
(2)由800 ×0.5%=x ×16%
所以:x=25kg
课堂小结
一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.公式:溶质的质量分数=溶质的质量/溶液的质量×100%
二、溶质质量分数的计算
1. 有关溶质的质量分数的简单计算
2. 溶质的质量分数与溶解度的关系
一定温度下的饱和溶液中:
3. 有关溶液的稀释、浓缩和混合问题的计算
