6.2 金属的化学性质 第1课时 课件 (共20张PPT内嵌视频)2023-2024学年科粤版化学九年级下册
文档属性
| 名称 | 6.2 金属的化学性质 第1课时 课件 (共20张PPT内嵌视频)2023-2024学年科粤版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 80.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 22:00:12 | ||
图片预览








文档简介
(共20张PPT)
6.2 金属的化学性质
第1课时
黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜冒充黄金进行诈活动。因为黄铜(铜、锌合金)单纯从颜色、外型上看,与黄金极为相似,所以很难区分,现请你设计一个实验方案鉴别真假黄金。
学习目标
1.了解镁、铁、铜等常见金属与氧气的反应。
2.初步认识常见金属与酸的反应 。
3.理解置换反应的概念。
学习目标
新知学习
一、金属的发现和利用
人类发现和大量冶炼几种常用金属的年代
铜(距今3000年前)
铁(距今1500年前)
铝(仅100多年前)
新知学习
金属材料的发展经历:青铜器时代 →铁器时代 →铝的利用 →各种功能材料。
铝的利用要比铜和铁晚得多,那仅仅是100多年前的事情。铝具有密度小和抗腐蚀等优良性能。现在,世界上铝的年产量已超过铜,位于铁之后,居第二位。
为什么它们的发现和利用的年代差距如此之大 这与它们的化学性质有关吗
新知学习
二、金属跟氧气的反应
镁条燃烧
铁丝燃烧
铜丝加热
新知学习
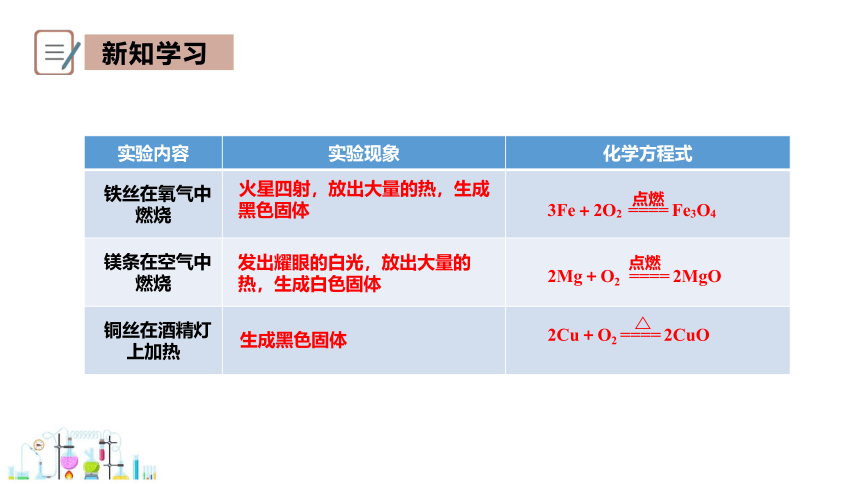
实验内容 实验现象 化学方程式
铁丝在氧气中燃烧
镁条在空气中燃烧
铜丝在酒精灯上加热
火星四射,放出大量的热,生成黑色固体
发出耀眼的白光,放出大量的热,生成白色固体
生成黑色固体
3Fe+2O2 ==== Fe3O4
点燃
2Mg+O2 ==== 2MgO
点燃
2Cu+O2 ==== 2CuO
新知学习
实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同
镁在常温下就能与氧气反应
铁、铜在常温下不能与氧气反应, 但在高温时能与氧气反应
镁的活泼性>铁的活泼性>铜的活泼性。
新知学习
1.镁条点燃之前为什么要先用砂纸打磨?铝制品在空气中为什么失去金属光泽变暗?
砂纸打磨是为了除去表面的氧化膜,
镁、铝在常温下可与空气中的氧气发生反应。
思考
常温下铝与空气中的氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化。因此,铝制品具有耐腐蚀性。
2.铝的化学性质很活泼,而铝制品却很难腐蚀,为什么?
新知学习
3.从化学角度分析“真金不怕火炼”。
金在高温下也不与氧气发生反应。
新知学习
三、金属跟酸的反应
新知学习
稀盐酸 化学方程式
镁
锌
铁
铜
大量气泡,反应最快
很多气泡,反应快
产生气泡,反应较快
没有气泡,不反应
实验现象:
Mg+2HCl = MgCl2+H2↑
Zn+2HCl = ZnCl2+H2↑
Fe+2HCl = FeCl2+H2↑
/
新知学习
为什么铝、铁能跟稀盐酸(或稀硫酸)反应产生氢气而铜却不能呢
思考:
铝、铁与稀盐酸(或稀硫酸)反应,而铜不与稀盐酸(或稀硫酸)反应,说明铝铁的金属活动性比铜强,它们能够置换算中的氢,是活泼金属。
实验结论:
1. 能与盐酸、稀硫酸反应的金属有 。
2. 比较三种金属分别与盐酸、稀硫酸反应的难易和剧烈程度,由易到难的顺序是 。
镁、铁、锌
镁、锌、铁
新知学习
判断金属活动性的方法:
1. 利用金属与氧气反应进行金属活动性的判断。相同条件下,金属与氧气反应越容易,金属的活动性就越强。
2.利用金属与酸的反应进行金属活动性的判断。相同条件下,与相同质量分数的酸反应,越活泼的金属反应越快。
小结
新知学习
观察下列化学方程式,分析这些反应有什么共同特点?(从反应物和生成物的物质类别角度分析)
单质
单质
化合物
化合物
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
四、置换反应
新知学习
上述反应中,都是一种单质与一种化合物反应,生成另一种单质与另一种化合物,我们把这类反应叫作置换反应。
表达式:A+BC ==B+AC(属于基本反应类型)
反应物和生成物都是两种物质,且都是一种单质和一种化合物
在反应前后一定有元素化合价发生改变
当堂检测
1.下列金属能在空气中燃烧的是( )
A.铜 B.银
C.镁 D.铁
C
2.下列反应属于置换反应的是( )
A.
D.
B.
C.
C
当堂检测
3. “药金”是锌和铜的合金,因外形似黄金而得名。下列厨房用品可用来鉴别“药金”为假黄金的是( )
食盐水 B. 白醋
C. 料酒 D. 酱油
B
当堂检测
4. 把一根洁净的铁钉放入稀硫酸中,①铁钉表面产生气泡;②溶液由无色变为浅绿色;③铁钉质量减轻;④溶液的质量增加。以上叙述中正确的是( )
①②③ B. ①③④
C. ①④ D. ①②③④
D
课堂小结
金属的化学性质
高温时:铁、铜
不与氧反应:金
常温下:镁
镁、锌、铁可反应,铜不能反应
与酸反应
与氧气反应
置换反应
一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
6.2 金属的化学性质
第1课时
黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜冒充黄金进行诈活动。因为黄铜(铜、锌合金)单纯从颜色、外型上看,与黄金极为相似,所以很难区分,现请你设计一个实验方案鉴别真假黄金。
学习目标
1.了解镁、铁、铜等常见金属与氧气的反应。
2.初步认识常见金属与酸的反应 。
3.理解置换反应的概念。
学习目标
新知学习
一、金属的发现和利用
人类发现和大量冶炼几种常用金属的年代
铜(距今3000年前)
铁(距今1500年前)
铝(仅100多年前)
新知学习
金属材料的发展经历:青铜器时代 →铁器时代 →铝的利用 →各种功能材料。
铝的利用要比铜和铁晚得多,那仅仅是100多年前的事情。铝具有密度小和抗腐蚀等优良性能。现在,世界上铝的年产量已超过铜,位于铁之后,居第二位。
为什么它们的发现和利用的年代差距如此之大 这与它们的化学性质有关吗
新知学习
二、金属跟氧气的反应
镁条燃烧
铁丝燃烧
铜丝加热
新知学习
实验内容 实验现象 化学方程式
铁丝在氧气中燃烧
镁条在空气中燃烧
铜丝在酒精灯上加热
火星四射,放出大量的热,生成黑色固体
发出耀眼的白光,放出大量的热,生成白色固体
生成黑色固体
3Fe+2O2 ==== Fe3O4
点燃
2Mg+O2 ==== 2MgO
点燃
2Cu+O2 ==== 2CuO
新知学习
实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同
镁在常温下就能与氧气反应
铁、铜在常温下不能与氧气反应, 但在高温时能与氧气反应
镁的活泼性>铁的活泼性>铜的活泼性。
新知学习
1.镁条点燃之前为什么要先用砂纸打磨?铝制品在空气中为什么失去金属光泽变暗?
砂纸打磨是为了除去表面的氧化膜,
镁、铝在常温下可与空气中的氧气发生反应。
思考
常温下铝与空气中的氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化。因此,铝制品具有耐腐蚀性。
2.铝的化学性质很活泼,而铝制品却很难腐蚀,为什么?
新知学习
3.从化学角度分析“真金不怕火炼”。
金在高温下也不与氧气发生反应。
新知学习
三、金属跟酸的反应
新知学习
稀盐酸 化学方程式
镁
锌
铁
铜
大量气泡,反应最快
很多气泡,反应快
产生气泡,反应较快
没有气泡,不反应
实验现象:
Mg+2HCl = MgCl2+H2↑
Zn+2HCl = ZnCl2+H2↑
Fe+2HCl = FeCl2+H2↑
/
新知学习
为什么铝、铁能跟稀盐酸(或稀硫酸)反应产生氢气而铜却不能呢
思考:
铝、铁与稀盐酸(或稀硫酸)反应,而铜不与稀盐酸(或稀硫酸)反应,说明铝铁的金属活动性比铜强,它们能够置换算中的氢,是活泼金属。
实验结论:
1. 能与盐酸、稀硫酸反应的金属有 。
2. 比较三种金属分别与盐酸、稀硫酸反应的难易和剧烈程度,由易到难的顺序是 。
镁、铁、锌
镁、锌、铁
新知学习
判断金属活动性的方法:
1. 利用金属与氧气反应进行金属活动性的判断。相同条件下,金属与氧气反应越容易,金属的活动性就越强。
2.利用金属与酸的反应进行金属活动性的判断。相同条件下,与相同质量分数的酸反应,越活泼的金属反应越快。
小结
新知学习
观察下列化学方程式,分析这些反应有什么共同特点?(从反应物和生成物的物质类别角度分析)
单质
单质
化合物
化合物
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
四、置换反应
新知学习
上述反应中,都是一种单质与一种化合物反应,生成另一种单质与另一种化合物,我们把这类反应叫作置换反应。
表达式:A+BC ==B+AC(属于基本反应类型)
反应物和生成物都是两种物质,且都是一种单质和一种化合物
在反应前后一定有元素化合价发生改变
当堂检测
1.下列金属能在空气中燃烧的是( )
A.铜 B.银
C.镁 D.铁
C
2.下列反应属于置换反应的是( )
A.
D.
B.
C.
C
当堂检测
3. “药金”是锌和铜的合金,因外形似黄金而得名。下列厨房用品可用来鉴别“药金”为假黄金的是( )
食盐水 B. 白醋
C. 料酒 D. 酱油
B
当堂检测
4. 把一根洁净的铁钉放入稀硫酸中,①铁钉表面产生气泡;②溶液由无色变为浅绿色;③铁钉质量减轻;④溶液的质量增加。以上叙述中正确的是( )
①②③ B. ①③④
C. ①④ D. ①②③④
D
课堂小结
金属的化学性质
高温时:铁、铜
不与氧反应:金
常温下:镁
镁、锌、铁可反应,铜不能反应
与酸反应
与氧气反应
置换反应
一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
