8.4 常见的盐 第2课时 课件(共20张PPT) 2023-2024学年科粤版化学九年级下册
文档属性
| 名称 | 8.4 常见的盐 第2课时 课件(共20张PPT) 2023-2024学年科粤版化学九年级下册 |
|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 00:00:00 | ||
图片预览








文档简介
(共20张PPT)
8.4 常见的盐
第2课时
Fe + CuSO4 == FeSO4 + Cu
除此之外,盐还能与哪些物质反应呢?我们一起来回顾一下。
通过前面的学习我们知道,盐能与活泼金属发生置换反应,如:
学习目标
1.回顾酸、碱、金属的化学性质的基础上总结出盐的化学性质。
2.根据复分解反应发生的条件,判断一些常见酸、碱、盐之间的反应能否发生。
学习目标
新知学习
一、盐的化学性质
①碳酸钙与盐酸的复分解反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
②硝酸银与盐酸的复分解反应:AgNO3 + HCl == AgCl↓ + HNO3
1.盐与酸的反应
盐可能与酸发生复分解反应,生成新盐和新酸
盐+酸——>新盐+新酸
【回顾】碳酸钙与盐酸的反应
新知学习
硫酸铜或氯化铁跟氢氧化钙的复分解反应:
CuSO4 + Ca(OH)2 === Cu(OH)2↓ + CaSO4
2FeCl3 + 3Ca(OH)2 === 2Fe(OH)3↓ + 3CaCl2
2.盐与碱的反应
盐可能跟碱发生复分解反应,生成新盐和新碱
盐+碱——>新盐+新碱
新知学习
①氯化钡与碳酸钠的复分解反应:BaCl2 + Na2CO3 == BaCO3 ↓+ 2NaCl
3.盐与盐的反应
两种盐之间可能发生复分解反应,生成另外两种新盐。
②氯化钡与硫酸钠的复分解反应:BaCl2 + Na2SO4 == BaSO4 ↓ + 2NaCl
盐1+盐2——>新盐1+新盐2
新知学习
4.检验硫酸和硫酸盐
【实验8-15】用硫酸钠溶液与硝酸钡溶液反应。
观察现象: 。
化学方程式: 。
【实验8-16】请在上一实验所得有硫酸钡沉淀的试管中,滴加几滴稀硝酸,观察到的现象是 。
有白色沉淀生成
Na2SO4+Ba(NO3)2 = 2NaNO3+BaSO4 ↓
无明显现象
这个实验现象说明了____________________________。
硫酸钡沉淀不溶于稀硝酸。
新知学习
【实验8-17】用碳酸钠溶液代替硫酸钠溶液,重做上述两个实验:
(1)在碳酸钠溶液中滴入硝酸钡溶液;
(2)继续向刚才实验的试管中加入几滴稀硝酸。结果如何?写出相关的化学方程式。
分项 实验现象 化学方程式
实验8-17(1)
实验8-17(2)
有白色沉淀生成
Ba(NO3 )2 + Na2CO3 == BaCO3↓ + 2NaNO3
白色沉淀消失,并有气泡产生
BaCO3+2HNO3 =Ba(NO3)2+CO2↑+H2O
硫酸钡沉淀不溶于稀硝酸,根据这一特征,可用硝酸钡溶液鉴别硫酸和可溶性硫酸盐。
新知学习
知识视窗
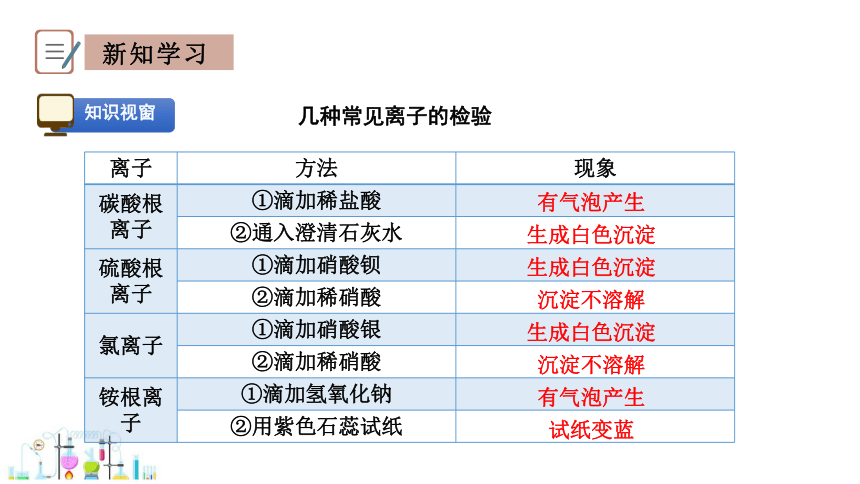
几种常见离子的检验
离子 方法 现象
碳酸根离子 ①滴加稀盐酸
②通入澄清石灰水
硫酸根离子 ①滴加硝酸钡
②滴加稀硝酸
氯离子 ①滴加硝酸银
②滴加稀硝酸
铵根离子 ①滴加氢氧化钠
②用紫色石蕊试纸
有气泡产生
生成白色沉淀
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀不溶解
有气泡产生
试纸变蓝
新知学习
知识小结
1.盐跟酸、碱、其他盐间可能发生复分解反应:
①盐+酸 →新盐+新酸 条件:生成物中有沉淀或气体或水
②盐+碱 →新盐+新碱 条件:反应物两者均可溶,生成物有沉淀或气体或水
③盐1+盐2 →新盐1+新盐2 条件:反应物两者均可溶,生成物有沉淀
盐的化学性质
2.盐溶液与某些金属可能发生置换反应:
盐+较活泼金属 →新盐+较不活泼金属
在金属活动顺序表中,只有位于前面的金属才能把位于后面的金属从它的盐溶液中置换出来,与氢的位置无关;盐必须是可溶性盐。
新知学习
二、复分解反应发生的条件
请预测以下反应能否产生 你预测的依据是什么
NaCl+KNO3 → ?
不能发生。
新知学习
复分解反应的生成物特征
CaCO3+2HCl = CaCl2+CO2↑+H2O
FeCl3+3Ca(OH)2 = 2Fe(OH)3↓+3CaCl2
BaCl2+3Na2CO3=BaCO3↓+2NaCl2
H2SO4+ Ca(OH)2 = 2 H2O+CaSO4
由此可知,复分解反应发生的条件是:生成物中有沉淀 (难溶物)、气体和水等,否则不能发生复分解反应。
上述复分解反应的生成物都生成了水或气体或沉淀。
新知学习
请判断下列反应是否可以进行,如可以,请补充反应的生成物,并说明反应可以发生的原因。
AgNO3+NaCl == _________________________________
CaCO3+2HNO3==_________________________________
Cu(OH)2+2HNO3==_________________________________
AgCl↓+NaNO3
Ca(NO3)2+CO2↑+H2O
Cu(NO3)2+2H2O
反应生成了气体和水
反应生成了水
反应生成了沉淀
新知学习
知识视窗
溶洞里奇妙的石笋和钟乳石
许多同学可能参观过溶洞吧?你一定会为洞里千姿百态的石笋和钟乳石而惊叹不已。
你是否思考过它们是怎样形成的呢?
新知学习
知识视窗
溶洞里奇妙的石笋和钟乳石
原来,形成石灰岩地区溶洞岩石的主要成分是碳酸钙。
碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:
CaCO3+CO2+H2O —— Ca(HCO3)2
溶有碳酸氢钙的水遇热或减压时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,同时产生二氧化碳和水:
Ca(HCO3)2 —— CaCO3 ↓ +CO2 ↑ +H2O
新知学习
为什么又有石笋、 钟乳石和石柱的不同呢
石笋
钟乳石
石柱
洞顶的水在缓慢向下渗漏时,水中的碳酸氢钙发生分解。有的沉积在洞底慢慢地形成石笋;有的残留在洞顶渐 渐地形成钟乳石。当石笋和钟乳石逐渐相连时就形了石柱。
当堂检测
1.食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能做成的实验是:①检验自来水中是否含有氯离子;②鉴别食盐和纯碱;③检验鸡蛋壳能否溶于酸;④除去热水瓶中的水垢( )
A.①②③④ B.①③ C.②④ D.②③④
2.欲证明生石灰中含有未烧透的石灰石,最简单的方法是( )
A.滴加稀盐酸 B.加热 C.加水溶解 D.加入Na2CO3
D
A
当堂检测
3.胃酸能帮助消化,但过多的胃酸会危害健康。可用于治疗胃酸过多的物质是 ( )
A.NaCl B.Al(OH)3 C.CaO D.NaO
4.下列各组离子能共存的是( )
A.Na+ 、NO3-、CO32-、H+ B.K+、Mg2+、NO3-、H+
C.Fe3+、SO42-、OH-、Cu2+ D.Ag+、Cl-、NO3-、K+
B
B
当堂检测
5.化学反应要符合一定的原理和条件,下列认识正确的是( )
A.化合反应和分解反应一定有单质参加或生成
B.置换反应只能发生在金属与金属的化合物之间
C.复分解反应要有沉淀或气体或水生成
D.有盐和水生成的反应一定是中和反应
6.有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种溶液,两物质间能发生的化学反应共有( )
A.3个 B.4个 C.5个 D.6个
C
C
课堂小结
一、盐的化学性质
1.盐+金属=新盐+新金属(前置后,盐溶液)
2.盐+酸=新盐+新酸
3.盐+碱=新盐+新碱(两者都要可溶)
4.盐+盐=新盐+新盐(两者都要可溶)
二、复分解反应发生的条件
生成物中有沉淀、气体或水。
8.4 常见的盐
第2课时
Fe + CuSO4 == FeSO4 + Cu
除此之外,盐还能与哪些物质反应呢?我们一起来回顾一下。
通过前面的学习我们知道,盐能与活泼金属发生置换反应,如:
学习目标
1.回顾酸、碱、金属的化学性质的基础上总结出盐的化学性质。
2.根据复分解反应发生的条件,判断一些常见酸、碱、盐之间的反应能否发生。
学习目标
新知学习
一、盐的化学性质
①碳酸钙与盐酸的复分解反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
②硝酸银与盐酸的复分解反应:AgNO3 + HCl == AgCl↓ + HNO3
1.盐与酸的反应
盐可能与酸发生复分解反应,生成新盐和新酸
盐+酸——>新盐+新酸
【回顾】碳酸钙与盐酸的反应
新知学习
硫酸铜或氯化铁跟氢氧化钙的复分解反应:
CuSO4 + Ca(OH)2 === Cu(OH)2↓ + CaSO4
2FeCl3 + 3Ca(OH)2 === 2Fe(OH)3↓ + 3CaCl2
2.盐与碱的反应
盐可能跟碱发生复分解反应,生成新盐和新碱
盐+碱——>新盐+新碱
新知学习
①氯化钡与碳酸钠的复分解反应:BaCl2 + Na2CO3 == BaCO3 ↓+ 2NaCl
3.盐与盐的反应
两种盐之间可能发生复分解反应,生成另外两种新盐。
②氯化钡与硫酸钠的复分解反应:BaCl2 + Na2SO4 == BaSO4 ↓ + 2NaCl
盐1+盐2——>新盐1+新盐2
新知学习
4.检验硫酸和硫酸盐
【实验8-15】用硫酸钠溶液与硝酸钡溶液反应。
观察现象: 。
化学方程式: 。
【实验8-16】请在上一实验所得有硫酸钡沉淀的试管中,滴加几滴稀硝酸,观察到的现象是 。
有白色沉淀生成
Na2SO4+Ba(NO3)2 = 2NaNO3+BaSO4 ↓
无明显现象
这个实验现象说明了____________________________。
硫酸钡沉淀不溶于稀硝酸。
新知学习
【实验8-17】用碳酸钠溶液代替硫酸钠溶液,重做上述两个实验:
(1)在碳酸钠溶液中滴入硝酸钡溶液;
(2)继续向刚才实验的试管中加入几滴稀硝酸。结果如何?写出相关的化学方程式。
分项 实验现象 化学方程式
实验8-17(1)
实验8-17(2)
有白色沉淀生成
Ba(NO3 )2 + Na2CO3 == BaCO3↓ + 2NaNO3
白色沉淀消失,并有气泡产生
BaCO3+2HNO3 =Ba(NO3)2+CO2↑+H2O
硫酸钡沉淀不溶于稀硝酸,根据这一特征,可用硝酸钡溶液鉴别硫酸和可溶性硫酸盐。
新知学习
知识视窗
几种常见离子的检验
离子 方法 现象
碳酸根离子 ①滴加稀盐酸
②通入澄清石灰水
硫酸根离子 ①滴加硝酸钡
②滴加稀硝酸
氯离子 ①滴加硝酸银
②滴加稀硝酸
铵根离子 ①滴加氢氧化钠
②用紫色石蕊试纸
有气泡产生
生成白色沉淀
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀不溶解
有气泡产生
试纸变蓝
新知学习
知识小结
1.盐跟酸、碱、其他盐间可能发生复分解反应:
①盐+酸 →新盐+新酸 条件:生成物中有沉淀或气体或水
②盐+碱 →新盐+新碱 条件:反应物两者均可溶,生成物有沉淀或气体或水
③盐1+盐2 →新盐1+新盐2 条件:反应物两者均可溶,生成物有沉淀
盐的化学性质
2.盐溶液与某些金属可能发生置换反应:
盐+较活泼金属 →新盐+较不活泼金属
在金属活动顺序表中,只有位于前面的金属才能把位于后面的金属从它的盐溶液中置换出来,与氢的位置无关;盐必须是可溶性盐。
新知学习
二、复分解反应发生的条件
请预测以下反应能否产生 你预测的依据是什么
NaCl+KNO3 → ?
不能发生。
新知学习
复分解反应的生成物特征
CaCO3+2HCl = CaCl2+CO2↑+H2O
FeCl3+3Ca(OH)2 = 2Fe(OH)3↓+3CaCl2
BaCl2+3Na2CO3=BaCO3↓+2NaCl2
H2SO4+ Ca(OH)2 = 2 H2O+CaSO4
由此可知,复分解反应发生的条件是:生成物中有沉淀 (难溶物)、气体和水等,否则不能发生复分解反应。
上述复分解反应的生成物都生成了水或气体或沉淀。
新知学习
请判断下列反应是否可以进行,如可以,请补充反应的生成物,并说明反应可以发生的原因。
AgNO3+NaCl == _________________________________
CaCO3+2HNO3==_________________________________
Cu(OH)2+2HNO3==_________________________________
AgCl↓+NaNO3
Ca(NO3)2+CO2↑+H2O
Cu(NO3)2+2H2O
反应生成了气体和水
反应生成了水
反应生成了沉淀
新知学习
知识视窗
溶洞里奇妙的石笋和钟乳石
许多同学可能参观过溶洞吧?你一定会为洞里千姿百态的石笋和钟乳石而惊叹不已。
你是否思考过它们是怎样形成的呢?
新知学习
知识视窗
溶洞里奇妙的石笋和钟乳石
原来,形成石灰岩地区溶洞岩石的主要成分是碳酸钙。
碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:
CaCO3+CO2+H2O —— Ca(HCO3)2
溶有碳酸氢钙的水遇热或减压时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,同时产生二氧化碳和水:
Ca(HCO3)2 —— CaCO3 ↓ +CO2 ↑ +H2O
新知学习
为什么又有石笋、 钟乳石和石柱的不同呢
石笋
钟乳石
石柱
洞顶的水在缓慢向下渗漏时,水中的碳酸氢钙发生分解。有的沉积在洞底慢慢地形成石笋;有的残留在洞顶渐 渐地形成钟乳石。当石笋和钟乳石逐渐相连时就形了石柱。
当堂检测
1.食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能做成的实验是:①检验自来水中是否含有氯离子;②鉴别食盐和纯碱;③检验鸡蛋壳能否溶于酸;④除去热水瓶中的水垢( )
A.①②③④ B.①③ C.②④ D.②③④
2.欲证明生石灰中含有未烧透的石灰石,最简单的方法是( )
A.滴加稀盐酸 B.加热 C.加水溶解 D.加入Na2CO3
D
A
当堂检测
3.胃酸能帮助消化,但过多的胃酸会危害健康。可用于治疗胃酸过多的物质是 ( )
A.NaCl B.Al(OH)3 C.CaO D.NaO
4.下列各组离子能共存的是( )
A.Na+ 、NO3-、CO32-、H+ B.K+、Mg2+、NO3-、H+
C.Fe3+、SO42-、OH-、Cu2+ D.Ag+、Cl-、NO3-、K+
B
B
当堂检测
5.化学反应要符合一定的原理和条件,下列认识正确的是( )
A.化合反应和分解反应一定有单质参加或生成
B.置换反应只能发生在金属与金属的化合物之间
C.复分解反应要有沉淀或气体或水生成
D.有盐和水生成的反应一定是中和反应
6.有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种溶液,两物质间能发生的化学反应共有( )
A.3个 B.4个 C.5个 D.6个
C
C
课堂小结
一、盐的化学性质
1.盐+金属=新盐+新金属(前置后,盐溶液)
2.盐+酸=新盐+新酸
3.盐+碱=新盐+新碱(两者都要可溶)
4.盐+盐=新盐+新盐(两者都要可溶)
二、复分解反应发生的条件
生成物中有沉淀、气体或水。
