4.3 质量守恒定律 课件(共20张PPT) 2023-2024学年初中化学科粤版九年级上册
文档属性
| 名称 | 4.3 质量守恒定律 课件(共20张PPT) 2023-2024学年初中化学科粤版九年级上册 |
|
|
| 格式 | pptx | ||
| 文件大小 | 766.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-07 23:48:41 | ||
图片预览








文档简介
(共20张PPT)
4.3 质量守恒定律
一天,福尔摩斯像往常一样滋滋有味地 抽着他的烟斗,房间里充满了刺鼻的烟味。华生问道:“敬爱的先生,别人都说你很聪明,那么你能告诉我你吐出的这些烟和气体有多重吗?”
福尔摩斯慢条斯理地说:“这个问题很简单,我只要称出抽烟前烟斗和烟丝的总重量,再减去抽完烟后烟斗和剩余烟灰的总重量,不就是我吐出烟和气体的重量了么!”
学习目标
1.能说出质量守恒定律的概念。
2.能从微观角度解释质量守恒定律。
3.能运用质量守恒定律解释一些实验现象。
学习目标
新知学习
提出问题
观察活动
物质发生化学变化的前后,参加反应的各物质的质量总和会等于生成的各物质的质量总和吗?
猜想与假设
会
不会
新知学习
在实验前我们先来回忆一下托盘天平的使用
1.校准:称量前要对天平进行校准,即检查天平是否平衡。方法是称盘应先垫好洁净纸,把游码放在标尺零刻度处,看指针在分度盘左右两边摆动的格数是否接近相等,或指针是否停在正中。如不平衡,应调节平衡螺母,使天平达到平衡。
2.称量:左盘放被称物,右盘放砝码,加减砝码要用镊子,先加质量大的,再加小的。1g以下可移动游码,直到天平平衡。砝码和游码所示质量之和,等于被称物的质量。
称量完毕后,即把砝码放回盒中,游码移回零处。
新知学习
实验与事实
【演示实验4-7】如图装置,锥形瓶塞中插入玻璃管与大气相通。往装有石灰石小块的锥形瓶里滴入吸在滴管里的稀盐酸。反应前后称量作比较。
请同学们仔细观察实验现象,做好记录
新知学习
【演示实验4-8】如图装置,往锥形瓶塞里的玻璃管上缚紧气球。往装有石灰石小块的瓶内滴入吸在滴管里的稀盐酸。反应前后再称量作比较。
请同学们仔细观察实验现象,做好记录
新知学习
【演示实验4-9】如图装置,往锥形瓶里的硫酸铜溶液中滴入氢氧化钠溶液。反应前后称量作比较。
请同学们仔细观察实验现象,做好记录
新知学习
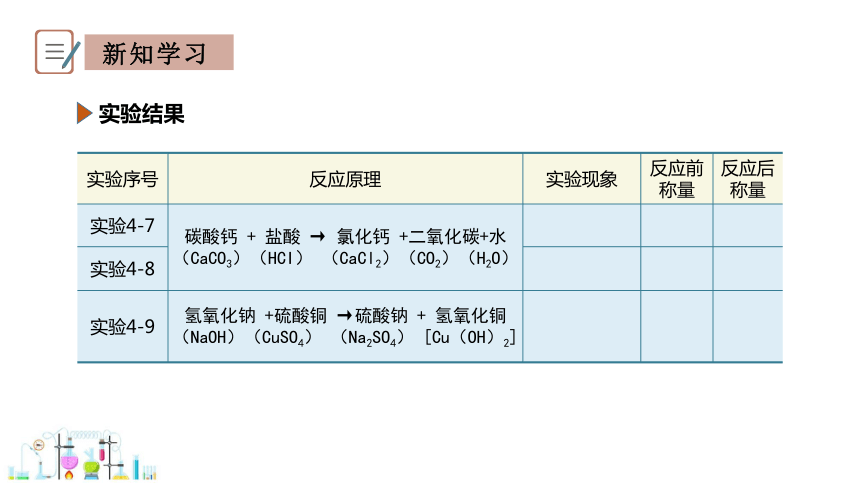
实验结果
实验序号 反应原理 实验现象 反应前称量 反应后称量
实验4-7 碳酸钙 + 盐酸 → 氯化钙 +二氧化碳+水 (CaCO3)(HCI) (CaCl2)(CO2)(H2O)
实验4-8
实验4-9 氢氧化钠 +硫酸铜 →硫酸钠 + 氢氧化铜 (NaOH)(CuSO4) (Na2SO4) [Cu(OH)2]
新知学习
讨论与交流
1.为什么【实验4-7】和【实验4-8】都属同一个反应,反应前后各物质的总质量,前者不相等而后者相等?
盐酸 + 碳酸钙 → 氯化钙 + 水 +二氧化碳
M1 M2
气体溢出
在密闭容器中:
盐酸 + 碳酸钙 → 氯化钙 + 水 +二氧化碳
M1 = M2
在敞开容器中:
新知学习
2.我们应当以哪些实验为依据来探究化学反应前后物质质量总和的关系?能从中得到什么结论?
通过【实验4-8】和【实验4-9】这两个实验我们看到,发生化学反应时反应物的质量总和与生成物的质量总和存在相等的关系。其实不仅仅这两个实验如此,无数的实验证明,反应前后反应物和生成物的质量总和相等,这个规律叫做质量守恒定律。
新知学习
一、质量守恒定律
定义:在化学反应里,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。
参加的各物质
的质量总和
生成的各物质的质量总和
化学反应
为什么参加化学反应的物质,反应前后质量总和会保持不变呢?
不应把杂质、不反应的物质或多余的反应物计入总质量中。
只强调质量守恒,并不包括分子数、体积等方面的守恒
新知学习
二、质量守恒定律的微观解释
O
H
H
O
H
H
2个水分子
2个氢分子
氧分子
2H2
O2
通电
水通电分解的微观过程
组合
新知学习
分子
原子
新分子
种类不变
数目不变
质量不变
质量守恒
原子
质量守恒的微观解释:
新知学习
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
物质总质量
元素的化合价
三、从质量守恒定律的角度认识化学反应
新知学习
讨论与交流
1.为了验证质量守恒定律,某同学在托盘天平的左盘上放一块石棉网,在石棉网上放一段经过砂纸打磨过的镁条,称量。然后点燃镁条,将生成的白色固体全部收集在石棉网上,冷却后再称量,发现质量比实验前的质量增大了。怎样解释反应前后质量不等的现象?
请你运用质量守恒定律讨论化学实验过程中出现质量变化的问题。
2.你能否从微观的角度,用图示表明上述实验也是符合质量守恒定律的?
镁条 + 氧气 → 氧化镁
M1 < M2
增加了气体质量
当堂检测
1.在A+B→C的反应中,5克A和4克B恰好完全反应,求生成C的质量。
2.在A+B→C的反应中,5克A和4克B充分反应后,剩余1克B,求生成C的质量。
3.在A+B→C的反应中,5克A和4克B恰好能完全反应,5克A和6克B充分反应后,生成C的质量为多少?
9克
8克
9克
当堂检测
4.碱式碳酸铜受热分解成CuO、CO2、和H2O三种物质,则碱式碳酸铜的组成是( )
A.只含有碳、氢、氧元素
B.一定含有碳、氢、铜元素,可能含有氧元素
C.一定含有碳、氢、氧元素,可能含有铜元素
D.肯定含有碳、氢、氧、铜元素
D
当堂检测
5.根据质量守恒定律解释下列现象。
(1)铁丝在氧气中燃烧后,生成物的质量比铁丝的质量大:
。
。
(2)高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小: 。
。
。
根据质量守恒定律,反应物高锰酸钾的质量应当等于生成物锰酸钾、二氧化锰和氧气的质量之和,由于氧气逸出,所以剩余固体的质量比高锰酸钾的质量小
参加反应的铁丝和氧气的质量之和等于生成的四氧化三铁的质量,
故生成物四氧化三铁的质量大于铁丝的质量
课堂小结
质量守恒定律
内容
解释
应用
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和
原子种类没有改变
原子数目没有增减
原子质量没有变化
进行有关的计算
推测一些物质的组成
解释一些实验现象
4.3 质量守恒定律
一天,福尔摩斯像往常一样滋滋有味地 抽着他的烟斗,房间里充满了刺鼻的烟味。华生问道:“敬爱的先生,别人都说你很聪明,那么你能告诉我你吐出的这些烟和气体有多重吗?”
福尔摩斯慢条斯理地说:“这个问题很简单,我只要称出抽烟前烟斗和烟丝的总重量,再减去抽完烟后烟斗和剩余烟灰的总重量,不就是我吐出烟和气体的重量了么!”
学习目标
1.能说出质量守恒定律的概念。
2.能从微观角度解释质量守恒定律。
3.能运用质量守恒定律解释一些实验现象。
学习目标
新知学习
提出问题
观察活动
物质发生化学变化的前后,参加反应的各物质的质量总和会等于生成的各物质的质量总和吗?
猜想与假设
会
不会
新知学习
在实验前我们先来回忆一下托盘天平的使用
1.校准:称量前要对天平进行校准,即检查天平是否平衡。方法是称盘应先垫好洁净纸,把游码放在标尺零刻度处,看指针在分度盘左右两边摆动的格数是否接近相等,或指针是否停在正中。如不平衡,应调节平衡螺母,使天平达到平衡。
2.称量:左盘放被称物,右盘放砝码,加减砝码要用镊子,先加质量大的,再加小的。1g以下可移动游码,直到天平平衡。砝码和游码所示质量之和,等于被称物的质量。
称量完毕后,即把砝码放回盒中,游码移回零处。
新知学习
实验与事实
【演示实验4-7】如图装置,锥形瓶塞中插入玻璃管与大气相通。往装有石灰石小块的锥形瓶里滴入吸在滴管里的稀盐酸。反应前后称量作比较。
请同学们仔细观察实验现象,做好记录
新知学习
【演示实验4-8】如图装置,往锥形瓶塞里的玻璃管上缚紧气球。往装有石灰石小块的瓶内滴入吸在滴管里的稀盐酸。反应前后再称量作比较。
请同学们仔细观察实验现象,做好记录
新知学习
【演示实验4-9】如图装置,往锥形瓶里的硫酸铜溶液中滴入氢氧化钠溶液。反应前后称量作比较。
请同学们仔细观察实验现象,做好记录
新知学习
实验结果
实验序号 反应原理 实验现象 反应前称量 反应后称量
实验4-7 碳酸钙 + 盐酸 → 氯化钙 +二氧化碳+水 (CaCO3)(HCI) (CaCl2)(CO2)(H2O)
实验4-8
实验4-9 氢氧化钠 +硫酸铜 →硫酸钠 + 氢氧化铜 (NaOH)(CuSO4) (Na2SO4) [Cu(OH)2]
新知学习
讨论与交流
1.为什么【实验4-7】和【实验4-8】都属同一个反应,反应前后各物质的总质量,前者不相等而后者相等?
盐酸 + 碳酸钙 → 氯化钙 + 水 +二氧化碳
M1 M2
气体溢出
在密闭容器中:
盐酸 + 碳酸钙 → 氯化钙 + 水 +二氧化碳
M1 = M2
在敞开容器中:
新知学习
2.我们应当以哪些实验为依据来探究化学反应前后物质质量总和的关系?能从中得到什么结论?
通过【实验4-8】和【实验4-9】这两个实验我们看到,发生化学反应时反应物的质量总和与生成物的质量总和存在相等的关系。其实不仅仅这两个实验如此,无数的实验证明,反应前后反应物和生成物的质量总和相等,这个规律叫做质量守恒定律。
新知学习
一、质量守恒定律
定义:在化学反应里,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。
参加的各物质
的质量总和
生成的各物质的质量总和
化学反应
为什么参加化学反应的物质,反应前后质量总和会保持不变呢?
不应把杂质、不反应的物质或多余的反应物计入总质量中。
只强调质量守恒,并不包括分子数、体积等方面的守恒
新知学习
二、质量守恒定律的微观解释
O
H
H
O
H
H
2个水分子
2个氢分子
氧分子
2H2
O2
通电
水通电分解的微观过程
组合
新知学习
分子
原子
新分子
种类不变
数目不变
质量不变
质量守恒
原子
质量守恒的微观解释:
新知学习
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
物质总质量
元素的化合价
三、从质量守恒定律的角度认识化学反应
新知学习
讨论与交流
1.为了验证质量守恒定律,某同学在托盘天平的左盘上放一块石棉网,在石棉网上放一段经过砂纸打磨过的镁条,称量。然后点燃镁条,将生成的白色固体全部收集在石棉网上,冷却后再称量,发现质量比实验前的质量增大了。怎样解释反应前后质量不等的现象?
请你运用质量守恒定律讨论化学实验过程中出现质量变化的问题。
2.你能否从微观的角度,用图示表明上述实验也是符合质量守恒定律的?
镁条 + 氧气 → 氧化镁
M1 < M2
增加了气体质量
当堂检测
1.在A+B→C的反应中,5克A和4克B恰好完全反应,求生成C的质量。
2.在A+B→C的反应中,5克A和4克B充分反应后,剩余1克B,求生成C的质量。
3.在A+B→C的反应中,5克A和4克B恰好能完全反应,5克A和6克B充分反应后,生成C的质量为多少?
9克
8克
9克
当堂检测
4.碱式碳酸铜受热分解成CuO、CO2、和H2O三种物质,则碱式碳酸铜的组成是( )
A.只含有碳、氢、氧元素
B.一定含有碳、氢、铜元素,可能含有氧元素
C.一定含有碳、氢、氧元素,可能含有铜元素
D.肯定含有碳、氢、氧、铜元素
D
当堂检测
5.根据质量守恒定律解释下列现象。
(1)铁丝在氧气中燃烧后,生成物的质量比铁丝的质量大:
。
。
(2)高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小: 。
。
。
根据质量守恒定律,反应物高锰酸钾的质量应当等于生成物锰酸钾、二氧化锰和氧气的质量之和,由于氧气逸出,所以剩余固体的质量比高锰酸钾的质量小
参加反应的铁丝和氧气的质量之和等于生成的四氧化三铁的质量,
故生成物四氧化三铁的质量大于铁丝的质量
课堂小结
质量守恒定律
内容
解释
应用
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和
原子种类没有改变
原子数目没有增减
原子质量没有变化
进行有关的计算
推测一些物质的组成
解释一些实验现象
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
