5.2.3 硝酸 酸雨及其防治 课件 (共36张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.3 硝酸 酸雨及其防治 课件 (共36张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 21.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-08 08:49:42 | ||
图片预览










文档简介
(共36张PPT)
第二节 氮及其化合物
第五章化工生产中的重要非金属元素
第4课时 硝酸 酸雨及其防治
硝酸的个人阐述
大家好!我的名字叫硝酸,内心纯净透明,热衷于穿棕色的衣服,爱好广泛,喜欢游泳,向往自由,有机会就在空气中溜达,有一些人不喜欢我,因为我会散发出刺激性的味道。但是,一个名叫“工业”的人相当喜欢我。告诉大家一个秘密,我有双重人格,主人格(+5价的氮元素)很强势,次人格(+1价的氢元素)比较温婉,和金属交往,主人格强势牵手,但并不是所有的金属都能牵手成功,有的牵手成功一瞬间就遭到了反对,我也是很无奈呀!如果你深入的了解我,一定会喜欢我!现在,开启我们愉快的相处之旅吧......
无色液体
很强
沸点低,易挥发
跟水任意比互溶,溶解放出大量热。
1、硝酸的物理性质
A.色态:
B.腐蚀性:
C.沸点:
D.溶解性:
硝酸(HNO3)
95%以上的硝酸称为“发烟硝酸”
发烟硝酸的“发烟”原因是挥发出的硝酸和空气中的水蒸气形成硝酸小液滴,所发出的“烟”实际上是 。
雾
①与指示剂反应:稀硝酸使石蕊试液由紫变红;
浓硝酸使紫色石蕊试液先变红后褪色 ;
②与碱的反应,生成盐和水;
③与碱性氧化物反应生成盐和水;
④与盐的反应生成新盐和新酸
1)酸的通性
Fe2O3+ 6H+ = 2Fe3+ + 3H2O
H+ + OH- = H2O
Na2CO3+2HNO3= 2NaNO3+CO2↑+ H2O
2、硝酸的化学性质
载29吨硝酸的铝槽车侧翻发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染。
思考1:为什么现场有大量红棕色的烟雾?
思考2:从化合价的角度分析,除了NO2气体,还会有什么物质产生?
浓硝酸不稳定,见光或受热会分解生成NO2
硝酸泄漏
4HNO3=====4NO2↑+O2↑+2H2O
光照或加热
注:保存方法
2)不稳定性
保存硝酸要用棕色瓶(防光)、置于阴凉处(防热),玻璃塞(橡胶塞易被氧化)。
【情境·思考】某同学在实验室取出一瓶浓硝酸,
发现溶液显黄色,与教材中关于硝酸的描述出现偏差。
(1)请解释一下原因
浓硝酸不稳定,见光或受热会分解生成NO2,
NO2溶于浓硝酸使溶液显黄色。
(2)如何去除硝酸的黄色
向浓硝酸中通入氧气(或空气),发生反应4NO2+O2+2H2O===4HNO3,消除黄色。
小结:通常见光易分解的物质(提示---棕色试剂瓶)有:
回忆:高锰酸钾、硝酸银、双氧水、氯水(次氯酸)、硝酸...
①常温下,铁、铝遇浓硝酸钝化
②与金属反应:
浓硝酸→NO2,稀硝酸→NO,无H2放出
3)强氧化性
HNO3中氢元素为+1价氮元素为+5价,而HNO3中的+5价氮的氧化性强于+1氢,导致与金属反应时是HNO3中的+5价氮得电子被还原,不能生成H2。
Ⅰ、铜与硝酸反应:
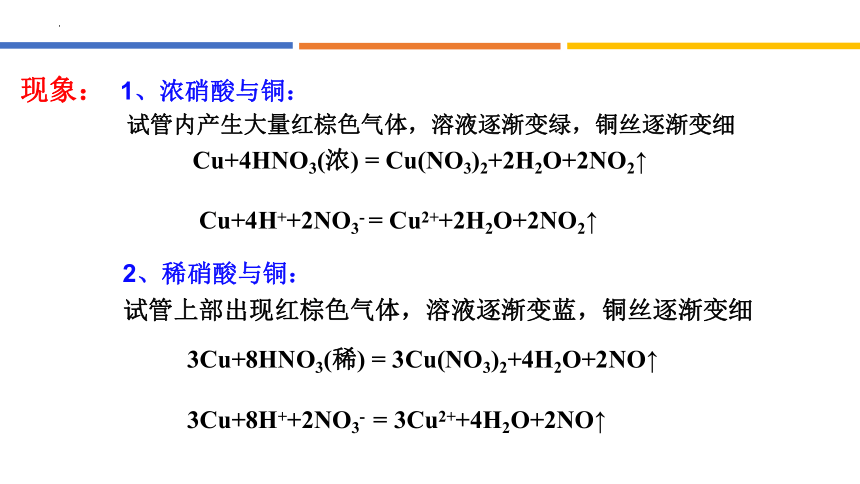
Cu+4HNO3(浓) = Cu(NO3)2+2H2O+2NO2↑
Cu+4H++2NO3- = Cu2++2H2O+2NO2↑
3Cu+8HNO3(稀) = 3Cu(NO3)2+4H2O+2NO↑
3Cu+8H++2NO3- = 3Cu2++4H2O+2NO↑
现象:
1、浓硝酸与铜:
2、稀硝酸与铜:
试管内产生大量红棕色气体,溶液逐渐变绿,铜丝逐渐变细
试管上部出现红棕色气体,溶液逐渐变蓝,铜丝逐渐变细
Ⅱ、铁与硝酸反应:
硝酸过量:
Fe+4HNO3(稀)= Fe(NO3)3+2H2O+NO↑
Fe+4H++NO3- = Fe3++2H2O+NO↑
硝酸不足:
3Fe+8HNO3(稀)= 3Fe(NO3)2+4H2O+2NO↑
3Fe+8H++2NO3- = 3Fe2++4H2O+2NO↑
④与非金属反应:
C+4HNO3(浓) = CO2↑+4NO2↑+2H2O
⑤与还原性离子反应:
SO32-→SO42-、Fe2+→Fe3+、I-→I2
浓硫酸 HNO3
稳定性
酸的通性
与Cu 反应
钝化现象
与C 反应
吸水性 脱水性
使Fe、 Al 钝化
浓硝酸 使Fe、 Al 钝化
有吸水性、脱水性
无
Cu+2H2SO4 (浓)===CuSO4+SO2↑+2H2O
△
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
4HNO3(浓)+C=4NO2↑+CO2↑+2H2O
2H2SO4(浓)+C==2SO2↑+CO2↑+2H2O
△
浓硫酸与硝酸的比较
稳定
不稳定
是
是
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
能使不溶于硝酸的金属如金、铂等溶解。
浓硝酸和浓盐酸按体积比为1∶3混合得到的混合物。
王水
1.下列反应中硝酸既能表现出酸性又表现出氧化性的是( )
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
B
2.下列有关浓硝酸的说法不正确的是( )
A.实验室常用浓硝酸与金属锌反应制备氢气
B.常温下浓硝酸能使金属铝钝化
C.浓硝酸不稳定,见光易分解,需要避光保存
D.浓硝酸易挥发,打开瓶塞,瓶口有白雾产生
A
三阶段 三反应 三设备
NO氧化成NO2 热交换器
硝酸的生成 吸收塔
氨的催化氧化 转化器
4NH3+ 5O2 === 4NO+6H2O
催化剂
△
2NO+ O2 === 2NO2
3NO2+H2O=2HNO3+NO
3.工业上制硝酸的原理
催化剂
NH3空气
空气NH3
热交换器
转化器
吸收塔
工业制备硝酸的流程
NO、O2、N2等
NO2、O2、N2等
HNO3
H2O
煤、石油和某些金属矿物中含有硫,在燃烧或冶炼时往往会生成二氧化硫。在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物。它们会引起呼吸道疾病,危害人体健康,严重时会使人死亡。
二、酸雨及防治
(1)对人体的直接危害首先是它的刺激性,其次是它会形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部,引起肺水肿等疾病而使人致死。
(2)引起河流、湖泊的水体酸化,
严重影响水生动物生长。
(3)破坏土壤、植被、森林。
(4)腐蚀金属、油漆、皮革、纺织品及建筑材料等。
(5)渗入地下,可引起地下水酸化,酸化后的地下水中铝、铜、锌、镉等对人体有害金属元素的含量会偏高。
酸雨的危害
2
饮用酸化的地下水危害人类
腐蚀建筑物和工业设备
破坏土壤成分使农作物减产甚至死亡
损坏植物叶面导致森林死亡
破坏露天文物古迹
使湖泊中鱼虾死亡
酸雨的危害:
(1)调整能源结构,积极开发新能源
(2)对煤(其中含硫为0.3%-5%)进行处理,如选洗加工、综合
开发、在煤中加入适量的生石灰、对排放的烟进行处理等
(3)种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉)等
(4)加强工厂废气的回收处理
(5)改进汽车尾气的处理技术,控制尾气排放
酸雨的防治
3
酸雨:主要指 pH小于5.6 的雨水,其主要是含有硫酸和硝酸。
S
SO2
SO3
H2SO4
硫酸型酸雨:
硝酸型酸雨:
NO2
HNO3
成因:主要是大气中的SO2与NOx溶于水形成的。
酸雨的形成
1
Ⅰ.硫酸型酸雨的形成过程:
①SO2→SO3:____________________。
②SO2→H2SO3:__________________。
③SO3→H2SO4:_____________________。
④H2SO3→H2SO4:______________________。
SO3+H2O === H2SO4
2H2SO3+O2 === 2H2SO4
Ⅱ.硝酸型酸雨形成过程:
①NO→NO2:____________________。
②NO2→HNO3:____________________________。
2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
SO2+H2O H2SO3
2SO2+O2 2 SO3
△
催化剂
S
SO2
SO3
H2SO4
NO2
HNO3
硝化炸药军事上用得比较多的是2, 4, 6-三硝基甲苯(TNT)。它是由甲苯与浓硝酸和浓硫酸反应制得的,是一种黄色片状物,具有爆炸威力大、药性稳定、吸湿性小等优点,常用做炮弹、手榴弹、地雷和鱼雷等的炸药,也可用于采矿等爆破作业。
【科学态度与社会责任】
硝酸甘油用于治疗冠心病
制化肥、农药、染料等
【科学态度与社会责任】
“三酸两碱”是重要的化工原料,是指:
硝酸、硫酸、盐酸、
烧碱、纯碱
“三酸两碱”是衡量一个国家化工发展水平的标志
【科学态度与社会责任】
①原子守恒法
②电子得失守恒法
③电荷守恒法
④利用离子方程式计算法
4.硝酸与金属计算:
1、原子守恒法
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 ↑ + 2H2O
HNO3与金属反应时,一部分HNO3起酸的作用以NO3-的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3物质的量。
n(反应的硝酸)
= n(被还原的硝酸)+ n(未被还原的硝酸)
= n(氮的氧化物)+2n(Cu2+)
例. 25.6 mg Cu跟含有1.4×10-3 mol的硝酸恰好完全反应,反应完毕后收集到的气体在标准状况下的体积为( )
A.7.84 mL B.13.44 mL
C.15.68 mL D.17.92 mL
B
2、电子得失守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
例.某二价金属与硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则HNO3的还原产物是 ( )
A.NH4NO3 B.N2O C.NO D.NO2
AB
HNO3过量时反应后溶液中(不考虑OH-)则有:
c(NO3- )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
3、电荷守恒法
例.3.2 g铜与过量硝酸反应,硝酸被还原为NO2和NO。反应后溶液中含H+ a mol,则此时溶液中含NO3-的物质的量为__________mol。
(a+0.1)
4、利用离子方程式计算法
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO 3- 在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
例. 1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为 ( )
A.2.4g B.3.2g C. 6.4g D.9.6g
D
水吸收
碱吸收或氧化剂
还原剂
应用氮元素的二维图设计转化方案,实现氮氧化物的无害化处理
知识拓展 如何减少主要污染源—NO2
方法1:SCR(选择性催化还原)
知识拓展 如何减少主要污染源—NO2
8NH3+6NO2 ===7N2+12H2O
催化剂
方法2:碱液吸收法
2NO2+2NaOH=NaNO3+NaNO2+H2O
方法3:NSR(NOX储存还原)
方法4:汽车尾气催化转化器
2NO2+4CO==4CO2+N2
知识拓展 如何减少主要污染源—NO2
第二节 氮及其化合物
第五章化工生产中的重要非金属元素
第4课时 硝酸 酸雨及其防治
硝酸的个人阐述
大家好!我的名字叫硝酸,内心纯净透明,热衷于穿棕色的衣服,爱好广泛,喜欢游泳,向往自由,有机会就在空气中溜达,有一些人不喜欢我,因为我会散发出刺激性的味道。但是,一个名叫“工业”的人相当喜欢我。告诉大家一个秘密,我有双重人格,主人格(+5价的氮元素)很强势,次人格(+1价的氢元素)比较温婉,和金属交往,主人格强势牵手,但并不是所有的金属都能牵手成功,有的牵手成功一瞬间就遭到了反对,我也是很无奈呀!如果你深入的了解我,一定会喜欢我!现在,开启我们愉快的相处之旅吧......
无色液体
很强
沸点低,易挥发
跟水任意比互溶,溶解放出大量热。
1、硝酸的物理性质
A.色态:
B.腐蚀性:
C.沸点:
D.溶解性:
硝酸(HNO3)
95%以上的硝酸称为“发烟硝酸”
发烟硝酸的“发烟”原因是挥发出的硝酸和空气中的水蒸气形成硝酸小液滴,所发出的“烟”实际上是 。
雾
①与指示剂反应:稀硝酸使石蕊试液由紫变红;
浓硝酸使紫色石蕊试液先变红后褪色 ;
②与碱的反应,生成盐和水;
③与碱性氧化物反应生成盐和水;
④与盐的反应生成新盐和新酸
1)酸的通性
Fe2O3+ 6H+ = 2Fe3+ + 3H2O
H+ + OH- = H2O
Na2CO3+2HNO3= 2NaNO3+CO2↑+ H2O
2、硝酸的化学性质
载29吨硝酸的铝槽车侧翻发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染。
思考1:为什么现场有大量红棕色的烟雾?
思考2:从化合价的角度分析,除了NO2气体,还会有什么物质产生?
浓硝酸不稳定,见光或受热会分解生成NO2
硝酸泄漏
4HNO3=====4NO2↑+O2↑+2H2O
光照或加热
注:保存方法
2)不稳定性
保存硝酸要用棕色瓶(防光)、置于阴凉处(防热),玻璃塞(橡胶塞易被氧化)。
【情境·思考】某同学在实验室取出一瓶浓硝酸,
发现溶液显黄色,与教材中关于硝酸的描述出现偏差。
(1)请解释一下原因
浓硝酸不稳定,见光或受热会分解生成NO2,
NO2溶于浓硝酸使溶液显黄色。
(2)如何去除硝酸的黄色
向浓硝酸中通入氧气(或空气),发生反应4NO2+O2+2H2O===4HNO3,消除黄色。
小结:通常见光易分解的物质(提示---棕色试剂瓶)有:
回忆:高锰酸钾、硝酸银、双氧水、氯水(次氯酸)、硝酸...
①常温下,铁、铝遇浓硝酸钝化
②与金属反应:
浓硝酸→NO2,稀硝酸→NO,无H2放出
3)强氧化性
HNO3中氢元素为+1价氮元素为+5价,而HNO3中的+5价氮的氧化性强于+1氢,导致与金属反应时是HNO3中的+5价氮得电子被还原,不能生成H2。
Ⅰ、铜与硝酸反应:
Cu+4HNO3(浓) = Cu(NO3)2+2H2O+2NO2↑
Cu+4H++2NO3- = Cu2++2H2O+2NO2↑
3Cu+8HNO3(稀) = 3Cu(NO3)2+4H2O+2NO↑
3Cu+8H++2NO3- = 3Cu2++4H2O+2NO↑
现象:
1、浓硝酸与铜:
2、稀硝酸与铜:
试管内产生大量红棕色气体,溶液逐渐变绿,铜丝逐渐变细
试管上部出现红棕色气体,溶液逐渐变蓝,铜丝逐渐变细
Ⅱ、铁与硝酸反应:
硝酸过量:
Fe+4HNO3(稀)= Fe(NO3)3+2H2O+NO↑
Fe+4H++NO3- = Fe3++2H2O+NO↑
硝酸不足:
3Fe+8HNO3(稀)= 3Fe(NO3)2+4H2O+2NO↑
3Fe+8H++2NO3- = 3Fe2++4H2O+2NO↑
④与非金属反应:
C+4HNO3(浓) = CO2↑+4NO2↑+2H2O
⑤与还原性离子反应:
SO32-→SO42-、Fe2+→Fe3+、I-→I2
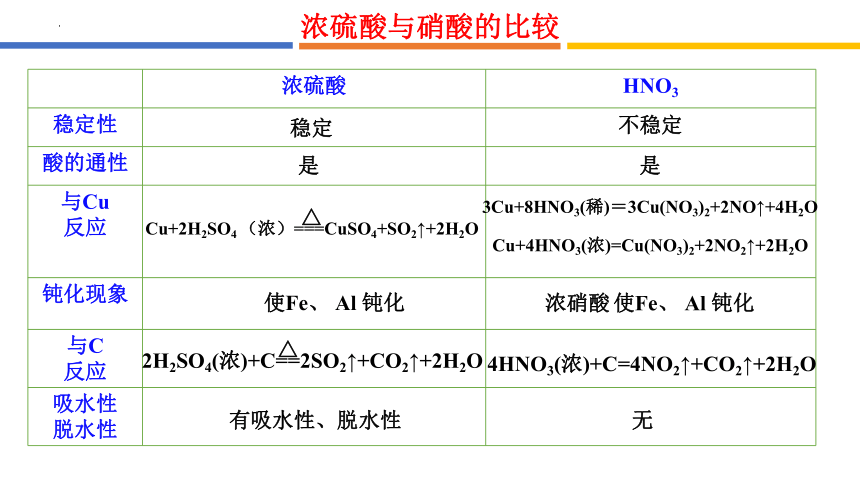
浓硫酸 HNO3
稳定性
酸的通性
与Cu 反应
钝化现象
与C 反应
吸水性 脱水性
使Fe、 Al 钝化
浓硝酸 使Fe、 Al 钝化
有吸水性、脱水性
无
Cu+2H2SO4 (浓)===CuSO4+SO2↑+2H2O
△
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
4HNO3(浓)+C=4NO2↑+CO2↑+2H2O
2H2SO4(浓)+C==2SO2↑+CO2↑+2H2O
△
浓硫酸与硝酸的比较
稳定
不稳定
是
是
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
能使不溶于硝酸的金属如金、铂等溶解。
浓硝酸和浓盐酸按体积比为1∶3混合得到的混合物。
王水
1.下列反应中硝酸既能表现出酸性又表现出氧化性的是( )
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
B
2.下列有关浓硝酸的说法不正确的是( )
A.实验室常用浓硝酸与金属锌反应制备氢气
B.常温下浓硝酸能使金属铝钝化
C.浓硝酸不稳定,见光易分解,需要避光保存
D.浓硝酸易挥发,打开瓶塞,瓶口有白雾产生
A
三阶段 三反应 三设备
NO氧化成NO2 热交换器
硝酸的生成 吸收塔
氨的催化氧化 转化器
4NH3+ 5O2 === 4NO+6H2O
催化剂
△
2NO+ O2 === 2NO2
3NO2+H2O=2HNO3+NO
3.工业上制硝酸的原理
催化剂
NH3空气
空气NH3
热交换器
转化器
吸收塔
工业制备硝酸的流程
NO、O2、N2等
NO2、O2、N2等
HNO3
H2O
煤、石油和某些金属矿物中含有硫,在燃烧或冶炼时往往会生成二氧化硫。在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物。它们会引起呼吸道疾病,危害人体健康,严重时会使人死亡。
二、酸雨及防治
(1)对人体的直接危害首先是它的刺激性,其次是它会形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部,引起肺水肿等疾病而使人致死。
(2)引起河流、湖泊的水体酸化,
严重影响水生动物生长。
(3)破坏土壤、植被、森林。
(4)腐蚀金属、油漆、皮革、纺织品及建筑材料等。
(5)渗入地下,可引起地下水酸化,酸化后的地下水中铝、铜、锌、镉等对人体有害金属元素的含量会偏高。
酸雨的危害
2
饮用酸化的地下水危害人类
腐蚀建筑物和工业设备
破坏土壤成分使农作物减产甚至死亡
损坏植物叶面导致森林死亡
破坏露天文物古迹
使湖泊中鱼虾死亡
酸雨的危害:
(1)调整能源结构,积极开发新能源
(2)对煤(其中含硫为0.3%-5%)进行处理,如选洗加工、综合
开发、在煤中加入适量的生石灰、对排放的烟进行处理等
(3)种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉)等
(4)加强工厂废气的回收处理
(5)改进汽车尾气的处理技术,控制尾气排放
酸雨的防治
3
酸雨:主要指 pH小于5.6 的雨水,其主要是含有硫酸和硝酸。
S
SO2
SO3
H2SO4
硫酸型酸雨:
硝酸型酸雨:
NO2
HNO3
成因:主要是大气中的SO2与NOx溶于水形成的。
酸雨的形成
1
Ⅰ.硫酸型酸雨的形成过程:
①SO2→SO3:____________________。
②SO2→H2SO3:__________________。
③SO3→H2SO4:_____________________。
④H2SO3→H2SO4:______________________。
SO3+H2O === H2SO4
2H2SO3+O2 === 2H2SO4
Ⅱ.硝酸型酸雨形成过程:
①NO→NO2:____________________。
②NO2→HNO3:____________________________。
2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
SO2+H2O H2SO3
2SO2+O2 2 SO3
△
催化剂
S
SO2
SO3
H2SO4
NO2
HNO3
硝化炸药军事上用得比较多的是2, 4, 6-三硝基甲苯(TNT)。它是由甲苯与浓硝酸和浓硫酸反应制得的,是一种黄色片状物,具有爆炸威力大、药性稳定、吸湿性小等优点,常用做炮弹、手榴弹、地雷和鱼雷等的炸药,也可用于采矿等爆破作业。
【科学态度与社会责任】
硝酸甘油用于治疗冠心病
制化肥、农药、染料等
【科学态度与社会责任】
“三酸两碱”是重要的化工原料,是指:
硝酸、硫酸、盐酸、
烧碱、纯碱
“三酸两碱”是衡量一个国家化工发展水平的标志
【科学态度与社会责任】
①原子守恒法
②电子得失守恒法
③电荷守恒法
④利用离子方程式计算法
4.硝酸与金属计算:
1、原子守恒法
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 ↑ + 2H2O
HNO3与金属反应时,一部分HNO3起酸的作用以NO3-的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3物质的量。
n(反应的硝酸)
= n(被还原的硝酸)+ n(未被还原的硝酸)
= n(氮的氧化物)+2n(Cu2+)
例. 25.6 mg Cu跟含有1.4×10-3 mol的硝酸恰好完全反应,反应完毕后收集到的气体在标准状况下的体积为( )
A.7.84 mL B.13.44 mL
C.15.68 mL D.17.92 mL
B
2、电子得失守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
例.某二价金属与硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则HNO3的还原产物是 ( )
A.NH4NO3 B.N2O C.NO D.NO2
AB
HNO3过量时反应后溶液中(不考虑OH-)则有:
c(NO3- )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
3、电荷守恒法
例.3.2 g铜与过量硝酸反应,硝酸被还原为NO2和NO。反应后溶液中含H+ a mol,则此时溶液中含NO3-的物质的量为__________mol。
(a+0.1)
4、利用离子方程式计算法
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO 3- 在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
例. 1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为 ( )
A.2.4g B.3.2g C. 6.4g D.9.6g
D
水吸收
碱吸收或氧化剂
还原剂
应用氮元素的二维图设计转化方案,实现氮氧化物的无害化处理
知识拓展 如何减少主要污染源—NO2
方法1:SCR(选择性催化还原)
知识拓展 如何减少主要污染源—NO2
8NH3+6NO2 ===7N2+12H2O
催化剂
方法2:碱液吸收法
2NO2+2NaOH=NaNO3+NaNO2+H2O
方法3:NSR(NOX储存还原)
方法4:汽车尾气催化转化器
2NO2+4CO==4CO2+N2
知识拓展 如何减少主要污染源—NO2
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
