广东省广州市白云中学2023-2024学年高一(上)期末化学模拟试卷(含解析)
文档属性
| 名称 | 广东省广州市白云中学2023-2024学年高一(上)期末化学模拟试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 165.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-08 15:22:50 | ||
图片预览




文档简介
2023-2024学年广东省广州市白云中学高一(上)期末化学模拟试卷
一.选择题(共14小题,满分28分,每小题2分)
1.(2分)爆炸是一种极快速的瞬时反应,较早研究爆炸反应并获得过1956年诺贝尔化学奖的科学家是( )
①欣谢尔伍德 ②艾根 ③泽韦尔 ④谢苗若夫.
A.① B.② C.③ D.①④
2.(2分)下列关于蛋白质的叙述中,错误的是( )
A.蛋白质溶液里加(NH4)2SO4溶液可使蛋白质发生变性
B.在豆浆中加少量石膏,能使豆浆凝结为豆腐
C.温度越高,酶可能失去活性,对某些化学反应的催化效率可能降低
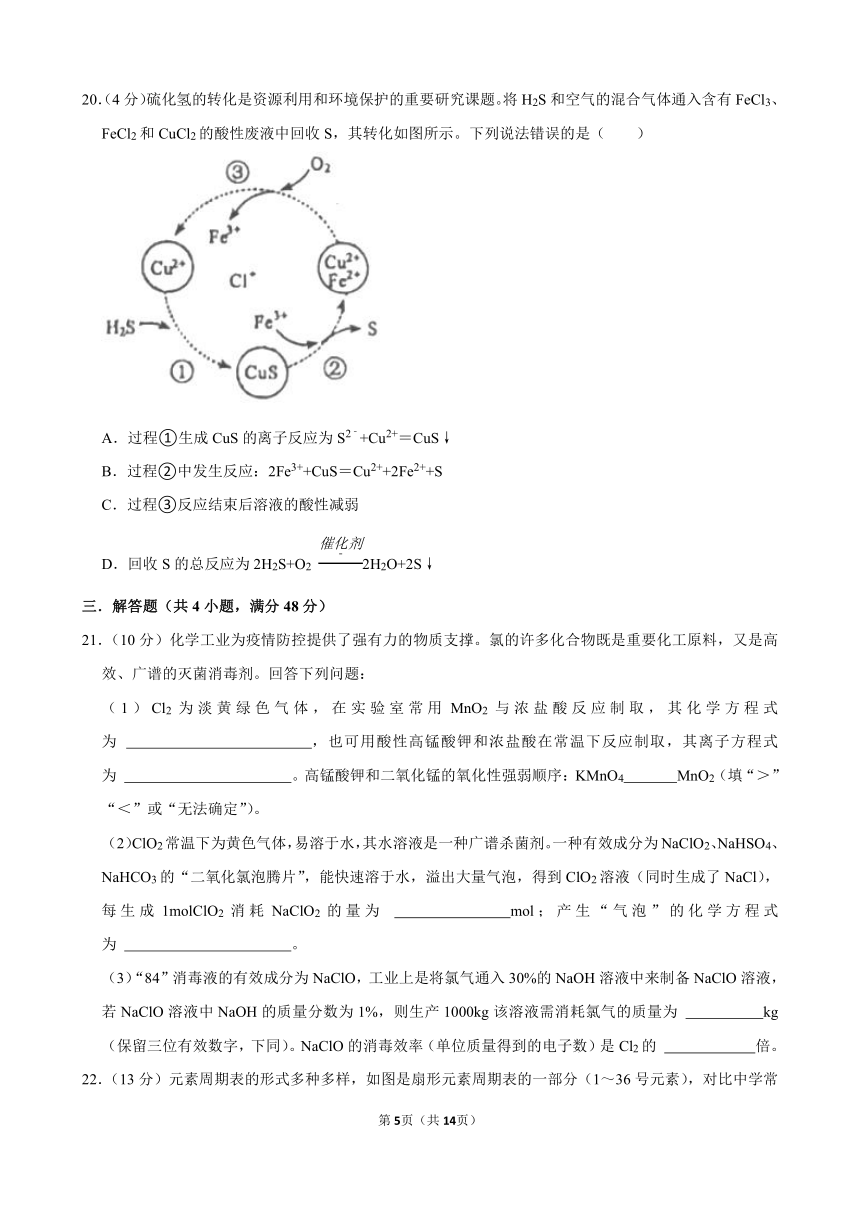
D.不是所有的蛋白质遇到浓硝酸都变成黄色
3.(2分)下列物质混合时,既能生成沉淀,又能产生气体的一组是( )
A.碳酸钠和稀盐酸 B.金属钠和硫酸铜溶液
C.金属镁和硫酸铜溶液 D.铝粉和氢氧化钠溶液
4.(2分)下列说法正确的是( )
A.C60和石墨互为同素异形体
B.H、D、T是同一种核素
C.14C与14N中含有相同的中子数
D.1H、2H2、3H+互为同位素
5.(2分)合金的应用极大地促进了人类社会的发展。下列不属于合金的是( )
A.滑雪杖杆(铝、镁等) B.地铁阻燃橡胶地板
C.航母甲板(钢) D.潜水器外壳(钛、铝等)
6.(2分)从周期表推测,若存在116号元素(用X表示),其最外层有6个电子,下列性质推断正确的是( )
A.其钠盐的化学式为Na2X
B.X是非金属元素
C.其最高价氧化物的水化物为强酸
D.其最高价氧化物为XO3
7.(2分)为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)( )
选项 实验目的 玻璃仪器 试剂
A 配制100mL一定物质的量浓度的FeCl3 100mL容量瓶、烧杯、量筒 蒸馏水、FeCl3固体
B 滴定法测定H2C2O4含量 酸式滴定管、烧杯、胶头滴管 KMnO4标准溶液
C 从海带灰获取含I﹣的溶液 烧杯、玻璃棒、漏斗 海带灰、蒸馏水
D 比较Fe3+和Cu2+对H2O2分解的催化效果 试管、胶头滴管 CuSO4溶液、FeCl3溶液、5%H2O2溶液
A.A B.B C.C D.D
8.(2分)下列说法错误的是( )
①NO2与H2O反应生成HNO3和NO,故NO2是酸性氧化物
②氨气溶于水得到的氨水能导电,氨气是电解质
③固态氯化氢不导电,液态氯化氢可以导电
④实验室中取用后剩余的钠要放回原试剂瓶中
⑤碱性氧化物一定是金属氧化物
⑥钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3
A.①②③ B.④⑤⑥ C.②④ D.①②③⑤
9.(2分)下列反应能用离子方程式:SO42﹣+Ba2+═BaSO4↓表示的是( )
A.硫酸钾溶液与硝酸钡溶液反应
B.氢氧化钡溶液与稀硫酸反应
C.氢氧化钡溶液与硫酸铜溶液反应
D.碳酸钡与稀硫酸反应
10.(2分)如图表示1gO2与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
A.C2H4 B.H2S C.NH3 D.NO
11.(2分)常温时,下列各组离子能大量共存的是( )
A.Cu2+、K+、、
B.Fe3+、、、
C.Fe2+、Na+、Cl﹣、ClO﹣
D.H+、Cl﹣、、C6H5O﹣
12.(2分)下列各组化合物中,化学键的类型相同的是( )
A.CaCl2和Na2S B.Na2O和H2O
C.CO2和NaCl D.HCl和NaOH
13.(2分)下列有关含铁物质的叙述正确的是( )
A.因Fe常温下与稀硝酸发生钝化,故能用Fe制器皿盛放稀硝酸
B.Fe3+与KSCN溶液反应产生红色沉淀
C.Fe2O3俗称铁红,Fe3O4俗称磁性氧化铁
D.配制FeSO4溶液时,需加入少量铁粉防止Fe2+发生水解反应
14.(2分)已知 Fe3O4可以表示成 FeO Fe2O3. 水热法制备 Fe3O4纳米颗粒的反应为:3Fe2++2S2O32﹣+O2+xOH﹣═Fe3O4+S4O62﹣+2H2O,下列说法正确的是( )
A.Fe2+是还原剂,S2O32﹣和 O2是氧化剂
B.每生成 1 mol Fe3O4反应转移的电子数为 2 mol
C.若有 2mol Fe2+被氧化,被 Fe2+还原的 O2为 0.5mol
D.将纳米 Fe3O4分散在水中 Fe3O4不能透过滤纸
二.选择题(共6小题,满分24分,每小题4分)
15.(4分)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,3.36 L氟化氢中含有的电子数目为1.5NA
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有共用电子对的数目为1.5NA
C.标准状况下,22.4 L己烷中含共价键数目为19 NA
D.18 g D2O和18 g H2O中含有的质子数均为10NA
16.(4分)X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述不正确的是( )
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y)
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
17.(4分)下列实验操作可以达到目的是( )
目的 操作
A 提纯含有少量甲酸的福尔马林 向含有少量甲酸的福尔马林中加入过量饱和碳酸钠溶液,充分振荡,蒸馏,收集馏出物
B 检验溴乙烷中的溴元素 取样,加NaOH溶液,振荡后再加AgNO3溶液
C 提纯含有少量苯酚的苯 向含有少量苯酚的苯中加入过量的浓溴水振荡后静置过滤,除去三溴苯酚沉淀
D 检验蔗糖是否水解 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象
A.A B.B C.C D.D
18.(4分)下列关于新制氯水和液氯的说法正确的是( )
A.新制氯水和液氯中都存在Cl2
B.新制氯水和液氯都为纯净物
C.常温下,新制氯水和液氯都可用钢瓶存放
D.新制氯水无毒,而液氯有毒
19.(4分)最近日本科学家确认世界还存在着另一种“分子足球”N60,它与C60分子结构相似.N60在高温和撞击后会释放出巨大能量.下列对N60的说法不正确的是( )
A.N60和14N都是氮的同位素
B.N60和N2都是氮的同素异形体
C.N60中氮原子之间由共价键结合
D.N60高温和撞击后应该生成N2
20.(4分)硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入含有FeCl3、FeCl2和CuCl2的酸性废液中回收S,其转化如图所示。下列说法错误的是( )
A.过程①生成CuS的离子反应为S2﹣+Cu2+=CuS↓
B.过程②中发生反应:2Fe3++CuS=Cu2++2Fe2++S
C.过程③反应结束后溶液的酸性减弱
D.回收S的总反应为2H2S+O2 2H2O+2S↓
三.解答题(共4小题,满分48分)
21.(10分)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)Cl2为淡黄绿色气体,在实验室常用MnO2与浓盐酸反应制取,其化学方程式为 ,也可用酸性高锰酸钾和浓盐酸在常温下反应制取,其离子方程式为 。高锰酸钾和二氧化锰的氧化性强弱顺序:KMnO4 MnO2(填“>”“<”或“无法确定”)。
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液(同时生成了NaCl),每生成1molClO2消耗NaClO2的量为 mol;产生“气泡”的化学方程式为 。
(3)“84”消毒液的有效成分为NaClO,工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留三位有效数字,下同)。NaClO的消毒效率(单位质量得到的电子数)是Cl2的 倍。
22.(13分)元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
(1)表中用字母标出的14种元素中,化学性质最不活泼的是 (用元素符号表示,下同);常温常压下其单质为液态的非金属元素是 。
(2)N的基态原子的价层电子排布式为 ,属于 区元素。
(3)这14种元素中第一电离能最小的是 (用元素符号表示,下同),电负性最大的是 。
(4)这些元素中的第三周期主族元素中,原子半径最小的是 (填元素符号),简单离子半径最小的是 。(填离子符号)
23.(10分)如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:
(1)装置A中反应的化学方程式为 ;
(2)装置B中的反应的离子方程式是 ;
(3)装置C中现象是 ,原因是: ;
(4)装置D中所装试剂是 ,作用是 ;
(5)装置F中发生反应的化学方程式为 .
24.(15分)据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。某兴趣小组制备KH2PO4,流程如图。
已知:
a.KH2PO4有潮解性,溶于水,不溶于乙醇和醚等有机溶剂。
b.HCl易溶于乙醇和醚等有机溶剂。
请回答:
(1)步骤Ⅱ的实验操作是 。
(2)有关步骤Ⅲ,下列说法正确的是 。
A.有机溶剂M可用乙醇
B.步骤Ⅲ与步骤Ⅱ的实验操作基本相同
C.NH4Cl在水中溶解度明显大于在有机溶剂M中
D.有机溶剂M可循环使用
(3)试从平衡角度分析,由步骤Ⅰ、Ⅱ得到KH2PO4溶液的原理: 。
(4)在下列仪器中,使用前需进行“检漏”操作的是 。
A.吸滤瓶 B.球型分液漏斗 C.蒸馏烧瓶 D.碱式滴定管
(5)步骤Ⅳ,包括蒸发浓缩、冷却结晶、过滤、干燥等多步操作。在冷却结晶操作中,为了得到磷酸二氢钾大晶体,常采取的措施有 。某同学发现使用加热浓缩、冷却结晶得到的磷酸二氢钾晶体欠佳,请提出针对性的改进实验方案: ,然后经过滤、干燥得到晶体。
2023-2024学年广东省广州市白云中学高一(上)期末化学模拟试卷
参考答案与试题解析
一.选择题(共14小题,满分28分,每小题2分)
1.【解答】解:爆炸是一种极快速的瞬时反应,在极短的时间内和有限的空间内快速反应,气体的体积急速膨胀导致爆炸的发生。1956年,欣谢尔伍德和谢苗若夫由于研究爆炸反应而获得诺贝尔化学奖,故选D。
2.【解答】解:A.饱和(NH4)2SO4溶液可使蛋白质发生盐析,故A错误;
B.豆浆是胶体,遇电解质会聚沉,石膏是电解质,故豆浆会凝结为豆腐,故B正确;
C.酶在高温下会变性,从而失去活性,故C正确;
D.含苯环的蛋白质遇浓硝酸才会变黄色,故并不一定所有的蛋白质遇浓硝酸都变黄,故D错误;
故选:A。
3.【解答】解:A、碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,故A错误;
B、钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故B正确;
C、镁和硫酸铜溶液反应生成硫酸镁和铜,反应为:CuSO4+Mg=Cu+MgSO4,故C错误;
D、铝粉和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故D错误;
故选:B。
4.【解答】解:A.C60和石墨是碳元素的不同单质,互为同素异形体,故A正确;
B.H、D、T是氢元素质量数不同的三种核素,故B错误;
C.14C与14N中含有的中子数分别为14﹣6=8,14﹣7=7,中子数不同,故C错误;
D.1H、2H2、3H+分别为原子、分子和离子,不是原子,不能互为同位素,故D错误;
故选:A。
5.【解答】解:A.滑雪杖杆(铝、镁等)为镁铝合金,故A不选;
B.地铁阻燃橡胶地板,橡胶为有机高分子材料,不是合金,故B选;
C.航母甲板(钢),钢为碳、铁合金,故C不选;
D.潜水器外壳(钛、铝等)为钛铝合金,故D不选;
故选:B。
6.【解答】解:A.X应为金属元素,不存在Na2X,故A错误;
B.X的金属性大于Po,为金属元素,故B错误;
C.X为金属元素,其最高价氧化物的水化物显碱性,故C错误;
D.最高价为+6价,其最高价氧化物为XO3,故D正确;
故选:D。
7.【解答】解:A.配制100mL一定物质的量浓度的FeCl3时缺少玻璃棒和胶头滴管,故A错误;
B.滴定法测定H2C2O4含量时,缺少H2C2O4溶液和锥形瓶,故B错误;
C.从海带灰获取含I﹣的溶液需要溶解和过滤,使用的试剂是海带灰、蒸馏水,玻璃仪器是烧杯、玻璃棒、漏斗,故C正确;
D.两种盐溶液中阴阳离子都不同,无法比较Fe3+和Cu2+对H2O2分解的催化效果,要完成实验需要同浓度且同种阴离子的铁盐和铜盐,故D错误;
故选:C。
8.【解答】解:①酸性氧化物与水反应只生成酸,二氧化氮与水反应生成硝酸和一氧化氮,不是酸性氧化物,故①错误;
②氨气溶于水得到的氨水能导电是一水合氨导电,氨气是非电解质,故②错误;
③液态氯化氢没有自由移动的离子,故不能导电,故③错误;
④钠比较活泼,用完后不能随意丢弃,实验室中取用后剩余的钠要放回原试剂瓶中,故④正确;
⑤碱性氧化物一定是金属氧化物,故⑤正确;
⑥钠与水先反应生成氢氧化钠和氢气,氢氧化钠再和氯化铵反应生成氨气,故⑥正确;
故错误的是①②③;
故选:A。
9.【解答】解:A.硫酸钾与硝酸钡溶液反应的离子方程式为:SO42﹣+Ba2+═BaSO4↓,故A正确;
B.氢氧化钡与稀硫酸反应的离子方程式为:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O,反应中还生成了水,不能用SO42﹣+Ba2+═BaSO4↓表示,故B错误;
C.氢氧化钡溶液与硫酸铜溶液反应的离子方程式为:SO42﹣+Ba2++Cu2++2OH﹣=Cu(OH)2↓+BaSO4↓,反应还生成了氢氧化铜沉淀,不能用SO42﹣+Ba2+═BaSO4↓表示,故C错误;
D.碳酸钡与稀硫酸反应的离子方程式为:BaCO3+2H++SO42﹣═BaSO4+H2O+CO2↑,碳酸钡不能拆开,不能用SO42﹣+Ba2+═BaSO4↓表示,故D错误;
故选:A。
10.【解答】解:由图可知,相同温度时,p(O2)>p(X),根据PV=nRTRT知,在同质量、同体积条件下,气体相对分子质量与压强成反比,即相对分子质量越大,压强越小,只有H2S的相对分子质量大于O2,所以该气体可能是硫化氢,
故选:B。
11.【解答】解:A.Cu2+、反应生成沉淀而不能大量共存,故A错误;
B.离子之间不发生任何反应,可大量共存,故B正确;
C.Fe2+、ClO﹣发生氧化还原反应而不能大量共存,故C错误;
D.H+、C6H5O﹣生成苯酚而不能大量共存,故D错误。
故选:B。
12.【解答】解:A.均含离子键,故A选;
B.Na2O中含离子键,H2O中含共价键,故B不选;
C.CO2中含共价键,NaCl中含离子键,故C不选;
D.HCl中含共价键,NaOH中含离子键和共价键,故D不选;
故选:A。
13.【解答】解:A.Fe常温下与稀硝酸可发生氧化还原反应生成硝酸盐、NO和水,不能发生钝化,常温下Fe遇浓硝酸发生钝化,故A错误;
B.Fe3+与KSCN溶液反应,溶液为血红色,不生成沉淀,故B错误;
C.Fe2O3为红棕色,Fe3O4可被磁铁吸引,则Fe2O3俗称铁红,Fe3O4俗称磁性氧化铁,故C正确;
D.Fe具有还原性,可还原铁离子生成亚铁离子,则配制FeSO4溶液时,需加入少量铁粉防止Fe2+被氧化,故D错误;
故选:C。
14.【解答】解:A.Fe、S元素的化合价升高,O元素的化合价降低,则O2是氧化剂,S2O32﹣和Fe2+是还原剂,故A错误;
B.每生成1molFe3O4,由O元素的化合价变化可知,转移电子数为1mol×2×(2﹣0)=4mol,故B错误;
C.若有2molFe2+被氧化,由电子守恒可知,则被Fe2+还原的O2为0.5mol,故C正确;
D.将纳米 Fe3O4分散是胶体,在水中 Fe3O4能透过滤纸,故D错误;
故选:C。
二.选择题(共6小题,满分24分,每小题4分)
15.【解答】解:A.标况下,氢氟酸为液体不能使用气体摩尔体积,故A错误;
B.乙烯和丙烯最简式都是CH2,70g乙烯和丙烯混合物含有CH2单元0.5mol,含有共用电子对0.5mol×3=1.5mol,含有共用电子对的数目为1.5NA,故B正确;
C.标准状况下己烷为液体,不能使用气体摩尔体积,无法计算22.4 L己烷物质的量,故C错误;
D.18 g D2O物质的量为0.9mol,含有9NA个质子,18 g H2O物质的量为1mol,含有的质子数为10NA,故D错误;
故选:B。
16.【解答】解:X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的金属性最强,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的核外电子数是17,所以R是Cl元素,
A.X是C元素,Y是O元素,含有碳氧元素的化合物有一氧化碳和二氧化碳,故A正确;
B.原子的电子层数越多,其原子半径越大,同一周期中,元素的原子半径随着原子序数的增大而减小,C、O元素位于第二周期,Na、Cl元素位于第三周期,且O元素的原子序数大于C、Cl的原子序数大于Na,所以原子半径大小顺序是rz>rR>rx>ry,故B正确;
C.X、Z分别与R形成的化合物分别是CCl4、NaCl,四氯化碳中只含共价键,氯化钠中只含离子键,故C正确;
D.Y、Z、R分别是O、Na、Cl元素,含有三种元素的化合物有NaClO、NaClO2、NaClO3、NaClO4等,故D错误;
故选:D。
17.【解答】解:A.甲酸与碳酸钠反应,增大与甲醛的沸点差异,充分振荡,蒸馏,收集馏出物可除杂,故A正确;
B.溴乙烷水解后,应在酸性条件下检验溴离子,则没有加硝酸至酸性,不能检验,故B错误;
C.溴易溶于苯,不能除杂,应选NaOH、分液,故C错误;
D.蔗糖水解后,应在碱性条件下检验葡萄糖,没有加碱至碱性不能检验,故D错误;
故选:A。
18.【解答】解:A.氯水中存在化学平衡,存在氯气分子,液氯是液态氯气,故A正确;
B.新制氯水为混合物,故B错误;
C.液氯可以用钢瓶存放,但氯水中的HCl和HClO都会与铁反应,不能用钢瓶存放,故C错误;
D.新制氯水含Cl2,也有毒,故D错误;
故选:A。
19.【解答】解:A.N60是单质,14N是氮的同位素,故A错误;
B.N60与N2符合同素异形体的概念,N60与N2互为同素异形体,故B正确;
C.N60中只含氮原子,原子之间由共价键结合,故C正确;
D.N60在高温和撞击后释放巨大能量,说明生成了N元素的很稳定的形式,而熟知的N最稳定存在形式就是N2,故D正确。
故选:A。
20.【解答】解:A.过程①中,H2S与Cu2+发生复分解反应生成沉淀,则生成CuS的反应为H2S+Cu2+═CuS↓+2H+,故A错误;
B.过程②中发生反应CuS+2Fe3+=S+2Fe2++Cu2+,故B正确;
C.过程③中发生4Fe2++O2+4H+=4Fe3++2H2O,氢离子浓度减小,溶液酸性减弱,故C正确;
D.由反应①②③可知,回收S的总反应为2H2S+O22H2O+2S↓,故D正确;
故选:A。
三.解答题(共4小题,满分48分)
21.【解答】解:(1)二氧化锰与浓盐酸加热反应生成氯气、氯化锰和水,发生反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;酸性高锰酸钾和浓盐酸在常温下反应制取氯气,依据得失电子守恒和电荷守恒可知,离子方程式为210Cl﹣+16H+=2Mn2++5Cl2↑+8H2O,KMnO4与浓盐酸反应制备氯气时不需要加热,二氧化锰与浓盐酸反应生成氯气需要加热,故KMnO4的氧化性强于MnO2,所以氧化性由强到弱的顺序为KMnO4>MnO2,
故答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;210Cl﹣+16H+=2Mn2++5Cl2↑+8H2O;>;
(2)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液,上述过程中,生成ClO2的反应属于歧化反应,54H+═4ClO2+Cl﹣+2H2O,54H+═4ClO2+Cl﹣+2H2O中5个反应生成4个ClO2和1个Cl﹣,则每生成 1mol ClO2消耗NaClO2的量为1.25mol;NaHSO4和NaHCO3混合产生“气泡”,其反应的化学方程式为NaHCO3+NaHSO4=CO2↑+Na2SO4+H2O,
故答案为:1.25;NaHCO3+NaHSO4=CO2↑+Na2SO4+H2O;
(3)根据反应:Cl2+2NaOH=NaClO+NaCl+H2O,设氯气质量为xkg,其物质的量为mol,则消耗的NaOH的质量为mol×2×40g/molgkg,溶液中剩余NaOH为1000kg×1%=10kg,100%=30%,解得:x=203kg,设质量都是71g,氯气得到的电子数为2×1=2mol,NaClO得到的电子数为1×2mol,则NaClO的消毒效率(单位质量得到的电子数)是Cl2的倍数为0.953,
故答案为:203;0.953。
22.【解答】解:根据图知,A﹣N分别是H、K、C、N、F、Mg、Al、Ge、P、S、Cl、Ar、Ca、Br,
(1)几种元素中化学性质最不活泼的是稀有气体元素,则最不活泼的是Ar;常温常压下其单质为液态的非金属元素是Br,
故答案为:Ar;Br;
(2)N是Br元素,最外层为第四层,具有7个电子,则Br的基态原子的价层电子排布式为4s24p5;Br原子的最外层电子为p电子,属于p区元素,
故答案为:4s24p5;p;
(3)元素的金属性越强,越容易失去电子,最容易失电子最外层一个电子的元素,其第一电离能最小,则第一电离能最小的是K,非金属性越强,电负性越强,所以电负性最强的是F,
故答案为:K;F;
(4)第三周期主族元素中,从左到右原子半径逐渐减小,则第三周期主族元素中,原子半径最小的是Cl;电子层相同时,原子序数越大,微粒半径越小,则离子半径:P3﹣>S2﹣>Cl﹣>Mg2+>Al3+,所以简单离子半径最小的是Al3+,
故答案为:Cl;Al3+。
23.【解答】解:(1)由装置图和实验目的分析判断,制备氯气是用固体二氧化锰和液体浓盐酸,固体在圆底烧瓶中,盐酸在分液漏斗中;浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,反应化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)氯气有氧化性,能置换出碘化钾中的碘,碘单质遇到淀粉变蓝;发生反应的离子方程式为:Cl2+2I﹣=2Cl﹣+I2,
故答案为:Cl2+2I﹣=2Cl﹣+I2;
(3)氯气和水反应生成次氯酸、盐酸,次氯酸具有漂白性能使有色布条褪色,
故答案为:有色布条褪色;氯气与水反应生成了有漂白性的HClO;
(4)浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气,
故答案为:浓硫酸;吸收水分干燥氯气;
(5)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气,反应化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O.
24.【解答】解:(1)反应产生的HCl易溶于有机萃取剂,经萃取后,有机层含有HCl,步骤Ⅱ的实验操作是萃取、分液。
故答案为:萃取、分液;
(2)A.乙醇与水互溶,不分层,有机溶剂 M 不可用乙醇,故A错误;
B.步骤Ⅲ与步骤Ⅱ的实验操作基本相同,都是萃取、分液,故B正确;
C.Ⅲ.用氨水进行反萃取,Ⅴ.可得到氯化铵,说明NH4Cl 在水中溶解度明显大于在有机溶剂 M 中,故C正确;
D.用氨水进行反萃取,有机溶剂 M 可循环使用,故D正确。
故答案为:BCD;
(3)由步骤Ⅰ、Ⅱ得到 KH2PO4 溶液的原理:步骤Ⅰ.磷酸加入KCl,发生KCl+H3PO4 KH2PO4+HCl,步骤Ⅱ.反应产生的HCl易溶于有机萃取剂,经萃取后,水相中HCl浓度降低,平衡正向移动,生成KH2PO4。
故答案为:步骤Ⅰ.磷酸加入KCl,发生KCl+H3PO4 KH2PO4+HCl,步骤Ⅱ.反应产生的HCl易溶于有机萃取剂,经萃取后,水相中HCl浓度降低,平衡正向移动,生成KH2PO4;
(4)有活塞的仪器在使用前需进行“检漏”操作。
A.吸滤瓶没有活塞,连接好仪器后要检查气密性,故A不选;
B.球型分液漏斗有活塞,在使用前需进行“检漏”操作,故B选;
C.蒸馏烧瓶没有活塞,连接好仪器后要检查气密性,故C不选;
D.碱式滴定管有活塞,在使用前需进行“检漏”操作,故D选。
故答案为:BD;
(5)步骤Ⅳ,包括蒸发浓缩、冷却结晶、过滤、干燥等多步操作。在冷却结晶操作中,为了得到磷酸二氢钾大晶体,常采取的措施有:自然冷却(缓慢冷却)。某同学发现使用加热浓缩、冷却结晶得到的磷酸二氢钾晶体欠佳,请提出针对性的改进实验 方案:在磷酸二氢钾溶液中加入乙醇,然后经过滤、干燥得到晶体。
故答案为:自然冷却(缓慢冷却);在磷酸二氢钾溶液中加入乙醇。
第1页(共1页)
一.选择题(共14小题,满分28分,每小题2分)
1.(2分)爆炸是一种极快速的瞬时反应,较早研究爆炸反应并获得过1956年诺贝尔化学奖的科学家是( )
①欣谢尔伍德 ②艾根 ③泽韦尔 ④谢苗若夫.
A.① B.② C.③ D.①④
2.(2分)下列关于蛋白质的叙述中,错误的是( )
A.蛋白质溶液里加(NH4)2SO4溶液可使蛋白质发生变性
B.在豆浆中加少量石膏,能使豆浆凝结为豆腐
C.温度越高,酶可能失去活性,对某些化学反应的催化效率可能降低
D.不是所有的蛋白质遇到浓硝酸都变成黄色
3.(2分)下列物质混合时,既能生成沉淀,又能产生气体的一组是( )
A.碳酸钠和稀盐酸 B.金属钠和硫酸铜溶液
C.金属镁和硫酸铜溶液 D.铝粉和氢氧化钠溶液
4.(2分)下列说法正确的是( )
A.C60和石墨互为同素异形体
B.H、D、T是同一种核素
C.14C与14N中含有相同的中子数
D.1H、2H2、3H+互为同位素
5.(2分)合金的应用极大地促进了人类社会的发展。下列不属于合金的是( )
A.滑雪杖杆(铝、镁等) B.地铁阻燃橡胶地板
C.航母甲板(钢) D.潜水器外壳(钛、铝等)
6.(2分)从周期表推测,若存在116号元素(用X表示),其最外层有6个电子,下列性质推断正确的是( )
A.其钠盐的化学式为Na2X
B.X是非金属元素
C.其最高价氧化物的水化物为强酸
D.其最高价氧化物为XO3
7.(2分)为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)( )
选项 实验目的 玻璃仪器 试剂
A 配制100mL一定物质的量浓度的FeCl3 100mL容量瓶、烧杯、量筒 蒸馏水、FeCl3固体
B 滴定法测定H2C2O4含量 酸式滴定管、烧杯、胶头滴管 KMnO4标准溶液
C 从海带灰获取含I﹣的溶液 烧杯、玻璃棒、漏斗 海带灰、蒸馏水
D 比较Fe3+和Cu2+对H2O2分解的催化效果 试管、胶头滴管 CuSO4溶液、FeCl3溶液、5%H2O2溶液
A.A B.B C.C D.D
8.(2分)下列说法错误的是( )
①NO2与H2O反应生成HNO3和NO,故NO2是酸性氧化物
②氨气溶于水得到的氨水能导电,氨气是电解质
③固态氯化氢不导电,液态氯化氢可以导电
④实验室中取用后剩余的钠要放回原试剂瓶中
⑤碱性氧化物一定是金属氧化物
⑥钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3
A.①②③ B.④⑤⑥ C.②④ D.①②③⑤
9.(2分)下列反应能用离子方程式:SO42﹣+Ba2+═BaSO4↓表示的是( )
A.硫酸钾溶液与硝酸钡溶液反应
B.氢氧化钡溶液与稀硫酸反应
C.氢氧化钡溶液与硫酸铜溶液反应
D.碳酸钡与稀硫酸反应
10.(2分)如图表示1gO2与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
A.C2H4 B.H2S C.NH3 D.NO
11.(2分)常温时,下列各组离子能大量共存的是( )
A.Cu2+、K+、、
B.Fe3+、、、
C.Fe2+、Na+、Cl﹣、ClO﹣
D.H+、Cl﹣、、C6H5O﹣
12.(2分)下列各组化合物中,化学键的类型相同的是( )
A.CaCl2和Na2S B.Na2O和H2O
C.CO2和NaCl D.HCl和NaOH
13.(2分)下列有关含铁物质的叙述正确的是( )
A.因Fe常温下与稀硝酸发生钝化,故能用Fe制器皿盛放稀硝酸
B.Fe3+与KSCN溶液反应产生红色沉淀
C.Fe2O3俗称铁红,Fe3O4俗称磁性氧化铁
D.配制FeSO4溶液时,需加入少量铁粉防止Fe2+发生水解反应
14.(2分)已知 Fe3O4可以表示成 FeO Fe2O3. 水热法制备 Fe3O4纳米颗粒的反应为:3Fe2++2S2O32﹣+O2+xOH﹣═Fe3O4+S4O62﹣+2H2O,下列说法正确的是( )
A.Fe2+是还原剂,S2O32﹣和 O2是氧化剂
B.每生成 1 mol Fe3O4反应转移的电子数为 2 mol
C.若有 2mol Fe2+被氧化,被 Fe2+还原的 O2为 0.5mol
D.将纳米 Fe3O4分散在水中 Fe3O4不能透过滤纸
二.选择题(共6小题,满分24分,每小题4分)
15.(4分)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,3.36 L氟化氢中含有的电子数目为1.5NA
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有共用电子对的数目为1.5NA
C.标准状况下,22.4 L己烷中含共价键数目为19 NA
D.18 g D2O和18 g H2O中含有的质子数均为10NA
16.(4分)X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述不正确的是( )
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y)
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
17.(4分)下列实验操作可以达到目的是( )
目的 操作
A 提纯含有少量甲酸的福尔马林 向含有少量甲酸的福尔马林中加入过量饱和碳酸钠溶液,充分振荡,蒸馏,收集馏出物
B 检验溴乙烷中的溴元素 取样,加NaOH溶液,振荡后再加AgNO3溶液
C 提纯含有少量苯酚的苯 向含有少量苯酚的苯中加入过量的浓溴水振荡后静置过滤,除去三溴苯酚沉淀
D 检验蔗糖是否水解 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象
A.A B.B C.C D.D
18.(4分)下列关于新制氯水和液氯的说法正确的是( )
A.新制氯水和液氯中都存在Cl2
B.新制氯水和液氯都为纯净物
C.常温下,新制氯水和液氯都可用钢瓶存放
D.新制氯水无毒,而液氯有毒
19.(4分)最近日本科学家确认世界还存在着另一种“分子足球”N60,它与C60分子结构相似.N60在高温和撞击后会释放出巨大能量.下列对N60的说法不正确的是( )
A.N60和14N都是氮的同位素
B.N60和N2都是氮的同素异形体
C.N60中氮原子之间由共价键结合
D.N60高温和撞击后应该生成N2
20.(4分)硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入含有FeCl3、FeCl2和CuCl2的酸性废液中回收S,其转化如图所示。下列说法错误的是( )
A.过程①生成CuS的离子反应为S2﹣+Cu2+=CuS↓
B.过程②中发生反应:2Fe3++CuS=Cu2++2Fe2++S
C.过程③反应结束后溶液的酸性减弱
D.回收S的总反应为2H2S+O2 2H2O+2S↓
三.解答题(共4小题,满分48分)
21.(10分)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)Cl2为淡黄绿色气体,在实验室常用MnO2与浓盐酸反应制取,其化学方程式为 ,也可用酸性高锰酸钾和浓盐酸在常温下反应制取,其离子方程式为 。高锰酸钾和二氧化锰的氧化性强弱顺序:KMnO4 MnO2(填“>”“<”或“无法确定”)。
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液(同时生成了NaCl),每生成1molClO2消耗NaClO2的量为 mol;产生“气泡”的化学方程式为 。
(3)“84”消毒液的有效成分为NaClO,工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留三位有效数字,下同)。NaClO的消毒效率(单位质量得到的电子数)是Cl2的 倍。
22.(13分)元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
(1)表中用字母标出的14种元素中,化学性质最不活泼的是 (用元素符号表示,下同);常温常压下其单质为液态的非金属元素是 。
(2)N的基态原子的价层电子排布式为 ,属于 区元素。
(3)这14种元素中第一电离能最小的是 (用元素符号表示,下同),电负性最大的是 。
(4)这些元素中的第三周期主族元素中,原子半径最小的是 (填元素符号),简单离子半径最小的是 。(填离子符号)
23.(10分)如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:
(1)装置A中反应的化学方程式为 ;
(2)装置B中的反应的离子方程式是 ;
(3)装置C中现象是 ,原因是: ;
(4)装置D中所装试剂是 ,作用是 ;
(5)装置F中发生反应的化学方程式为 .
24.(15分)据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。某兴趣小组制备KH2PO4,流程如图。
已知:
a.KH2PO4有潮解性,溶于水,不溶于乙醇和醚等有机溶剂。
b.HCl易溶于乙醇和醚等有机溶剂。
请回答:
(1)步骤Ⅱ的实验操作是 。
(2)有关步骤Ⅲ,下列说法正确的是 。
A.有机溶剂M可用乙醇
B.步骤Ⅲ与步骤Ⅱ的实验操作基本相同
C.NH4Cl在水中溶解度明显大于在有机溶剂M中
D.有机溶剂M可循环使用
(3)试从平衡角度分析,由步骤Ⅰ、Ⅱ得到KH2PO4溶液的原理: 。
(4)在下列仪器中,使用前需进行“检漏”操作的是 。
A.吸滤瓶 B.球型分液漏斗 C.蒸馏烧瓶 D.碱式滴定管
(5)步骤Ⅳ,包括蒸发浓缩、冷却结晶、过滤、干燥等多步操作。在冷却结晶操作中,为了得到磷酸二氢钾大晶体,常采取的措施有 。某同学发现使用加热浓缩、冷却结晶得到的磷酸二氢钾晶体欠佳,请提出针对性的改进实验方案: ,然后经过滤、干燥得到晶体。
2023-2024学年广东省广州市白云中学高一(上)期末化学模拟试卷
参考答案与试题解析
一.选择题(共14小题,满分28分,每小题2分)
1.【解答】解:爆炸是一种极快速的瞬时反应,在极短的时间内和有限的空间内快速反应,气体的体积急速膨胀导致爆炸的发生。1956年,欣谢尔伍德和谢苗若夫由于研究爆炸反应而获得诺贝尔化学奖,故选D。
2.【解答】解:A.饱和(NH4)2SO4溶液可使蛋白质发生盐析,故A错误;
B.豆浆是胶体,遇电解质会聚沉,石膏是电解质,故豆浆会凝结为豆腐,故B正确;
C.酶在高温下会变性,从而失去活性,故C正确;
D.含苯环的蛋白质遇浓硝酸才会变黄色,故并不一定所有的蛋白质遇浓硝酸都变黄,故D错误;
故选:A。
3.【解答】解:A、碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,故A错误;
B、钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故B正确;
C、镁和硫酸铜溶液反应生成硫酸镁和铜,反应为:CuSO4+Mg=Cu+MgSO4,故C错误;
D、铝粉和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故D错误;
故选:B。
4.【解答】解:A.C60和石墨是碳元素的不同单质,互为同素异形体,故A正确;
B.H、D、T是氢元素质量数不同的三种核素,故B错误;
C.14C与14N中含有的中子数分别为14﹣6=8,14﹣7=7,中子数不同,故C错误;
D.1H、2H2、3H+分别为原子、分子和离子,不是原子,不能互为同位素,故D错误;
故选:A。
5.【解答】解:A.滑雪杖杆(铝、镁等)为镁铝合金,故A不选;
B.地铁阻燃橡胶地板,橡胶为有机高分子材料,不是合金,故B选;
C.航母甲板(钢),钢为碳、铁合金,故C不选;
D.潜水器外壳(钛、铝等)为钛铝合金,故D不选;
故选:B。
6.【解答】解:A.X应为金属元素,不存在Na2X,故A错误;
B.X的金属性大于Po,为金属元素,故B错误;
C.X为金属元素,其最高价氧化物的水化物显碱性,故C错误;
D.最高价为+6价,其最高价氧化物为XO3,故D正确;
故选:D。
7.【解答】解:A.配制100mL一定物质的量浓度的FeCl3时缺少玻璃棒和胶头滴管,故A错误;
B.滴定法测定H2C2O4含量时,缺少H2C2O4溶液和锥形瓶,故B错误;
C.从海带灰获取含I﹣的溶液需要溶解和过滤,使用的试剂是海带灰、蒸馏水,玻璃仪器是烧杯、玻璃棒、漏斗,故C正确;
D.两种盐溶液中阴阳离子都不同,无法比较Fe3+和Cu2+对H2O2分解的催化效果,要完成实验需要同浓度且同种阴离子的铁盐和铜盐,故D错误;
故选:C。
8.【解答】解:①酸性氧化物与水反应只生成酸,二氧化氮与水反应生成硝酸和一氧化氮,不是酸性氧化物,故①错误;
②氨气溶于水得到的氨水能导电是一水合氨导电,氨气是非电解质,故②错误;
③液态氯化氢没有自由移动的离子,故不能导电,故③错误;
④钠比较活泼,用完后不能随意丢弃,实验室中取用后剩余的钠要放回原试剂瓶中,故④正确;
⑤碱性氧化物一定是金属氧化物,故⑤正确;
⑥钠与水先反应生成氢氧化钠和氢气,氢氧化钠再和氯化铵反应生成氨气,故⑥正确;
故错误的是①②③;
故选:A。
9.【解答】解:A.硫酸钾与硝酸钡溶液反应的离子方程式为:SO42﹣+Ba2+═BaSO4↓,故A正确;
B.氢氧化钡与稀硫酸反应的离子方程式为:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O,反应中还生成了水,不能用SO42﹣+Ba2+═BaSO4↓表示,故B错误;
C.氢氧化钡溶液与硫酸铜溶液反应的离子方程式为:SO42﹣+Ba2++Cu2++2OH﹣=Cu(OH)2↓+BaSO4↓,反应还生成了氢氧化铜沉淀,不能用SO42﹣+Ba2+═BaSO4↓表示,故C错误;
D.碳酸钡与稀硫酸反应的离子方程式为:BaCO3+2H++SO42﹣═BaSO4+H2O+CO2↑,碳酸钡不能拆开,不能用SO42﹣+Ba2+═BaSO4↓表示,故D错误;
故选:A。
10.【解答】解:由图可知,相同温度时,p(O2)>p(X),根据PV=nRTRT知,在同质量、同体积条件下,气体相对分子质量与压强成反比,即相对分子质量越大,压强越小,只有H2S的相对分子质量大于O2,所以该气体可能是硫化氢,
故选:B。
11.【解答】解:A.Cu2+、反应生成沉淀而不能大量共存,故A错误;
B.离子之间不发生任何反应,可大量共存,故B正确;
C.Fe2+、ClO﹣发生氧化还原反应而不能大量共存,故C错误;
D.H+、C6H5O﹣生成苯酚而不能大量共存,故D错误。
故选:B。
12.【解答】解:A.均含离子键,故A选;
B.Na2O中含离子键,H2O中含共价键,故B不选;
C.CO2中含共价键,NaCl中含离子键,故C不选;
D.HCl中含共价键,NaOH中含离子键和共价键,故D不选;
故选:A。
13.【解答】解:A.Fe常温下与稀硝酸可发生氧化还原反应生成硝酸盐、NO和水,不能发生钝化,常温下Fe遇浓硝酸发生钝化,故A错误;
B.Fe3+与KSCN溶液反应,溶液为血红色,不生成沉淀,故B错误;
C.Fe2O3为红棕色,Fe3O4可被磁铁吸引,则Fe2O3俗称铁红,Fe3O4俗称磁性氧化铁,故C正确;
D.Fe具有还原性,可还原铁离子生成亚铁离子,则配制FeSO4溶液时,需加入少量铁粉防止Fe2+被氧化,故D错误;
故选:C。
14.【解答】解:A.Fe、S元素的化合价升高,O元素的化合价降低,则O2是氧化剂,S2O32﹣和Fe2+是还原剂,故A错误;
B.每生成1molFe3O4,由O元素的化合价变化可知,转移电子数为1mol×2×(2﹣0)=4mol,故B错误;
C.若有2molFe2+被氧化,由电子守恒可知,则被Fe2+还原的O2为0.5mol,故C正确;
D.将纳米 Fe3O4分散是胶体,在水中 Fe3O4能透过滤纸,故D错误;
故选:C。
二.选择题(共6小题,满分24分,每小题4分)
15.【解答】解:A.标况下,氢氟酸为液体不能使用气体摩尔体积,故A错误;
B.乙烯和丙烯最简式都是CH2,70g乙烯和丙烯混合物含有CH2单元0.5mol,含有共用电子对0.5mol×3=1.5mol,含有共用电子对的数目为1.5NA,故B正确;
C.标准状况下己烷为液体,不能使用气体摩尔体积,无法计算22.4 L己烷物质的量,故C错误;
D.18 g D2O物质的量为0.9mol,含有9NA个质子,18 g H2O物质的量为1mol,含有的质子数为10NA,故D错误;
故选:B。
16.【解答】解:X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的金属性最强,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的核外电子数是17,所以R是Cl元素,
A.X是C元素,Y是O元素,含有碳氧元素的化合物有一氧化碳和二氧化碳,故A正确;
B.原子的电子层数越多,其原子半径越大,同一周期中,元素的原子半径随着原子序数的增大而减小,C、O元素位于第二周期,Na、Cl元素位于第三周期,且O元素的原子序数大于C、Cl的原子序数大于Na,所以原子半径大小顺序是rz>rR>rx>ry,故B正确;
C.X、Z分别与R形成的化合物分别是CCl4、NaCl,四氯化碳中只含共价键,氯化钠中只含离子键,故C正确;
D.Y、Z、R分别是O、Na、Cl元素,含有三种元素的化合物有NaClO、NaClO2、NaClO3、NaClO4等,故D错误;
故选:D。
17.【解答】解:A.甲酸与碳酸钠反应,增大与甲醛的沸点差异,充分振荡,蒸馏,收集馏出物可除杂,故A正确;
B.溴乙烷水解后,应在酸性条件下检验溴离子,则没有加硝酸至酸性,不能检验,故B错误;
C.溴易溶于苯,不能除杂,应选NaOH、分液,故C错误;
D.蔗糖水解后,应在碱性条件下检验葡萄糖,没有加碱至碱性不能检验,故D错误;
故选:A。
18.【解答】解:A.氯水中存在化学平衡,存在氯气分子,液氯是液态氯气,故A正确;
B.新制氯水为混合物,故B错误;
C.液氯可以用钢瓶存放,但氯水中的HCl和HClO都会与铁反应,不能用钢瓶存放,故C错误;
D.新制氯水含Cl2,也有毒,故D错误;
故选:A。
19.【解答】解:A.N60是单质,14N是氮的同位素,故A错误;
B.N60与N2符合同素异形体的概念,N60与N2互为同素异形体,故B正确;
C.N60中只含氮原子,原子之间由共价键结合,故C正确;
D.N60在高温和撞击后释放巨大能量,说明生成了N元素的很稳定的形式,而熟知的N最稳定存在形式就是N2,故D正确。
故选:A。
20.【解答】解:A.过程①中,H2S与Cu2+发生复分解反应生成沉淀,则生成CuS的反应为H2S+Cu2+═CuS↓+2H+,故A错误;
B.过程②中发生反应CuS+2Fe3+=S+2Fe2++Cu2+,故B正确;
C.过程③中发生4Fe2++O2+4H+=4Fe3++2H2O,氢离子浓度减小,溶液酸性减弱,故C正确;
D.由反应①②③可知,回收S的总反应为2H2S+O22H2O+2S↓,故D正确;
故选:A。
三.解答题(共4小题,满分48分)
21.【解答】解:(1)二氧化锰与浓盐酸加热反应生成氯气、氯化锰和水,发生反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;酸性高锰酸钾和浓盐酸在常温下反应制取氯气,依据得失电子守恒和电荷守恒可知,离子方程式为210Cl﹣+16H+=2Mn2++5Cl2↑+8H2O,KMnO4与浓盐酸反应制备氯气时不需要加热,二氧化锰与浓盐酸反应生成氯气需要加热,故KMnO4的氧化性强于MnO2,所以氧化性由强到弱的顺序为KMnO4>MnO2,
故答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;210Cl﹣+16H+=2Mn2++5Cl2↑+8H2O;>;
(2)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液,上述过程中,生成ClO2的反应属于歧化反应,54H+═4ClO2+Cl﹣+2H2O,54H+═4ClO2+Cl﹣+2H2O中5个反应生成4个ClO2和1个Cl﹣,则每生成 1mol ClO2消耗NaClO2的量为1.25mol;NaHSO4和NaHCO3混合产生“气泡”,其反应的化学方程式为NaHCO3+NaHSO4=CO2↑+Na2SO4+H2O,
故答案为:1.25;NaHCO3+NaHSO4=CO2↑+Na2SO4+H2O;
(3)根据反应:Cl2+2NaOH=NaClO+NaCl+H2O,设氯气质量为xkg,其物质的量为mol,则消耗的NaOH的质量为mol×2×40g/molgkg,溶液中剩余NaOH为1000kg×1%=10kg,100%=30%,解得:x=203kg,设质量都是71g,氯气得到的电子数为2×1=2mol,NaClO得到的电子数为1×2mol,则NaClO的消毒效率(单位质量得到的电子数)是Cl2的倍数为0.953,
故答案为:203;0.953。
22.【解答】解:根据图知,A﹣N分别是H、K、C、N、F、Mg、Al、Ge、P、S、Cl、Ar、Ca、Br,
(1)几种元素中化学性质最不活泼的是稀有气体元素,则最不活泼的是Ar;常温常压下其单质为液态的非金属元素是Br,
故答案为:Ar;Br;
(2)N是Br元素,最外层为第四层,具有7个电子,则Br的基态原子的价层电子排布式为4s24p5;Br原子的最外层电子为p电子,属于p区元素,
故答案为:4s24p5;p;
(3)元素的金属性越强,越容易失去电子,最容易失电子最外层一个电子的元素,其第一电离能最小,则第一电离能最小的是K,非金属性越强,电负性越强,所以电负性最强的是F,
故答案为:K;F;
(4)第三周期主族元素中,从左到右原子半径逐渐减小,则第三周期主族元素中,原子半径最小的是Cl;电子层相同时,原子序数越大,微粒半径越小,则离子半径:P3﹣>S2﹣>Cl﹣>Mg2+>Al3+,所以简单离子半径最小的是Al3+,
故答案为:Cl;Al3+。
23.【解答】解:(1)由装置图和实验目的分析判断,制备氯气是用固体二氧化锰和液体浓盐酸,固体在圆底烧瓶中,盐酸在分液漏斗中;浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,反应化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)氯气有氧化性,能置换出碘化钾中的碘,碘单质遇到淀粉变蓝;发生反应的离子方程式为:Cl2+2I﹣=2Cl﹣+I2,
故答案为:Cl2+2I﹣=2Cl﹣+I2;
(3)氯气和水反应生成次氯酸、盐酸,次氯酸具有漂白性能使有色布条褪色,
故答案为:有色布条褪色;氯气与水反应生成了有漂白性的HClO;
(4)浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气,
故答案为:浓硫酸;吸收水分干燥氯气;
(5)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气,反应化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O.
24.【解答】解:(1)反应产生的HCl易溶于有机萃取剂,经萃取后,有机层含有HCl,步骤Ⅱ的实验操作是萃取、分液。
故答案为:萃取、分液;
(2)A.乙醇与水互溶,不分层,有机溶剂 M 不可用乙醇,故A错误;
B.步骤Ⅲ与步骤Ⅱ的实验操作基本相同,都是萃取、分液,故B正确;
C.Ⅲ.用氨水进行反萃取,Ⅴ.可得到氯化铵,说明NH4Cl 在水中溶解度明显大于在有机溶剂 M 中,故C正确;
D.用氨水进行反萃取,有机溶剂 M 可循环使用,故D正确。
故答案为:BCD;
(3)由步骤Ⅰ、Ⅱ得到 KH2PO4 溶液的原理:步骤Ⅰ.磷酸加入KCl,发生KCl+H3PO4 KH2PO4+HCl,步骤Ⅱ.反应产生的HCl易溶于有机萃取剂,经萃取后,水相中HCl浓度降低,平衡正向移动,生成KH2PO4。
故答案为:步骤Ⅰ.磷酸加入KCl,发生KCl+H3PO4 KH2PO4+HCl,步骤Ⅱ.反应产生的HCl易溶于有机萃取剂,经萃取后,水相中HCl浓度降低,平衡正向移动,生成KH2PO4;
(4)有活塞的仪器在使用前需进行“检漏”操作。
A.吸滤瓶没有活塞,连接好仪器后要检查气密性,故A不选;
B.球型分液漏斗有活塞,在使用前需进行“检漏”操作,故B选;
C.蒸馏烧瓶没有活塞,连接好仪器后要检查气密性,故C不选;
D.碱式滴定管有活塞,在使用前需进行“检漏”操作,故D选。
故答案为:BD;
(5)步骤Ⅳ,包括蒸发浓缩、冷却结晶、过滤、干燥等多步操作。在冷却结晶操作中,为了得到磷酸二氢钾大晶体,常采取的措施有:自然冷却(缓慢冷却)。某同学发现使用加热浓缩、冷却结晶得到的磷酸二氢钾晶体欠佳,请提出针对性的改进实验 方案:在磷酸二氢钾溶液中加入乙醇,然后经过滤、干燥得到晶体。
故答案为:自然冷却(缓慢冷却);在磷酸二氢钾溶液中加入乙醇。
第1页(共1页)
同课章节目录
