2023—2024学年鲁教版(五四学制)化学九年级全一册第四单元 金属 期末学情复习题(含答案)
文档属性
| 名称 | 2023—2024学年鲁教版(五四学制)化学九年级全一册第四单元 金属 期末学情复习题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 276.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-09 08:56:02 | ||
图片预览




文档简介
2023—2024学年鲁教版(五四学制)化学九年级全一册第四单元 金属 期末学情复习题含答案
鲁教版(五四学制)第四单元 金属
一、选择题。(16题)
1、下列实验现象描述错误的是( )
A.在软水中加入肥皂水会产生较多的泡沫
B.将镁条放入稀硫酸中,有大量气泡产生
C.黄铜片和铜片互相刻划,铜片上留下的痕迹比黄铜片上的浅
D.将一氧化碳通入灼热的氧化铁,红棕色粉末逐渐变为黑色粉末
2、下列说法正确的一项是( )
A. 空气中O2质量分数约为21%
B. 吹灭蜡烛,利用了二氧化碳不能支持燃烧的性质
C. 可燃冰可能成为替代化石燃料的新能源
D. 四氧化三铁是合金
3、除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )
A.CaO(CaCO3)——高温充分煅烧
B.CuCl2溶液(FeCl2)——加入过量的铁粉,充分反应后过滤
C.氧气(水蒸气)——通过装有足量无水氯化钙的干燥管
D.KCl(MnO2)——加入足量的水溶解,过滤,蒸发结晶
4、下列有关废旧金属回收的意义,说法错误的是( )
A.耗费大量人力物力,得不偿失
B.是保护金属资源的重要途径
C.可以减少废旧金属对环境的污染
D.可以节约宝贵的金属资源
5、将某稀硫酸分成两等份,分别向其中加入锌粉或铁粉,反应结束后剩余的铁比剩余的锌多,产生氢气分别为a g和b g,则a和b的关系是( )
A.ab D.无法判断
6、物质的性质决定用途。下列物质的用途中利用其物理性质的是( )
①氧气用作助燃剂 ②稀有气体用作电光源
③铜丝用作导线 ④干冰用作舞台效果
⑤生石灰用作食品干燥剂 ⑥氮气用作保护气
A.①⑤⑥ B.②③④ C.②③④⑤ D.③④⑥
7、“中国制造”、“一带一路”的基础建设都需要用到大量金属材料。下列有关金属材料的说法正确的是( )
A. 黄铜片比铜片硬度小
B. 合金中一定不含有非金属
C. 生锈的钢铁制品没有回收价值
D. 多数合金的熔点低于组成它的成分金属
8、为了探究镁、锌、铜三种金属的活动性强弱,将形状、大小相同的三种金属分别放入装有X溶液的试管中,通过观察现象即能得出实验结论。则X溶液是
A.稀硫酸 B.硝酸银溶液 C.氯化铜溶液 D.氯化镁溶液
9、下列环境中,铁钉表面最容易生锈的是( )
A.在稀盐酸中 B.在潮湿空气中
C.在干燥空气中 D.浸没在植物油中
10、在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,后过滤,滤液仍为蓝色。有关判断正确的是( )
A. 滤渣中一定有银,没有铜和锌
B. 滤渣中一定有银和锌,可能有铜
C. 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
D. 滤液中一定有硝酸锌、硝酸铜、硝酸银
11、下列物质质量增加的变化有一种与其它三种存在本质的区别,这种变化是( )
A.长期放置在空气中的氢氧化钠质量增加
B.长期敞口放置的浓硫酸质量增加
C.久置的铜器生锈质量增加
D.久置的生石灰质量增加
12、下列物质的性质与用途具有对应关系的是( )
A. 氦气的密度小,可用来制作探空气球
B. 铁具有良好的导电性,可用于制造炊具
C. 一氧化碳有可燃性,可用于工业冶炼金属
D. 二氧化碳密度比空气大,可用于制碳酸饮料
13、下列四种金属中,能与稀H2SO4反应放出H2的是( )
A.Cu B.Ag C.Zn D.Hg
14、下列防锈措施不合理的是( )
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
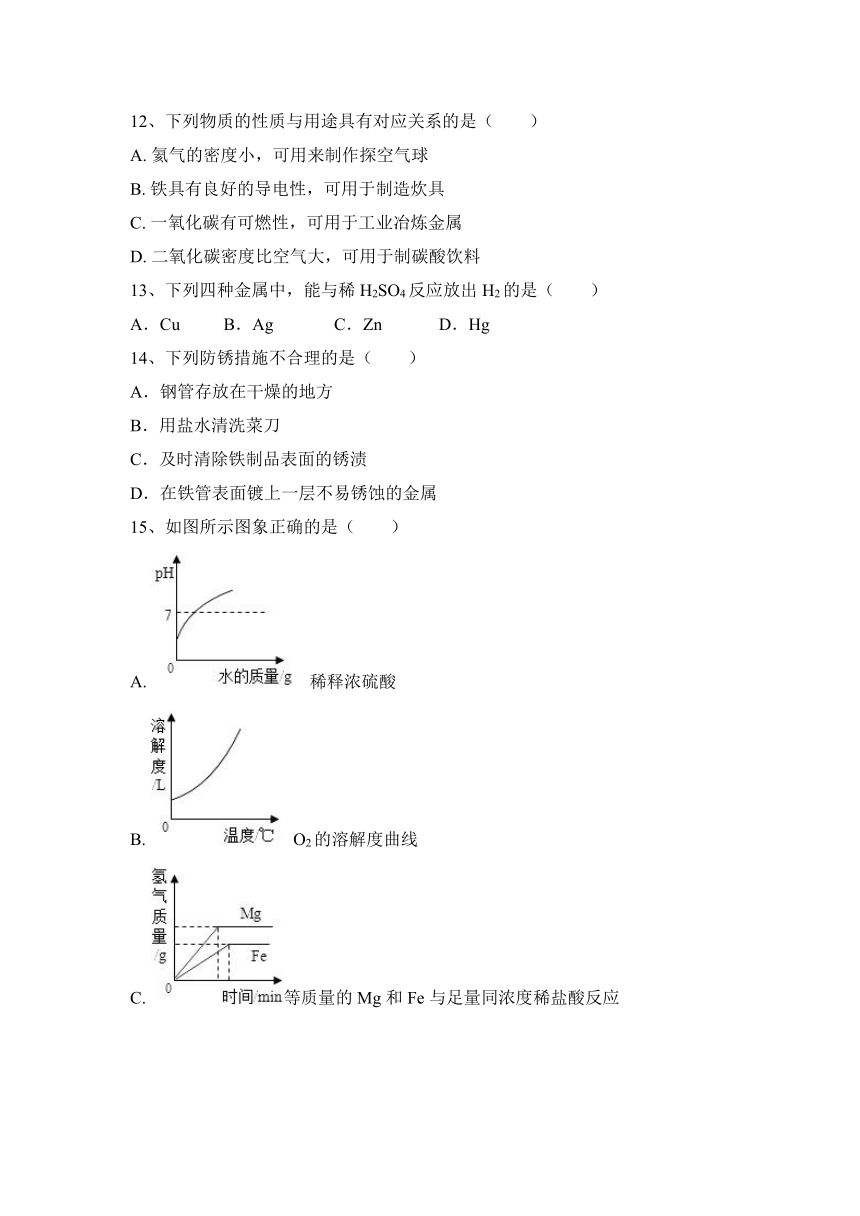
15、如图所示图象正确的是( )
A. 稀释浓硫酸
B. O2的溶解度曲线
C. 等质量的Mg和Fe与足量同浓度稀盐酸反应
D. 浓硫酸露置空气中
16、下列推理正确的是( )
A.燃烧过程中伴随着发光放热,所以有发光放热现象的变化一定是燃烧
B.因为“质量守恒”,所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等
C.单质只含一种元素,但含一种元素的物质不一定是单质
D.铁能置换出稀硫酸中的氢,铜是金属,也能置换出稀硫酸中的氢
二、填空题。
17、从①青铜、②武德合金、③活性炭、④甲烷、⑤一氧化碳中,选择适当的物质的序号填空。
(1)可用于消除水中异味的是______。
(2)可用作家庭电路保险丝是______。
(3)与煤矿发生爆炸有关的主要物质是______。
18、金属活动性顺序从强到弱是____、Ca、____、____、Al、____、____、Sn、Pb、(H) 、____、Hg、____、Pt、____。
19、根据金属锈蚀的条件,防止金属生锈的方法可以是:
(1)保持金属制品(特别是钢铁)表面的洁净和____ 。
(2)在金属制品(特别是钢铁)表面涂上一层_____ ,如涂油、喷漆、覆盖搪瓷、塑料等;
(3)改变金属的_____ ,如加入铬、镍等制成不锈钢。
20、将生锈的铁钉放入足量的稀盐酸中,稍稍加热,首先观察到的现象是:
________ ,化学反应方程式为________ ;然后可看到铁钉表面________ ,其化学反应方程式为:________ 。
21、电池的变革。
(1)伏打电池(如图)食盐水中的溶质是_______(填化学式,下同);可用_______溶液比较电池中锌和银两种金属的活动性强弱。
(2)锌锰干电池(如图)其中能导电的非金属单质是_______(填化学式)。
(3)铅酸蓄电池工作原理为Pb+X+2H2SO4=2PbSO4+2H2O,则X的化学式为_______。
(4)燃料电池燃料在一定条件下与氧气反应,将_______能转化为电能。
(5)锂离子电池其电解液的溶剂常用碳酸乙烯酯(C3H4O3),碳酸乙烯酯完全燃烧的产物是____ 。
三、综合题。
22、金属与人类的生活和生产密切相关。
(1)图1为放置在空气中的铁锅,其中最容易生锈的部位是________(填字母代号)。
(2)图2为元素周期表中的一格,下列说法不正确的是________。
A.铝是地壳中含量最多的金属元素
B.铝原子的核外电子数为13
C.铝元素的原子结构示意图为
D.铝元素的相对原子质量为26.98
(3)在研究金属性质时,某小组同学进行了如下实验探究:将一定量铁粉加入到硫酸锌和硫酸铜的混合溶液中,充分反应后过滤,然后对滤纸上的物质进行分析和实验。
【提出问题】滤纸上的物质是什么?
【做出猜想】甲认为只有铜;乙认为是铜和铁的混合物;丙认为是铜、铁、锌的混合物。
【交流讨论】大家一致认为丙的猜想不合理,其理由是____________________。
【实验与结论】同学们通过实验确定了滤纸上物质的成分,请填写下表空白。
实验步骤 现象和结论 有关反应的化学方程式
取少量滤纸上剩余的物质于试管中,向其中滴加适量的________ ____________________ ___________________
(4)钢铁是人类生活和生产中非常重要的材料。
①工业炼铁的反应过程如图3所示。其中焦炭的作用是_____________________;属于化合反应的是________________。
②在工业冶炼中要得到224 t铁,理论上需要含Fe2O380%的赤铁矿石的质量是__________。
四、实验题。
23、科学探究可以培养学生良好的科学思维,某兴趣小组进行了金属燃烧实验:
实验 1、 2、 3、
步骤 将一片铝箔在空气中用酒精灯加热 将另一片相同铝箔伸入到充满氧气的集气瓶中,引燃 将一段镁条在空气中用酒精灯加热
现象 铝箔不燃烧,熔化后也不滴下,外面立即形成一层薄膜 铝箔剧烈人少,发出耀眼白光 镁条剧烈燃烧,发出耀眼白光
试回答下列问题:
(1)进行1、2实验的目的是为研究铝和氧气反应的剧烈程度是否与氧气的______有关。
(2)某同学分析1、3实验后就得出了如下结论:不同金属的活动性是不同的,其他同学认为这个结论不可靠,你认为他们的理由是:
________________________________ 。
(3)在实验1中,有同学用细针去刺破液态铝外的薄膜.观察到里面的液体铝依然没有流出来,实验后,同学们查阅资料获知该薄膜是氧化铝,其熔点明显高于酒精灯火焰的温度,由此推断,刺破薄膜后液态铝会迅速和_______反应又会形成致密氧化膜,所以液态铝不会流出来。
五、综合类计算题。
24、为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁粉,然后将100g稀硫酸平均分五次加入,测得加入稀硫酸质虽与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸、硫酸铜溶液反应)
第一次 第二次 第三次 第四次 第五次
加入稀硫酸的质量/g 20 20 20 20 20
产生氢气的累计质量/g 0.05 0.10 m 0.20 0.20
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是多少(写出计算过程, 结果精确到0.1%)
(3)请根据数据和计算结果,在右图坐标中画出对应的曲线图。
(4)若另取同种生铁粉6g进行下图所示的实验,由图中数据可求得,100g混合溶液中所含H2SO4的质量为__________。
2023—2024学年鲁教版(五四学制)化学九年级全一册第四单元 金属 期末学情复习题含答案
鲁教版(五四学制)第四单元 金属
一、选择题。
1、下列实验现象描述错误的是( )
A.在软水中加入肥皂水会产生较多的泡沫
B.将镁条放入稀硫酸中,有大量气泡产生
C.黄铜片和铜片互相刻划,铜片上留下的痕迹比黄铜片上的浅
D.将一氧化碳通入灼热的氧化铁,红棕色粉末逐渐变为黑色粉末
【答案】C
2、下列说法正确的一项是( )
A. 空气中O2质量分数约为21%
B. 吹灭蜡烛,利用了二氧化碳不能支持燃烧的性质
C. 可燃冰可能成为替代化石燃料的新能源
D. 四氧化三铁是合金
【答案】C
3、除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )
A.CaO(CaCO3)——高温充分煅烧
B.CuCl2溶液(FeCl2)——加入过量的铁粉,充分反应后过滤
C.氧气(水蒸气)——通过装有足量无水氯化钙的干燥管
D.KCl(MnO2)——加入足量的水溶解,过滤,蒸发结晶
【答案】B
4、下列有关废旧金属回收的意义,说法错误的是( )
A.耗费大量人力物力,得不偿失
B.是保护金属资源的重要途径
C.可以减少废旧金属对环境的污染
D.可以节约宝贵的金属资源
【答案】A
5、将某稀硫酸分成两等份,分别向其中加入锌粉或铁粉,反应结束后剩余的铁比剩余的锌多,产生氢气分别为a g和b g,则a和b的关系是( )
A.ab D.无法判断
【答案】B
6、物质的性质决定用途。下列物质的用途中利用其物理性质的是( )
①氧气用作助燃剂 ②稀有气体用作电光源
③铜丝用作导线 ④干冰用作舞台效果
⑤生石灰用作食品干燥剂 ⑥氮气用作保护气
A.①⑤⑥ B.②③④ C.②③④⑤ D.③④⑥
【答案】B
7、“中国制造”、“一带一路”的基础建设都需要用到大量金属材料。下列有关金属材料的说法正确的是( )
A. 黄铜片比铜片硬度小
B. 合金中一定不含有非金属
C. 生锈的钢铁制品没有回收价值
D. 多数合金的熔点低于组成它的成分金属
【答案】D
8、为了探究镁、锌、铜三种金属的活动性强弱,将形状、大小相同的三种金属分别放入装有X溶液的试管中,通过观察现象即能得出实验结论。则X溶液是
A.稀硫酸 B.硝酸银溶液 C.氯化铜溶液 D.氯化镁溶液
【答案】A
9、下列环境中,铁钉表面最容易生锈的是( )
A.在稀盐酸中 B.在潮湿空气中
C.在干燥空气中 D.浸没在植物油中
【答案】B
10、在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,后过滤,滤液仍为蓝色。有关判断正确的是( )
A. 滤渣中一定有银,没有铜和锌
B. 滤渣中一定有银和锌,可能有铜
C. 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
D. 滤液中一定有硝酸锌、硝酸铜、硝酸银
【答案】C
11、下列物质质量增加的变化有一种与其它三种存在本质的区别,这种变化是( )
A.长期放置在空气中的氢氧化钠质量增加
B.长期敞口放置的浓硫酸质量增加
C.久置的铜器生锈质量增加
D.久置的生石灰质量增加
【答案】B
12、下列物质的性质与用途具有对应关系的是( )
A. 氦气的密度小,可用来制作探空气球
B. 铁具有良好的导电性,可用于制造炊具
C. 一氧化碳有可燃性,可用于工业冶炼金属
D. 二氧化碳密度比空气大,可用于制碳酸饮料
【答案】A
13、下列四种金属中,能与稀H2SO4反应放出H2的是( )
A.Cu B.Ag C.Zn D.Hg
【答案】C
14、下列防锈措施不合理的是( )
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
【答案】B
15、如图所示图象正确的是( )
A. 稀释浓硫酸
B. O2的溶解度曲线
C. 等质量的Mg和Fe与足量同浓度稀盐酸反应
D. 浓硫酸露置空气中
【答案】C
16、下列推理正确的是( )
A.燃烧过程中伴随着发光放热,所以有发光放热现象的变化一定是燃烧
B.因为“质量守恒”,所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等
C.单质只含一种元素,但含一种元素的物质不一定是单质
D.铁能置换出稀硫酸中的氢,铜是金属,也能置换出稀硫酸中的氢
【答案】C
二、填空题。
17、从①青铜、②武德合金、③活性炭、④甲烷、⑤一氧化碳中,选择适当的物质的序号填空。
(1)可用于消除水中异味的是______。
(2)可用作家庭电路保险丝是______。
(3)与煤矿发生爆炸有关的主要物质是______。
【答案】③ ② ④
18、金属活动性顺序从强到弱是____、Ca、____、____、Al、____、____、Sn、Pb、(H) 、____、Hg、____、Pt、____。
【答案】K Na Mg Zn Fe Cu Ag Au
19、根据金属锈蚀的条件,防止金属生锈的方法可以是:
(1)保持金属制品(特别是钢铁)表面的洁净和____ 。
(2)在金属制品(特别是钢铁)表面涂上一层_____ ,如涂油、喷漆、覆盖搪瓷、塑料等;
(3)改变金属的_____ ,如加入铬、镍等制成不锈钢。
【答案】 (1) 干燥 (2)保护层 (3)结构
20、将生锈的铁钉放入足量的稀盐酸中,稍稍加热,首先观察到的现象是:
________ ,化学反应方程式为________ ;然后可看到铁钉表面________ ,其化学反应方程式为:________ 。
【答案】铁锈溶解、生成黄色溶液 ;Fe2O3+6HCl=2FeCl3+3H2O ;
有气泡冒出 ;Fe+2HCl=FeCl2+H2↑
21、电池的变革。
(1)伏打电池(如图)食盐水中的溶质是_______(填化学式,下同);可用_______溶液比较电池中锌和银两种金属的活动性强弱。
(2)锌锰干电池(如图)其中能导电的非金属单质是_______(填化学式)。
(3)铅酸蓄电池工作原理为Pb+X+2H2SO4=2PbSO4+2H2O,则X的化学式为_______。
(4)燃料电池燃料在一定条件下与氧气反应,将_______能转化为电能。
(5)锂离子电池其电解液的溶剂常用碳酸乙烯酯(C3H4O3),碳酸乙烯酯完全燃烧的产物是____ 。
【答案】(1) NaCl 盐酸 (2)C
(3)PbO2 (4)化学 (5)二氧化碳和水
三、综合题。
22、金属与人类的生活和生产密切相关。
(1)图1为放置在空气中的铁锅,其中最容易生锈的部位是________(填字母代号)。
(2)图2为元素周期表中的一格,下列说法不正确的是________。
A.铝是地壳中含量最多的金属元素
B.铝原子的核外电子数为13
C.铝元素的原子结构示意图为
D.铝元素的相对原子质量为26.98
(3)在研究金属性质时,某小组同学进行了如下实验探究:将一定量铁粉加入到硫酸锌和硫酸铜的混合溶液中,充分反应后过滤,然后对滤纸上的物质进行分析和实验。
【提出问题】滤纸上的物质是什么?
【做出猜想】甲认为只有铜;乙认为是铜和铁的混合物;丙认为是铜、铁、锌的混合物。
【交流讨论】大家一致认为丙的猜想不合理,其理由是____________________。
【实验与结论】同学们通过实验确定了滤纸上物质的成分,请填写下表空白。
实验步骤 现象和结论 有关反应的化学方程式
取少量滤纸上剩余的物质于试管中,向其中滴加适量的________ ____________________ ___________________
(4)钢铁是人类生活和生产中非常重要的材料。
①工业炼铁的反应过程如图3所示。其中焦炭的作用是_____________________;属于化合反应的是________________。
②在工业冶炼中要得到224 t铁,理论上需要含Fe2O380%的赤铁矿石的质量是__________。
【答案】 (1) b (2)C
(3)锌比铁活泼,铁不能置换硫酸锌中的锌
稀盐酸 若产生气泡,则乙猜想正确,若不产生气泡,则甲猜想正确
Fe+2HCl===FeCl2+H2↑
(4)生成还原剂一氧化碳 反应Ⅰ和反应Ⅱ 400 t
四、实验题。
23、科学探究可以培养学生良好的科学思维,某兴趣小组进行了金属燃烧实验:
实验 1、 2、 3、
步骤 将一片铝箔在空气中用酒精灯加热 将另一片相同铝箔伸入到充满氧气的集气瓶中,引燃 将一段镁条在空气中用酒精灯加热
现象 铝箔不燃烧,熔化后也不滴下,外面立即形成一层薄膜 铝箔剧烈人少,发出耀眼白光 镁条剧烈燃烧,发出耀眼白光
试回答下列问题:
(1)进行1、2实验的目的是为研究铝和氧气反应的剧烈程度是否与氧气的______有关。
(2)某同学分析1、3实验后就得出了如下结论:不同金属的活动性是不同的,其他同学认为这个结论不可靠,你认为他们的理由是:
________________________________ 。
(3)在实验1中,有同学用细针去刺破液态铝外的薄膜.观察到里面的液体铝依然没有流出来,实验后,同学们查阅资料获知该薄膜是氧化铝,其熔点明显高于酒精灯火焰的温度,由此推断,刺破薄膜后液态铝会迅速和_______反应又会形成致密氧化膜,所以液态铝不会流出来。
【答案】(1)浓度 (2)只用镁、铝做实验,选择的金属样品种类太少
(3)氧气
五、综合类计算题。
24、为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁粉,然后将100g稀硫酸平均分五次加入,测得加入稀硫酸质虽与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸、硫酸铜溶液反应)
第一次 第二次 第三次 第四次 第五次
加入稀硫酸的质量/g 20 20 20 20 20
产生氢气的累计质量/g 0.05 0.10 m 0.20 0.20
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是多少(写出计算过程, 结果精确到0.1%)
(3)请根据数据和计算结果,在右图坐标中画出对应的曲线图。
(4)若另取同种生铁粉6g进行下图所示的实验,由图中数据可求得,100g混合溶液中所含H2SO4的质量为__________。
【答案】(1)0.15; (2)93.3%;
(3)如图所示:
;
(4)1.225g
鲁教版(五四学制)第四单元 金属
一、选择题。(16题)
1、下列实验现象描述错误的是( )
A.在软水中加入肥皂水会产生较多的泡沫
B.将镁条放入稀硫酸中,有大量气泡产生
C.黄铜片和铜片互相刻划,铜片上留下的痕迹比黄铜片上的浅
D.将一氧化碳通入灼热的氧化铁,红棕色粉末逐渐变为黑色粉末
2、下列说法正确的一项是( )
A. 空气中O2质量分数约为21%
B. 吹灭蜡烛,利用了二氧化碳不能支持燃烧的性质
C. 可燃冰可能成为替代化石燃料的新能源
D. 四氧化三铁是合金
3、除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )
A.CaO(CaCO3)——高温充分煅烧
B.CuCl2溶液(FeCl2)——加入过量的铁粉,充分反应后过滤
C.氧气(水蒸气)——通过装有足量无水氯化钙的干燥管
D.KCl(MnO2)——加入足量的水溶解,过滤,蒸发结晶
4、下列有关废旧金属回收的意义,说法错误的是( )
A.耗费大量人力物力,得不偿失
B.是保护金属资源的重要途径
C.可以减少废旧金属对环境的污染
D.可以节约宝贵的金属资源
5、将某稀硫酸分成两等份,分别向其中加入锌粉或铁粉,反应结束后剩余的铁比剩余的锌多,产生氢气分别为a g和b g,则a和b的关系是( )
A.ab D.无法判断
6、物质的性质决定用途。下列物质的用途中利用其物理性质的是( )
①氧气用作助燃剂 ②稀有气体用作电光源
③铜丝用作导线 ④干冰用作舞台效果
⑤生石灰用作食品干燥剂 ⑥氮气用作保护气
A.①⑤⑥ B.②③④ C.②③④⑤ D.③④⑥
7、“中国制造”、“一带一路”的基础建设都需要用到大量金属材料。下列有关金属材料的说法正确的是( )
A. 黄铜片比铜片硬度小
B. 合金中一定不含有非金属
C. 生锈的钢铁制品没有回收价值
D. 多数合金的熔点低于组成它的成分金属
8、为了探究镁、锌、铜三种金属的活动性强弱,将形状、大小相同的三种金属分别放入装有X溶液的试管中,通过观察现象即能得出实验结论。则X溶液是
A.稀硫酸 B.硝酸银溶液 C.氯化铜溶液 D.氯化镁溶液
9、下列环境中,铁钉表面最容易生锈的是( )
A.在稀盐酸中 B.在潮湿空气中
C.在干燥空气中 D.浸没在植物油中
10、在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,后过滤,滤液仍为蓝色。有关判断正确的是( )
A. 滤渣中一定有银,没有铜和锌
B. 滤渣中一定有银和锌,可能有铜
C. 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
D. 滤液中一定有硝酸锌、硝酸铜、硝酸银
11、下列物质质量增加的变化有一种与其它三种存在本质的区别,这种变化是( )
A.长期放置在空气中的氢氧化钠质量增加
B.长期敞口放置的浓硫酸质量增加
C.久置的铜器生锈质量增加
D.久置的生石灰质量增加
12、下列物质的性质与用途具有对应关系的是( )
A. 氦气的密度小,可用来制作探空气球
B. 铁具有良好的导电性,可用于制造炊具
C. 一氧化碳有可燃性,可用于工业冶炼金属
D. 二氧化碳密度比空气大,可用于制碳酸饮料
13、下列四种金属中,能与稀H2SO4反应放出H2的是( )
A.Cu B.Ag C.Zn D.Hg
14、下列防锈措施不合理的是( )
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
15、如图所示图象正确的是( )
A. 稀释浓硫酸
B. O2的溶解度曲线
C. 等质量的Mg和Fe与足量同浓度稀盐酸反应
D. 浓硫酸露置空气中
16、下列推理正确的是( )
A.燃烧过程中伴随着发光放热,所以有发光放热现象的变化一定是燃烧
B.因为“质量守恒”,所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等
C.单质只含一种元素,但含一种元素的物质不一定是单质
D.铁能置换出稀硫酸中的氢,铜是金属,也能置换出稀硫酸中的氢
二、填空题。
17、从①青铜、②武德合金、③活性炭、④甲烷、⑤一氧化碳中,选择适当的物质的序号填空。
(1)可用于消除水中异味的是______。
(2)可用作家庭电路保险丝是______。
(3)与煤矿发生爆炸有关的主要物质是______。
18、金属活动性顺序从强到弱是____、Ca、____、____、Al、____、____、Sn、Pb、(H) 、____、Hg、____、Pt、____。
19、根据金属锈蚀的条件,防止金属生锈的方法可以是:
(1)保持金属制品(特别是钢铁)表面的洁净和____ 。
(2)在金属制品(特别是钢铁)表面涂上一层_____ ,如涂油、喷漆、覆盖搪瓷、塑料等;
(3)改变金属的_____ ,如加入铬、镍等制成不锈钢。
20、将生锈的铁钉放入足量的稀盐酸中,稍稍加热,首先观察到的现象是:
________ ,化学反应方程式为________ ;然后可看到铁钉表面________ ,其化学反应方程式为:________ 。
21、电池的变革。
(1)伏打电池(如图)食盐水中的溶质是_______(填化学式,下同);可用_______溶液比较电池中锌和银两种金属的活动性强弱。
(2)锌锰干电池(如图)其中能导电的非金属单质是_______(填化学式)。
(3)铅酸蓄电池工作原理为Pb+X+2H2SO4=2PbSO4+2H2O,则X的化学式为_______。
(4)燃料电池燃料在一定条件下与氧气反应,将_______能转化为电能。
(5)锂离子电池其电解液的溶剂常用碳酸乙烯酯(C3H4O3),碳酸乙烯酯完全燃烧的产物是____ 。
三、综合题。
22、金属与人类的生活和生产密切相关。
(1)图1为放置在空气中的铁锅,其中最容易生锈的部位是________(填字母代号)。
(2)图2为元素周期表中的一格,下列说法不正确的是________。
A.铝是地壳中含量最多的金属元素
B.铝原子的核外电子数为13
C.铝元素的原子结构示意图为
D.铝元素的相对原子质量为26.98
(3)在研究金属性质时,某小组同学进行了如下实验探究:将一定量铁粉加入到硫酸锌和硫酸铜的混合溶液中,充分反应后过滤,然后对滤纸上的物质进行分析和实验。
【提出问题】滤纸上的物质是什么?
【做出猜想】甲认为只有铜;乙认为是铜和铁的混合物;丙认为是铜、铁、锌的混合物。
【交流讨论】大家一致认为丙的猜想不合理,其理由是____________________。
【实验与结论】同学们通过实验确定了滤纸上物质的成分,请填写下表空白。
实验步骤 现象和结论 有关反应的化学方程式
取少量滤纸上剩余的物质于试管中,向其中滴加适量的________ ____________________ ___________________
(4)钢铁是人类生活和生产中非常重要的材料。
①工业炼铁的反应过程如图3所示。其中焦炭的作用是_____________________;属于化合反应的是________________。
②在工业冶炼中要得到224 t铁,理论上需要含Fe2O380%的赤铁矿石的质量是__________。
四、实验题。
23、科学探究可以培养学生良好的科学思维,某兴趣小组进行了金属燃烧实验:
实验 1、 2、 3、
步骤 将一片铝箔在空气中用酒精灯加热 将另一片相同铝箔伸入到充满氧气的集气瓶中,引燃 将一段镁条在空气中用酒精灯加热
现象 铝箔不燃烧,熔化后也不滴下,外面立即形成一层薄膜 铝箔剧烈人少,发出耀眼白光 镁条剧烈燃烧,发出耀眼白光
试回答下列问题:
(1)进行1、2实验的目的是为研究铝和氧气反应的剧烈程度是否与氧气的______有关。
(2)某同学分析1、3实验后就得出了如下结论:不同金属的活动性是不同的,其他同学认为这个结论不可靠,你认为他们的理由是:
________________________________ 。
(3)在实验1中,有同学用细针去刺破液态铝外的薄膜.观察到里面的液体铝依然没有流出来,实验后,同学们查阅资料获知该薄膜是氧化铝,其熔点明显高于酒精灯火焰的温度,由此推断,刺破薄膜后液态铝会迅速和_______反应又会形成致密氧化膜,所以液态铝不会流出来。
五、综合类计算题。
24、为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁粉,然后将100g稀硫酸平均分五次加入,测得加入稀硫酸质虽与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸、硫酸铜溶液反应)
第一次 第二次 第三次 第四次 第五次
加入稀硫酸的质量/g 20 20 20 20 20
产生氢气的累计质量/g 0.05 0.10 m 0.20 0.20
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是多少(写出计算过程, 结果精确到0.1%)
(3)请根据数据和计算结果,在右图坐标中画出对应的曲线图。
(4)若另取同种生铁粉6g进行下图所示的实验,由图中数据可求得,100g混合溶液中所含H2SO4的质量为__________。
2023—2024学年鲁教版(五四学制)化学九年级全一册第四单元 金属 期末学情复习题含答案
鲁教版(五四学制)第四单元 金属
一、选择题。
1、下列实验现象描述错误的是( )
A.在软水中加入肥皂水会产生较多的泡沫
B.将镁条放入稀硫酸中,有大量气泡产生
C.黄铜片和铜片互相刻划,铜片上留下的痕迹比黄铜片上的浅
D.将一氧化碳通入灼热的氧化铁,红棕色粉末逐渐变为黑色粉末
【答案】C
2、下列说法正确的一项是( )
A. 空气中O2质量分数约为21%
B. 吹灭蜡烛,利用了二氧化碳不能支持燃烧的性质
C. 可燃冰可能成为替代化石燃料的新能源
D. 四氧化三铁是合金
【答案】C
3、除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )
A.CaO(CaCO3)——高温充分煅烧
B.CuCl2溶液(FeCl2)——加入过量的铁粉,充分反应后过滤
C.氧气(水蒸气)——通过装有足量无水氯化钙的干燥管
D.KCl(MnO2)——加入足量的水溶解,过滤,蒸发结晶
【答案】B
4、下列有关废旧金属回收的意义,说法错误的是( )
A.耗费大量人力物力,得不偿失
B.是保护金属资源的重要途径
C.可以减少废旧金属对环境的污染
D.可以节约宝贵的金属资源
【答案】A
5、将某稀硫酸分成两等份,分别向其中加入锌粉或铁粉,反应结束后剩余的铁比剩余的锌多,产生氢气分别为a g和b g,则a和b的关系是( )
A.ab D.无法判断
【答案】B
6、物质的性质决定用途。下列物质的用途中利用其物理性质的是( )
①氧气用作助燃剂 ②稀有气体用作电光源
③铜丝用作导线 ④干冰用作舞台效果
⑤生石灰用作食品干燥剂 ⑥氮气用作保护气
A.①⑤⑥ B.②③④ C.②③④⑤ D.③④⑥
【答案】B
7、“中国制造”、“一带一路”的基础建设都需要用到大量金属材料。下列有关金属材料的说法正确的是( )
A. 黄铜片比铜片硬度小
B. 合金中一定不含有非金属
C. 生锈的钢铁制品没有回收价值
D. 多数合金的熔点低于组成它的成分金属
【答案】D
8、为了探究镁、锌、铜三种金属的活动性强弱,将形状、大小相同的三种金属分别放入装有X溶液的试管中,通过观察现象即能得出实验结论。则X溶液是
A.稀硫酸 B.硝酸银溶液 C.氯化铜溶液 D.氯化镁溶液
【答案】A
9、下列环境中,铁钉表面最容易生锈的是( )
A.在稀盐酸中 B.在潮湿空气中
C.在干燥空气中 D.浸没在植物油中
【答案】B
10、在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,后过滤,滤液仍为蓝色。有关判断正确的是( )
A. 滤渣中一定有银,没有铜和锌
B. 滤渣中一定有银和锌,可能有铜
C. 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
D. 滤液中一定有硝酸锌、硝酸铜、硝酸银
【答案】C
11、下列物质质量增加的变化有一种与其它三种存在本质的区别,这种变化是( )
A.长期放置在空气中的氢氧化钠质量增加
B.长期敞口放置的浓硫酸质量增加
C.久置的铜器生锈质量增加
D.久置的生石灰质量增加
【答案】B
12、下列物质的性质与用途具有对应关系的是( )
A. 氦气的密度小,可用来制作探空气球
B. 铁具有良好的导电性,可用于制造炊具
C. 一氧化碳有可燃性,可用于工业冶炼金属
D. 二氧化碳密度比空气大,可用于制碳酸饮料
【答案】A
13、下列四种金属中,能与稀H2SO4反应放出H2的是( )
A.Cu B.Ag C.Zn D.Hg
【答案】C
14、下列防锈措施不合理的是( )
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
【答案】B
15、如图所示图象正确的是( )
A. 稀释浓硫酸
B. O2的溶解度曲线
C. 等质量的Mg和Fe与足量同浓度稀盐酸反应
D. 浓硫酸露置空气中
【答案】C
16、下列推理正确的是( )
A.燃烧过程中伴随着发光放热,所以有发光放热现象的变化一定是燃烧
B.因为“质量守恒”,所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等
C.单质只含一种元素,但含一种元素的物质不一定是单质
D.铁能置换出稀硫酸中的氢,铜是金属,也能置换出稀硫酸中的氢
【答案】C
二、填空题。
17、从①青铜、②武德合金、③活性炭、④甲烷、⑤一氧化碳中,选择适当的物质的序号填空。
(1)可用于消除水中异味的是______。
(2)可用作家庭电路保险丝是______。
(3)与煤矿发生爆炸有关的主要物质是______。
【答案】③ ② ④
18、金属活动性顺序从强到弱是____、Ca、____、____、Al、____、____、Sn、Pb、(H) 、____、Hg、____、Pt、____。
【答案】K Na Mg Zn Fe Cu Ag Au
19、根据金属锈蚀的条件,防止金属生锈的方法可以是:
(1)保持金属制品(特别是钢铁)表面的洁净和____ 。
(2)在金属制品(特别是钢铁)表面涂上一层_____ ,如涂油、喷漆、覆盖搪瓷、塑料等;
(3)改变金属的_____ ,如加入铬、镍等制成不锈钢。
【答案】 (1) 干燥 (2)保护层 (3)结构
20、将生锈的铁钉放入足量的稀盐酸中,稍稍加热,首先观察到的现象是:
________ ,化学反应方程式为________ ;然后可看到铁钉表面________ ,其化学反应方程式为:________ 。
【答案】铁锈溶解、生成黄色溶液 ;Fe2O3+6HCl=2FeCl3+3H2O ;
有气泡冒出 ;Fe+2HCl=FeCl2+H2↑
21、电池的变革。
(1)伏打电池(如图)食盐水中的溶质是_______(填化学式,下同);可用_______溶液比较电池中锌和银两种金属的活动性强弱。
(2)锌锰干电池(如图)其中能导电的非金属单质是_______(填化学式)。
(3)铅酸蓄电池工作原理为Pb+X+2H2SO4=2PbSO4+2H2O,则X的化学式为_______。
(4)燃料电池燃料在一定条件下与氧气反应,将_______能转化为电能。
(5)锂离子电池其电解液的溶剂常用碳酸乙烯酯(C3H4O3),碳酸乙烯酯完全燃烧的产物是____ 。
【答案】(1) NaCl 盐酸 (2)C
(3)PbO2 (4)化学 (5)二氧化碳和水
三、综合题。
22、金属与人类的生活和生产密切相关。
(1)图1为放置在空气中的铁锅,其中最容易生锈的部位是________(填字母代号)。
(2)图2为元素周期表中的一格,下列说法不正确的是________。
A.铝是地壳中含量最多的金属元素
B.铝原子的核外电子数为13
C.铝元素的原子结构示意图为
D.铝元素的相对原子质量为26.98
(3)在研究金属性质时,某小组同学进行了如下实验探究:将一定量铁粉加入到硫酸锌和硫酸铜的混合溶液中,充分反应后过滤,然后对滤纸上的物质进行分析和实验。
【提出问题】滤纸上的物质是什么?
【做出猜想】甲认为只有铜;乙认为是铜和铁的混合物;丙认为是铜、铁、锌的混合物。
【交流讨论】大家一致认为丙的猜想不合理,其理由是____________________。
【实验与结论】同学们通过实验确定了滤纸上物质的成分,请填写下表空白。
实验步骤 现象和结论 有关反应的化学方程式
取少量滤纸上剩余的物质于试管中,向其中滴加适量的________ ____________________ ___________________
(4)钢铁是人类生活和生产中非常重要的材料。
①工业炼铁的反应过程如图3所示。其中焦炭的作用是_____________________;属于化合反应的是________________。
②在工业冶炼中要得到224 t铁,理论上需要含Fe2O380%的赤铁矿石的质量是__________。
【答案】 (1) b (2)C
(3)锌比铁活泼,铁不能置换硫酸锌中的锌
稀盐酸 若产生气泡,则乙猜想正确,若不产生气泡,则甲猜想正确
Fe+2HCl===FeCl2+H2↑
(4)生成还原剂一氧化碳 反应Ⅰ和反应Ⅱ 400 t
四、实验题。
23、科学探究可以培养学生良好的科学思维,某兴趣小组进行了金属燃烧实验:
实验 1、 2、 3、
步骤 将一片铝箔在空气中用酒精灯加热 将另一片相同铝箔伸入到充满氧气的集气瓶中,引燃 将一段镁条在空气中用酒精灯加热
现象 铝箔不燃烧,熔化后也不滴下,外面立即形成一层薄膜 铝箔剧烈人少,发出耀眼白光 镁条剧烈燃烧,发出耀眼白光
试回答下列问题:
(1)进行1、2实验的目的是为研究铝和氧气反应的剧烈程度是否与氧气的______有关。
(2)某同学分析1、3实验后就得出了如下结论:不同金属的活动性是不同的,其他同学认为这个结论不可靠,你认为他们的理由是:
________________________________ 。
(3)在实验1中,有同学用细针去刺破液态铝外的薄膜.观察到里面的液体铝依然没有流出来,实验后,同学们查阅资料获知该薄膜是氧化铝,其熔点明显高于酒精灯火焰的温度,由此推断,刺破薄膜后液态铝会迅速和_______反应又会形成致密氧化膜,所以液态铝不会流出来。
【答案】(1)浓度 (2)只用镁、铝做实验,选择的金属样品种类太少
(3)氧气
五、综合类计算题。
24、为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁粉,然后将100g稀硫酸平均分五次加入,测得加入稀硫酸质虽与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸、硫酸铜溶液反应)
第一次 第二次 第三次 第四次 第五次
加入稀硫酸的质量/g 20 20 20 20 20
产生氢气的累计质量/g 0.05 0.10 m 0.20 0.20
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是多少(写出计算过程, 结果精确到0.1%)
(3)请根据数据和计算结果,在右图坐标中画出对应的曲线图。
(4)若另取同种生铁粉6g进行下图所示的实验,由图中数据可求得,100g混合溶液中所含H2SO4的质量为__________。
【答案】(1)0.15; (2)93.3%;
(3)如图所示:
;
(4)1.225g
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
