3.1 构成物质的微粒 第3课时 课件(共20张PPT) 2023-2024学年初中化学沪教版九年级上册
文档属性
| 名称 | 3.1 构成物质的微粒 第3课时 课件(共20张PPT) 2023-2024学年初中化学沪教版九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 520.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-08 23:11:19 | ||
图片预览








文档简介
(共20张PPT)
第1节 构成物质的微粒
第3课时
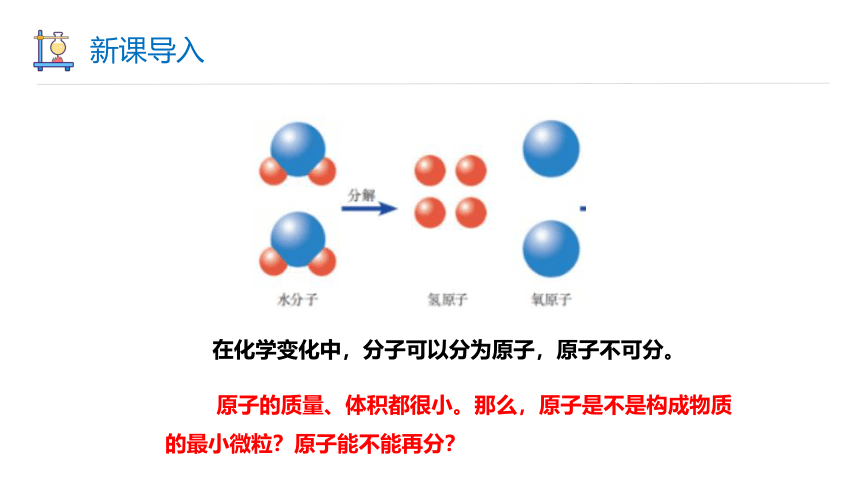
在化学变化中,分子可以分为原子,原子不可分。
原子的质量、体积都很小。那么,原子是不是构成物质的最小微粒?原子能不能再分?
1.能概述原子的构成及构成粒子之间的关系。
2.能说出相对原子质量的概念,并会查相对原子质量表。
3.能根据相对原子质量计算相对分子质量。
1897年,汤姆生发现原子含有____________________,原子并不是构成物质的最小微粒。
1911年,卢瑟福通过_________________实验,
发现原子是由____________________________构成
1919年,卢瑟福通过______________________实验,发现了原子核内有_______
1932年,科学家们发现原子核中还很含有_________
知识点一、原子的构成
带负电荷的电子
α粒子轰击金箔
由原子核和与核外电子
质子
α 粒子“轰击”了氮原子核
中子
原子核半径大约是原子半径的_____________。原子核在原子中所占体积______,核外电子在核外空间作____________。
原子核体积虽然很小,但原子核几乎集中了原子的___________,电子质量相对要小得多。
十万分之一
极小
高速运动
全部质量
科学家研究发现,原子是由带正电荷的原子核(atomic nucleus)和带负电荷的核外电子(electron)构成的。两者所带的______________,__________,因而原子呈电中性。
原子核所带的电荷数 ( _________ ) 等于核内质子所带的电荷数 ( 质子数 ), 也等于原子核外________。
核电荷数 = 质子数 = 核外电子数
电量大小相等
电性相反
电子数
核电荷数
以一种______________________作为基准,其他原子的质量与这一基准的___,称为这种原子的相对原子质量。
碳原子的质量的 1/12
比
各原子
的总和
碳原子
碳原子质量的1/12
氧原子的相对原子质量=
≈16
相对分子质量 (Mr) 等于构成分子的______的相对原子质量 (Ar) ______
各原子
的总和
观察与思考
请你根据课本第75 页表 3-4 相对原子质量的数据和以下实例, 算一算氧气(O2)、二氧化碳(CO2)的相对分子质量是多少。
解:氧气的相对分子质量 Mr( O2)= 16×2=32
解:二氧化碳的相对分子质量 Mr( CO2)= 12+16×2=44
枣糕模型
1897年,英国科学家汤姆生确认了所有原子都含有带负电荷的电子,一个电子带一个单位的负电荷,这表明原子内部结构比较复杂,原子并不是构成物质的最小微粒。
【探究1】:原子的构成
英国科学家卢瑟福
行星模型
①原子的大部分体积是空的 ②在原子的中心有一个很小的原子核③原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部。带负电的电子在核外空间进行绕核运动。
原子核内有什么?
1919 年,卢瑟福和他的助手用α 粒子“轰击”了氮原子核等,发现原子核里面有质子 (proton),1 个质子带 1 个单位正电荷。
1932 年,经过不少科学家的反复实验后确实发现原子核含有中子,中子是不显电性的中性粒子。
拓展视野
原子的结构模型
1911年,英国科学家卢瑟福用一束带正电荷的α粒子轰击金箔时,发现大多数 α粒子能穿透金箔,而且不改变原来的前进方向,但也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了不可穿透的坚硬质点而被弹了回来。你能试着对上述实验现象进行解释吗?请将你的看法与同学交流、讨论。
交流与讨论
大多数α粒子不改变方向
一小部分α粒子改变了原来的运动路径
极少部分α粒子被弹了回来
说明了原子核在原子中所占的体积很小
说明了原子核带正电
说明金的原子核质量远大于粒子的质量
中子、质子、电子是构成原子的微粒,那么是不是所有原子都含有这三种微粒?请举例说明。
大部分原子都是由中子、电子、质子构成的,如某种碳原子核内有6个质子、6个中子、核外有6个电子;但是有的原子中不含有中子,比如某种氢原子核内只含有一个质子,没有中子,核外有一个电子。
交流与讨论
原子核所带的电荷数 ( 核电荷数 ) 等于核内质子所带的电荷数 ( 质子数 ),也等于原子核外电子数。那么核内中子数和核内质子数与核外电子数是否也存在某种数量关系?
核内质子数和原子核外电子数一定相等,但是核内中子数不一定和它们相等,它们之间没有必然联系。
交流与讨论
结合相对原子质量和相对分子质量比较下列微粒质量的大小。
水分子
Mr(H2O)=18
氧分子
氢分子
氢原子
氧原子
Mr(H2)=2
Mr(O2)=32
Ar(H)=1
Ar(O)=16
微粒的质量与相对原子质量(或相对分子质量)成正比关,相对分子质量越大的微粒,其对应微粒的质量也越大
质量大小关系:水分子>氧分子>氧原子>氢分子>氢原子
交流与讨论
【探究2】:原子的质量
从上述微粒质量的比较结果,你能得出什么结论?与同学们交流、讨论。
交流与讨论
1.分子是由原子构成的,但是不能说分子的质量一定比原子质量大
2.分子的质量一定比构成分子的原子质量大
1.在分子、原子、原子核、质子、中子、电子等微粒中,找出符合下列条件的微粒,并填写在相应的横线上。
(1)带正电荷的微粒是____________________。
(2)不显电性的微粒是____________________。
(3)质量最小的微粒是____________________。
(4)化学变化中的最小微粒________________。
质子
原子核
中子
原子
分子
电子
原子
2.计算下列物质的相对分子质量(列出计算式)。
(1)氯气(Cl2)_____________________________________。
(2)二氧化碳(CO2)________________________________。
(3)氯酸钾(KClO3)________________________________。
(4)碱式碳酸铜[Cu2(OH)2CO3]_______________________。
35.5×2=71
12+16×2=44
39+35.5+16×3=122.5
64×2+(16+1)×2+12+16×3=222
1.原子的构成
原子
核外电子
原子核
质子
中子
每个电子带1个单位的负电荷
每个质子带1个单位的正电荷
不带电
核电核数=质子数=核外电子数
2.原子的质量
以一种碳原子的质量的 1/12 作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。
第1节 构成物质的微粒
第3课时
在化学变化中,分子可以分为原子,原子不可分。
原子的质量、体积都很小。那么,原子是不是构成物质的最小微粒?原子能不能再分?
1.能概述原子的构成及构成粒子之间的关系。
2.能说出相对原子质量的概念,并会查相对原子质量表。
3.能根据相对原子质量计算相对分子质量。
1897年,汤姆生发现原子含有____________________,原子并不是构成物质的最小微粒。
1911年,卢瑟福通过_________________实验,
发现原子是由____________________________构成
1919年,卢瑟福通过______________________实验,发现了原子核内有_______
1932年,科学家们发现原子核中还很含有_________
知识点一、原子的构成
带负电荷的电子
α粒子轰击金箔
由原子核和与核外电子
质子
α 粒子“轰击”了氮原子核
中子
原子核半径大约是原子半径的_____________。原子核在原子中所占体积______,核外电子在核外空间作____________。
原子核体积虽然很小,但原子核几乎集中了原子的___________,电子质量相对要小得多。
十万分之一
极小
高速运动
全部质量
科学家研究发现,原子是由带正电荷的原子核(atomic nucleus)和带负电荷的核外电子(electron)构成的。两者所带的______________,__________,因而原子呈电中性。
原子核所带的电荷数 ( _________ ) 等于核内质子所带的电荷数 ( 质子数 ), 也等于原子核外________。
核电荷数 = 质子数 = 核外电子数
电量大小相等
电性相反
电子数
核电荷数
以一种______________________作为基准,其他原子的质量与这一基准的___,称为这种原子的相对原子质量。
碳原子的质量的 1/12
比
各原子
的总和
碳原子
碳原子质量的1/12
氧原子的相对原子质量=
≈16
相对分子质量 (Mr) 等于构成分子的______的相对原子质量 (Ar) ______
各原子
的总和
观察与思考
请你根据课本第75 页表 3-4 相对原子质量的数据和以下实例, 算一算氧气(O2)、二氧化碳(CO2)的相对分子质量是多少。
解:氧气的相对分子质量 Mr( O2)= 16×2=32
解:二氧化碳的相对分子质量 Mr( CO2)= 12+16×2=44
枣糕模型
1897年,英国科学家汤姆生确认了所有原子都含有带负电荷的电子,一个电子带一个单位的负电荷,这表明原子内部结构比较复杂,原子并不是构成物质的最小微粒。
【探究1】:原子的构成
英国科学家卢瑟福
行星模型
①原子的大部分体积是空的 ②在原子的中心有一个很小的原子核③原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部。带负电的电子在核外空间进行绕核运动。
原子核内有什么?
1919 年,卢瑟福和他的助手用α 粒子“轰击”了氮原子核等,发现原子核里面有质子 (proton),1 个质子带 1 个单位正电荷。
1932 年,经过不少科学家的反复实验后确实发现原子核含有中子,中子是不显电性的中性粒子。
拓展视野
原子的结构模型
1911年,英国科学家卢瑟福用一束带正电荷的α粒子轰击金箔时,发现大多数 α粒子能穿透金箔,而且不改变原来的前进方向,但也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了不可穿透的坚硬质点而被弹了回来。你能试着对上述实验现象进行解释吗?请将你的看法与同学交流、讨论。
交流与讨论
大多数α粒子不改变方向
一小部分α粒子改变了原来的运动路径
极少部分α粒子被弹了回来
说明了原子核在原子中所占的体积很小
说明了原子核带正电
说明金的原子核质量远大于粒子的质量
中子、质子、电子是构成原子的微粒,那么是不是所有原子都含有这三种微粒?请举例说明。
大部分原子都是由中子、电子、质子构成的,如某种碳原子核内有6个质子、6个中子、核外有6个电子;但是有的原子中不含有中子,比如某种氢原子核内只含有一个质子,没有中子,核外有一个电子。
交流与讨论
原子核所带的电荷数 ( 核电荷数 ) 等于核内质子所带的电荷数 ( 质子数 ),也等于原子核外电子数。那么核内中子数和核内质子数与核外电子数是否也存在某种数量关系?
核内质子数和原子核外电子数一定相等,但是核内中子数不一定和它们相等,它们之间没有必然联系。
交流与讨论
结合相对原子质量和相对分子质量比较下列微粒质量的大小。
水分子
Mr(H2O)=18
氧分子
氢分子
氢原子
氧原子
Mr(H2)=2
Mr(O2)=32
Ar(H)=1
Ar(O)=16
微粒的质量与相对原子质量(或相对分子质量)成正比关,相对分子质量越大的微粒,其对应微粒的质量也越大
质量大小关系:水分子>氧分子>氧原子>氢分子>氢原子
交流与讨论
【探究2】:原子的质量
从上述微粒质量的比较结果,你能得出什么结论?与同学们交流、讨论。
交流与讨论
1.分子是由原子构成的,但是不能说分子的质量一定比原子质量大
2.分子的质量一定比构成分子的原子质量大
1.在分子、原子、原子核、质子、中子、电子等微粒中,找出符合下列条件的微粒,并填写在相应的横线上。
(1)带正电荷的微粒是____________________。
(2)不显电性的微粒是____________________。
(3)质量最小的微粒是____________________。
(4)化学变化中的最小微粒________________。
质子
原子核
中子
原子
分子
电子
原子
2.计算下列物质的相对分子质量(列出计算式)。
(1)氯气(Cl2)_____________________________________。
(2)二氧化碳(CO2)________________________________。
(3)氯酸钾(KClO3)________________________________。
(4)碱式碳酸铜[Cu2(OH)2CO3]_______________________。
35.5×2=71
12+16×2=44
39+35.5+16×3=122.5
64×2+(16+1)×2+12+16×3=222
1.原子的构成
原子
核外电子
原子核
质子
中子
每个电子带1个单位的负电荷
每个质子带1个单位的正电荷
不带电
核电核数=质子数=核外电子数
2.原子的质量
以一种碳原子的质量的 1/12 作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
