4.2 电解池(含解析) 课后训练 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2 电解池(含解析) 课后训练 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 542.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-08 21:50:31 | ||
图片预览



文档简介
4.2 电解池 课后训练
一、单选题
1.下列不是氯碱工业的直接产品的是( )
A.氢气 B.氯气 C.氯化氢 D.氢氧化钠
2.化学与生产生活密切相关,下列说法错误的是( )
A.利用丁达尔效应可鉴别Al(OH)3胶体和KCl溶液
B.电解饱和食盐水可得到氢氧化钠溶液
C.将Cl2通入澄清石灰水中可制得漂白粉
D.服用小苏打片可以治疗胃酸过多
3.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
4.化学与生产、生活密切相关。下列说法错误的是 ( )
A.氯碱工业是电解熔融的,在阳极能得到
B.电渗析法淡化海水利用了离子交换膜技术
C.晶体硅制得的光电池,能直接将光能转化为电能
D.煤经过气化和液化等化学变化可转化为清洁能源
5.铜片和锌片用导线连接后插入稀硫酸中,锌片是( )
A.正极 B.负极 C.阳极 D.阴极
6.铝合金(含Cu、Mg和Si等)用途广泛,可利用电解原理处理铝合金废料获得高纯铝,从而使资源得到合理利用。下列有关说法正确的是( )
A.铝合金与电源的负极相连
B.铝合金电极只发生反应Al-3e-=Al3+
C.电解槽中可以盛装等浓度的H2SO4和Al2(SO4)3的混合溶液
D.理论上阴阳两极的质量变化值:阳极>阴极
7.将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤.取滤液,用铂电极电解一段时间.则两极区析出的氧化产物与还原产物的质量比约为( )
A.35.5:108 B.108:35.5 C.8:1 D.1:2
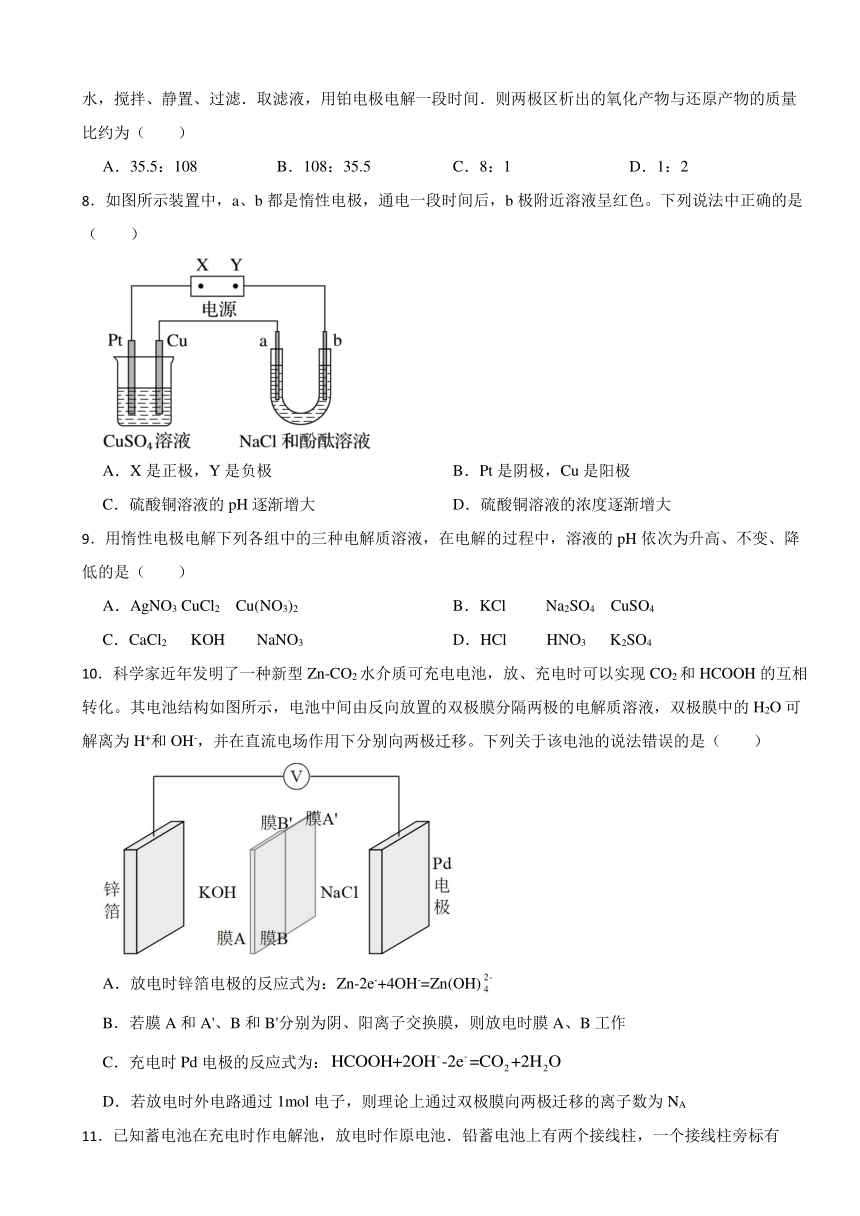
8.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法中正确的是( )
A.X是正极,Y是负极 B.Pt是阴极,Cu是阳极
C.硫酸铜溶液的pH逐渐增大 D.硫酸铜溶液的浓度逐渐增大
9.用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A.AgNO3 CuCl2 Cu(NO3)2 B.KCl Na2SO4 CuSO4
C.CaCl2 KOH NaNO3 D.HCl HNO3 K2SO4
10.科学家近年发明了一种新型Zn-CO2水介质可充电电池,放、充电时可以实现CO2和HCOOH的互相转化。其电池结构如图所示,电池中间由反向放置的双极膜分隔两极的电解质溶液,双极膜中的H2O可解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列关于该电池的说法错误的是( )
A.放电时锌箔电极的反应式为:Zn-2e-+4OH-=Zn(OH)
B.若膜A和A'、B和B'分别为阴、阳离子交换膜,则放电时膜A、B工作
C.充电时Pd电极的反应式为:
D.若放电时外电路通过1mol电子,则理论上通过双极膜向两极迁移的离子数为NA
11.已知蓄电池在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“﹣”.关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作负极 B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
12.用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到224mL 气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.0.1mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
13.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法。下列叙述错误的是( )
A.电镀铜时,只能选用氯化铜溶液作电解质溶液
B.镀层金属通常是在空气或溶液里不易起变化的金属或合金
C.电镀的方法可以应用在铜的精炼上
D.电镀的主要目的之一是使金属增强抗腐蚀的能力
14.原电池的正极和电解池的阴极所发生的反应分别是( )
A.氧化、还原 B.还原、氧化 C.氧化、氧化 D.还原、还原
15.如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )
A.标准状况下,生成22.4LCl2的同时有2molNaOH生成
B.从C口流出的是NaOH溶液
C.从E口逸出的气体是H2
D.从F口逸出的气体是Cl2
16.某有色金属工业的高盐废水中主要含有、、、、和,利用如图电解装置可回收、并尽可能除去和,其中双极膜(BP)中间层的解离为和,并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法错误的是
A.BP膜中均向右侧溶液迁移,M膜为一价阴离子交换膜
B.溶液a的溶质主要为HF和HCl,溶液b的溶质主要为和
C.当阳极产生22.4L气体(标准状况)时,有4mol离子通过N膜
D.电解过程中,应控制高盐废水的pH不能过高
二、综合题
17.电池和电解池在日常生活中有着广泛的应用。
(1)干电池应用广泛,其电解质溶液是混合溶液。该电池的负极材料是 ,电池工作时,电子流向 (填“正极”或“负极”)。若混合溶液中含有杂质,会加速某电极的反应,形成“自放电”现象,其主要原因是 。
(2)铅蓄电池是常用的化学电源,其电极材料分别是和,电解质溶液为硫酸。该电池总反应式为:。请根据上述情况判断:该蓄电池放电时,发生 (填“氧化”或“还原”)反应;正极附近溶液的酸性 (填“增强”、“减弱”或“不变”);充电时,电解质溶液中阴离子移向 (填“”或“”)电极,阴极的电极反应式为 。
(3)按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。
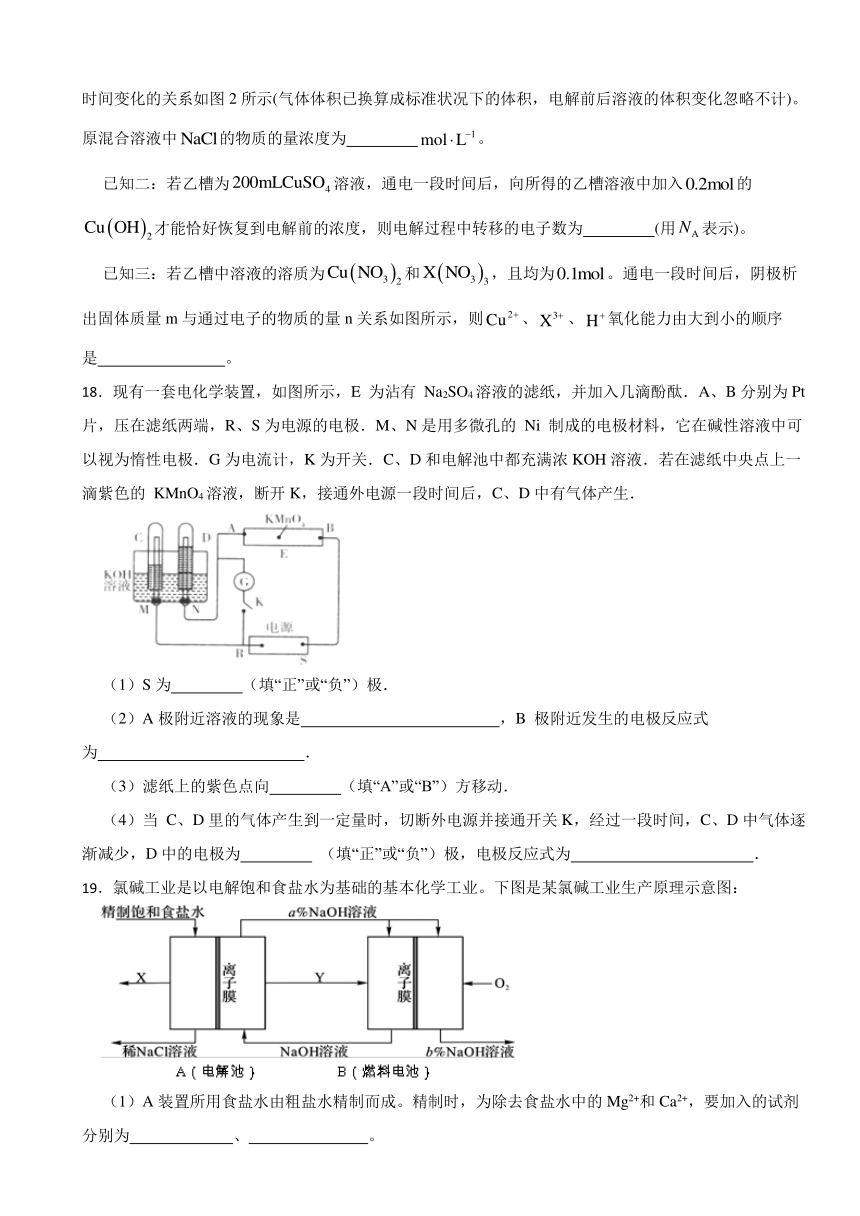
已知一:甲槽电解的是一定浓度的与的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。原混合溶液中的物质的量浓度为 。
已知二:若乙槽为溶液,通电一段时间后,向所得的乙槽溶液中加入的才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为 (用表示)。
已知三:若乙槽中溶液的溶质为和,且均为。通电一段时间后,阴极析出固体质量m与通过电子的物质的量n关系如图所示,则、、氧化能力由大到小的顺序是 。
18.现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生.
(1)S为 (填“正”或“负”)极.
(2)A极附近溶液的现象是 ,B 极附近发生的电极反应式为 .
(3)滤纸上的紫色点向 (填“A”或“B”)方移动.
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为 (填“正”或“负”)极,电极反应式为 .
19.氯碱工业是以电解饱和食盐水为基础的基本化学工业。下图是某氯碱工业生产原理示意图:
(1)A装置所用食盐水由粗盐水精制而成。精制时,为除去食盐水中的Mg2+和Ca2+,要加入的试剂分别为 、 。
(2)写出装置A在通电条件下反应的化学方程式 。
(3)氯碱工业是高耗能产业,按上图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,且相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是 (填化学式);X与稀NaOH溶液反应的离子方程式是: 。
②分析比较图示中氢氧化钠质量分数a%与b%的大小 。
③若用B装置作为A装置的辅助电源,每当消耗标准状况下氧气的体积为11.2 L时,则B装置可向A装置提供的电量约为 (一个e-的电量为1.60×10-19C;计算结果精确到0.01)。
20.镍氢电池广泛用于油电一体的混合动力汽车,该电池材料的回收利用也成为研究热点。
(1)Ⅰ.某品牌镍氢电池的总反应为,其中,MH为吸附了氢原子的储氢合金。图1为该电池放电时的工作原理示意图。
混合动力车上坡时利用电池放电提供能源。
①电极A是 (填“正极”或“负极”)。
②正极的电极反应式为 。
(2)混合动力车下坡时利用动能回收给电池充电,此时电极A附近的pH (填“变大”“不变”或“变小”)
(3)Ⅱ.该品牌废旧镍氢电池回收过程中,金属镍的转化过程如下:
转化过程中所用和NaOH溶液通过电解溶液获得,装置如图2。
已知:阴离子交换膜可选择性透过阴离子,阳离子交换膜可选择性透过阳离子。
图2中,电极C为电解池的 (填“阴极”或“阳极”)。
(4)产生的是 (填“甲池”“乙池”或“丙池”),结合化学用语说明产生的原理: 。
(5)回收该品牌废旧镍氢电池过程中,在阴极收集到气体134.4L(标准状况下),理论上最多可回收得到(摩尔质量为)的质量为 。
21.下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极,e、f是小试管。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。
请回答下列问题:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为: 。
(4)AgNO3溶液的浓度 (填增大、减小或不变。下同),H2SO4溶液的pH 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
答案解析部分
1.【答案】C
【解析】【解答】电解饱和食盐水阳极氯离子失去电子,化合价从-1价变化为0价,发生氧化反应,电极反应为:2Cl--2e-═Cl2↑,阴极氢离子得到电子,氢元素化合价从+1价变化为0价,发生还原反应,电极反应为:2H++2e-═H2↑;总反应为:2NaCl+2H2O=2NaOH+H2+Cl2,所以氯化氢不是氯碱工业的直接产品,故C符合题意;
故答案为:C。
【分析】工业上制取氯气大多采用电解饱和食盐水的方法,以此为基础的工业称为“氯碱工业”,电解饱和食盐水可产生氯气、氢气和氢氧化钠,据此分析进行解答。
2.【答案】C
【解析】【解答】A.丁达尔效应是胶体特有性质,利用丁达尔效应可以可鉴别Al(OH)3胶体和KCl溶液,故A不符合题意;
B.电解饱和食盐水可得到氯气、氢气和氢氧化钠溶液,故B不符合题意;
C.氢氧化钙微溶,应该将Cl2通入石灰乳中可制得漂白粉,故C符合题意;
D.碳酸氢钠能与盐酸反应,且碱性较弱,服用小苏打片可以治疗胃酸过多,故D不符合题意;
故答案为:C。
【分析】A、丁达尔效应可以鉴别胶体和溶液;
B、电解饱和食盐水可以制取氢氧化钠、氯气和氢气;
C、澄清石灰水中氢氧化钙含量很少;
D、小苏打为碳酸氢钠,可以治疗胃酸。
3.【答案】D
【解析】【解答】A.铅笔端作阴极,发生还原反应,故A不符合题意;
B.铂片端作阳极,发生氧化反应,故B不符合题意;
C.铅笔端作阴极,溶液中的阳离子在铅笔端放电,所以不会生成氯气,故C不符合题意;
D.铅笔端作阴极,则a是电源的负极,b是正极,故D符合题意;
答案选D。
【分析】出现红色字迹,说明溶液中有OH-生成,所以铅笔端作阴极,氢离子放电,发生还原反应,因此a是电源的负极,b是正极。
4.【答案】A
【解析】【解答】A.氯碱工业是指电解NaCl溶液制氢氧化钠及氯气,故A符合题意;
B.海水淡化的方法有蒸馏法、离子交换法和电渗析法等,其中电渗析法淡化海水利用了离子交换膜技术,故B不符合题意;
C.硅是良好的半导体材料,晶体硅制得的光电池,能直接将光能转化为电能,故C不符合题意;
D.煤经过气化和液化等化学变化可转化为清洁能源,故D不符合题意;
故答案为:A
【分析】A、氯碱工业是电解氯化钠溶液;
B、电渗析法利用离子交换膜技术淡化海水;
C、太阳能电池将光能转化为电能;
D、煤的气化和液化为化学变化。
5.【答案】B
【解析】【解答】锌比铜活泼,铜片和锌片用导线连接后插入稀硫酸中,锌片是负极,故B符合题意。
【分析】原电池中活泼金属易被氧化,做原电池的负极,据此解答即可。
6.【答案】D
【解析】【解答】A.利用电解原理处理铝合金废料时,铝合金应与电源的正极相连,A不符合题意;
B.铝合金电极即阳极上,比Al活泼的金属失电子生成离子,还发生Mg-2e-=Mg2+,B不符合题意;
C.若电解槽中可以盛装等浓度的H2SO4和Al2(SO4)3的混合溶液,则H+先于Al3+在阴极上反应,C不符合题意;
D.阳极上Mg和Al失电子变为离子,同时还有阳极泥生成,阴极上Al3+得电子生成Al,转移相同电子时,阴阳两极的质量变化值:阳极>阴极,D符合题意;
故答案为:D。
【分析】依据电解池中,与电源正极相连的电极是阳极,阳极失电子,发生氧化反应,与电源负极相连的电极是阴极,阴极上得电子,发生还原反应;及电解时放电顺序分析。
7.【答案】C
【解析】【解答】解:将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,发生反应:
K2SO4+Ba(NO3)2=BaSO4↓+2KNO3,AgNO3+NaCl=AgCl↓+NaNO3,搅拌、静置、过滤,滤液为KNO3和NaNO3溶液,
电解时发生:2H2O 2H2↑+O2↑,氧化产物为O2,还原产物为H2,
两极区析出的氧化产物与还原产物的质量比约为32:2×2=8:1,
故选C.
【分析】将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,发生反应:
K2SO4+Ba(NO3)2=BaSO4↓+2KNO3,AgNO3+NaCl=AgCl↓+NaNO3,反应后为KNO3和NaNO3溶液,用铂电极电解,实际上电解的为水,在两极上分别生成氧气和氢气.
8.【答案】A
【解析】【解答】U型管中是NaCl和酚酞溶液,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则b极得到NaOH和H2,作阴极,与其连接的Y极是外接直流电源的负极;则X是正极,Pt是阳极,Cu是阴极,a是阳极。
A.据以上分析,X是正极,Y是负极,A符合题意;
B.据以上分析,Pt是阳极,Cu是阴极,B不符合题意;
C.据以上分析,形成惰性电极电解硫酸铜溶液,阳极是,阴极是,溶液酸性增强,pH逐渐减小,C不符合题意;
D.据C项分析,铜离子不断生成铜单质析出,硫酸铜溶液的浓度逐渐较小,D不符合题意;
故答案为:A。
【分析】依据题目的现象,利用电解原理判断。
9.【答案】B
【解析】【解答】由电解规律可得:
类型 化学物质 pH变化
放O2生酸型 CuSO4、AgNO3、Cu(NO3)2 降低
放O2生酸型 KCl、CaCl2 升高
电解电解质型 CuCl2 升高
HCl 升高
电解H2O型 NaNO3、Na2SO4、K2SO4 不变
KaOH 升高
HNO3 降低
故答案为:B。
【分析】本题是用惰性电极电解,所以无需考虑阳极材料的放电问题,只需确定好离子的放电顺序便可以。
A.电解硝酸银生成硝酸,pH减小。
C.电解氢氧化钾相当于电解水,氢氧根浓度变大,pH变大。
D.电解硝酸相当于电解水氢离子浓度变大,pH变小。
10.【答案】D
【解析】【解答】A.放电时,锌箔为负极,锌失去电子发生氧化反应,电解质溶液为KOH,则电极反应式为Zn-2e-+4OH-=Zn(OH),故A不符合题意;
B.放电时为原电池,原电池工作时,阴离子向负极移动,阳离子向正极移动,则双极膜中的H2O解离的OH-通过膜A(阴离子交换膜)移向负极,H+通过膜B(阳离子交换膜)移向正极,故B不符合题意;
C.充电时Pd电极为阳极,HCOOH在阳极失电子发生氧化反应得到CO2,电极反应式为,故C不符合题意;
D.若放电时外电路通过1mol电子,理论上有1molOH-移向负极,1molH+移向正极,则理论上通过双极膜向两极迁移的离子数为2NA,故D符合题意;
故答案为:D。
【分析】根据题干信息,放电时为原电池,锌为负极,发生氧化反应,电极反应式为Zn-2e-+4OH-=Zn(OH)42-;Pd为正极,发生还原反应,电极反应式为CO2+2H++2e-=HCOOH。原电池工作时,阳离子想正极移动,阴离子向负极移动。充电时为电解池,Pd为阳极,发生氧化反应;锌为阴极,发生还原反应。注意充电时的电极反应式与放电时的正好相反。
11.【答案】B
【解析】【解答】解:铅蓄电池为二次电池,标有“+”的接线柱,放电时为原电池的正极,充电时为电解池的阳极,
故选B.
【分析】标有“+”的接线柱,放电时为原电池的正极,充电时为电解池的阳极,以此来解答.
12.【答案】A
【解析】【解答】电解100 mL H2SO4与CuSO4的混合溶液,阳极发生的反应为: 4OH--4e=2H2O+O2↑,阴极上发生的电极反应为:Cu2+ +2e- =Cu;2H++2e-=H2↑,两极均收集到0.224L (标况)气体,即均生成0.01mol的气体,阳极生成0.01mol氧气说明转移了0.04mol电子,而阴极上生成的0.01molH2只得到了0.02mol电子,所以剩余0.02mol电子由铜离子获得,且溶液中有0.01mol铜离子,据c= 即得到铜离子的浓度c=0.1mol/ L,故A符合题意;
故答案为A。
【分析】阳极发生的反应为: 4OH--4e=2H2O+O2↑,阴极上发生的电极反应为:Cu2+ +2e- =Cu;2H++2e-=H2↑,根据电子转移守恒计算。
13.【答案】A
【解析】【解答】A.电镀铜时,可以选用可溶性铜盐作电解质溶液,不一定要选用氯化铜溶液,故A符合题意;
B.电镀的主要目的之一是使金属增强抗腐蚀的能力,镀层金属通常是在空气或溶液里不易起变化的金属或合金,故B不符合题意;
C.电镀和精炼铜都是电解原理的应用,都是在阴极上析出金属,故C不符合题意;
D.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,故D不符合题意;
故答案为:A。
【分析】A.电镀铜时粗铜作阳极,纯铜作阴极,含铜离子的盐溶液作电解质溶液;
B.镀层金属化学性质稳定,抗腐蚀性能强;
C.电镀和电解精炼铜都是应用的电解原理;
D.电镀是在容易被腐蚀的金属上镀上不易被腐蚀的金属,隔绝空气,防止易腐蚀的金属被腐蚀。
14.【答案】D
【解析】【解答】解:原电池放电时,正极上得电子发生还原反应;电解池工作时,阴极上得电子发生还原反应,
故选D.
【分析】根据原电池正极和电解池阴极上得失电子判断反应类型,得电子的物质发生还原反应,失电子的物质发生氧化反应.
15.【答案】B
【解析】【解答】解:A.电解原理方程式2NaCl+2H2O 2NaOH+Cl2↑+H2↑,标准状况下每生成22.4L即1molCl2,便产生2molNaOH,故A正确;
B.阳离子交换膜仅允许Na+通过,则在C口不可能有NaOH导出,故B错误;
C.在电解池中,钠离子移向阴极,所以D极是阴极,发生2H++2e﹣=H2↑,故从E口逸出的气体是H2,故C正确;
D.左侧电极阳极,溶液中的阴离子氯离子失电子生成氯气,电极反应为:2Cl﹣﹣2e﹣=Cl2↑,故D正确;
故选B.
【分析】由电源正负极可知左侧电极为阳极,发生:2Cl﹣﹣2e﹣=Cl2↑,则右侧电极为阴极,发生2H++2e﹣=H2↑,电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,阴极生成OH﹣,且Na+向阴极移动,则产品烧碱溶液从阴极区导出,注意题中阳离子交换膜仅允许Na+通过的特点.
16.【答案】B
【解析】【解答】A.电解池中阳离子向阴极移动,BP膜中均向右侧溶液迁移;氟离子、氯离子通过M膜向左侧迁移,故M膜为一价阴离子交换膜,A不符合题意;
B.溶液a中氟离子、氯离子通过M膜向左侧迁移,氢离子与右侧双极膜迁移出来的OH-中和,故反应后溶液a的溶质主要为和;溶液b的溶质主要为右侧迁移过来的氟离子、氯离子与左侧前过来的氢离子生成的为HF和HCl,B符合题意;
C.阳极反应为,当阳极产生22.4L气体(标准状况下为1mol)时,根据电子守恒可知,有4mol离子通过N膜,C不符合题意;
D.电解过程中,若pH过高则会导致锌离子、铜离子转化为沉淀,故应控制高盐废水的pH不能过高,D不符合题意;
故答案为:B。
【分析】AB.依据电解时,阴离子通过阴离子交换膜移向阳极,阳离子通过阳离子交换膜移向阴极判断;
C.根据电子守恒分析;
D.依据A项分析判断。
17.【答案】(1)(或锌);正极;与反应生成,与构成微电池,加速锌极损失
(2)氧化;减弱;;
(3)0.1;;
【解析】【解答】(1)原电池的负极是发生氧化反应的一极:Zn-2e-===Zn2+;电池工作时,电子从负极流向正极;Zn与Cu2+发生氧化还原反应,生成的Cu附着在Zn的表面构成铜锌原电池,加快反应速率,从而加快Zn的腐蚀;
故答案为:Zn(或锌);正极;Zn 与Cu2+反应生成Cu,Zn与Cu构成微电池,加速锌极损失;
(2)铅蓄电池工作时,放电时,铅为负极,失去电子被氧化,电极反应为:,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低、酸性减弱,原电池放电时阴离子向负极移动;充电时,阴离子移向阳极,阴极的电极反应式为负极反应的逆反应;
故答案为:氧化;减弱;PbO2;;
(3)①阳极上离子放电顺序为Cl->OH-,阴极上离子放电顺序为,开始阶段阴极上析出Cu,阳极上产生Cl2,则图2中曲I代表阴极产生气体体积的变化,曲线Ⅱ代表阳极产生气体体积的变化。阳极上发生的反应依次为,,由曲线Ⅱ可知,Cl-放电完全时生成标准状况下224mLCl2,根据Cl原子守恒,溶液中;
故答案为:0.1;
②电解CuSO4溶液时,Cu2+在阴极放电,水电离的OH-在阳极放电,电解反应的离子方程式当加入0.2molCu(OH)2相当于加入0.2molCuO和0.2molH2O,则电解过程中转移电子的物质的量为0.2mol×2+0.2mol×2=0.8mol,即0.8NA;
故答案为:0.8NA;
③根据电解C的图像可知,通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达到最大,证明此时析出的固体是铜。如果是X3+析出,电子数应该是0.3mol,则氧化能力为Cu2+>X3+,当电子超过0.2mol时,固体质量没变,说明这阴极产生的氢气即电解水,说明氧化能力H+>X3+,故氧化能力为Cu2+>H+>X3+;
故答案为:Cu2+>H+>X3+。
【分析】(1) 锌锰原电池中负极材料为活泼金属Zn,MnO2为正极,电池工作时电子从负极经外电路流向正极;若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;
(2) 铅蓄电池工作时,阴离子向负极移动负极上金属失电子化合价升高,正极得电子发生还原反应;充电时,阳极发生氧化反应,阴极发生还原反应;
(3)①根据计算;
②根据计算;
③通过电子为0.2mol时,析出固体质量达到最大,证明此时析出的固体是铜, 当电子超过0.2mol时,固体质量没变,说明阴极产生的是氢气,即电解水,说明氧化能力H+>X3+。
18.【答案】(1)正
(2)溶液由无色逐渐变红色;4OH﹣﹣4e﹣=2H2O+O2↑
(3)B
(4)正;O2+4e﹣+2H2O=4OH﹣
【解析】【解答】解:(1)闭合K,通直流电,电极C、D及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,C极上气体体积是D极上气体体积的2倍,所以C极上得氢气,D极上得到氧气,故R是负极,S是正极,所以B极是阳极,A极是阴极,故答案为:正;(2)A极是阴极,电解高锰酸钾时,在该极上放电的是氢离子,所以该极上碱性增强,酚酞显红色,B极是阳极,该极附近发生的电极反应式为:4OH﹣﹣4e﹣=2H2O+O2↑,故答案为:溶液由无色逐渐变红色;4OH﹣﹣4e﹣=2H2O+O2↑;(3)浸有高锰酸钾的滤纸和电极A、B与电源也构成了电解池,因为R是负极,S是正极,所以B极是阳极,A极是阴极,电解质溶液中的阴离子高锰酸跟离子向阳极移动,所以B极呈紫色,故答案为:B;(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,构成氢氧燃料电池,在燃料电池中,燃料氢气为负极,方程式为2H2+4OH﹣﹣4e﹣=4H2O;
氧气作正极,方程式为O2+2H2O+4e﹣=4OH﹣,
故答案为:正;O2+2H2O+4e﹣=4OH﹣.
【分析】(1)根据C、D两电极得到的气体体积判断电极名称,从而确定电源S电极名称;(2)先判断A、B 的电极名称,根据电解池的工作原理来书写电极反应式;(3)根据电解池的工作原理判断电解时溶液中离子的移动方向;(4)根据原电池中燃料电池的工作原理和规律来回答.
19.【答案】(1)NaOH溶液;Na2CO3溶液
(2)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(3)H2;2OH-+Cl2=ClO-+Cl-+H2O;b%>a%;1.93×105C
【解析】【解答】(1)除去杂质不能引入新的杂质,即除去Mg2+用NaOH,除去Ca2+用Na2CO3;
故答案为:NaOH溶液 ; Na2CO3溶液。
(2)根据生产流程示意图,装置A是电解池装置,电解饱和食盐水,因此化学反应方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
(3)①装置A右端产生NaOH溶液,说明左端电极是阴极,发生2H2O+2e-=H2↑+2OH-,因此Y是氢气,装置A的左端是阳极,发生2Cl--2e-=Cl2↑,X为Cl2,和NaOH溶液的反应式Cl2+2OH-=Cl-+ClO-+H2O。
②装置B中通氧气的一极为正极,环境是NaOH,因此正极反应式为O2+2H2O+4e-=4OH-,产生NaOH,因此b%>a%。
故答案为:b%>a%。
③两者装置通过的电量相等,即转移的电量是:11.2×4×6.02×1023×1.6×10-19/22.4C=1.93×105C。
故答案为:1.93×105C。
【分析】(1)利用氢氧根离子除去镁离子,利用碳酸根离子除去钙离子;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气;
(3)B为燃料电池,一端通入氧气,另一端通入的肯定是可燃性气体,电解饱和氯化钠溶液生成的可燃性气体是氢气,结合氢氧为燃料电池的反应进行分析即可。
20.【答案】(1)负极;H2O+NiOOH+e-=Ni(OH)2+OH-
(2)变大
(3)阳极
(4)甲;电极C为该电解池的阳极,H2O在阳极失去电子生成O2,电极方程式为:2H2O-4e-= O2↑+4H+,生成H+,同时通过阴离子交换膜进入甲池,产生
(5)558
【解析】【解答】(1)①由电池中电子流向可知,电极A是负极;
②镍氢电池的总反应为,正极NiOOH得电子发生还原反应,电极方程式为:H2O+NiOOH+e-=Ni(OH)2+OH-。
(2)电池充电时A是阴极,由可知,充电时M得电子生成MH,电极方程式为:H2O+M+e-=MH+OH-,此时电极A附近的氢氧根浓度增大,pH变大。
(3)电解池中阳离子向阴极移动,由Na+的流向可知,电极D为阴极,电极C为阳极。
(4)电极C为该电解池的阳极,H2O在阳极失去电子生成O2,电极方程式为:2H2O-4e-= O2↑+4H+,生成H+,同时通过阴离子交换膜进入甲池,产生的是甲池。
(5)电解过程中,H2O在阴极得到电子生成H2,电极方程式为:2H2O+2e-= H2↑+2OH-,在阴极收集到H2的体积为134.4L(标准状况下),物质的量为,转移电子12mol,则在阳极生成6mol,则生成6molNiSO4,最终得到6mol,质量为6mol×=558g。
【分析】Ⅰ.根据电子流向可知,电极A为该电池的负极,电极B为电池正极,电极反应式为H2O+NiOOH+e-=Ni(OH)2+OH-,则充电时,电极A为阴极,电极B为阳极;
Ⅱ.根据钠离子的移动方向可知,电池C为电解池的阳极,电极反应式为2H2O-4e-= O2↑+4H+,电极D为阴极,电极反应式为2H2O+2e-= H2↑+2OH-。
21.【答案】(1)正
(2)Ag;2.16
(3)4∶4∶1∶2
(4)不变;减小
(5)45.18
【解析】【解答】(1)右侧装置中盛有5.00%的稀H2SO4,实际上是电解其中的水,阴极产生H2,阳极产生O2,且V(H2):V(O2)=2:1,由e、f中气体体积分析,可确定d极为阴极,则电源的N极为负极,M为正极。
(2)在c、d两极上共收集到336mL(标准状况)气体,根据电解硫酸溶液的反应:2H2O 2H2↑+O2↑得,V(H2)=336mL×2/3=224mL,即为0.01mol,V(O2)=336mL×1/3=112mL,即为0.005mol,因为电子转移关系:2H2~O2~4e-,则电路上有0.02mol电子,因此在Pt极(b、阴极)产生Ag,质量为:0.02mol×108g mol-1=2.16g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为,n(e-):n(Ag):n(O2):n(H2)=0.02:0.02:0.005:0.01=4:4:1:2。
(4)左侧装置为由Ag(阳极)电极、Pt(阴极)电极和AgNO3溶液组成的电镀池,因此AgNO3溶液浓度不变;电解5.00%的H2SO4溶液,由于其中的水发生电解,因此H2SO4溶液浓度增大,pH减小。
(5)根据前面的计算,电解生成H20.01mol,由2H2O 2H2↑+O2↑得,电解消耗水0.01mol×18g mol-1=0.18g,设原5.00%的H2SO4溶液为xg,则:5.00% x=5.02% (x-0.18),解得:x=45.18g。
【分析】(1)电解硫酸溶液,实质为电解水,阴极生成氢气,阳极生成氧气,且体积比为2:1,判断e为阳极,f为阴极,N为电源附近,M为电源正极;
(2)a为阳极,Ag失电子生成Ag+进入溶液中,b为阴极,溶液中的Ag+得电子生成Ag单质,从b极析出;根据氧化还原反应中得失电子守恒,利用氢气,氧气的体积计算出转移的电子数,以及Ag的质量;
(3)根据(2)中计算的物质的量,求比值;
(4)a为阳极,Ag失电子生成Ag+进入溶液中,b为阴极,溶液中的Ag+得电子生成Ag单质,溶液溶度不变;电解硫酸溶液实质为电解水,溶液中H+浓度增大,pH减小;
(5)根据电解过程中硫酸溶液中的溶质硫酸的质量不变解答;
一、单选题
1.下列不是氯碱工业的直接产品的是( )
A.氢气 B.氯气 C.氯化氢 D.氢氧化钠
2.化学与生产生活密切相关,下列说法错误的是( )
A.利用丁达尔效应可鉴别Al(OH)3胶体和KCl溶液
B.电解饱和食盐水可得到氢氧化钠溶液
C.将Cl2通入澄清石灰水中可制得漂白粉
D.服用小苏打片可以治疗胃酸过多
3.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
4.化学与生产、生活密切相关。下列说法错误的是 ( )
A.氯碱工业是电解熔融的,在阳极能得到
B.电渗析法淡化海水利用了离子交换膜技术
C.晶体硅制得的光电池,能直接将光能转化为电能
D.煤经过气化和液化等化学变化可转化为清洁能源
5.铜片和锌片用导线连接后插入稀硫酸中,锌片是( )
A.正极 B.负极 C.阳极 D.阴极
6.铝合金(含Cu、Mg和Si等)用途广泛,可利用电解原理处理铝合金废料获得高纯铝,从而使资源得到合理利用。下列有关说法正确的是( )
A.铝合金与电源的负极相连
B.铝合金电极只发生反应Al-3e-=Al3+
C.电解槽中可以盛装等浓度的H2SO4和Al2(SO4)3的混合溶液
D.理论上阴阳两极的质量变化值:阳极>阴极
7.将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤.取滤液,用铂电极电解一段时间.则两极区析出的氧化产物与还原产物的质量比约为( )
A.35.5:108 B.108:35.5 C.8:1 D.1:2
8.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法中正确的是( )
A.X是正极,Y是负极 B.Pt是阴极,Cu是阳极
C.硫酸铜溶液的pH逐渐增大 D.硫酸铜溶液的浓度逐渐增大
9.用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A.AgNO3 CuCl2 Cu(NO3)2 B.KCl Na2SO4 CuSO4
C.CaCl2 KOH NaNO3 D.HCl HNO3 K2SO4
10.科学家近年发明了一种新型Zn-CO2水介质可充电电池,放、充电时可以实现CO2和HCOOH的互相转化。其电池结构如图所示,电池中间由反向放置的双极膜分隔两极的电解质溶液,双极膜中的H2O可解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列关于该电池的说法错误的是( )
A.放电时锌箔电极的反应式为:Zn-2e-+4OH-=Zn(OH)
B.若膜A和A'、B和B'分别为阴、阳离子交换膜,则放电时膜A、B工作
C.充电时Pd电极的反应式为:
D.若放电时外电路通过1mol电子,则理论上通过双极膜向两极迁移的离子数为NA
11.已知蓄电池在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“﹣”.关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作负极 B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
12.用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到224mL 气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.0.1mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
13.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法。下列叙述错误的是( )
A.电镀铜时,只能选用氯化铜溶液作电解质溶液
B.镀层金属通常是在空气或溶液里不易起变化的金属或合金
C.电镀的方法可以应用在铜的精炼上
D.电镀的主要目的之一是使金属增强抗腐蚀的能力
14.原电池的正极和电解池的阴极所发生的反应分别是( )
A.氧化、还原 B.还原、氧化 C.氧化、氧化 D.还原、还原
15.如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )
A.标准状况下,生成22.4LCl2的同时有2molNaOH生成
B.从C口流出的是NaOH溶液
C.从E口逸出的气体是H2
D.从F口逸出的气体是Cl2
16.某有色金属工业的高盐废水中主要含有、、、、和,利用如图电解装置可回收、并尽可能除去和,其中双极膜(BP)中间层的解离为和,并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法错误的是
A.BP膜中均向右侧溶液迁移,M膜为一价阴离子交换膜
B.溶液a的溶质主要为HF和HCl,溶液b的溶质主要为和
C.当阳极产生22.4L气体(标准状况)时,有4mol离子通过N膜
D.电解过程中,应控制高盐废水的pH不能过高
二、综合题
17.电池和电解池在日常生活中有着广泛的应用。
(1)干电池应用广泛,其电解质溶液是混合溶液。该电池的负极材料是 ,电池工作时,电子流向 (填“正极”或“负极”)。若混合溶液中含有杂质,会加速某电极的反应,形成“自放电”现象,其主要原因是 。
(2)铅蓄电池是常用的化学电源,其电极材料分别是和,电解质溶液为硫酸。该电池总反应式为:。请根据上述情况判断:该蓄电池放电时,发生 (填“氧化”或“还原”)反应;正极附近溶液的酸性 (填“增强”、“减弱”或“不变”);充电时,电解质溶液中阴离子移向 (填“”或“”)电极,阴极的电极反应式为 。
(3)按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。
已知一:甲槽电解的是一定浓度的与的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。原混合溶液中的物质的量浓度为 。
已知二:若乙槽为溶液,通电一段时间后,向所得的乙槽溶液中加入的才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为 (用表示)。
已知三:若乙槽中溶液的溶质为和,且均为。通电一段时间后,阴极析出固体质量m与通过电子的物质的量n关系如图所示,则、、氧化能力由大到小的顺序是 。
18.现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生.
(1)S为 (填“正”或“负”)极.
(2)A极附近溶液的现象是 ,B 极附近发生的电极反应式为 .
(3)滤纸上的紫色点向 (填“A”或“B”)方移动.
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为 (填“正”或“负”)极,电极反应式为 .
19.氯碱工业是以电解饱和食盐水为基础的基本化学工业。下图是某氯碱工业生产原理示意图:
(1)A装置所用食盐水由粗盐水精制而成。精制时,为除去食盐水中的Mg2+和Ca2+,要加入的试剂分别为 、 。
(2)写出装置A在通电条件下反应的化学方程式 。
(3)氯碱工业是高耗能产业,按上图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,且相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是 (填化学式);X与稀NaOH溶液反应的离子方程式是: 。
②分析比较图示中氢氧化钠质量分数a%与b%的大小 。
③若用B装置作为A装置的辅助电源,每当消耗标准状况下氧气的体积为11.2 L时,则B装置可向A装置提供的电量约为 (一个e-的电量为1.60×10-19C;计算结果精确到0.01)。
20.镍氢电池广泛用于油电一体的混合动力汽车,该电池材料的回收利用也成为研究热点。
(1)Ⅰ.某品牌镍氢电池的总反应为,其中,MH为吸附了氢原子的储氢合金。图1为该电池放电时的工作原理示意图。
混合动力车上坡时利用电池放电提供能源。
①电极A是 (填“正极”或“负极”)。
②正极的电极反应式为 。
(2)混合动力车下坡时利用动能回收给电池充电,此时电极A附近的pH (填“变大”“不变”或“变小”)
(3)Ⅱ.该品牌废旧镍氢电池回收过程中,金属镍的转化过程如下:
转化过程中所用和NaOH溶液通过电解溶液获得,装置如图2。
已知:阴离子交换膜可选择性透过阴离子,阳离子交换膜可选择性透过阳离子。
图2中,电极C为电解池的 (填“阴极”或“阳极”)。
(4)产生的是 (填“甲池”“乙池”或“丙池”),结合化学用语说明产生的原理: 。
(5)回收该品牌废旧镍氢电池过程中,在阴极收集到气体134.4L(标准状况下),理论上最多可回收得到(摩尔质量为)的质量为 。
21.下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极,e、f是小试管。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。
请回答下列问题:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为: 。
(4)AgNO3溶液的浓度 (填增大、减小或不变。下同),H2SO4溶液的pH 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
答案解析部分
1.【答案】C
【解析】【解答】电解饱和食盐水阳极氯离子失去电子,化合价从-1价变化为0价,发生氧化反应,电极反应为:2Cl--2e-═Cl2↑,阴极氢离子得到电子,氢元素化合价从+1价变化为0价,发生还原反应,电极反应为:2H++2e-═H2↑;总反应为:2NaCl+2H2O=2NaOH+H2+Cl2,所以氯化氢不是氯碱工业的直接产品,故C符合题意;
故答案为:C。
【分析】工业上制取氯气大多采用电解饱和食盐水的方法,以此为基础的工业称为“氯碱工业”,电解饱和食盐水可产生氯气、氢气和氢氧化钠,据此分析进行解答。
2.【答案】C
【解析】【解答】A.丁达尔效应是胶体特有性质,利用丁达尔效应可以可鉴别Al(OH)3胶体和KCl溶液,故A不符合题意;
B.电解饱和食盐水可得到氯气、氢气和氢氧化钠溶液,故B不符合题意;
C.氢氧化钙微溶,应该将Cl2通入石灰乳中可制得漂白粉,故C符合题意;
D.碳酸氢钠能与盐酸反应,且碱性较弱,服用小苏打片可以治疗胃酸过多,故D不符合题意;
故答案为:C。
【分析】A、丁达尔效应可以鉴别胶体和溶液;
B、电解饱和食盐水可以制取氢氧化钠、氯气和氢气;
C、澄清石灰水中氢氧化钙含量很少;
D、小苏打为碳酸氢钠,可以治疗胃酸。
3.【答案】D
【解析】【解答】A.铅笔端作阴极,发生还原反应,故A不符合题意;
B.铂片端作阳极,发生氧化反应,故B不符合题意;
C.铅笔端作阴极,溶液中的阳离子在铅笔端放电,所以不会生成氯气,故C不符合题意;
D.铅笔端作阴极,则a是电源的负极,b是正极,故D符合题意;
答案选D。
【分析】出现红色字迹,说明溶液中有OH-生成,所以铅笔端作阴极,氢离子放电,发生还原反应,因此a是电源的负极,b是正极。
4.【答案】A
【解析】【解答】A.氯碱工业是指电解NaCl溶液制氢氧化钠及氯气,故A符合题意;
B.海水淡化的方法有蒸馏法、离子交换法和电渗析法等,其中电渗析法淡化海水利用了离子交换膜技术,故B不符合题意;
C.硅是良好的半导体材料,晶体硅制得的光电池,能直接将光能转化为电能,故C不符合题意;
D.煤经过气化和液化等化学变化可转化为清洁能源,故D不符合题意;
故答案为:A
【分析】A、氯碱工业是电解氯化钠溶液;
B、电渗析法利用离子交换膜技术淡化海水;
C、太阳能电池将光能转化为电能;
D、煤的气化和液化为化学变化。
5.【答案】B
【解析】【解答】锌比铜活泼,铜片和锌片用导线连接后插入稀硫酸中,锌片是负极,故B符合题意。
【分析】原电池中活泼金属易被氧化,做原电池的负极,据此解答即可。
6.【答案】D
【解析】【解答】A.利用电解原理处理铝合金废料时,铝合金应与电源的正极相连,A不符合题意;
B.铝合金电极即阳极上,比Al活泼的金属失电子生成离子,还发生Mg-2e-=Mg2+,B不符合题意;
C.若电解槽中可以盛装等浓度的H2SO4和Al2(SO4)3的混合溶液,则H+先于Al3+在阴极上反应,C不符合题意;
D.阳极上Mg和Al失电子变为离子,同时还有阳极泥生成,阴极上Al3+得电子生成Al,转移相同电子时,阴阳两极的质量变化值:阳极>阴极,D符合题意;
故答案为:D。
【分析】依据电解池中,与电源正极相连的电极是阳极,阳极失电子,发生氧化反应,与电源负极相连的电极是阴极,阴极上得电子,发生还原反应;及电解时放电顺序分析。
7.【答案】C
【解析】【解答】解:将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,发生反应:
K2SO4+Ba(NO3)2=BaSO4↓+2KNO3,AgNO3+NaCl=AgCl↓+NaNO3,搅拌、静置、过滤,滤液为KNO3和NaNO3溶液,
电解时发生:2H2O 2H2↑+O2↑,氧化产物为O2,还原产物为H2,
两极区析出的氧化产物与还原产物的质量比约为32:2×2=8:1,
故选C.
【分析】将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,发生反应:
K2SO4+Ba(NO3)2=BaSO4↓+2KNO3,AgNO3+NaCl=AgCl↓+NaNO3,反应后为KNO3和NaNO3溶液,用铂电极电解,实际上电解的为水,在两极上分别生成氧气和氢气.
8.【答案】A
【解析】【解答】U型管中是NaCl和酚酞溶液,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则b极得到NaOH和H2,作阴极,与其连接的Y极是外接直流电源的负极;则X是正极,Pt是阳极,Cu是阴极,a是阳极。
A.据以上分析,X是正极,Y是负极,A符合题意;
B.据以上分析,Pt是阳极,Cu是阴极,B不符合题意;
C.据以上分析,形成惰性电极电解硫酸铜溶液,阳极是,阴极是,溶液酸性增强,pH逐渐减小,C不符合题意;
D.据C项分析,铜离子不断生成铜单质析出,硫酸铜溶液的浓度逐渐较小,D不符合题意;
故答案为:A。
【分析】依据题目的现象,利用电解原理判断。
9.【答案】B
【解析】【解答】由电解规律可得:
类型 化学物质 pH变化
放O2生酸型 CuSO4、AgNO3、Cu(NO3)2 降低
放O2生酸型 KCl、CaCl2 升高
电解电解质型 CuCl2 升高
HCl 升高
电解H2O型 NaNO3、Na2SO4、K2SO4 不变
KaOH 升高
HNO3 降低
故答案为:B。
【分析】本题是用惰性电极电解,所以无需考虑阳极材料的放电问题,只需确定好离子的放电顺序便可以。
A.电解硝酸银生成硝酸,pH减小。
C.电解氢氧化钾相当于电解水,氢氧根浓度变大,pH变大。
D.电解硝酸相当于电解水氢离子浓度变大,pH变小。
10.【答案】D
【解析】【解答】A.放电时,锌箔为负极,锌失去电子发生氧化反应,电解质溶液为KOH,则电极反应式为Zn-2e-+4OH-=Zn(OH),故A不符合题意;
B.放电时为原电池,原电池工作时,阴离子向负极移动,阳离子向正极移动,则双极膜中的H2O解离的OH-通过膜A(阴离子交换膜)移向负极,H+通过膜B(阳离子交换膜)移向正极,故B不符合题意;
C.充电时Pd电极为阳极,HCOOH在阳极失电子发生氧化反应得到CO2,电极反应式为,故C不符合题意;
D.若放电时外电路通过1mol电子,理论上有1molOH-移向负极,1molH+移向正极,则理论上通过双极膜向两极迁移的离子数为2NA,故D符合题意;
故答案为:D。
【分析】根据题干信息,放电时为原电池,锌为负极,发生氧化反应,电极反应式为Zn-2e-+4OH-=Zn(OH)42-;Pd为正极,发生还原反应,电极反应式为CO2+2H++2e-=HCOOH。原电池工作时,阳离子想正极移动,阴离子向负极移动。充电时为电解池,Pd为阳极,发生氧化反应;锌为阴极,发生还原反应。注意充电时的电极反应式与放电时的正好相反。
11.【答案】B
【解析】【解答】解:铅蓄电池为二次电池,标有“+”的接线柱,放电时为原电池的正极,充电时为电解池的阳极,
故选B.
【分析】标有“+”的接线柱,放电时为原电池的正极,充电时为电解池的阳极,以此来解答.
12.【答案】A
【解析】【解答】电解100 mL H2SO4与CuSO4的混合溶液,阳极发生的反应为: 4OH--4e=2H2O+O2↑,阴极上发生的电极反应为:Cu2+ +2e- =Cu;2H++2e-=H2↑,两极均收集到0.224L (标况)气体,即均生成0.01mol的气体,阳极生成0.01mol氧气说明转移了0.04mol电子,而阴极上生成的0.01molH2只得到了0.02mol电子,所以剩余0.02mol电子由铜离子获得,且溶液中有0.01mol铜离子,据c= 即得到铜离子的浓度c=0.1mol/ L,故A符合题意;
故答案为A。
【分析】阳极发生的反应为: 4OH--4e=2H2O+O2↑,阴极上发生的电极反应为:Cu2+ +2e- =Cu;2H++2e-=H2↑,根据电子转移守恒计算。
13.【答案】A
【解析】【解答】A.电镀铜时,可以选用可溶性铜盐作电解质溶液,不一定要选用氯化铜溶液,故A符合题意;
B.电镀的主要目的之一是使金属增强抗腐蚀的能力,镀层金属通常是在空气或溶液里不易起变化的金属或合金,故B不符合题意;
C.电镀和精炼铜都是电解原理的应用,都是在阴极上析出金属,故C不符合题意;
D.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,故D不符合题意;
故答案为:A。
【分析】A.电镀铜时粗铜作阳极,纯铜作阴极,含铜离子的盐溶液作电解质溶液;
B.镀层金属化学性质稳定,抗腐蚀性能强;
C.电镀和电解精炼铜都是应用的电解原理;
D.电镀是在容易被腐蚀的金属上镀上不易被腐蚀的金属,隔绝空气,防止易腐蚀的金属被腐蚀。
14.【答案】D
【解析】【解答】解:原电池放电时,正极上得电子发生还原反应;电解池工作时,阴极上得电子发生还原反应,
故选D.
【分析】根据原电池正极和电解池阴极上得失电子判断反应类型,得电子的物质发生还原反应,失电子的物质发生氧化反应.
15.【答案】B
【解析】【解答】解:A.电解原理方程式2NaCl+2H2O 2NaOH+Cl2↑+H2↑,标准状况下每生成22.4L即1molCl2,便产生2molNaOH,故A正确;
B.阳离子交换膜仅允许Na+通过,则在C口不可能有NaOH导出,故B错误;
C.在电解池中,钠离子移向阴极,所以D极是阴极,发生2H++2e﹣=H2↑,故从E口逸出的气体是H2,故C正确;
D.左侧电极阳极,溶液中的阴离子氯离子失电子生成氯气,电极反应为:2Cl﹣﹣2e﹣=Cl2↑,故D正确;
故选B.
【分析】由电源正负极可知左侧电极为阳极,发生:2Cl﹣﹣2e﹣=Cl2↑,则右侧电极为阴极,发生2H++2e﹣=H2↑,电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,阴极生成OH﹣,且Na+向阴极移动,则产品烧碱溶液从阴极区导出,注意题中阳离子交换膜仅允许Na+通过的特点.
16.【答案】B
【解析】【解答】A.电解池中阳离子向阴极移动,BP膜中均向右侧溶液迁移;氟离子、氯离子通过M膜向左侧迁移,故M膜为一价阴离子交换膜,A不符合题意;
B.溶液a中氟离子、氯离子通过M膜向左侧迁移,氢离子与右侧双极膜迁移出来的OH-中和,故反应后溶液a的溶质主要为和;溶液b的溶质主要为右侧迁移过来的氟离子、氯离子与左侧前过来的氢离子生成的为HF和HCl,B符合题意;
C.阳极反应为,当阳极产生22.4L气体(标准状况下为1mol)时,根据电子守恒可知,有4mol离子通过N膜,C不符合题意;
D.电解过程中,若pH过高则会导致锌离子、铜离子转化为沉淀,故应控制高盐废水的pH不能过高,D不符合题意;
故答案为:B。
【分析】AB.依据电解时,阴离子通过阴离子交换膜移向阳极,阳离子通过阳离子交换膜移向阴极判断;
C.根据电子守恒分析;
D.依据A项分析判断。
17.【答案】(1)(或锌);正极;与反应生成,与构成微电池,加速锌极损失
(2)氧化;减弱;;
(3)0.1;;
【解析】【解答】(1)原电池的负极是发生氧化反应的一极:Zn-2e-===Zn2+;电池工作时,电子从负极流向正极;Zn与Cu2+发生氧化还原反应,生成的Cu附着在Zn的表面构成铜锌原电池,加快反应速率,从而加快Zn的腐蚀;
故答案为:Zn(或锌);正极;Zn 与Cu2+反应生成Cu,Zn与Cu构成微电池,加速锌极损失;
(2)铅蓄电池工作时,放电时,铅为负极,失去电子被氧化,电极反应为:,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低、酸性减弱,原电池放电时阴离子向负极移动;充电时,阴离子移向阳极,阴极的电极反应式为负极反应的逆反应;
故答案为:氧化;减弱;PbO2;;
(3)①阳极上离子放电顺序为Cl->OH-,阴极上离子放电顺序为,开始阶段阴极上析出Cu,阳极上产生Cl2,则图2中曲I代表阴极产生气体体积的变化,曲线Ⅱ代表阳极产生气体体积的变化。阳极上发生的反应依次为,,由曲线Ⅱ可知,Cl-放电完全时生成标准状况下224mLCl2,根据Cl原子守恒,溶液中;
故答案为:0.1;
②电解CuSO4溶液时,Cu2+在阴极放电,水电离的OH-在阳极放电,电解反应的离子方程式当加入0.2molCu(OH)2相当于加入0.2molCuO和0.2molH2O,则电解过程中转移电子的物质的量为0.2mol×2+0.2mol×2=0.8mol,即0.8NA;
故答案为:0.8NA;
③根据电解C的图像可知,通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达到最大,证明此时析出的固体是铜。如果是X3+析出,电子数应该是0.3mol,则氧化能力为Cu2+>X3+,当电子超过0.2mol时,固体质量没变,说明这阴极产生的氢气即电解水,说明氧化能力H+>X3+,故氧化能力为Cu2+>H+>X3+;
故答案为:Cu2+>H+>X3+。
【分析】(1) 锌锰原电池中负极材料为活泼金属Zn,MnO2为正极,电池工作时电子从负极经外电路流向正极;若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;
(2) 铅蓄电池工作时,阴离子向负极移动负极上金属失电子化合价升高,正极得电子发生还原反应;充电时,阳极发生氧化反应,阴极发生还原反应;
(3)①根据计算;
②根据计算;
③通过电子为0.2mol时,析出固体质量达到最大,证明此时析出的固体是铜, 当电子超过0.2mol时,固体质量没变,说明阴极产生的是氢气,即电解水,说明氧化能力H+>X3+。
18.【答案】(1)正
(2)溶液由无色逐渐变红色;4OH﹣﹣4e﹣=2H2O+O2↑
(3)B
(4)正;O2+4e﹣+2H2O=4OH﹣
【解析】【解答】解:(1)闭合K,通直流电,电极C、D及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,C极上气体体积是D极上气体体积的2倍,所以C极上得氢气,D极上得到氧气,故R是负极,S是正极,所以B极是阳极,A极是阴极,故答案为:正;(2)A极是阴极,电解高锰酸钾时,在该极上放电的是氢离子,所以该极上碱性增强,酚酞显红色,B极是阳极,该极附近发生的电极反应式为:4OH﹣﹣4e﹣=2H2O+O2↑,故答案为:溶液由无色逐渐变红色;4OH﹣﹣4e﹣=2H2O+O2↑;(3)浸有高锰酸钾的滤纸和电极A、B与电源也构成了电解池,因为R是负极,S是正极,所以B极是阳极,A极是阴极,电解质溶液中的阴离子高锰酸跟离子向阳极移动,所以B极呈紫色,故答案为:B;(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,构成氢氧燃料电池,在燃料电池中,燃料氢气为负极,方程式为2H2+4OH﹣﹣4e﹣=4H2O;
氧气作正极,方程式为O2+2H2O+4e﹣=4OH﹣,
故答案为:正;O2+2H2O+4e﹣=4OH﹣.
【分析】(1)根据C、D两电极得到的气体体积判断电极名称,从而确定电源S电极名称;(2)先判断A、B 的电极名称,根据电解池的工作原理来书写电极反应式;(3)根据电解池的工作原理判断电解时溶液中离子的移动方向;(4)根据原电池中燃料电池的工作原理和规律来回答.
19.【答案】(1)NaOH溶液;Na2CO3溶液
(2)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(3)H2;2OH-+Cl2=ClO-+Cl-+H2O;b%>a%;1.93×105C
【解析】【解答】(1)除去杂质不能引入新的杂质,即除去Mg2+用NaOH,除去Ca2+用Na2CO3;
故答案为:NaOH溶液 ; Na2CO3溶液。
(2)根据生产流程示意图,装置A是电解池装置,电解饱和食盐水,因此化学反应方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
(3)①装置A右端产生NaOH溶液,说明左端电极是阴极,发生2H2O+2e-=H2↑+2OH-,因此Y是氢气,装置A的左端是阳极,发生2Cl--2e-=Cl2↑,X为Cl2,和NaOH溶液的反应式Cl2+2OH-=Cl-+ClO-+H2O。
②装置B中通氧气的一极为正极,环境是NaOH,因此正极反应式为O2+2H2O+4e-=4OH-,产生NaOH,因此b%>a%。
故答案为:b%>a%。
③两者装置通过的电量相等,即转移的电量是:11.2×4×6.02×1023×1.6×10-19/22.4C=1.93×105C。
故答案为:1.93×105C。
【分析】(1)利用氢氧根离子除去镁离子,利用碳酸根离子除去钙离子;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气;
(3)B为燃料电池,一端通入氧气,另一端通入的肯定是可燃性气体,电解饱和氯化钠溶液生成的可燃性气体是氢气,结合氢氧为燃料电池的反应进行分析即可。
20.【答案】(1)负极;H2O+NiOOH+e-=Ni(OH)2+OH-
(2)变大
(3)阳极
(4)甲;电极C为该电解池的阳极,H2O在阳极失去电子生成O2,电极方程式为:2H2O-4e-= O2↑+4H+,生成H+,同时通过阴离子交换膜进入甲池,产生
(5)558
【解析】【解答】(1)①由电池中电子流向可知,电极A是负极;
②镍氢电池的总反应为,正极NiOOH得电子发生还原反应,电极方程式为:H2O+NiOOH+e-=Ni(OH)2+OH-。
(2)电池充电时A是阴极,由可知,充电时M得电子生成MH,电极方程式为:H2O+M+e-=MH+OH-,此时电极A附近的氢氧根浓度增大,pH变大。
(3)电解池中阳离子向阴极移动,由Na+的流向可知,电极D为阴极,电极C为阳极。
(4)电极C为该电解池的阳极,H2O在阳极失去电子生成O2,电极方程式为:2H2O-4e-= O2↑+4H+,生成H+,同时通过阴离子交换膜进入甲池,产生的是甲池。
(5)电解过程中,H2O在阴极得到电子生成H2,电极方程式为:2H2O+2e-= H2↑+2OH-,在阴极收集到H2的体积为134.4L(标准状况下),物质的量为,转移电子12mol,则在阳极生成6mol,则生成6molNiSO4,最终得到6mol,质量为6mol×=558g。
【分析】Ⅰ.根据电子流向可知,电极A为该电池的负极,电极B为电池正极,电极反应式为H2O+NiOOH+e-=Ni(OH)2+OH-,则充电时,电极A为阴极,电极B为阳极;
Ⅱ.根据钠离子的移动方向可知,电池C为电解池的阳极,电极反应式为2H2O-4e-= O2↑+4H+,电极D为阴极,电极反应式为2H2O+2e-= H2↑+2OH-。
21.【答案】(1)正
(2)Ag;2.16
(3)4∶4∶1∶2
(4)不变;减小
(5)45.18
【解析】【解答】(1)右侧装置中盛有5.00%的稀H2SO4,实际上是电解其中的水,阴极产生H2,阳极产生O2,且V(H2):V(O2)=2:1,由e、f中气体体积分析,可确定d极为阴极,则电源的N极为负极,M为正极。
(2)在c、d两极上共收集到336mL(标准状况)气体,根据电解硫酸溶液的反应:2H2O 2H2↑+O2↑得,V(H2)=336mL×2/3=224mL,即为0.01mol,V(O2)=336mL×1/3=112mL,即为0.005mol,因为电子转移关系:2H2~O2~4e-,则电路上有0.02mol电子,因此在Pt极(b、阴极)产生Ag,质量为:0.02mol×108g mol-1=2.16g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为,n(e-):n(Ag):n(O2):n(H2)=0.02:0.02:0.005:0.01=4:4:1:2。
(4)左侧装置为由Ag(阳极)电极、Pt(阴极)电极和AgNO3溶液组成的电镀池,因此AgNO3溶液浓度不变;电解5.00%的H2SO4溶液,由于其中的水发生电解,因此H2SO4溶液浓度增大,pH减小。
(5)根据前面的计算,电解生成H20.01mol,由2H2O 2H2↑+O2↑得,电解消耗水0.01mol×18g mol-1=0.18g,设原5.00%的H2SO4溶液为xg,则:5.00% x=5.02% (x-0.18),解得:x=45.18g。
【分析】(1)电解硫酸溶液,实质为电解水,阴极生成氢气,阳极生成氧气,且体积比为2:1,判断e为阳极,f为阴极,N为电源附近,M为电源正极;
(2)a为阳极,Ag失电子生成Ag+进入溶液中,b为阴极,溶液中的Ag+得电子生成Ag单质,从b极析出;根据氧化还原反应中得失电子守恒,利用氢气,氧气的体积计算出转移的电子数,以及Ag的质量;
(3)根据(2)中计算的物质的量,求比值;
(4)a为阳极,Ag失电子生成Ag+进入溶液中,b为阴极,溶液中的Ag+得电子生成Ag单质,溶液溶度不变;电解硫酸溶液实质为电解水,溶液中H+浓度增大,pH减小;
(5)根据电解过程中硫酸溶液中的溶质硫酸的质量不变解答;
