3.2.2铝及铝的合金 课件(共17张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.2.2铝及铝的合金 课件(共17张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-09 09:19:17 | ||
图片预览





文档简介
(共17张PPT)
铝制电线
易拉罐
铝制餐具
铝合金门窗
航空航天
潜艇
军事
铝和铝合金
课程标准要求
核心素养发展目标
1、了解铝的性质
2、了解两性氧化物——氧化铝
3、了解合金的性质
1、能从铝的原子结构示意图与金属活动性顺序表预测铝的性质,培养宏观辨识与微观探析的能力。
2、能根据反应物及实验现象,科学、合理的分析生成物,培养学生的实验探究与证据推理能力。
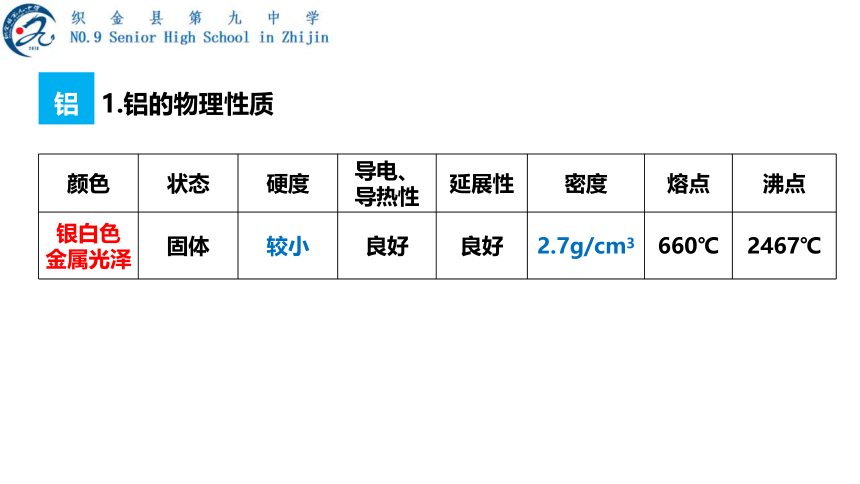
1.铝的物理性质
颜色 状态 硬度 导电、导热性 延展性 密度 熔点 沸点
银白色 金属光泽 固体 较小 良好 良好 2.7g/cm3 660℃ 2467℃
铝
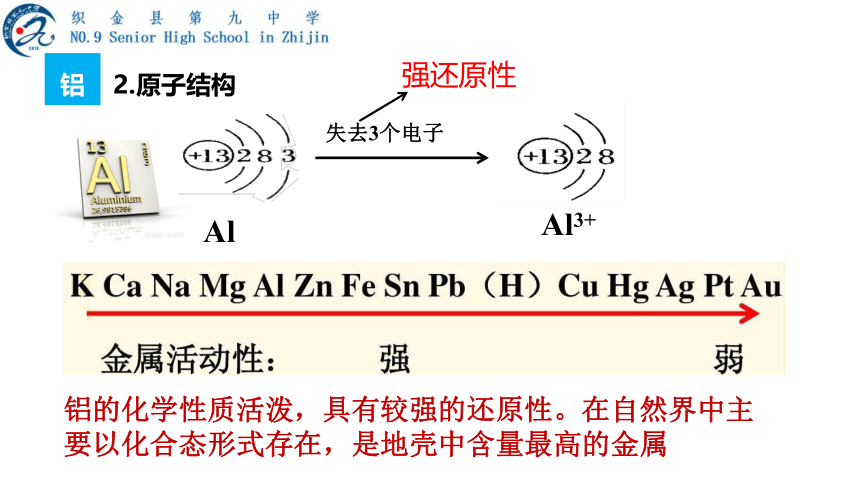
2.原子结构
铝
强还原性
Al
Al3+
失去3个电子
铝的化学性质活泼,具有较强的还原性。在自然界中主要以化合态形式存在,是地壳中含量最高的金属
铝表面会与空气中氧气生成一层致密的氧化铝薄膜,保护内部金属。
4Al+3O2 = 2Al2O3
思考:铝是一种活泼的金属,为什么却能在空气中稳定的存在?
(1)、与氧气反应
3.铝的化学性质
在一支试管中加入5 mL盐酸,再向其中放入一小块铝片,观察现象。你观察到什么现象
实验操作
实验现象
实验原理
铝片逐渐溶解,一段时间后产生气泡,试管壁有发热现象
2Al+6H+ =2Al3++3H2↑
Al2O3+6H+=2Al3++3H2O
(2)、与酸反应:
2Al+6H+ =2Al3++3H2↑
2Al+6HCl === 2AlCl3+3H2↑
Al2O3+6HCl=2AlCl3+3H2O
实验操作
实验现象
实验原理
铝片逐渐溶解,开始没有气泡,一段时间后才产生气泡
2Al + 2NaOH +6H2O = 2Na[ Al(OH)4]+ 3H2↑
2Al+ 2OH-+6H2O = 2Al(OH)4- +3H2↑
Al2O3+2OH- + 3H2O =2Al(OH)4-
Al2O3 + 2NaOH + 3H2O = 2Na[ Al(OH)4]
与碱溶液反应生成盐和水
与酸溶液反应生成盐和水
两性
氧化物
Al2O3
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH = 2NaAlO2+H2O
铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性的食物
二、合金
合金的硬度一般比组成它的纯金属大
硬度大、熔点低、密度小、耐磨、耐腐蚀等。
多数合金的熔点低于组成它的成分金属
2、在常温下,将铝分别放人下列溶液中,溶液质量会减少的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸铜溶液 D.食盐水
C
1、下列关于金属铝及氧化铝的说法不正确的是( )
A.铝是地壳中含量最多的元素
B.铝在自然界中通常以化合态形式存在
C.金属铝在空气中有良好的抗腐蚀性
D.氧化铝是一种高硬度、高熔沸点的化合物,红宝石、蓝宝石的主要成分均是氧化铝
A
3、我国高铁技术处于世界领先水平。车厢大部分采用铝合金材料制造,是因为铝合金( )
A.比纯铝熔点高
B.具有比较活泼的化学性质
C.各种成分在自然界中含量丰富,容易获取
D.质量轻,强度大,抗腐蚀能力比较强
D
课堂小结
铝和铝合金
铝
物理性质
存在形式
化学性质
铝合金
与O2反应
与酸反应
与碱反应
氧化铝
与酸反应
与碱反应
作业布置:同步解析习题
Thanks
感谢聆听
铝制电线
易拉罐
铝制餐具
铝合金门窗
航空航天
潜艇
军事
铝和铝合金
课程标准要求
核心素养发展目标
1、了解铝的性质
2、了解两性氧化物——氧化铝
3、了解合金的性质
1、能从铝的原子结构示意图与金属活动性顺序表预测铝的性质,培养宏观辨识与微观探析的能力。
2、能根据反应物及实验现象,科学、合理的分析生成物,培养学生的实验探究与证据推理能力。
1.铝的物理性质
颜色 状态 硬度 导电、导热性 延展性 密度 熔点 沸点
银白色 金属光泽 固体 较小 良好 良好 2.7g/cm3 660℃ 2467℃
铝
2.原子结构
铝
强还原性
Al
Al3+
失去3个电子
铝的化学性质活泼,具有较强的还原性。在自然界中主要以化合态形式存在,是地壳中含量最高的金属
铝表面会与空气中氧气生成一层致密的氧化铝薄膜,保护内部金属。
4Al+3O2 = 2Al2O3
思考:铝是一种活泼的金属,为什么却能在空气中稳定的存在?
(1)、与氧气反应
3.铝的化学性质
在一支试管中加入5 mL盐酸,再向其中放入一小块铝片,观察现象。你观察到什么现象
实验操作
实验现象
实验原理
铝片逐渐溶解,一段时间后产生气泡,试管壁有发热现象
2Al+6H+ =2Al3++3H2↑
Al2O3+6H+=2Al3++3H2O
(2)、与酸反应:
2Al+6H+ =2Al3++3H2↑
2Al+6HCl === 2AlCl3+3H2↑
Al2O3+6HCl=2AlCl3+3H2O
实验操作
实验现象
实验原理
铝片逐渐溶解,开始没有气泡,一段时间后才产生气泡
2Al + 2NaOH +6H2O = 2Na[ Al(OH)4]+ 3H2↑
2Al+ 2OH-+6H2O = 2Al(OH)4- +3H2↑
Al2O3+2OH- + 3H2O =2Al(OH)4-
Al2O3 + 2NaOH + 3H2O = 2Na[ Al(OH)4]
与碱溶液反应生成盐和水
与酸溶液反应生成盐和水
两性
氧化物
Al2O3
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH = 2NaAlO2+H2O
铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性的食物
二、合金
合金的硬度一般比组成它的纯金属大
硬度大、熔点低、密度小、耐磨、耐腐蚀等。
多数合金的熔点低于组成它的成分金属
2、在常温下,将铝分别放人下列溶液中,溶液质量会减少的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸铜溶液 D.食盐水
C
1、下列关于金属铝及氧化铝的说法不正确的是( )
A.铝是地壳中含量最多的元素
B.铝在自然界中通常以化合态形式存在
C.金属铝在空气中有良好的抗腐蚀性
D.氧化铝是一种高硬度、高熔沸点的化合物,红宝石、蓝宝石的主要成分均是氧化铝
A
3、我国高铁技术处于世界领先水平。车厢大部分采用铝合金材料制造,是因为铝合金( )
A.比纯铝熔点高
B.具有比较活泼的化学性质
C.各种成分在自然界中含量丰富,容易获取
D.质量轻,强度大,抗腐蚀能力比较强
D
课堂小结
铝和铝合金
铝
物理性质
存在形式
化学性质
铝合金
与O2反应
与酸反应
与碱反应
氧化铝
与酸反应
与碱反应
作业布置:同步解析习题
Thanks
感谢聆听
