福建省三明市五校2023-2024学年高一上学期期中联考化学试题(PDF版含答案)
文档属性
| 名称 | 福建省三明市五校2023-2024学年高一上学期期中联考化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 564.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-09 15:52:39 | ||
图片预览


文档简介
三明市 2023-2024学年高一上学期期中五校联考
化 学 试 卷
(考试时间:90分钟 满分:100分)
参考的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
Fe-56 Cu-64
一、选择题(每小题只有一个正确选项,每小题 3分,共 48分)
1. 化学与生活生产密切相关,下列说法错误的是
A.“卤水点豆腐,一物降一物”,该过程发生胶体的聚沉
B.“凡石灰,经火焚炼为用”,这里的石灰是 CaCO3
C.“青蒿一握,以水二升渍,绞取汁”,受此启发屠呦呦利用乙醚提取青蒿素
D. NaHCO3能与碱反应,所以可用作焙制糕点的膨松剂
2. 晋代葛洪的《食肉方》去除黑痣的药方中记载:“取白炭灰(熟石灰),获灰(草木灰),等分,
煎令如膏……,并可与去黑子”。对于能除去黑痣的物质的说法正确的是
A. 是 Ca(OH)2 B. 有强腐蚀性
C. 只有溶于水才能电离 D. 是 K2CO3
3. 2019年诺贝尔化学奖颁给几位在锂离子电池研发领域做出贡献的科学家,锂单质化学性质与
3
钠类似,活泼性比钠略弱。它的密度为 0.534g/cm,将绿豆大的锂投入水中,下列实验现象
合理的有
①锂沉入水中 ②锂浮在水面上 ③水中有大量气泡
④反应后在水中加入几滴石蕊试液,溶液变红
⑤反应比钠剧烈 ⑥锂四处游动
A. ②③⑥ B. ①③⑥ C. ②③⑤ D. ②④⑤⑥
4. 已知两瓶气体,分别是 HCl 和 Cl2,可以区别它们的方法或试剂是
①观察颜色 ②打开瓶盖看有无白雾 ③硝酸银溶液 ④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸
A. ①③④ B. ①②④ C. ①②④⑤ D. ①②⑤
5. 下列物质分类组合正确的是
选项 混合物 酸性氧化物 碱性氧化物 盐
A 漂白粉 CO2 K2O Cu2(OH)2CO3
B 碱石灰 SO3 Na2O2 NH4NO3
C CuSO4 5H2O SO2 MgO NaHCO3
D 冰水混合物 CO Na2O FeCl3
五校联考高一化学试卷 第 1页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
6. 新型冠状病毒(冠状病毒粒子直径约 60~220nm)主要传播途径有飞沫传播、接触传播和气溶胶
传播。下列有关说法不正确的是
A. 气溶胶的分散剂为气体
B. 利用丁达尔效应可检测气溶胶中的冠状病毒
C. 用含氯消毒剂如 84消毒液、ClO2等可杀灭新冠病毒
D. 用“人工肾”进行血液透析救治危重新冠肺炎患者,
利用了胶体的性质
7. 设 NA为阿伏加德罗常数的值,下列叙述正确的是
A. 78gNa2O2中所含离子数为 4NA
+
B. 0.1molNH4中含有的质子数为 NA
-1
C. 将 1L2mol L 的 FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为 2NA
D. 常温常压下,4.6gNO2与 N2O4的混和气体中含有的原子数目为 0.3NA
8.一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入
1 mol N2,右边充入 CO和 CO2的混合气体共 8 g时,隔板处于如图位置(左、右两侧温度相同)。
右侧 CO与 CO2分子数之比为
A.1∶3
B.3∶1
C.1∶2
D.2∶1
+
9. 把 NaHCO3和 Na2CO3·10H2O 混合物 6.56g 溶于水制成 100mL 溶液,测得溶液中 Na 的浓度为
0.5mol/L。向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为
A. 2.925g B. 5.85 g C. 6.56g D. 无法确定
- - -1 - -
10. 下列溶液中 c(Cl)和 n(Cl)与 50mL1mol L 的 AlCl3溶液中 c(Cl)和 n(Cl)分别相
等的是
-1 -1
A. 75mL3mol L 的 NH4Cl溶液 B. 150mL1mol L 的 NaCl的溶液
-1 -1
C. 50mL1.5mol L 的 CaCl2溶液 D. 50mL3mol L 的 NaClO溶液
11. 下列反应的离子方程式正确的是
+ - -
A. 氯气与水反应:Cl2+H2O=2H +Cl +ClO
2+ +
B. 往 CaCl2溶液中通入少量 CO2:Ca +H2O+CO2=CaCO3↓+2H
Δ
3+ +
C. 向沸水中滴加饱和 FeCl3溶液制备 Fe(OH)3胶体:Fe +3H2O Fe(OH)3↓+6H
2+ - + 2-
D. Ba(OH)2溶液中加入过量的 NaHSO4溶液:Ba +2OH +2H +SO4 =BaSO4↓+2H2O
五校联考高一化学试卷 第 2页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
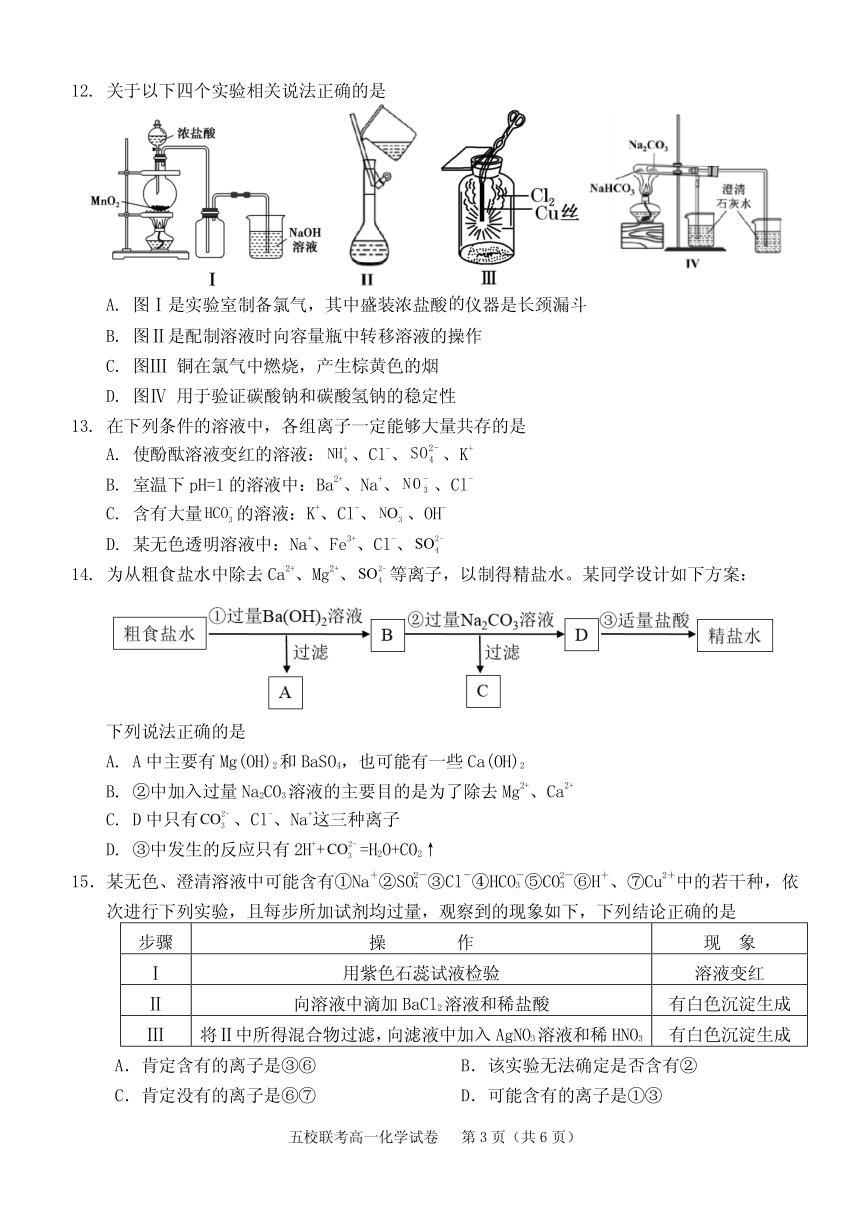
12. 关于以下四个实验相关说法正确的是
A. 图Ⅰ是实验室制备氯气,其中盛装浓盐酸的仪器是长颈漏斗
B. 图Ⅱ是配制溶液时向容量瓶中转移溶液的操作
C. 图Ⅲ 铜在氯气中燃烧,产生棕黄色的烟
D. 图Ⅳ 用于验证碳酸钠和碳酸氢钠的稳定性
13. 在下列条件的溶液中,各组离子一定能够大量共存的是
+ - 2- +
A. 使酚酞溶液变红的溶液: NH4、Cl、SO 4 、K
2+ + NO - -B. 室温下 pH=1的溶液中:Ba 、Na、 3 、Cl
C. 含有大量 HCO
- + - - -
3的溶液:K、Cl、 NO3、OH
+ 3+ - 2-
D. 某无色透明溶液中:Na、Fe 、Cl、SO4
2+ 2+ 2-
14. 为从粗食盐水中除去 Ca 、Mg 、SO4 等离子,以制得精盐水。某同学设计如下方案:
下列说法正确的是
A. A中主要有 Mg(OH)2和 BaSO4,也可能有一些 Ca(OH)2
2+ 2+
B. ②中加入过量 Na2CO3溶液的主要目的是为了除去 Mg 、Ca
2- - +
C. D中只有CO3 、Cl、Na这三种离子
+ 2-
D. ③中发生的反应只有 2H +CO3 =H2O+CO2↑
+ 2- - - 2- + 2+
15.某无色、澄清溶液中可能含有①Na ②SO4 ③Cl ④HCO3⑤CO3 ⑥H 、⑦Cu 中的若干种,依
次进行下列实验,且每步所加试剂均过量,观察到的现象如下,下列结论正确的是
步骤 操 作 现 象
Ⅰ 用紫色石蕊试液检验 溶液变红
Ⅱ 向溶液中滴加 BaCl2溶液和稀盐酸 有白色沉淀生成
Ⅲ 将Ⅱ中所得混合物过滤,向滤液中加入 AgNO3溶液和稀 HNO3 有白色沉淀生成
A.肯定含有的离子是③⑥ B.该实验无法确定是否含有②
C.肯定没有的离子是⑥⑦ D.可能含有的离子是①③
五校联考高一化学试卷 第 3页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
16.相对分子质量为 Mr的气态化合物 VL(标准状况)溶于 mg水中,得到溶液的质量分数为ω,
3
密度为ρg/cm,物质的量浓度为 cmol/L。下列说法正确的是
MrV 1000ρV
A.溶液的质量分数ω可表示为 22.4m+M V B.物质的量浓度 c可表示为 r 22.4m
cM m×ω
C.溶液密度ρ可表示为 r D.相对分子质量 Mr可表示为ω (1-ω)V
二、填空题(本题含 4小题,共 52分)
17. (12分)回答下列问题:
素材 I.“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:CuSO4+Fe=FeSO4+Cu。结合素材回
答问题(1)~(3):
(1)该反应中 CuSO4的摩尔质量是________。
(2)28g铁粉中含有的 Fe原子数是_______。
(3)若 28g铁粉完全反应,析出 Cu单质的物质的量为_______。
素材 II.宋代《洗冤集录》中记载有“银针探毒”,其原理是:4Ag+2H2S+O2=2Ag2S+2H2O。
结合素材回答问题(4)~(5):
(4)在相同条件下体积相同的 H2S和 O2两种气体含有的原子数之比为_______。
(5)在 0℃、101kPa条件下,11.2L氧气完全反应,消耗的 H2S的体积是_______。
素材 III.向空气中排放 SO2会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
+ 2- + - +
离子 NH SO4 4 Na Cl H
-1
浓度(mmol L ) 0.06 0.08 0.02 0.04 a
-1
(6)该雨水中氢离子的浓度 a=______mmol L 。
18.(14分) 阅读下列科普短文并填空。
燃料电池具有能量转化率高、对环境友好等特点。燃料电池在工作时,从负极连续通入①氢
气或②CH4等燃料,从正极连续通入③氧气,二者在电池内部(含有④H2SO4或⑤KOH等物质的溶液)
发生反应生成⑥H2O、⑦CO2或⑧K2CO3溶液,同时产生电能。
(1)在上述短文标有序号的物质中,能导电的是____(填序号,下同);属于强电解质的是_____;
属于非电解质的是_______。
(2)过量⑦通入⑤的溶液或⑧中均能生成同种物质,该物质与④的溶液反应的离子方程式为
_______。
(3)将⑤的溶液逐滴加入 10mL同浓度④的溶液中,此过程溶液的电导率
变化曲线为右图中的_____(填“I”或“II”),a=_______mL。
(4)将甲烷燃料电池产生的气体⑦,体积为 11.2L(标准状况下)通入 2L
⑤的溶液中生成正盐,该溶液⑤的物质的量浓度为 mol/L。
五校联考高一化学试卷 第 4页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
19.(12分) 84消毒液是杀菌性强、杀菌范围广的产品,以次氯酸钠为主要成分。
I.(1)工业上制取 84消毒液的离子方程式是
II.84消毒液有效氯是指单位体积消毒液含与NaClO消毒能力相当的氯气的质量(1molNaClO消毒
能力与 1mol氯气相当),一般市售 84消毒液有效氯为 55-60g/L。
(2)某兴趣小组通过实验测得某品牌 84消毒液有效氯为 56.8g/L,
假设有效氯都来自次氯酸钠,则该消毒液中 NaClO的物质的
量浓度为_______。
(3)将该品牌消毒液准确稀释成有效氯为 568mg/L的稀溶液 500mL,用于餐具消毒。
①实验中需要的玻璃仪器除量筒、胶头滴管、烧杯外还要_______;
②下列操作会导致有效氯偏低的是_______(填字母序号);
A.容量瓶用蒸馏水洗涤后未干燥 B.用量筒量取 84消毒液时仰视读数
C.移液时有少量液体溅出 D.加水定容时仰视刻度线
III.该小组继续探究 84消毒液在不同 pH下使红纸褪色的情况,做了如下实验:
步骤 1:将 5mL市售 84消毒液稀释至 100倍,测得稀释后溶液的 pH=12;
步骤 2:将稀释后溶液各 20mL分别加入 3个洁净的小烧杯中;
步骤 3:用 H2SO4溶液将 3个烧杯内溶液的 pH分别调至 10、7和 4(溶液体积变化忽略不计);
步骤 4:在 3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 溶液的 pH 现 象
a 10 10min后,红纸基本不褪色
b 7 10min后,红纸颜色变浅
c 4 10min后,红纸基本褪色
-
HClO和 ClO物质的量分数(a)随溶液 pH变化的关系如图所示:
(4)①由实验现象可获得结论:溶液的 pH在 4~10范围内,pH越大,红纸褪色_______。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是_______。
五校联考高一化学试卷 第 5页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
20.(14分)X、Y、Z、W四种化合物均由 1-18号元素组成,其中 X含有四种元素,X、Y、Z均
含钠元素,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物,产物及反应
条件已略去),回答下列问题:
(1)①X生成 Z的化学方程式_______。
②X溶于水的发生电离的方程式 。
③向 Z的水溶液中通入 CO2的离子方程式 。
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中两种化合物分别
放在装置Ⅰ、装置Ⅱ,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色
沉淀,装置 V中可收集到一种无色气体。
①装置Ⅱ中物质的化学式是_______。
②用 X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的
装置 V中气体,所需仪器装置是_______(从上图中选择必要装置,填写编号)。
(3)向 Z溶液中通入氯气,可制得生产和生活中某种消毒液的主要成分,同时有 X和氯化钠生
成,该反应的化学方程式是_______。
(4)为测定 X和 Z混合物中 Z的质量分数,某课外小组取 ag混合物充分加热,质量减少 bg,
则混合物中 Z的质量分数是_______(用含 a、b的代数式表示)。
五校联考高一化学试卷 第 6页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
三明市 2023-2024学年高一上学期期中五校联考
化 学 答 案
一、选择题(每小题 3分,共 48分)
1-5 D B A C A 6-10 B D B A C 11-15 D C B A D 16.A
17.(12分,每空 2分)
(1)160g/mol
(2)3.01×1023
(3)0.5 mol
(4) 3:2
(5)22.4L
(6)0.12
18.(14分,每空 2分)
(1)①. ⑥⑧ ②. ④⑤ ③. ②⑦
+
(2)HCO 3 +H =H2O+CO2↑
(3)①. Ⅱ ②. 20
(4)0.5
19.(12分,每空 2分)
- - -
(1)Cl2+2OH =Cl +ClO +H2O
(2)0.8mol/L
(3)①. 玻璃棒、500mL容量瓶 ②. CD
(4)①. 越慢
②. b烧杯中溶液的 pH大于 c烧杯中溶液的 pH,HClO的浓度较小,反应较慢,褪色较慢
20.(14分,每空 2分)
△
(1) ①. 2NaHCO3 Na2CO3 + H2O + CO2 ↑
+ -
②.NaHCO3 = Na +HCO3
③ CO2 3 + CO2 + H2O=2HCO
3
(2)①. Na2O2 ②. I、IV、V
(3) 2Na 2CO3 + Cl2 + H2O = NaClO + NaCl + 2NaHCO3
84b
(4) 1 ×100%
31a
五校联考高一化学试卷 第 7页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
化 学 试 卷
(考试时间:90分钟 满分:100分)
参考的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
Fe-56 Cu-64
一、选择题(每小题只有一个正确选项,每小题 3分,共 48分)
1. 化学与生活生产密切相关,下列说法错误的是
A.“卤水点豆腐,一物降一物”,该过程发生胶体的聚沉
B.“凡石灰,经火焚炼为用”,这里的石灰是 CaCO3
C.“青蒿一握,以水二升渍,绞取汁”,受此启发屠呦呦利用乙醚提取青蒿素
D. NaHCO3能与碱反应,所以可用作焙制糕点的膨松剂
2. 晋代葛洪的《食肉方》去除黑痣的药方中记载:“取白炭灰(熟石灰),获灰(草木灰),等分,
煎令如膏……,并可与去黑子”。对于能除去黑痣的物质的说法正确的是
A. 是 Ca(OH)2 B. 有强腐蚀性
C. 只有溶于水才能电离 D. 是 K2CO3
3. 2019年诺贝尔化学奖颁给几位在锂离子电池研发领域做出贡献的科学家,锂单质化学性质与
3
钠类似,活泼性比钠略弱。它的密度为 0.534g/cm,将绿豆大的锂投入水中,下列实验现象
合理的有
①锂沉入水中 ②锂浮在水面上 ③水中有大量气泡
④反应后在水中加入几滴石蕊试液,溶液变红
⑤反应比钠剧烈 ⑥锂四处游动
A. ②③⑥ B. ①③⑥ C. ②③⑤ D. ②④⑤⑥
4. 已知两瓶气体,分别是 HCl 和 Cl2,可以区别它们的方法或试剂是
①观察颜色 ②打开瓶盖看有无白雾 ③硝酸银溶液 ④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸
A. ①③④ B. ①②④ C. ①②④⑤ D. ①②⑤
5. 下列物质分类组合正确的是
选项 混合物 酸性氧化物 碱性氧化物 盐
A 漂白粉 CO2 K2O Cu2(OH)2CO3
B 碱石灰 SO3 Na2O2 NH4NO3
C CuSO4 5H2O SO2 MgO NaHCO3
D 冰水混合物 CO Na2O FeCl3
五校联考高一化学试卷 第 1页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
6. 新型冠状病毒(冠状病毒粒子直径约 60~220nm)主要传播途径有飞沫传播、接触传播和气溶胶
传播。下列有关说法不正确的是
A. 气溶胶的分散剂为气体
B. 利用丁达尔效应可检测气溶胶中的冠状病毒
C. 用含氯消毒剂如 84消毒液、ClO2等可杀灭新冠病毒
D. 用“人工肾”进行血液透析救治危重新冠肺炎患者,
利用了胶体的性质
7. 设 NA为阿伏加德罗常数的值,下列叙述正确的是
A. 78gNa2O2中所含离子数为 4NA
+
B. 0.1molNH4中含有的质子数为 NA
-1
C. 将 1L2mol L 的 FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为 2NA
D. 常温常压下,4.6gNO2与 N2O4的混和气体中含有的原子数目为 0.3NA
8.一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入
1 mol N2,右边充入 CO和 CO2的混合气体共 8 g时,隔板处于如图位置(左、右两侧温度相同)。
右侧 CO与 CO2分子数之比为
A.1∶3
B.3∶1
C.1∶2
D.2∶1
+
9. 把 NaHCO3和 Na2CO3·10H2O 混合物 6.56g 溶于水制成 100mL 溶液,测得溶液中 Na 的浓度为
0.5mol/L。向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为
A. 2.925g B. 5.85 g C. 6.56g D. 无法确定
- - -1 - -
10. 下列溶液中 c(Cl)和 n(Cl)与 50mL1mol L 的 AlCl3溶液中 c(Cl)和 n(Cl)分别相
等的是
-1 -1
A. 75mL3mol L 的 NH4Cl溶液 B. 150mL1mol L 的 NaCl的溶液
-1 -1
C. 50mL1.5mol L 的 CaCl2溶液 D. 50mL3mol L 的 NaClO溶液
11. 下列反应的离子方程式正确的是
+ - -
A. 氯气与水反应:Cl2+H2O=2H +Cl +ClO
2+ +
B. 往 CaCl2溶液中通入少量 CO2:Ca +H2O+CO2=CaCO3↓+2H
Δ
3+ +
C. 向沸水中滴加饱和 FeCl3溶液制备 Fe(OH)3胶体:Fe +3H2O Fe(OH)3↓+6H
2+ - + 2-
D. Ba(OH)2溶液中加入过量的 NaHSO4溶液:Ba +2OH +2H +SO4 =BaSO4↓+2H2O
五校联考高一化学试卷 第 2页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
12. 关于以下四个实验相关说法正确的是
A. 图Ⅰ是实验室制备氯气,其中盛装浓盐酸的仪器是长颈漏斗
B. 图Ⅱ是配制溶液时向容量瓶中转移溶液的操作
C. 图Ⅲ 铜在氯气中燃烧,产生棕黄色的烟
D. 图Ⅳ 用于验证碳酸钠和碳酸氢钠的稳定性
13. 在下列条件的溶液中,各组离子一定能够大量共存的是
+ - 2- +
A. 使酚酞溶液变红的溶液: NH4、Cl、SO 4 、K
2+ + NO - -B. 室温下 pH=1的溶液中:Ba 、Na、 3 、Cl
C. 含有大量 HCO
- + - - -
3的溶液:K、Cl、 NO3、OH
+ 3+ - 2-
D. 某无色透明溶液中:Na、Fe 、Cl、SO4
2+ 2+ 2-
14. 为从粗食盐水中除去 Ca 、Mg 、SO4 等离子,以制得精盐水。某同学设计如下方案:
下列说法正确的是
A. A中主要有 Mg(OH)2和 BaSO4,也可能有一些 Ca(OH)2
2+ 2+
B. ②中加入过量 Na2CO3溶液的主要目的是为了除去 Mg 、Ca
2- - +
C. D中只有CO3 、Cl、Na这三种离子
+ 2-
D. ③中发生的反应只有 2H +CO3 =H2O+CO2↑
+ 2- - - 2- + 2+
15.某无色、澄清溶液中可能含有①Na ②SO4 ③Cl ④HCO3⑤CO3 ⑥H 、⑦Cu 中的若干种,依
次进行下列实验,且每步所加试剂均过量,观察到的现象如下,下列结论正确的是
步骤 操 作 现 象
Ⅰ 用紫色石蕊试液检验 溶液变红
Ⅱ 向溶液中滴加 BaCl2溶液和稀盐酸 有白色沉淀生成
Ⅲ 将Ⅱ中所得混合物过滤,向滤液中加入 AgNO3溶液和稀 HNO3 有白色沉淀生成
A.肯定含有的离子是③⑥ B.该实验无法确定是否含有②
C.肯定没有的离子是⑥⑦ D.可能含有的离子是①③
五校联考高一化学试卷 第 3页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
16.相对分子质量为 Mr的气态化合物 VL(标准状况)溶于 mg水中,得到溶液的质量分数为ω,
3
密度为ρg/cm,物质的量浓度为 cmol/L。下列说法正确的是
MrV 1000ρV
A.溶液的质量分数ω可表示为 22.4m+M V B.物质的量浓度 c可表示为 r 22.4m
cM m×ω
C.溶液密度ρ可表示为 r D.相对分子质量 Mr可表示为ω (1-ω)V
二、填空题(本题含 4小题,共 52分)
17. (12分)回答下列问题:
素材 I.“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:CuSO4+Fe=FeSO4+Cu。结合素材回
答问题(1)~(3):
(1)该反应中 CuSO4的摩尔质量是________。
(2)28g铁粉中含有的 Fe原子数是_______。
(3)若 28g铁粉完全反应,析出 Cu单质的物质的量为_______。
素材 II.宋代《洗冤集录》中记载有“银针探毒”,其原理是:4Ag+2H2S+O2=2Ag2S+2H2O。
结合素材回答问题(4)~(5):
(4)在相同条件下体积相同的 H2S和 O2两种气体含有的原子数之比为_______。
(5)在 0℃、101kPa条件下,11.2L氧气完全反应,消耗的 H2S的体积是_______。
素材 III.向空气中排放 SO2会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
+ 2- + - +
离子 NH SO4 4 Na Cl H
-1
浓度(mmol L ) 0.06 0.08 0.02 0.04 a
-1
(6)该雨水中氢离子的浓度 a=______mmol L 。
18.(14分) 阅读下列科普短文并填空。
燃料电池具有能量转化率高、对环境友好等特点。燃料电池在工作时,从负极连续通入①氢
气或②CH4等燃料,从正极连续通入③氧气,二者在电池内部(含有④H2SO4或⑤KOH等物质的溶液)
发生反应生成⑥H2O、⑦CO2或⑧K2CO3溶液,同时产生电能。
(1)在上述短文标有序号的物质中,能导电的是____(填序号,下同);属于强电解质的是_____;
属于非电解质的是_______。
(2)过量⑦通入⑤的溶液或⑧中均能生成同种物质,该物质与④的溶液反应的离子方程式为
_______。
(3)将⑤的溶液逐滴加入 10mL同浓度④的溶液中,此过程溶液的电导率
变化曲线为右图中的_____(填“I”或“II”),a=_______mL。
(4)将甲烷燃料电池产生的气体⑦,体积为 11.2L(标准状况下)通入 2L
⑤的溶液中生成正盐,该溶液⑤的物质的量浓度为 mol/L。
五校联考高一化学试卷 第 4页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
19.(12分) 84消毒液是杀菌性强、杀菌范围广的产品,以次氯酸钠为主要成分。
I.(1)工业上制取 84消毒液的离子方程式是
II.84消毒液有效氯是指单位体积消毒液含与NaClO消毒能力相当的氯气的质量(1molNaClO消毒
能力与 1mol氯气相当),一般市售 84消毒液有效氯为 55-60g/L。
(2)某兴趣小组通过实验测得某品牌 84消毒液有效氯为 56.8g/L,
假设有效氯都来自次氯酸钠,则该消毒液中 NaClO的物质的
量浓度为_______。
(3)将该品牌消毒液准确稀释成有效氯为 568mg/L的稀溶液 500mL,用于餐具消毒。
①实验中需要的玻璃仪器除量筒、胶头滴管、烧杯外还要_______;
②下列操作会导致有效氯偏低的是_______(填字母序号);
A.容量瓶用蒸馏水洗涤后未干燥 B.用量筒量取 84消毒液时仰视读数
C.移液时有少量液体溅出 D.加水定容时仰视刻度线
III.该小组继续探究 84消毒液在不同 pH下使红纸褪色的情况,做了如下实验:
步骤 1:将 5mL市售 84消毒液稀释至 100倍,测得稀释后溶液的 pH=12;
步骤 2:将稀释后溶液各 20mL分别加入 3个洁净的小烧杯中;
步骤 3:用 H2SO4溶液将 3个烧杯内溶液的 pH分别调至 10、7和 4(溶液体积变化忽略不计);
步骤 4:在 3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 溶液的 pH 现 象
a 10 10min后,红纸基本不褪色
b 7 10min后,红纸颜色变浅
c 4 10min后,红纸基本褪色
-
HClO和 ClO物质的量分数(a)随溶液 pH变化的关系如图所示:
(4)①由实验现象可获得结论:溶液的 pH在 4~10范围内,pH越大,红纸褪色_______。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是_______。
五校联考高一化学试卷 第 5页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
20.(14分)X、Y、Z、W四种化合物均由 1-18号元素组成,其中 X含有四种元素,X、Y、Z均
含钠元素,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物,产物及反应
条件已略去),回答下列问题:
(1)①X生成 Z的化学方程式_______。
②X溶于水的发生电离的方程式 。
③向 Z的水溶液中通入 CO2的离子方程式 。
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中两种化合物分别
放在装置Ⅰ、装置Ⅱ,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色
沉淀,装置 V中可收集到一种无色气体。
①装置Ⅱ中物质的化学式是_______。
②用 X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的
装置 V中气体,所需仪器装置是_______(从上图中选择必要装置,填写编号)。
(3)向 Z溶液中通入氯气,可制得生产和生活中某种消毒液的主要成分,同时有 X和氯化钠生
成,该反应的化学方程式是_______。
(4)为测定 X和 Z混合物中 Z的质量分数,某课外小组取 ag混合物充分加热,质量减少 bg,
则混合物中 Z的质量分数是_______(用含 a、b的代数式表示)。
五校联考高一化学试卷 第 6页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
三明市 2023-2024学年高一上学期期中五校联考
化 学 答 案
一、选择题(每小题 3分,共 48分)
1-5 D B A C A 6-10 B D B A C 11-15 D C B A D 16.A
17.(12分,每空 2分)
(1)160g/mol
(2)3.01×1023
(3)0.5 mol
(4) 3:2
(5)22.4L
(6)0.12
18.(14分,每空 2分)
(1)①. ⑥⑧ ②. ④⑤ ③. ②⑦
+
(2)HCO 3 +H =H2O+CO2↑
(3)①. Ⅱ ②. 20
(4)0.5
19.(12分,每空 2分)
- - -
(1)Cl2+2OH =Cl +ClO +H2O
(2)0.8mol/L
(3)①. 玻璃棒、500mL容量瓶 ②. CD
(4)①. 越慢
②. b烧杯中溶液的 pH大于 c烧杯中溶液的 pH,HClO的浓度较小,反应较慢,褪色较慢
20.(14分,每空 2分)
△
(1) ①. 2NaHCO3 Na2CO3 + H2O + CO2 ↑
+ -
②.NaHCO3 = Na +HCO3
③ CO2 3 + CO2 + H2O=2HCO
3
(2)①. Na2O2 ②. I、IV、V
(3) 2Na 2CO3 + Cl2 + H2O = NaClO + NaCl + 2NaHCO3
84b
(4) 1 ×100%
31a
五校联考高一化学试卷 第 7页(共 6页)
{#{QQABZYKUggCIABJAABhCQQXYCkKQkACCCAoOBEAIIAABwBFABAA=}#}
同课章节目录
