第二章海水中的重要元素--钠和氯单元同步测试(含解析)-2023--2024学年高一化学人教版必修1
文档属性
| 名称 | 第二章海水中的重要元素--钠和氯单元同步测试(含解析)-2023--2024学年高一化学人教版必修1 | 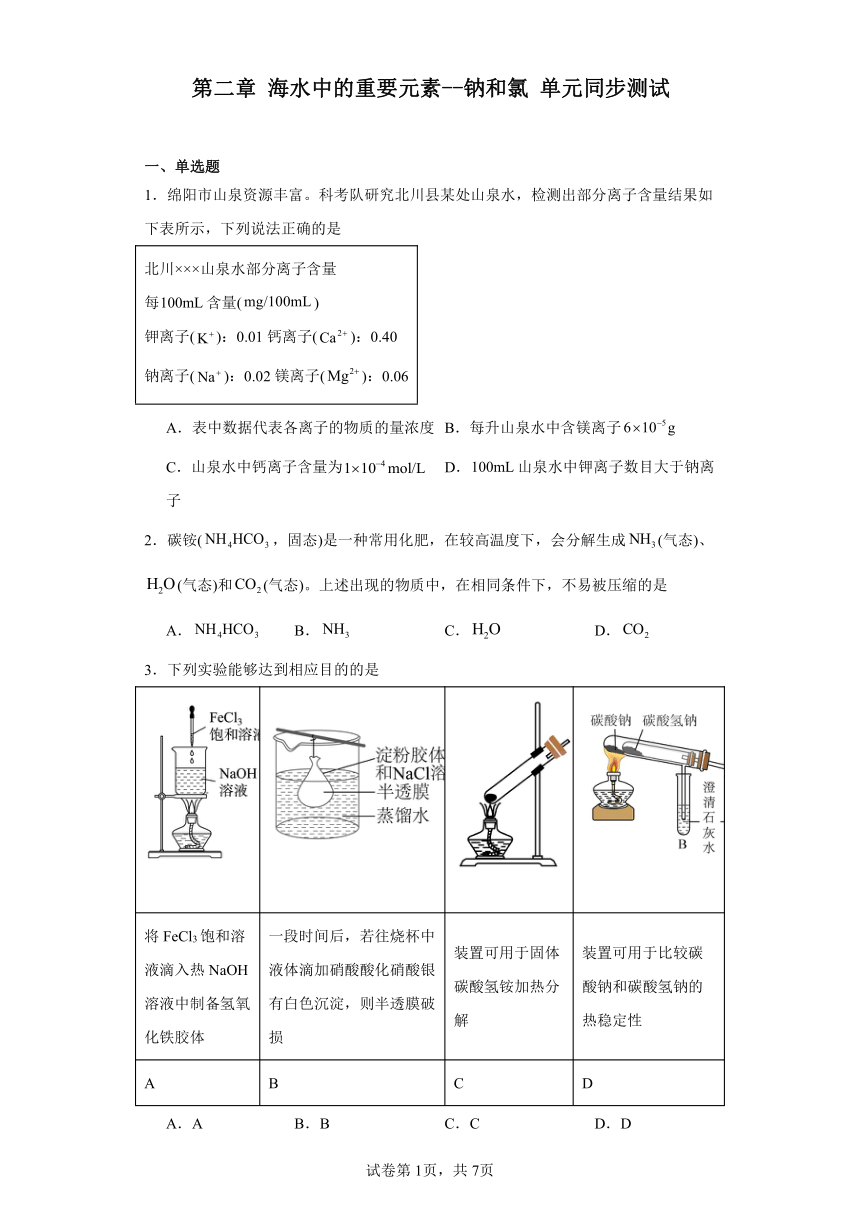 | |
| 格式 | docx | ||
| 文件大小 | 699.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-09 19:46:03 | ||
图片预览




文档简介
第二章 海水中的重要元素--钠和氯 单元同步测试
一、单选题
1.绵阳市山泉资源丰富。科考队研究北川县某处山泉水,检测出部分离子含量结果如下表所示,下列说法正确的是
北川×××山泉水部分离子含量 每含量() 钾离子():0.01钙离子():0.40 钠离子():0.02镁离子():0.06
A.表中数据代表各离子的物质的量浓度 B.每升山泉水中含镁离子
C.山泉水中钙离子含量为 D.山泉水中钾离子数目大于钠离子
2.碳铵(,固态)是一种常用化肥,在较高温度下,会分解生成(气态)、(气态)和(气态)。上述出现的物质中,在相同条件下,不易被压缩的是
A. B. C. D.
3.下列实验能够达到相应目的的是
将FeCl3饱和溶液滴入热NaOH溶液中制备氢氧化铁胶体 一段时间后,若往烧杯中液体滴加硝酸酸化硝酸银有白色沉淀,则半透膜破损 装置可用于固体碳酸氢铵加热分解 装置可用于比较碳酸钠和碳酸氢钠的热稳定性
A B C D
A.A B.B C.C D.D
4.下列关于结构、性质与用途具有对应关系且可行的是
A.钠有还原性,可用于制造高压钠灯
B.、溶液显碱性,可用作食用碱或工业用碱
C.胶体有吸附性,可以用于杀菌消毒
D.钠比铁活泼,可以利用钠将溶液中的铁置换出来
5.侯氏制碱法生产纯碱的主要流程如图所示,请结合流程图判断下列说法不正确的是
A.该流程中未涉及氧化还原反应
B.该流程中可以循环利用的物质为
C.该流程中步骤①和②不可以调整顺序
D.该流程中步骤③用离子方程式表示为:
6.部分常见含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是
A.实验室可通过加热MnO2与d的稀溶液制得a
B.e有强氧化性,可将CO2通入c溶液中得到
C.理论上d溶液和c溶液混合可制得a
D.存在a→c→e→d→b→a的循环转化关系
7.有关氯及其化合物,下列叙述正确的是
A.纯净的H2在Cl2中安静地燃烧,火焰呈苍白色,集气瓶口出现白色烟雾
B.红热的铜丝在氯气里剧烈燃烧,产生蓝绿色的烟
C.若发生Cl2泄漏,应立即向山谷等低处转移
D.金属铁和铜在氯气中燃烧均得到高价态的金属氯化物
8.有关Na2CO3和NaHCO3的性质,下列叙述错误的是
A.向Na2CO3饱和溶液中通入足量的CO2,有NaHCO3晶体析出
B.等质量的Na2CO3、NaHCO3与足量的稀H2SO4反应,生成气体的量后者多
C.鉴别Na2CO3和NaHCO3可用Ba(OH)2溶液
D.除去Na2CO3固体中的NaHCO3固体杂质,可将固体加热足够长时间
9.工业生产中除去电石浆(主要含CaO)中的并制取硫酸盐的流程如下图所示。下列说法正确的是
A.过程Ⅰ中被氧化的微粒为 B.在酸性条件下,氧化性:
C.经过过程Ⅱ后,溶液的碱性增强 D.若消耗56L,理论上除去的质量为16g
10.化学来源于生活,也服务于生活。下列关于氯及其化合物的叙述正确的是
A.难溶于水,一般用排水法收集
B.漂白粉的有效成分为NaClO
C.性质活泼,与Fe反应生成
D.HClO不稳定,光照条件下分解产生
11.下列说法不正确的是
A.某硝酸密度为,质量分数为,此硝酸物质的量浓度为
B.将的氨水和的氨水等体积混合后,所得溶液的质量分数可能为小于或等于
C.浓度为的硫酸中加入一定的水稀释成,则加入水的体积大于
D.将标准状况下的氯化氢气体溶于水中,得到的盐酸的密度为,则该盐酸的物质的量浓度是
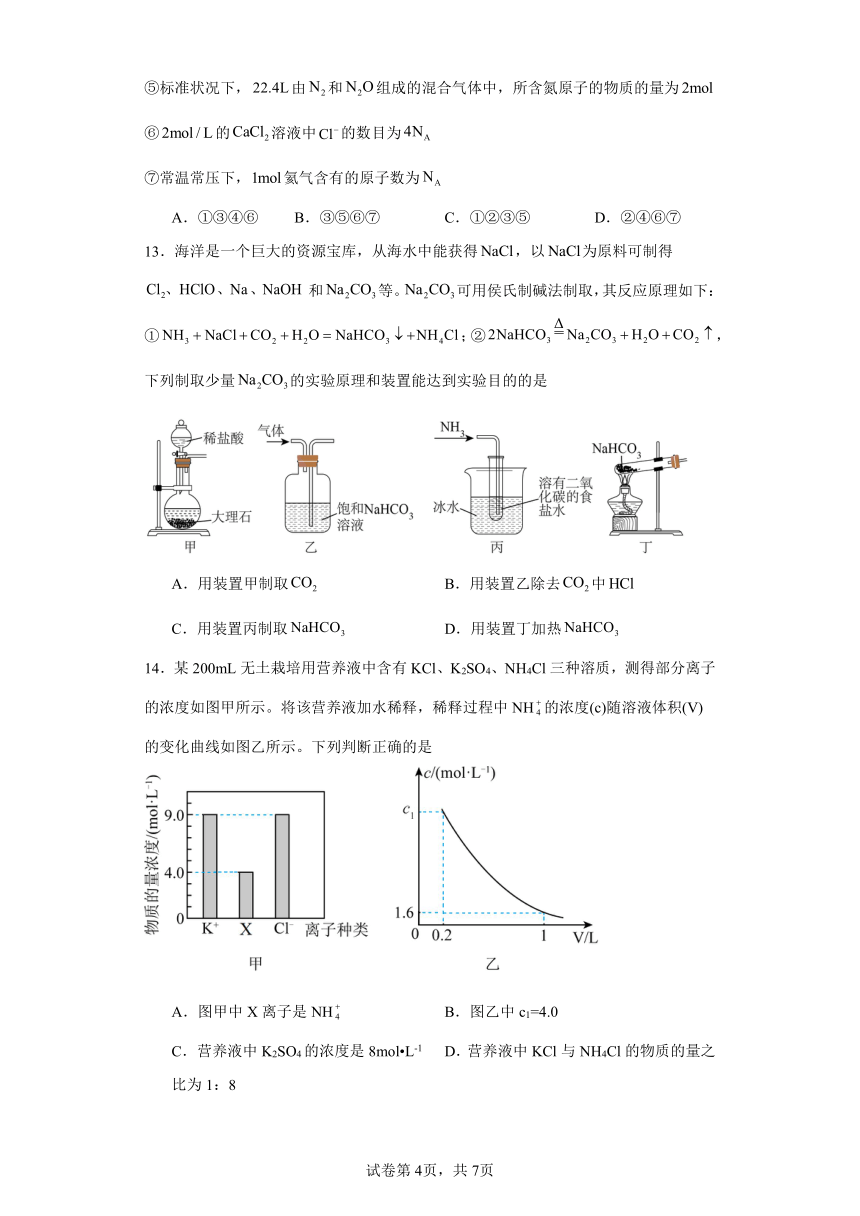
12.阿伏加德罗常数的值为,下列叙述中错误的是
①标准状况下,水中含有个水分子
②常温常压下,含有的分子数约为
③的摩尔质量为
④的气体摩尔体积约为
⑤标准状况下,由和组成的混合气体中,所含氮原子的物质的量为
⑥的溶液中的数目为
⑦常温常压下,氦气含有的原子数为
A.①③④⑥ B.③⑤⑥⑦ C.①②③⑤ D.②④⑥⑦
13.海洋是一个巨大的资源宝库,从海水中能获得,以为原料可制得和等。可用侯氏制碱法制取,其反应原理如下:①;②,下列制取少量的实验原理和装置能达到实验目的的是
A.用装置甲制取 B.用装置乙除去中
C.用装置丙制取 D.用装置丁加热
14.某200mL无土栽培用营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得部分离子的浓度如图甲所示。将该营养液加水稀释,稀释过程中NH的浓度(c)随溶液体积(V)的变化曲线如图乙所示。下列判断正确的是
A.图甲中X离子是NH B.图乙中c1=4.0
C.营养液中K2SO4的浓度是8mol L-1 D.营养液中KCl与NH4Cl的物质的量之比为1:8
二、非选择题
15.根据所学知识,回答下列问题:
I.硫酸是一种重要的工业原料。
(1)稀硫酸具有酸性,50mL0.1mol L-1稀硫酸溶液中,n(H+)= mol。
(2)稀硫酸与铝恰好完全反应,所得VmLAl2(SO4)3溶液中含有mgAl3+,则该溶液中SO物质的量浓度为 mol L-1。
Ⅱ.回答下列问题:
(3)在同温同压下,NO和SO2两种气体,密度比为 ,若两者质量相等,其体积比为 。
(4)30gRO中,核外电子总数比质子总数多6.02×1023,则R的摩尔质量为 。
(5)实验室利用反应2KClO32KCl+3O2↑制取氧气,现有12.25gKClO3参加反应,计算得到标准状况下的氧气的体积是 L。
(6)某元素G的一种含氧酸化学式为H3GO3,属于二元酸,则H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为 (填“酸式盐”或“正盐”)。
(7)某密闭容器,中间有一可自由滑动的隔板(厚度忽略不计)将容器分成两部分,装置如图所示(左、右两侧温度相同)。左边充入1mol氦气,右边充入CO和NO的混合气体,原子总数为共1.6mol,则左右两室体积比为 。
16.Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2可在呼吸面具和潜水艇中作为氧气的来源,请写出Na2O2与CO2反应的化学方程式 。
(2)查阅资料知:Na2O2在一定条件下可以转化为NaNO2,NaNO2易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。上述反应中氧化剂是 ,氧化产物是 ;HI在反应中体现了 性。
②某厂废液中含有3%—6%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 。
A.浓硫酸 B.NH4Cl C.HNO3 D.KMnO4
17.要配制的溶液,配制过程中有如下操作步骤:
①把称量好的绿矾()放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入_______中;
③继续向容量瓶中加蒸馏水至液面距离刻度1~2cm处,改用_______滴加蒸馏水至液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,反复上下颠倒,摇匀;
⑥待溶液恢复到室温。
请填写下列空白:
(1)完成实验操作:② ,③ 。
(2)实验操作步骤的正确顺序为(填序号) ,完成此配制实验。
(3)实验室用绿矾()来配制该溶液,用托盘天平称量绿矾 g。
(4)由于错误操作,使得实际浓度比所要求的偏小的是_______(填写编号)。
A.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
B.使用容量瓶配制溶液时,俯视液面定容,
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有干燥
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
18.据已经学过的化学知识,回答下列问题。金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现 性; (填“能”或“不能”)用氢氧化钠溶液代替。
(2)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式: 。
(3)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,该反应的化学方程式为 。
(4)Na2CO3和NaHCO3是厨房中常见的两种盐,可用化学性质的差异进行鉴别。回答下列问题:
①与酸反应的差异。甲组进行了如图4组实验。
其中实验 和 (填实验序号)可以鉴别Na2CO3和NaHCO3。
②热稳定性差异。乙组设计如图装置进行实验(加热及夹持装置省略)。
将分别装有Na2CO3和NaHCO3的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象分别为: ,试管b中发生反应的化学方程式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.物质的量浓度单位为mol/L,故A错误;
B.根据表格镁离子的浓度为0.06mg/100mL,故每升山泉水中含镁离子0. 6mg,故B错误;
C.山泉水中钙离子含量为0.40mg/100mL,故钙离子的浓度为,故C正确;
D.山泉水中钾离子数目为,山泉水中钠离子数目为,故山泉水中钾离子数目小于钠离子,故D错误;
故选C。
2.A
【详解】A.是固体,微粒间距离很小,很难被压缩,故A符合题意;
B.是气体,分子间距离答,容易被压缩,故B不符合题意;
C.该条件下是气体,分子间距离答,容易被压缩,故C不符合题意;
D.是气体,分子间距离答,容易被压缩,故D不符合题意。
答案选A。
3.D
【详解】A.将FeCl3饱和溶液滴入热NaOH溶液中生成氢氧化铁沉淀,不能得到胶体,应滴入沸水中,故A错误;
B.Cl-离子可以透过半透膜,与银离子生成氯化银沉淀,胶体粒子不能透过半透膜,有白色沉淀生成半透膜不一定破损,故B错误;
C.固体加热分解需要试管口向下倾斜,防止生成水倒流进入试管使试管炸裂,故C错误;
D.碳酸钠高温不分解,碳酸氢钠分解,碳酸钠放入大试管温度高不分解,碳酸氢钠放入小试管温度低能分解,说明碳酸氢钠热稳定性差,故D正确;
答案选D。
4.B
【详解】A.钠元素焰色试验时火焰呈黄色,黄光透雾性强,可用于制造高压钠灯,与还原性无关,故A错误;
B.NaHCO3、Na2CO3溶液显碱性,可用作食用碱或工业用碱,故B正确;
C.胶体有吸附性,能吸附水中难溶性的悬浮杂质净水,不可以杀菌消毒,故C错误;
D.钠比铁活泼,但是钠加入溶液中时,钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与反应生成氢氧化铁沉淀,故D错误;
答案选B。
5.D
【分析】侯氏制碱法原理:氨气极易溶于水所得溶液呈碱性,饱和食盐水中通氨气到饱和、继续通过量二氧化碳则生成大量碳酸氢根,由于碳酸氢钠溶解度小,故形成碳酸氢钠的过饱和溶液、则析出碳酸氢钠晶体, ,过滤出碳酸氢钠,受热分解制得纯碱:2NaHCO3 Na2CO3+CO2↑+H2O,所得二氧化碳可以循环利用;
【详解】A. 据分析,该流程中相关反应化合价不变,故未涉及氧化还原反应,A正确;
B.据分析,该流程中可以循环利用的物质为,B正确;
C.氨气极易溶于水、二氧化碳能溶于水,为生成大量碳酸氢根,该流程中步骤①和②不可以调整顺序,C正确;
D.碳酸氢钠受热分解制得纯碱为固体反应,故该流程中步骤③不能用离子方程式表示,D不正确;
答案选D。
6.C
【分析】由题干信息可知,物质a、b、c、d、e分别为Cl2、NaCl(或其他盐酸盐)、NaClO(或其他次氯酸盐)、HCl、HClO;
【详解】A.实验室可以通过加热MnO2和浓盐酸制备氯气,选项A正确;
B.e为HClO,有强氧化性,酸性比碳酸弱,可将CO2通入NaClO(或其他次氯酸盐)溶液中得到,选项B正确;
C. NaClO溶液和NaCl溶液在酸性条件下混合才能制得Cl2,选项C错误;
D.可存在a→c→e→d→b→a的循环转化关系,即Cl2ClO-HClOHClCl-Cl2,选项D正确;
答案选C。
7.D
【详解】A.纯净的氢气在氯气中安静地燃烧,发出苍白色的火焰,集气瓶口出现大量白雾,故A错误;
B.红热的铜丝在氯气里剧烈燃烧,产生棕黄色的烟,故B错误;
C.氯气的密度比空气大,当发生氯气泄漏时,应立即向山谷等高处转移,防止中毒发生意外事故,故C错误;
D.氯气的氧化性强,当变价金属铁和铜在氯气中燃烧均得到高价态的金属氯化物,故D正确;
故选D。
8.C
【详解】A.碳酸氢钠的溶解度小于碳酸钠,则向饱和碳酸钠溶液中通入二氧化碳发生反应生成碳酸氢钠沉淀,故A正确;
B.碳酸氢钠的摩尔质量小于碳酸钠,由碳原子个数守恒可知,等质量的碳酸钠与足量稀硫酸反应生成二氧化碳的量小于碳酸氢钠,故B正确;
C.碳酸钠和碳酸氢钠都能与氢氧化钡溶液反应生成白色碳酸钡沉淀,则用氢氧化钡溶液不能鉴别碳酸钠和碳酸氢钠,故C错误;
D.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,则用加热方法可以除去碳酸钠中混有的碳酸氢钠杂质,故D正确;
故选C。
9.C
【分析】由流程可知,CaO与硫酸锰反应生成Mn(OH)2,通入氧气生成,过程Ⅰ中反应的离子方程式为2Mn(OH)2+O2+4OH-=2+4H2O;与S2-反应生,进而与氧气反应生成,过程Ⅱ中反应的离子方程式为4+2S2-+9H2O═+4Mn(OH)2↓+10OH-,以此解答该题;
【详解】A.过程Ⅰ中被氧化的微粒为Mn(OH)2,A错误;
B.由分析可知,碱性条件下,O2能将Mn(OH)2氧化为,能将S2-氧化为,故氧化性:,B错误;
C.过程Ⅱ中反应的离子方程式为4+2S2-+9H2O═+4Mn(OH)2↓+10OH-,溶液的碱性增强,C正确;
D.没有给出标况,无法计算氧气的物质的量,D错误;
故选C。
10.D
【详解】A.能溶于水但在饱和食盐水中溶解度小得多,故可以用排饱和食盐水法收集或者向上排空气法收集,A错误;
B.漂白粉的有效成分为,B错误;
C.性质活泼氧化性较强,与Fe反应生成,C错误;
D.HClO不稳定,光照条件下分解产生,D正确;
故答案为:D。
11.C
【详解】A.该溶液中硝酸物质的量浓度,故A正确;
B.设质量分数分别为a%与(100-a)%的氨水溶液的密度分别为xg/mL、yg/mL,假定体积为1mL,则a%氨水溶液的质量为:1mL×xg/mL=xg,溶质氨水的质量为xg×a%,(100-a)%的氨水溶液的质量为1mL×yg/mL=yg,溶质氨水的质量为:yg×(100-a)%,所以混合后氨水的质量分数为:,①当x=y时,a=100-a,则a=50,,②当x>y时,,a<100-a,a<50,则,③当x100-a,a>50,则,因此所得溶液的质量分数可能为小于或等于50%,故B正确;
C.因硫酸溶液密度大于水,因此100g浓度为cmol L-1的硫酸的体积小于100mL,若要使浓度变为原来的一半,则所加水的体积需小于100mL,故C错误;
D.,故D正确;
答案选C。
12.A
【详解】①标准状况下,水为液体,不能根据气体摩尔体积来计算其物质的量,故错误;②32gSO2的物质的量为0.5mol,故分子个数N=nNA=0.5NA个,故正确;③一种物质的摩尔质量在数值上等于其相对分子质量,故氢氧化钠的摩尔质量为40g/mol,和其物质的量无关,故错误;④气体摩尔体积和所处的状态有关,和气体的种类无关,故错误;⑤标况下22.4LN2和N2O混合气体的物质的量为1mol,而氮气和N2O中均含2个N原子,故1mol混合气体中含有的N原子物质的量为2mol,故正确;⑥溶液体积不明确,故溶液中的氯离子的个数无法计算,故错误;⑦氦气为单原子分子,故1mol氦气中含有的原子个数为NA个,故正确。故选A。
13.A
【详解】A.装置中试剂是稀盐酸和大理石反应生成二氧化碳气体,分液漏斗盛稀盐酸,该装置可以制备二氧化碳气体,故A正确;
B.除去CO2中HCl,可以把混合气体通入饱和碳酸氢钠溶液,导气管应长进短出,装置图中导气管通入气体是短进长出,不能达到除杂目的,故B错误;
C.装置图中向溶有足量氨气的饱和食盐水中通入二氧化碳,生成碳酸氢钠晶体和氯化铵,在冰水温度下发生反应更有利于NaHCO3析出,可以制备碳酸氢钠,故C错误;
D.碳酸氢钠固体受热分解过程中生成碳酸钠、二氧化碳和水,装置中生成的水会倒流炸裂试管,应试管口略向下倾斜,故D错误;
故答案为A。
14.D
【分析】稀释过程中NH的物质的量不变,根据稀释过程中NH的浓度(c)随溶液体积(V)的变化曲线,c1×0.2L=1.6mol/L×1L,c1=8mol/L,营养液中NH的浓度为8mol/L,则X离子是 。
【详解】A.根据以上分析,营养液中NH的物质的量为8mol/L,所以X离子不是NH,故A错误;
B.根据以上分析,图乙中c1=8.0 mol/L,故B错误;
C.营养液中的浓度为4mol/L,则K2SO4的浓度是4mol L-1,故C错误;
D.营养液中NH的物质的量为8mol/L,则NH4Cl的浓度为8mol/L,NH4Cl提供的Cl-的浓度为8mol/L,KCl提供的Cl-的浓度为9 mol/L -8mol/L=1mol/L,所以KCl的浓度为1mol/L,营养液中KCl与NH4Cl的物质的量之比为1:8,故D正确;
选D。
15.(1)0.01
(2)
(3) 15:32 32:15
(4)12g/mol
(5)3.36
(6)正盐
(7)5:4
【详解】(1)50mL0.1ml/L稀硫酸中n(H+)=mol=0.01mol;
(2)根据关系式,Al3+的质量为mg,则硫酸根的物质的量为=mol,硫酸根的物质的量浓度为mol/L。
(3)同温同压下,气体密度之比等于摩尔质量之比,NO和SO2的密度之比为30:64=15:32。若两者质量相等,体积之比为密度的反比,为32:15。
(4)1mol核外电子数比质子总数多2mol,当核外电子总数比质子总数多6.02×1023,则的物质的量为0.5mol,的摩尔质量为60g/mol,R的摩尔质量为12g/mol。
(5)的物质的量为0.1mol,反应产生氧气的物质的量为0.15mol,标准状况下的体积为=3.36L。
(6)H3GO3,属于二元酸,则H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为正盐,因为氢氧化钠过量,若为酸式盐则还会与氢氧化钠反应。
(7)两室的压强和温度相等,体积之比等与气体物质的量之比,右边充入CO和NO的混合气体,原子总数为共1.6mol,CO和NO都是双原子分子,则气体的物质的量为0.8mol,左右两室体积之比为1:0.8=5:4。
16.(1)2Na2O2+2CO2=2Na2CO3+O2
(2) NaNO2 I2 还原性和酸 B
【详解】(1)Na2O2与CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(2)①已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,上述反应中NaNO2中N元素的化合价由+3价转化为NO中的+2价,化合价降低被还原,故氧化剂是NaNO2,HI中部分I的化合价由-1价升高到I2中的0价,化合价升高被氧化,故氧化产物是I2;HI部分被氧化是还原剂,部分为被氧化,体现其酸性,故HI在反应中体现了还原性和酸性,故答案为:NaNO2;I2;还原性和酸;
②NaNO2转化为不引起二次污染的N2的过程中氮元素化合价降低,发生还原反应,需要加入还原剂,故需加入氯化铵,氯化铵和亚硝酸钠发生氧化还原反应生成氮气,故答案为:B。
17.(1) 500mL容量瓶 胶头滴管
(2)①⑥②④③⑤
(3)27.8
(4)ACE
【详解】(1)②要配制的溶液,选择500mL容量瓶,所以把①所得溶液小心转入500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
(2)配置一定物质的量浓度的溶液,步骤为:计算、称取、溶解经冷却、移液、洗涤、定容、摇匀,实验操作步骤的正确顺序为①⑥②④③⑤;
(3)要配制的溶液,选择500mL容量瓶,实验室用绿矾()来配制该溶液,用托盘天平称量绿矾m=cVM=。
(4)A.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,试剂瓶中残留的水稀释溶液,使得实际浓度比所要求的偏小,故选A;
B.使用容量瓶配制溶液时,俯视液面定容,溶液体积偏小,使得实际浓度比所要求的偏大,故不选B;
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中,溶质偏少,使得实际浓度比所要求的偏小,故选C;
D.容量瓶刚用蒸馏水洗净,没有干燥,对所配溶液的浓度无影响,故不选D;
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切,容量瓶中溶质偏少,使得实际浓度比所要求的偏小,故选E;
选ACE。
18.(1) 弱碱 不能
(2)NaHSO4=Na++H++SO
(3)Cu+H2SO4+H2O2=CuSO4+2H2O
(4) ① ② b中有气泡,有晶体析出 CO2+H2O+Na2CO3=2NaHCO3↓
【详解】(1)氢氧化铝是两性氢氧化物,能和胃酸反应生成氯化铝和水表现为弱碱性,氢氧化钠是强碱具有强腐蚀性,不能代替氢氧化铝做治疗胃酸过多的物质,故答案为:弱碱;不能;
(2)NaHSO4是一种酸式盐,水溶液中完全电离生成钠离子、氢离子和硫酸根离子,电离方程式:NaHSO4=Na++H++;
(3)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,说明生成了硫酸铜,结合元素守恒,反应产物生成水,反应的化学方程式:Cu+H2SO4+H2O2=CuSO4+2H2O;
(4)①当盐酸少量的情况下,碳酸钠溶液中加入盐酸不会立刻产生气泡,但是碳酸氢钠溶液可以,可以使用此方法分辨,实验序号为①、②,现象为①没有气泡产生,②立刻产生气泡,故答案为:①;②;
②碳酸氢钠受热分解产生二氧化碳,该实验用饱和碳酸钠溶液检验反应的产物,故a、b试管中的实验现象分别为a试管有气泡,但是没有沉淀产生,b试管有气泡并且有沉淀产生,试管b中产生的沉淀为碳酸氢钠,发生反应的化学方程式为CO2+H2O+Na2CO3=2NaHCO3↓,故答案为:b中有气泡,有晶体析出;CO2+H2O+Na2CO3=2NaHCO3↓。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.绵阳市山泉资源丰富。科考队研究北川县某处山泉水,检测出部分离子含量结果如下表所示,下列说法正确的是
北川×××山泉水部分离子含量 每含量() 钾离子():0.01钙离子():0.40 钠离子():0.02镁离子():0.06
A.表中数据代表各离子的物质的量浓度 B.每升山泉水中含镁离子
C.山泉水中钙离子含量为 D.山泉水中钾离子数目大于钠离子
2.碳铵(,固态)是一种常用化肥,在较高温度下,会分解生成(气态)、(气态)和(气态)。上述出现的物质中,在相同条件下,不易被压缩的是
A. B. C. D.
3.下列实验能够达到相应目的的是
将FeCl3饱和溶液滴入热NaOH溶液中制备氢氧化铁胶体 一段时间后,若往烧杯中液体滴加硝酸酸化硝酸银有白色沉淀,则半透膜破损 装置可用于固体碳酸氢铵加热分解 装置可用于比较碳酸钠和碳酸氢钠的热稳定性
A B C D
A.A B.B C.C D.D
4.下列关于结构、性质与用途具有对应关系且可行的是
A.钠有还原性,可用于制造高压钠灯
B.、溶液显碱性,可用作食用碱或工业用碱
C.胶体有吸附性,可以用于杀菌消毒
D.钠比铁活泼,可以利用钠将溶液中的铁置换出来
5.侯氏制碱法生产纯碱的主要流程如图所示,请结合流程图判断下列说法不正确的是
A.该流程中未涉及氧化还原反应
B.该流程中可以循环利用的物质为
C.该流程中步骤①和②不可以调整顺序
D.该流程中步骤③用离子方程式表示为:
6.部分常见含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是
A.实验室可通过加热MnO2与d的稀溶液制得a
B.e有强氧化性,可将CO2通入c溶液中得到
C.理论上d溶液和c溶液混合可制得a
D.存在a→c→e→d→b→a的循环转化关系
7.有关氯及其化合物,下列叙述正确的是
A.纯净的H2在Cl2中安静地燃烧,火焰呈苍白色,集气瓶口出现白色烟雾
B.红热的铜丝在氯气里剧烈燃烧,产生蓝绿色的烟
C.若发生Cl2泄漏,应立即向山谷等低处转移
D.金属铁和铜在氯气中燃烧均得到高价态的金属氯化物
8.有关Na2CO3和NaHCO3的性质,下列叙述错误的是
A.向Na2CO3饱和溶液中通入足量的CO2,有NaHCO3晶体析出
B.等质量的Na2CO3、NaHCO3与足量的稀H2SO4反应,生成气体的量后者多
C.鉴别Na2CO3和NaHCO3可用Ba(OH)2溶液
D.除去Na2CO3固体中的NaHCO3固体杂质,可将固体加热足够长时间
9.工业生产中除去电石浆(主要含CaO)中的并制取硫酸盐的流程如下图所示。下列说法正确的是
A.过程Ⅰ中被氧化的微粒为 B.在酸性条件下,氧化性:
C.经过过程Ⅱ后,溶液的碱性增强 D.若消耗56L,理论上除去的质量为16g
10.化学来源于生活,也服务于生活。下列关于氯及其化合物的叙述正确的是
A.难溶于水,一般用排水法收集
B.漂白粉的有效成分为NaClO
C.性质活泼,与Fe反应生成
D.HClO不稳定,光照条件下分解产生
11.下列说法不正确的是
A.某硝酸密度为,质量分数为,此硝酸物质的量浓度为
B.将的氨水和的氨水等体积混合后,所得溶液的质量分数可能为小于或等于
C.浓度为的硫酸中加入一定的水稀释成,则加入水的体积大于
D.将标准状况下的氯化氢气体溶于水中,得到的盐酸的密度为,则该盐酸的物质的量浓度是
12.阿伏加德罗常数的值为,下列叙述中错误的是
①标准状况下,水中含有个水分子
②常温常压下,含有的分子数约为
③的摩尔质量为
④的气体摩尔体积约为
⑤标准状况下,由和组成的混合气体中,所含氮原子的物质的量为
⑥的溶液中的数目为
⑦常温常压下,氦气含有的原子数为
A.①③④⑥ B.③⑤⑥⑦ C.①②③⑤ D.②④⑥⑦
13.海洋是一个巨大的资源宝库,从海水中能获得,以为原料可制得和等。可用侯氏制碱法制取,其反应原理如下:①;②,下列制取少量的实验原理和装置能达到实验目的的是
A.用装置甲制取 B.用装置乙除去中
C.用装置丙制取 D.用装置丁加热
14.某200mL无土栽培用营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得部分离子的浓度如图甲所示。将该营养液加水稀释,稀释过程中NH的浓度(c)随溶液体积(V)的变化曲线如图乙所示。下列判断正确的是
A.图甲中X离子是NH B.图乙中c1=4.0
C.营养液中K2SO4的浓度是8mol L-1 D.营养液中KCl与NH4Cl的物质的量之比为1:8
二、非选择题
15.根据所学知识,回答下列问题:
I.硫酸是一种重要的工业原料。
(1)稀硫酸具有酸性,50mL0.1mol L-1稀硫酸溶液中,n(H+)= mol。
(2)稀硫酸与铝恰好完全反应,所得VmLAl2(SO4)3溶液中含有mgAl3+,则该溶液中SO物质的量浓度为 mol L-1。
Ⅱ.回答下列问题:
(3)在同温同压下,NO和SO2两种气体,密度比为 ,若两者质量相等,其体积比为 。
(4)30gRO中,核外电子总数比质子总数多6.02×1023,则R的摩尔质量为 。
(5)实验室利用反应2KClO32KCl+3O2↑制取氧气,现有12.25gKClO3参加反应,计算得到标准状况下的氧气的体积是 L。
(6)某元素G的一种含氧酸化学式为H3GO3,属于二元酸,则H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为 (填“酸式盐”或“正盐”)。
(7)某密闭容器,中间有一可自由滑动的隔板(厚度忽略不计)将容器分成两部分,装置如图所示(左、右两侧温度相同)。左边充入1mol氦气,右边充入CO和NO的混合气体,原子总数为共1.6mol,则左右两室体积比为 。
16.Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2可在呼吸面具和潜水艇中作为氧气的来源,请写出Na2O2与CO2反应的化学方程式 。
(2)查阅资料知:Na2O2在一定条件下可以转化为NaNO2,NaNO2易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。上述反应中氧化剂是 ,氧化产物是 ;HI在反应中体现了 性。
②某厂废液中含有3%—6%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 。
A.浓硫酸 B.NH4Cl C.HNO3 D.KMnO4
17.要配制的溶液,配制过程中有如下操作步骤:
①把称量好的绿矾()放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入_______中;
③继续向容量瓶中加蒸馏水至液面距离刻度1~2cm处,改用_______滴加蒸馏水至液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,反复上下颠倒,摇匀;
⑥待溶液恢复到室温。
请填写下列空白:
(1)完成实验操作:② ,③ 。
(2)实验操作步骤的正确顺序为(填序号) ,完成此配制实验。
(3)实验室用绿矾()来配制该溶液,用托盘天平称量绿矾 g。
(4)由于错误操作,使得实际浓度比所要求的偏小的是_______(填写编号)。
A.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
B.使用容量瓶配制溶液时,俯视液面定容,
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有干燥
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
18.据已经学过的化学知识,回答下列问题。金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现 性; (填“能”或“不能”)用氢氧化钠溶液代替。
(2)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式: 。
(3)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,该反应的化学方程式为 。
(4)Na2CO3和NaHCO3是厨房中常见的两种盐,可用化学性质的差异进行鉴别。回答下列问题:
①与酸反应的差异。甲组进行了如图4组实验。
其中实验 和 (填实验序号)可以鉴别Na2CO3和NaHCO3。
②热稳定性差异。乙组设计如图装置进行实验(加热及夹持装置省略)。
将分别装有Na2CO3和NaHCO3的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象分别为: ,试管b中发生反应的化学方程式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.物质的量浓度单位为mol/L,故A错误;
B.根据表格镁离子的浓度为0.06mg/100mL,故每升山泉水中含镁离子0. 6mg,故B错误;
C.山泉水中钙离子含量为0.40mg/100mL,故钙离子的浓度为,故C正确;
D.山泉水中钾离子数目为,山泉水中钠离子数目为,故山泉水中钾离子数目小于钠离子,故D错误;
故选C。
2.A
【详解】A.是固体,微粒间距离很小,很难被压缩,故A符合题意;
B.是气体,分子间距离答,容易被压缩,故B不符合题意;
C.该条件下是气体,分子间距离答,容易被压缩,故C不符合题意;
D.是气体,分子间距离答,容易被压缩,故D不符合题意。
答案选A。
3.D
【详解】A.将FeCl3饱和溶液滴入热NaOH溶液中生成氢氧化铁沉淀,不能得到胶体,应滴入沸水中,故A错误;
B.Cl-离子可以透过半透膜,与银离子生成氯化银沉淀,胶体粒子不能透过半透膜,有白色沉淀生成半透膜不一定破损,故B错误;
C.固体加热分解需要试管口向下倾斜,防止生成水倒流进入试管使试管炸裂,故C错误;
D.碳酸钠高温不分解,碳酸氢钠分解,碳酸钠放入大试管温度高不分解,碳酸氢钠放入小试管温度低能分解,说明碳酸氢钠热稳定性差,故D正确;
答案选D。
4.B
【详解】A.钠元素焰色试验时火焰呈黄色,黄光透雾性强,可用于制造高压钠灯,与还原性无关,故A错误;
B.NaHCO3、Na2CO3溶液显碱性,可用作食用碱或工业用碱,故B正确;
C.胶体有吸附性,能吸附水中难溶性的悬浮杂质净水,不可以杀菌消毒,故C错误;
D.钠比铁活泼,但是钠加入溶液中时,钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与反应生成氢氧化铁沉淀,故D错误;
答案选B。
5.D
【分析】侯氏制碱法原理:氨气极易溶于水所得溶液呈碱性,饱和食盐水中通氨气到饱和、继续通过量二氧化碳则生成大量碳酸氢根,由于碳酸氢钠溶解度小,故形成碳酸氢钠的过饱和溶液、则析出碳酸氢钠晶体, ,过滤出碳酸氢钠,受热分解制得纯碱:2NaHCO3 Na2CO3+CO2↑+H2O,所得二氧化碳可以循环利用;
【详解】A. 据分析,该流程中相关反应化合价不变,故未涉及氧化还原反应,A正确;
B.据分析,该流程中可以循环利用的物质为,B正确;
C.氨气极易溶于水、二氧化碳能溶于水,为生成大量碳酸氢根,该流程中步骤①和②不可以调整顺序,C正确;
D.碳酸氢钠受热分解制得纯碱为固体反应,故该流程中步骤③不能用离子方程式表示,D不正确;
答案选D。
6.C
【分析】由题干信息可知,物质a、b、c、d、e分别为Cl2、NaCl(或其他盐酸盐)、NaClO(或其他次氯酸盐)、HCl、HClO;
【详解】A.实验室可以通过加热MnO2和浓盐酸制备氯气,选项A正确;
B.e为HClO,有强氧化性,酸性比碳酸弱,可将CO2通入NaClO(或其他次氯酸盐)溶液中得到,选项B正确;
C. NaClO溶液和NaCl溶液在酸性条件下混合才能制得Cl2,选项C错误;
D.可存在a→c→e→d→b→a的循环转化关系,即Cl2ClO-HClOHClCl-Cl2,选项D正确;
答案选C。
7.D
【详解】A.纯净的氢气在氯气中安静地燃烧,发出苍白色的火焰,集气瓶口出现大量白雾,故A错误;
B.红热的铜丝在氯气里剧烈燃烧,产生棕黄色的烟,故B错误;
C.氯气的密度比空气大,当发生氯气泄漏时,应立即向山谷等高处转移,防止中毒发生意外事故,故C错误;
D.氯气的氧化性强,当变价金属铁和铜在氯气中燃烧均得到高价态的金属氯化物,故D正确;
故选D。
8.C
【详解】A.碳酸氢钠的溶解度小于碳酸钠,则向饱和碳酸钠溶液中通入二氧化碳发生反应生成碳酸氢钠沉淀,故A正确;
B.碳酸氢钠的摩尔质量小于碳酸钠,由碳原子个数守恒可知,等质量的碳酸钠与足量稀硫酸反应生成二氧化碳的量小于碳酸氢钠,故B正确;
C.碳酸钠和碳酸氢钠都能与氢氧化钡溶液反应生成白色碳酸钡沉淀,则用氢氧化钡溶液不能鉴别碳酸钠和碳酸氢钠,故C错误;
D.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,则用加热方法可以除去碳酸钠中混有的碳酸氢钠杂质,故D正确;
故选C。
9.C
【分析】由流程可知,CaO与硫酸锰反应生成Mn(OH)2,通入氧气生成,过程Ⅰ中反应的离子方程式为2Mn(OH)2+O2+4OH-=2+4H2O;与S2-反应生,进而与氧气反应生成,过程Ⅱ中反应的离子方程式为4+2S2-+9H2O═+4Mn(OH)2↓+10OH-,以此解答该题;
【详解】A.过程Ⅰ中被氧化的微粒为Mn(OH)2,A错误;
B.由分析可知,碱性条件下,O2能将Mn(OH)2氧化为,能将S2-氧化为,故氧化性:,B错误;
C.过程Ⅱ中反应的离子方程式为4+2S2-+9H2O═+4Mn(OH)2↓+10OH-,溶液的碱性增强,C正确;
D.没有给出标况,无法计算氧气的物质的量,D错误;
故选C。
10.D
【详解】A.能溶于水但在饱和食盐水中溶解度小得多,故可以用排饱和食盐水法收集或者向上排空气法收集,A错误;
B.漂白粉的有效成分为,B错误;
C.性质活泼氧化性较强,与Fe反应生成,C错误;
D.HClO不稳定,光照条件下分解产生,D正确;
故答案为:D。
11.C
【详解】A.该溶液中硝酸物质的量浓度,故A正确;
B.设质量分数分别为a%与(100-a)%的氨水溶液的密度分别为xg/mL、yg/mL,假定体积为1mL,则a%氨水溶液的质量为:1mL×xg/mL=xg,溶质氨水的质量为xg×a%,(100-a)%的氨水溶液的质量为1mL×yg/mL=yg,溶质氨水的质量为:yg×(100-a)%,所以混合后氨水的质量分数为:,①当x=y时,a=100-a,则a=50,,②当x>y时,,a<100-a,a<50,则,③当x
C.因硫酸溶液密度大于水,因此100g浓度为cmol L-1的硫酸的体积小于100mL,若要使浓度变为原来的一半,则所加水的体积需小于100mL,故C错误;
D.,故D正确;
答案选C。
12.A
【详解】①标准状况下,水为液体,不能根据气体摩尔体积来计算其物质的量,故错误;②32gSO2的物质的量为0.5mol,故分子个数N=nNA=0.5NA个,故正确;③一种物质的摩尔质量在数值上等于其相对分子质量,故氢氧化钠的摩尔质量为40g/mol,和其物质的量无关,故错误;④气体摩尔体积和所处的状态有关,和气体的种类无关,故错误;⑤标况下22.4LN2和N2O混合气体的物质的量为1mol,而氮气和N2O中均含2个N原子,故1mol混合气体中含有的N原子物质的量为2mol,故正确;⑥溶液体积不明确,故溶液中的氯离子的个数无法计算,故错误;⑦氦气为单原子分子,故1mol氦气中含有的原子个数为NA个,故正确。故选A。
13.A
【详解】A.装置中试剂是稀盐酸和大理石反应生成二氧化碳气体,分液漏斗盛稀盐酸,该装置可以制备二氧化碳气体,故A正确;
B.除去CO2中HCl,可以把混合气体通入饱和碳酸氢钠溶液,导气管应长进短出,装置图中导气管通入气体是短进长出,不能达到除杂目的,故B错误;
C.装置图中向溶有足量氨气的饱和食盐水中通入二氧化碳,生成碳酸氢钠晶体和氯化铵,在冰水温度下发生反应更有利于NaHCO3析出,可以制备碳酸氢钠,故C错误;
D.碳酸氢钠固体受热分解过程中生成碳酸钠、二氧化碳和水,装置中生成的水会倒流炸裂试管,应试管口略向下倾斜,故D错误;
故答案为A。
14.D
【分析】稀释过程中NH的物质的量不变,根据稀释过程中NH的浓度(c)随溶液体积(V)的变化曲线,c1×0.2L=1.6mol/L×1L,c1=8mol/L,营养液中NH的浓度为8mol/L,则X离子是 。
【详解】A.根据以上分析,营养液中NH的物质的量为8mol/L,所以X离子不是NH,故A错误;
B.根据以上分析,图乙中c1=8.0 mol/L,故B错误;
C.营养液中的浓度为4mol/L,则K2SO4的浓度是4mol L-1,故C错误;
D.营养液中NH的物质的量为8mol/L,则NH4Cl的浓度为8mol/L,NH4Cl提供的Cl-的浓度为8mol/L,KCl提供的Cl-的浓度为9 mol/L -8mol/L=1mol/L,所以KCl的浓度为1mol/L,营养液中KCl与NH4Cl的物质的量之比为1:8,故D正确;
选D。
15.(1)0.01
(2)
(3) 15:32 32:15
(4)12g/mol
(5)3.36
(6)正盐
(7)5:4
【详解】(1)50mL0.1ml/L稀硫酸中n(H+)=mol=0.01mol;
(2)根据关系式,Al3+的质量为mg,则硫酸根的物质的量为=mol,硫酸根的物质的量浓度为mol/L。
(3)同温同压下,气体密度之比等于摩尔质量之比,NO和SO2的密度之比为30:64=15:32。若两者质量相等,体积之比为密度的反比,为32:15。
(4)1mol核外电子数比质子总数多2mol,当核外电子总数比质子总数多6.02×1023,则的物质的量为0.5mol,的摩尔质量为60g/mol,R的摩尔质量为12g/mol。
(5)的物质的量为0.1mol,反应产生氧气的物质的量为0.15mol,标准状况下的体积为=3.36L。
(6)H3GO3,属于二元酸,则H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为正盐,因为氢氧化钠过量,若为酸式盐则还会与氢氧化钠反应。
(7)两室的压强和温度相等,体积之比等与气体物质的量之比,右边充入CO和NO的混合气体,原子总数为共1.6mol,CO和NO都是双原子分子,则气体的物质的量为0.8mol,左右两室体积之比为1:0.8=5:4。
16.(1)2Na2O2+2CO2=2Na2CO3+O2
(2) NaNO2 I2 还原性和酸 B
【详解】(1)Na2O2与CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(2)①已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,上述反应中NaNO2中N元素的化合价由+3价转化为NO中的+2价,化合价降低被还原,故氧化剂是NaNO2,HI中部分I的化合价由-1价升高到I2中的0价,化合价升高被氧化,故氧化产物是I2;HI部分被氧化是还原剂,部分为被氧化,体现其酸性,故HI在反应中体现了还原性和酸性,故答案为:NaNO2;I2;还原性和酸;
②NaNO2转化为不引起二次污染的N2的过程中氮元素化合价降低,发生还原反应,需要加入还原剂,故需加入氯化铵,氯化铵和亚硝酸钠发生氧化还原反应生成氮气,故答案为:B。
17.(1) 500mL容量瓶 胶头滴管
(2)①⑥②④③⑤
(3)27.8
(4)ACE
【详解】(1)②要配制的溶液,选择500mL容量瓶,所以把①所得溶液小心转入500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
(2)配置一定物质的量浓度的溶液,步骤为:计算、称取、溶解经冷却、移液、洗涤、定容、摇匀,实验操作步骤的正确顺序为①⑥②④③⑤;
(3)要配制的溶液,选择500mL容量瓶,实验室用绿矾()来配制该溶液,用托盘天平称量绿矾m=cVM=。
(4)A.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,试剂瓶中残留的水稀释溶液,使得实际浓度比所要求的偏小,故选A;
B.使用容量瓶配制溶液时,俯视液面定容,溶液体积偏小,使得实际浓度比所要求的偏大,故不选B;
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中,溶质偏少,使得实际浓度比所要求的偏小,故选C;
D.容量瓶刚用蒸馏水洗净,没有干燥,对所配溶液的浓度无影响,故不选D;
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切,容量瓶中溶质偏少,使得实际浓度比所要求的偏小,故选E;
选ACE。
18.(1) 弱碱 不能
(2)NaHSO4=Na++H++SO
(3)Cu+H2SO4+H2O2=CuSO4+2H2O
(4) ① ② b中有气泡,有晶体析出 CO2+H2O+Na2CO3=2NaHCO3↓
【详解】(1)氢氧化铝是两性氢氧化物,能和胃酸反应生成氯化铝和水表现为弱碱性,氢氧化钠是强碱具有强腐蚀性,不能代替氢氧化铝做治疗胃酸过多的物质,故答案为:弱碱;不能;
(2)NaHSO4是一种酸式盐,水溶液中完全电离生成钠离子、氢离子和硫酸根离子,电离方程式:NaHSO4=Na++H++;
(3)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,说明生成了硫酸铜,结合元素守恒,反应产物生成水,反应的化学方程式:Cu+H2SO4+H2O2=CuSO4+2H2O;
(4)①当盐酸少量的情况下,碳酸钠溶液中加入盐酸不会立刻产生气泡,但是碳酸氢钠溶液可以,可以使用此方法分辨,实验序号为①、②,现象为①没有气泡产生,②立刻产生气泡,故答案为:①;②;
②碳酸氢钠受热分解产生二氧化碳,该实验用饱和碳酸钠溶液检验反应的产物,故a、b试管中的实验现象分别为a试管有气泡,但是没有沉淀产生,b试管有气泡并且有沉淀产生,试管b中产生的沉淀为碳酸氢钠,发生反应的化学方程式为CO2+H2O+Na2CO3=2NaHCO3↓,故答案为:b中有气泡,有晶体析出;CO2+H2O+Na2CO3=2NaHCO3↓。
答案第1页,共2页
答案第1页,共2页
