第二章《化学反应的方向、限度与速率》测试题(含解析)2023-2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第二章《化学反应的方向、限度与速率》测试题(含解析)2023-2024学年上学期高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1017.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-09 22:53:57 | ||
图片预览




文档简介
第二章《化学反应的方向、限度与速率》测试题
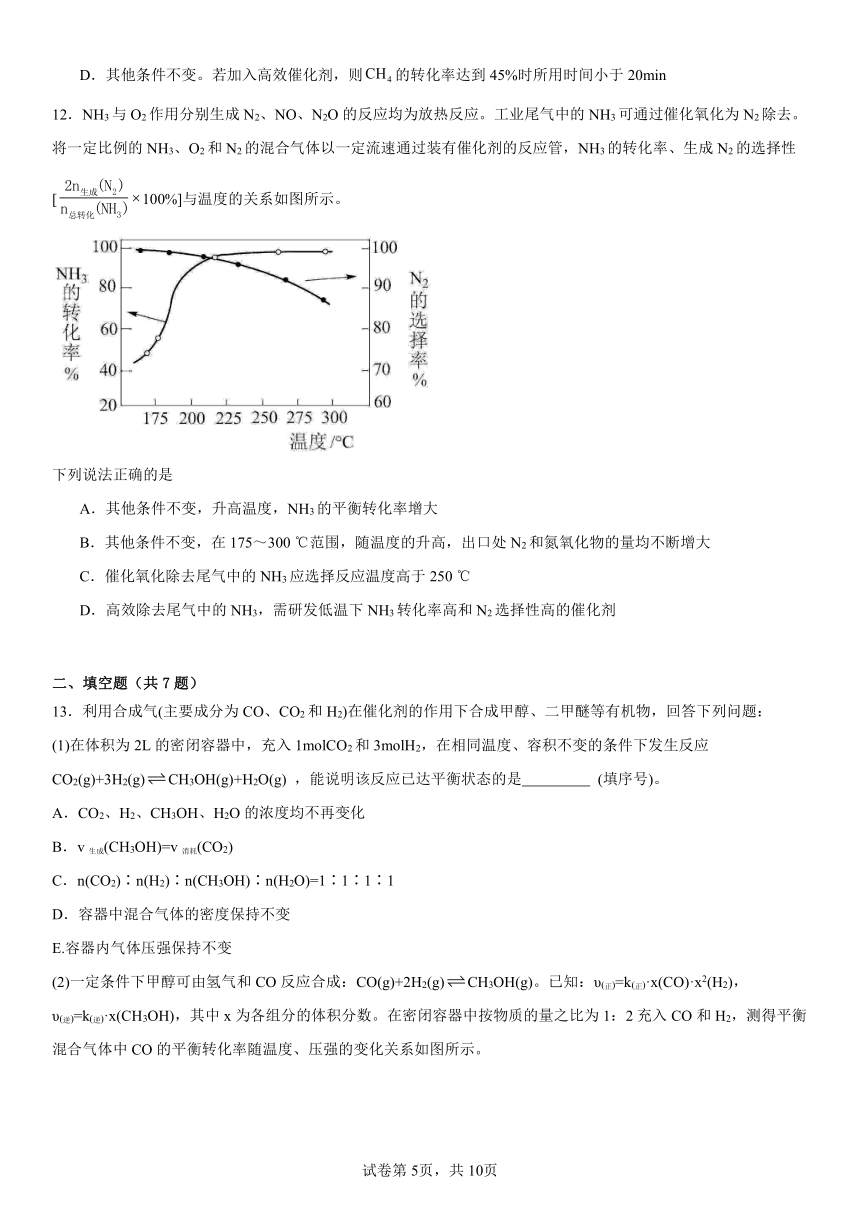
一、单选题(共12题)
1.一定条件下,通过下列反应可以制备特种陶瓷的原料MgO,MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) △H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变如图中横坐标的值,重新达到平衡后,纵坐标随之变化趋势合理的是
选项 x y
A CO的物质的量 CO的转化率
B 温度 容器内混合气体的平均相对分子质量
C MgSO4的质量(忽略体积) CO2的物质的量
D 新充入氦气的物质的量 CO物质的量浓度
A.A B.B C.C D.D
2.多相催化反应是反应物分子在催化剂表面通过吸附、解吸附过程进行的反应。我国学者发现在时,甲醇在铜基催化剂上的反应机理如下(该反应为可逆反应):
下列说法正确的是
A.反应是放热反应,,反应II是吸热反应,
B.是热能转化为化学能的过程
C.铜基催化剂可以加快反应速率,降低反应的活化能,但不参与反应
D.在反应中既生成又消耗,可认为是催化剂
3.已知:无CO时反应、有CO时反应。某研究小组以AgZSM为催化剂,在容积为1L的容器中,相同时间下测得0.1molNO转化为的转化率随温度变化如图所示。下列说法不正确的是
A.X点可以通过更换高效催化剂提高NO的反应速率
B.反应
C.Y点再通入CO、各0.1mol,此时
D.达平衡后,其他条件不变改变物料使,NO转化率下降
4.臭氧层中O3分解过程如图所示,下列说法正确的是
A.催化反应①②均为放热反应
B.决定O3分解反应速率的是催化反应②
C.E1是催化反应①对应的正反应的活化能,(E2+E3)是催化反应②对应的逆反应的活化能
D.温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大
5.密闭容器中发生可逆反应,在一定条件下达到平衡状态,下列叙述正确的是
A.增加A的量,平衡向正反应方向移动
B.压缩容器体积,平衡不移动,v正、v逆不变
C.达平衡后升温,正反应速率增大,逆反应速率减小
D.若向恒容容器中按1∶2再充入C、D,重新建立平衡后,v正、v逆均增大
6.以天然气为原料合成氨是新的生产氮肥的方法,具有污染小、成本低等诸多特点,其过程如下:
下列说法不正确的是
A.反应②的原子利用率小于100%
B.过程③可以通过物理变化实现
C.过程④采取高温条件的目的是为了提高平衡转化率
D.过程⑤理论上当n(NH3):n(O2)=1:1时,恰好完全反应
7.汽车尾气包括CO、碳氢化合物、NOx(氮氧化合物)等,三元催化器中净化原理如图所示。下列说法正确的是
A.铂、铑、钯属于主族元素
B.三元催化器中的催化剂可降低该反应的活化能
C.三元催化器中的多孔陶瓷可提高平衡时反应物的转化率
D.在反应NO+CO→N2+CO2中,每生成1molN2时转移2mol电子
8.铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法正确的是
A.该过程的总反应速率由Ⅳ→Ⅰ步骤决定,最大能垒为89.7
B.该反应过程中浓度不变
C.与均在该反应过程中起催化作用
D.甲酸在作用下的分解反应放出热量
9.一定温度下的密闭容器中发生可逆反应2SO2(g)+O2(g) 2SO3(g),不能说明该反应一定达到平衡状态的是
A.压强保持不变
B.SO2、O2、SO3的物质的量之比为2︰1︰2
C.SO2的消耗速率和SO2的生成速率相等
D.SO2的百分含量保持不变
10.下列有关化学反应原理的说法中正确的是
A.需要加热的反应都是非自发反应,不需要加热的反应都是自发反应
B.反应 ,则该反应能自发进行
C.100mL2mol/L的盐酸与锌片反应,加入少量NaCl固体,反应速率不变
D.若反应可以自发,则该反应的速率一定较快
11.一种制备蓝氢的原理是。向一体积为1L的恒容密闭容器中充入1mol和2mol,在一定条件下发生上述反应,测得的物质的量与时间的关系如表所示。下列叙述错误的是
t/min 0 5 10 15 20 25
/mol 0 0.5 0.75 0.85 0.9 0.9
A.0~10min,
B.CO的体积分数不变时,反应达到平衡状态
C.上述反应中,的转化率大于的转化率
D.其他条件不变。若加入高效催化剂,则的转化率达到45%时所用时间小于20min
12.NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性[100%]与温度的关系如图所示。
下列说法正确的是
A.其他条件不变,升高温度,NH3的平衡转化率增大
B.其他条件不变,在175~300 ℃范围,随温度的升高,出口处N2和氮氧化物的量均不断增大
C.催化氧化除去尾气中的NH3应选择反应温度高于250 ℃
D.高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂
二、填空题(共7题)
13.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇、二甲醚等有机物,回答下列问题:
(1)在体积为2L的密闭容器中,充入1molCO2和3molH2,在相同温度、容积不变的条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) ,能说明该反应已达平衡状态的是 (填序号)。
A.CO2、H2、CH3OH、H2O的浓度均不再变化
B.v生成(CH3OH)=v消耗(CO2)
C.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
D.容器中混合气体的密度保持不变
E.容器内气体压强保持不变
(2)一定条件下甲醇可由氢气和CO反应合成:CO(g)+2H2(g)CH3OH(g)。已知:υ(正)=k(正)·x(CO)·x2(H2),υ(逆)=k(逆)·x(CH3OH),其中x为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
①P1 P2(填“>”或“<”);升高温度, (填“增大”“减小”或“不变”);
②c、d、e三点平衡常数Kc、Kd、Ke三者之间的关系为 。
(3)燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为2L恒容密闭容器甲和乙,在甲中充入1moLCO2和3molH2,在乙中充入2moLCO2和6molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图2所示。下列说法正确的是 。
A图1中,反应2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)的
B.图1中,表示乙容器CO2的平衡转化率随温度变化的是曲线B
C.图1中,逆反应速率v逆:状态I<状态III
D.图2中,T3对应的平衡常数小于T4对应的平衡常数
E. 图2中,根据图中曲线分析,催化剂I的催化效果最好
14.如图表示时合成氨反应的能量变化曲线图。合成氨所需的氢气可由甲烷与水反应制备,发生的反应为。一定条件下,在容器中发生上述反应,各物质的物质的量浓度的变化如表所示:
0 0.2 0.3 0 0
2 0.3
3 0.3
4 0.09 0.19 x 0.33
回答下列问题:
(1)表中 ;前内的平均反应速率为 。
(2)内,反应过程中氢气浓度量增大的原因可能是 (填序号)。
A.升高温度 B.使用催化剂 C.充入氢气
15.尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2) B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为 。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)NH2COONH4(s)关于上述反应的平衡状态下列说法正确的是 。
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C. NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
16.将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) H2(g)+I2(g)△H<0
(1)该反应平衡常数的表达式为K= ,则H2(g)+I2(g) 2HI(g)平衡常数的表达式为K1= (用K表示)。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为 ,HI的分解率为 。
(3)能判断该反应达到平衡状态的依据是
A.容器中压强不变
B.混合气体中c(HI)不变
C.c(I2)=c(H2)
D.v(HI)正=v(H2)逆
(4)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的浓度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向 (填“正向”或“逆向”,下同)进行,若升高温度,反应向 进行。
17.按要求回答下列问题。
(1)2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。氮元素在周期表中的位置是 ,N2的电子式是 ,化合物Si3N4中N的化合价是 价。
(2)2020年6月23日,长征系列运载大箭将北斗三号“收官之星”成功送入太空。火箭燃料燃烧的化学方程式为:2N2H4+N2O4=3N2+4H20。该反应中氧化剂与还原剂的物质的量之比为 ,将封装有NO2和NO混合气体的圆底烧瓶浸入热水中,气体混合物颜色变 (填“深”或“浅”)。
(3)我国拥有自主知识产权的铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第5周期IA族元素。Rb元素原子的失电子能力 填(“强”或“弱”)于K,请用原子结构的知识解释其原因: 。
18.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。
(1)反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ mol-1
反应III:S(s)+O2(g)=SO2(g) ΔH3=-297kJ mol-1
反应II的热化学方程式: 。
(2)对反应II,在同一投料比,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2 p1(填“>”或“<”),得出该结论的理由是 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2= +SO+2I-
19.甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ,反应到某时刻测得各组分的物质的量如下:
物质 CO H2 CH3OH
物质的量/mol 0.4 0.4 0.8
请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而 (填“增大”或“减小”),其原因是 。图中的压强由大到小的顺序为 ,其判断理由是 。
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为 ,正极的反应式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.CO的物质的量增大,平衡正向移动,但CO的转化率降低,故A错误;
B.若x是温度,升高温度,平衡向吸热反应方向正反应方向移动,生成的二氧化碳和二氧化硫的相对分子质量均比一氧化碳大,Y为容器内混合气体的平均相对分子质量符合,故B正确;
C.MgSO4的质量(忽略体积)增大,对平衡没有影响,CO2的物质的量不变,故C错误;
D.在恒容的密闭容器中,新充入氦气的物质的量增大,CO物质的量浓度保持不变,故D错误;
故选B。
2.B
【详解】A.由过程和能量变化图得知,过程I是吸热反应,过程II是放热反应,故A错误;
B.由过程和能量变化图得知,反应物的能量低于生成物的能量,反应是吸热反应,热能转化为化学能,故B正确;
C.铜基催化剂可以加快反应速率,降低反应的活化能,在反应中参与反应,故C错误;
D.CO是中间产物,不是催化剂,故D错误;
答案选B。
3.D
【详解】A.X点更换高效催化剂,能加快反应速率,即可以提高NO反应速率,故A说法正确;
B.根据图像可知,曲线最高点说明反应达到平衡,随着温度的升高,NO的转化率降低,根据平衡移动原理,该反应的正反应方向为放热反应,即ΔH<0,故B说法正确;
C.Y点转化率为80%,Y点为平衡点,此时生成CO2的物质的量为1mol×80%=0.08mol,生成氮气的物质的量为0.04mol,该温度下平衡常数K==1600,Y点再通入CO、N2各物质的量0.1mol,此时Qc=≈156<1600=K,平衡正向移动,此时v(CO,正)>v(CO,逆),故C说法正确;
D.其他条件不变,时,相当于起始NO物质的量不变,增加CO的物质的量,NO的转化率增大,CO的转化率降低,故D说法错误;
答案为D。
4.C
【详解】A.从图上可知,反应①中生成物能量高于反应物,反应①是吸热反应,A项错误;
B.决定总反应速率的是慢反应,活化能越大反应越慢,据图可知催化反应①的正反应活化能更大,反应更慢,所以催化反应①决定臭氧的分解速率,B项错误;
C.据图可知E1为催化反应①中反应物断键吸收的能量,即催化反应①对应的正反应的活化能,E2+E3为催化反应②生成物成键时释放的能量,即催化反应②对应的逆反应的活化能,C项正确;
D.据图可知总反应的反应物能量高于生成物的能量,所以总反应为放热反应,升高温度,平衡逆向移动,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,平衡常数减小,D项错误;
答案选C。
5.D
【详解】A.A为固体,增加固体的量,化学反应速率不变,平衡不移动,A错误;
B.该反应是气体分子数不变的反应,压缩容器体积,平衡不移动,但v正、v逆均增大,B错误;
C.达平衡后升温,正逆反应速率均增大,C错误;
D.若向恒容容器中按1∶2再充入C、D,重新建立平衡后,等效为加压,则v正、v逆均增大,D正确;
故选D。
6.C
【详解】A.反应②是CO2、NH3在一定条件下条件下反应产生CO(NH2)2、H2O,生成物中不仅有尿素,还有H2O,因此原子利用率小于100%,A正确;
B.过程③是分离空气的成分得到N2、O2,由于没有新物质生成,因此该变化过程是物理变化,B正确;
C.过程④是N2、H2合成NH3,该反应的正反应是气体体积减小的放热反应,反应条件采取高温条件是因为在该温度下催化剂的活性最大,而不能提高物质的平衡转化率,C错误;
D.氨气与氧气反应生成硝酸铵的过程中,根据电子守恒和元素守恒可得总反应为2NH3+2O2NH4NO3+H2O,所以理论上n(NH3):n(O2)=1:1时恰好完全反应,D正确;
故合理选项是C。
7.B
【详解】A.铂、铑、钯属于第VIII族元素,故A错误;
B.三元催化器中的催化剂可降低该反应的活化能,提高反应速率,故B正确;
C.三元催化器中的多孔陶瓷增加接触面积,提高反应速率,但平衡不移动,转化率不变,故C错误;
D.在反应NO+CO=N2+CO2中,根据方程式+2价氮化合价降低变为0价氮,因此每生成1mol N2时转移4mol电子,故D错误。
综上所述,答案为B。
8.D
【分析】由能垒图可以看出,生成物的总能量低于反应物的总能量,该反应为放热反应;整个过程中有两个过渡态,过渡态Ⅰ的正反应的活化能为45.3+31.8=77.1kJ/mol;过渡态Ⅱ的正反应的活化能为43.5+42.6=86.1kJ/mol,过渡态Ⅱ的活化能大,为反应的决速步骤。根据第一张图可以看出,反应物为HCOOH,生成物为二氧化碳和氢气,故总反应为。
【详解】A.根据分析,过渡态Ⅱ的活化能大,由Ⅳ→Ⅰ步骤为反应的决速步骤,最大能垒为43.5 kJ/mol -(-42.6 kJ/mol) =86.1kJ/mol,A错误;
B.反应过程存在甲酸电离出氢离子,然后氢离子再生成氢气的过程,浓度先增大,后减小,B错误;
C.为反应的催化剂,为中间产物,C错误;
D.由能垒图可以看出,生成物的总能量低于反应物的总能量,该反应为放热反应,D正确;
故选D。
9.B
【详解】A.反应2SO2(g)+O2(g) 2SO3(g)是气体体积减小的反应,反应过程中压强不断减小,当压强保持不变时,说明反应达到平衡,故A不选;
B.平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故B选;
C.SO2的消耗速率和SO2的生成速率相等,证明化学反应中正逆反应速率相等,达到了平衡状态,故C不选;
D.SO2的百分含量保持不变,即SO3的质量保持不变,即浓度不变,说明反应达到化学平衡状态,故D不选;
故选B。
10.C
【详解】A.时反应自发进行,不能根据是否加热判断反应的自发进行情况,A错误;
B.反应 ,其,该反应的,则不能自发进行,B错误;
C.100mL2mol/L的盐酸与锌片反应,加入少量NaCl固体,溶液中氢离子浓度几乎不变,则反应速率不变,C正确;
D.反应能否自发与反应速率无关,如自然界中发生的缓慢的氧化还原反应属于自发反应,但反应速率很小,D错误;
故选C。
11.A
【详解】A.0~10min,,由方程式可知,故A错误;
B.CO的体积分数不变时,说明CO的物质的量不变,说明反应达到平衡,故B正确;
C.达到平衡时,=0.9mol,由方程式的系数关系可知,的转化率为=45%,的转化率为=22.5%,的转化率大于的转化率,故C正确;
D.其他条件不变。若加入高效催化剂,反应速率增大,但不影响最终平衡时的转化率,则的转化率达到45%时所用时间小于20min,故D正确;
故选A。
12.D
【详解】A.NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应,根据勒夏特列原理,升高温度,平衡向逆反应方向进行,氨气的平衡转化率降低,故A错误;
B.根据图象,在175~300 ℃范围,随温度的升高,N2的选择率降低,即产生氮气的量减少,故B错误;
C.根据图象,温度高于250℃ N2的选择率降低,且氨气的转化率变化并不大,浪费能源,根据图象,温度应略小于225℃,此时氨气的转化率、氮气的选择率较大,故C错误;
D.氮气对环境无污染,氮的氧化物污染环境,因此高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂,故D正确;
答案为D。
13.(1)AE
(2) > 减小 Kc>Kd=Ke
(3)CE
【详解】(1)A.CO2、H2、CH3OH、H2O的浓度均不再变化,说明该反应已达平衡状态,A符合题意;
B.v生成(CH3OH)、v消耗(CO2)都代表正反应方向的速率,则v生成(CH3OH)=v消耗(CO2),不能说明该反应已达平衡状态,B不符合题意;
C.n(CO2):n(H2) :n(CH3OH) :n(H2O)=1:1:1:1,不能说明该反应已达平衡状态,C不符合题意;
D.在相同温度、容积不变的条件下,体系的总质量和总体积都不变,则容器中混合气体的密度始终不变,故容器中混合气体的密度保持不变,不能说明该反应已达平衡状态,D不符合题意;
E.在相同温度、容积不变的条件下,反应前后,容器中混合气体的总物质的量减小,容器中混合气体的压强减小,故容器内气体压强保持不变,能说明该反应已达平衡状态,E符合题意;
故选AE。
(2)①该反应是气体体积减小的反应,增大压强,平衡正向移动,CO的转化率增大;同一温度,P1条件下的CO的转化率更高,故P1>P2;同一压强下,升高温度,CO的转化率减小,说明该反应是放热反应;平衡时,υ(正)=υ(逆),则k(正)·x(CO)·x2(H2)=k(逆)·x(CH3OH),==K;对于放热反应而言,升高温度,K减小,即减小;
②d点、e点的温度相同,Kd=Ke;对于放热反应而言,升高温度,K减小,则Kc>Ke;故c、d、e三点平衡常数Kc、Kd、Ke三者之间的关系为Kc>Kd=Ke;
(3)A.图1中,升高温度,CO2的平衡转化率减小,说明该反应是放热反应,ΔH<0,A错误;
B.容器甲、乙的体积相同,乙中CO2和H2的初始的总物质的量较多,则容器乙中的压强较大,该反应是气体体积减小的反应,则同一温度下,容器乙中,CO2的平衡转化率较高,故图1中,表示乙容器CO2的平衡转化率随温度变化的是曲线A,B错误;
C.图1中,状态III的温度高于状态I,故图1中,逆反应速率v逆:状态I<状态III,C正确;
D.图2中,T3<T4,该反应是放热反应,升高温度,K减小,故图2中,T3对应的平衡常数大于T4对应的平衡常数,D错误;
E.图2中,在较低温度下,相同时间内CO2的转化率最高的是催化剂I,即催化剂I的催化效果最好,E正确;
故选CE。
14.(1) 0.11
(2)A
【详解】(1)由表格数据可知,从反应开始至时氢气浓度的变化量为,由化学方程式可知;由、时的浓度均为可知,时反应达到平衡状态,由题给数据建立如下三段式:
根据三段式,前内甲烷的平均反应速率为;
(2)A.由表格数据可知,内,甲烷和水蒸气浓度减小,氢气的浓度增大,说明平衡向正反应方向移动。该反应为吸热反应,升高温度,平衡向正反应方向移动,甲烷和水蒸气浓度减小,氢气的浓度增大,故A符合题意;
B.使用催化剂,平衡不移动,反应物和生成物的浓度均不变,故B不符合题意;
C.充入氢气,生成物浓度增大,平衡向逆反应方向移动,甲烷和水蒸气浓度增大,故C不符合题意。
故选A。
15. 大于 75% C
【详解】(1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B点氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的逆反应速率,故v正(CO2)>v逆(CO2);
开始氨气体积分数为50%,设起始时,氨气为50mol,二氧化碳为50mol,氨气消耗的物质的量为x,则可列出三段式为(单位:mol)
,平衡时氨气的体积分数为20%,,解得x=37.5mol,则氨气的平衡转化率为;
(2)A. 因为氨基甲酸铵为固体,分离出少量的氨基甲酸铵,平衡不移动,所以反应物的转化率不变,故A错误;
B. 起始时,NH3和CO2的体积比为2∶1,因为氨基甲酸铵为固体,NH3与CO2按照2∶1消耗,所以NH3和CO2的体积比始终为2∶1,则CO2的体积分数不变,故B错误;
C. 因为起始时,NH3和CO2的体积比为2∶1,NH3与CO2按照2∶1的消耗,所以NH3的转化率始终等于CO2的转化率,故C正确;
D. 催化剂只改变速率,不改变平衡移动,所以加入有效的催化剂不能够提高氨基甲酸铵的产率,故D错误;
故选C。
16. K= K1= 0.5mol/L 20% BD 正向 逆向
【详解】试题分析:(1)化学平衡状态下,平衡常数为气态生成物浓度密之积比上气态反应物浓度密之积,K=,H2(g)+I2(g) 2HI(g)是2HI(g) H2(g)+I2(g)的逆反应,化学平衡常数为原反应平衡常数的倒数,K1=,故答案为K=;K1=;
(2)反应达到平衡时c(I2)=0.5mol/L,根据2HI(气) H2(气)+I2(气)可知,c(H2)= 0.5mol/L,HI分解的浓度为2×0.5mol/L=1mol/L,反应达到平衡时c(HI)=4mol/L,HI 的分解率为×100%=20%,故答案:0.5mol/L;20%;
(3)A.该反应属于气体的物质的量不变的反应,容器中压强始终不变,错误;B.混合气体中c(HI)不变,表示达到了平衡状态,正确;C.c(I2)=c(H2),浓度不一定保持不变,不能说明达到了平衡状态,错误;D.v(HI)正=v(H2)逆,表示达到了平衡状态,正确;故选BD;
(4) 某时刻,Qc===<1,反应向正反应方向进行,该反应正反应为吸热反应,升高温度,平衡逆向移动,故答案为正向,逆向
考点:考查了平衡状态的判断、化学平衡的移动以及平衡常数的相关知识。
17. 第2周期VA族 -3 1:2 深 强 K和Rb是上下相邻的同主族元素,Rb的原子半径大于K,原子核对最外层电子的吸引作用小于K,所以其原子的失电子能力强于K
【分析】(1)短周期元素在周期表中的位置是电子层数和最外层电子数决定,N2是共价分子,按其共用电子对的情况书写电子式,根据化合物中正负价代数和为0确定化合价数值;
(2)结合氧化还原反应的相关定义、找出2N2H4+N2O4=3N2+4H2O中氧化剂和还原剂并填空,将封装有NO2和NO混合气体中,有2NO2 N2O4,升温时平衡向吸热方向移动,红棕色NO2浓度变化导致混合物颜色变化;
(3)同主族金属元素,原子半径大,其原子的失电子能力强,据此回答。
【详解】(1)氮原子序数为7,电子分两层排布,最外层5个电子,在周期表中的位置是第2周期VA族,2个氮原子间通过共用3对电子对形成分子,故N2的电子式是,硅的非金属性比氮弱,化合价是+4价,故化合物Si3N4中N的化合价-3价;
(2)反应:2N2H4+N2O4=3N2+4H2O中,N2O4中氮元素化合价降低,氧化剂为N2O4、N2H4中氮元素化合价升高,还原剂为N2H4,氧化剂与还原剂的物质的量之比为1:2,将封装有NO2和NO混合气体的圆底烧瓶浸入热水中,2NO2 N2O4向逆反应方向移动,红棕色NO2浓度增大,混合物颜色变深;
(3)Rb元素原子的失电子能力大于K,K和Rb是上下相邻的同主族元素,Rb的原子半径大于K,原子核对最外层电子的吸引作用小于K,所以其原子的失电子能力强于K。
18.(1)3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-254kJ/mol
(2) > 反应Ⅱ为气体体积减小的反应,温度和投料比一定时,增大压强,平衡正向移动,H2SO4在平衡体系中物质的量分数增大
(3)4H+
【详解】(1)由图可知,反应Ⅱ为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),根据盖斯定律:-(I+Ⅲ)得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-(+551kJ mol-1)-(-297kJ mol-1)=-254kJ/mol;
(2)该反应为气体系数之和减小的反应,温度和投料比一定时,压强越大,平衡正向移动,H2SO4在平衡体系中物质的量分数越大,所以p2>p1;
(3)根据元素守恒可知反应ii为I2+2H2O+SO2=4H++SO+2I-。
19. a c = 减小 升高温度时,该反应为放热反应,平衡向向左移动,使得体系中CO的量增大; P1>P2>P3 相同温度下,由于该反应为气体分子数减小的反应,加压有利于提升CO的转化率 CH3OH+H2O-6e--═CO2+6H+ O2+4H++4e--═2H2O
【详解】(1)a.该反应前后气体的物质的量发生变化,但质量不变,混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态,故正确;b.反应达到平衡后,通入氩气,压强不变,但反应物和生成物的浓度不变,平衡不移动,CO转化率不变,故错误;c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小,故正确;d.使用催化剂,会改变反应的途径,但反应的焓变不变,故错误;故答案为a c;
(2)此时Qc===K=50L2 mol-2,所以反应处于平衡状态,正、逆反应速率相等,故答案为=;
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大, CO的转化率减小;该反应为气体分子数减小的反应,相同温度下,加压有利于提升CO的转化率,故压强:P1>P2>P3,故答案为减小;该反应为放热反应,升高温度时,平衡向向左移动,使得体系中CO的量增大,CO的转化率减小;P1>P2>P3;相同温度下,正反应为气体分子数减小的反应,增大压强有利于提升CO的转化率;
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,负极上甲醇发生氧化反应,反应式为CH3OH+H2O-6e--═CO2+6H+,正极上氧气发生还原反应,反应式为O2+4H++4e--═2H2O,故答案为CH3OH+H2O-6e--═CO2+6H+;O2+4H++4e--═2H2O。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.一定条件下,通过下列反应可以制备特种陶瓷的原料MgO,MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) △H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变如图中横坐标的值,重新达到平衡后,纵坐标随之变化趋势合理的是
选项 x y
A CO的物质的量 CO的转化率
B 温度 容器内混合气体的平均相对分子质量
C MgSO4的质量(忽略体积) CO2的物质的量
D 新充入氦气的物质的量 CO物质的量浓度
A.A B.B C.C D.D
2.多相催化反应是反应物分子在催化剂表面通过吸附、解吸附过程进行的反应。我国学者发现在时,甲醇在铜基催化剂上的反应机理如下(该反应为可逆反应):
下列说法正确的是
A.反应是放热反应,,反应II是吸热反应,
B.是热能转化为化学能的过程
C.铜基催化剂可以加快反应速率,降低反应的活化能,但不参与反应
D.在反应中既生成又消耗,可认为是催化剂
3.已知:无CO时反应、有CO时反应。某研究小组以AgZSM为催化剂,在容积为1L的容器中,相同时间下测得0.1molNO转化为的转化率随温度变化如图所示。下列说法不正确的是
A.X点可以通过更换高效催化剂提高NO的反应速率
B.反应
C.Y点再通入CO、各0.1mol,此时
D.达平衡后,其他条件不变改变物料使,NO转化率下降
4.臭氧层中O3分解过程如图所示,下列说法正确的是
A.催化反应①②均为放热反应
B.决定O3分解反应速率的是催化反应②
C.E1是催化反应①对应的正反应的活化能,(E2+E3)是催化反应②对应的逆反应的活化能
D.温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大
5.密闭容器中发生可逆反应,在一定条件下达到平衡状态,下列叙述正确的是
A.增加A的量,平衡向正反应方向移动
B.压缩容器体积,平衡不移动,v正、v逆不变
C.达平衡后升温,正反应速率增大,逆反应速率减小
D.若向恒容容器中按1∶2再充入C、D,重新建立平衡后,v正、v逆均增大
6.以天然气为原料合成氨是新的生产氮肥的方法,具有污染小、成本低等诸多特点,其过程如下:
下列说法不正确的是
A.反应②的原子利用率小于100%
B.过程③可以通过物理变化实现
C.过程④采取高温条件的目的是为了提高平衡转化率
D.过程⑤理论上当n(NH3):n(O2)=1:1时,恰好完全反应
7.汽车尾气包括CO、碳氢化合物、NOx(氮氧化合物)等,三元催化器中净化原理如图所示。下列说法正确的是
A.铂、铑、钯属于主族元素
B.三元催化器中的催化剂可降低该反应的活化能
C.三元催化器中的多孔陶瓷可提高平衡时反应物的转化率
D.在反应NO+CO→N2+CO2中,每生成1molN2时转移2mol电子
8.铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法正确的是
A.该过程的总反应速率由Ⅳ→Ⅰ步骤决定,最大能垒为89.7
B.该反应过程中浓度不变
C.与均在该反应过程中起催化作用
D.甲酸在作用下的分解反应放出热量
9.一定温度下的密闭容器中发生可逆反应2SO2(g)+O2(g) 2SO3(g),不能说明该反应一定达到平衡状态的是
A.压强保持不变
B.SO2、O2、SO3的物质的量之比为2︰1︰2
C.SO2的消耗速率和SO2的生成速率相等
D.SO2的百分含量保持不变
10.下列有关化学反应原理的说法中正确的是
A.需要加热的反应都是非自发反应,不需要加热的反应都是自发反应
B.反应 ,则该反应能自发进行
C.100mL2mol/L的盐酸与锌片反应,加入少量NaCl固体,反应速率不变
D.若反应可以自发,则该反应的速率一定较快
11.一种制备蓝氢的原理是。向一体积为1L的恒容密闭容器中充入1mol和2mol,在一定条件下发生上述反应,测得的物质的量与时间的关系如表所示。下列叙述错误的是
t/min 0 5 10 15 20 25
/mol 0 0.5 0.75 0.85 0.9 0.9
A.0~10min,
B.CO的体积分数不变时,反应达到平衡状态
C.上述反应中,的转化率大于的转化率
D.其他条件不变。若加入高效催化剂,则的转化率达到45%时所用时间小于20min
12.NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性[100%]与温度的关系如图所示。
下列说法正确的是
A.其他条件不变,升高温度,NH3的平衡转化率增大
B.其他条件不变,在175~300 ℃范围,随温度的升高,出口处N2和氮氧化物的量均不断增大
C.催化氧化除去尾气中的NH3应选择反应温度高于250 ℃
D.高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂
二、填空题(共7题)
13.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇、二甲醚等有机物,回答下列问题:
(1)在体积为2L的密闭容器中,充入1molCO2和3molH2,在相同温度、容积不变的条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) ,能说明该反应已达平衡状态的是 (填序号)。
A.CO2、H2、CH3OH、H2O的浓度均不再变化
B.v生成(CH3OH)=v消耗(CO2)
C.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
D.容器中混合气体的密度保持不变
E.容器内气体压强保持不变
(2)一定条件下甲醇可由氢气和CO反应合成:CO(g)+2H2(g)CH3OH(g)。已知:υ(正)=k(正)·x(CO)·x2(H2),υ(逆)=k(逆)·x(CH3OH),其中x为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
①P1 P2(填“>”或“<”);升高温度, (填“增大”“减小”或“不变”);
②c、d、e三点平衡常数Kc、Kd、Ke三者之间的关系为 。
(3)燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为2L恒容密闭容器甲和乙,在甲中充入1moLCO2和3molH2,在乙中充入2moLCO2和6molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图2所示。下列说法正确的是 。
A图1中,反应2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)的
B.图1中,表示乙容器CO2的平衡转化率随温度变化的是曲线B
C.图1中,逆反应速率v逆:状态I<状态III
D.图2中,T3对应的平衡常数小于T4对应的平衡常数
E. 图2中,根据图中曲线分析,催化剂I的催化效果最好
14.如图表示时合成氨反应的能量变化曲线图。合成氨所需的氢气可由甲烷与水反应制备,发生的反应为。一定条件下,在容器中发生上述反应,各物质的物质的量浓度的变化如表所示:
0 0.2 0.3 0 0
2 0.3
3 0.3
4 0.09 0.19 x 0.33
回答下列问题:
(1)表中 ;前内的平均反应速率为 。
(2)内,反应过程中氢气浓度量增大的原因可能是 (填序号)。
A.升高温度 B.使用催化剂 C.充入氢气
15.尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2) B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为 。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)NH2COONH4(s)关于上述反应的平衡状态下列说法正确的是 。
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C. NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
16.将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) H2(g)+I2(g)△H<0
(1)该反应平衡常数的表达式为K= ,则H2(g)+I2(g) 2HI(g)平衡常数的表达式为K1= (用K表示)。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为 ,HI的分解率为 。
(3)能判断该反应达到平衡状态的依据是
A.容器中压强不变
B.混合气体中c(HI)不变
C.c(I2)=c(H2)
D.v(HI)正=v(H2)逆
(4)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的浓度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向 (填“正向”或“逆向”,下同)进行,若升高温度,反应向 进行。
17.按要求回答下列问题。
(1)2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。氮元素在周期表中的位置是 ,N2的电子式是 ,化合物Si3N4中N的化合价是 价。
(2)2020年6月23日,长征系列运载大箭将北斗三号“收官之星”成功送入太空。火箭燃料燃烧的化学方程式为:2N2H4+N2O4=3N2+4H20。该反应中氧化剂与还原剂的物质的量之比为 ,将封装有NO2和NO混合气体的圆底烧瓶浸入热水中,气体混合物颜色变 (填“深”或“浅”)。
(3)我国拥有自主知识产权的铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第5周期IA族元素。Rb元素原子的失电子能力 填(“强”或“弱”)于K,请用原子结构的知识解释其原因: 。
18.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。
(1)反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ mol-1
反应III:S(s)+O2(g)=SO2(g) ΔH3=-297kJ mol-1
反应II的热化学方程式: 。
(2)对反应II,在同一投料比,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2 p1(填“>”或“<”),得出该结论的理由是 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2= +SO+2I-
19.甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ,反应到某时刻测得各组分的物质的量如下:
物质 CO H2 CH3OH
物质的量/mol 0.4 0.4 0.8
请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而 (填“增大”或“减小”),其原因是 。图中的压强由大到小的顺序为 ,其判断理由是 。
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为 ,正极的反应式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.CO的物质的量增大,平衡正向移动,但CO的转化率降低,故A错误;
B.若x是温度,升高温度,平衡向吸热反应方向正反应方向移动,生成的二氧化碳和二氧化硫的相对分子质量均比一氧化碳大,Y为容器内混合气体的平均相对分子质量符合,故B正确;
C.MgSO4的质量(忽略体积)增大,对平衡没有影响,CO2的物质的量不变,故C错误;
D.在恒容的密闭容器中,新充入氦气的物质的量增大,CO物质的量浓度保持不变,故D错误;
故选B。
2.B
【详解】A.由过程和能量变化图得知,过程I是吸热反应,过程II是放热反应,故A错误;
B.由过程和能量变化图得知,反应物的能量低于生成物的能量,反应是吸热反应,热能转化为化学能,故B正确;
C.铜基催化剂可以加快反应速率,降低反应的活化能,在反应中参与反应,故C错误;
D.CO是中间产物,不是催化剂,故D错误;
答案选B。
3.D
【详解】A.X点更换高效催化剂,能加快反应速率,即可以提高NO反应速率,故A说法正确;
B.根据图像可知,曲线最高点说明反应达到平衡,随着温度的升高,NO的转化率降低,根据平衡移动原理,该反应的正反应方向为放热反应,即ΔH<0,故B说法正确;
C.Y点转化率为80%,Y点为平衡点,此时生成CO2的物质的量为1mol×80%=0.08mol,生成氮气的物质的量为0.04mol,该温度下平衡常数K==1600,Y点再通入CO、N2各物质的量0.1mol,此时Qc=≈156<1600=K,平衡正向移动,此时v(CO,正)>v(CO,逆),故C说法正确;
D.其他条件不变,时,相当于起始NO物质的量不变,增加CO的物质的量,NO的转化率增大,CO的转化率降低,故D说法错误;
答案为D。
4.C
【详解】A.从图上可知,反应①中生成物能量高于反应物,反应①是吸热反应,A项错误;
B.决定总反应速率的是慢反应,活化能越大反应越慢,据图可知催化反应①的正反应活化能更大,反应更慢,所以催化反应①决定臭氧的分解速率,B项错误;
C.据图可知E1为催化反应①中反应物断键吸收的能量,即催化反应①对应的正反应的活化能,E2+E3为催化反应②生成物成键时释放的能量,即催化反应②对应的逆反应的活化能,C项正确;
D.据图可知总反应的反应物能量高于生成物的能量,所以总反应为放热反应,升高温度,平衡逆向移动,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,平衡常数减小,D项错误;
答案选C。
5.D
【详解】A.A为固体,增加固体的量,化学反应速率不变,平衡不移动,A错误;
B.该反应是气体分子数不变的反应,压缩容器体积,平衡不移动,但v正、v逆均增大,B错误;
C.达平衡后升温,正逆反应速率均增大,C错误;
D.若向恒容容器中按1∶2再充入C、D,重新建立平衡后,等效为加压,则v正、v逆均增大,D正确;
故选D。
6.C
【详解】A.反应②是CO2、NH3在一定条件下条件下反应产生CO(NH2)2、H2O,生成物中不仅有尿素,还有H2O,因此原子利用率小于100%,A正确;
B.过程③是分离空气的成分得到N2、O2,由于没有新物质生成,因此该变化过程是物理变化,B正确;
C.过程④是N2、H2合成NH3,该反应的正反应是气体体积减小的放热反应,反应条件采取高温条件是因为在该温度下催化剂的活性最大,而不能提高物质的平衡转化率,C错误;
D.氨气与氧气反应生成硝酸铵的过程中,根据电子守恒和元素守恒可得总反应为2NH3+2O2NH4NO3+H2O,所以理论上n(NH3):n(O2)=1:1时恰好完全反应,D正确;
故合理选项是C。
7.B
【详解】A.铂、铑、钯属于第VIII族元素,故A错误;
B.三元催化器中的催化剂可降低该反应的活化能,提高反应速率,故B正确;
C.三元催化器中的多孔陶瓷增加接触面积,提高反应速率,但平衡不移动,转化率不变,故C错误;
D.在反应NO+CO=N2+CO2中,根据方程式+2价氮化合价降低变为0价氮,因此每生成1mol N2时转移4mol电子,故D错误。
综上所述,答案为B。
8.D
【分析】由能垒图可以看出,生成物的总能量低于反应物的总能量,该反应为放热反应;整个过程中有两个过渡态,过渡态Ⅰ的正反应的活化能为45.3+31.8=77.1kJ/mol;过渡态Ⅱ的正反应的活化能为43.5+42.6=86.1kJ/mol,过渡态Ⅱ的活化能大,为反应的决速步骤。根据第一张图可以看出,反应物为HCOOH,生成物为二氧化碳和氢气,故总反应为。
【详解】A.根据分析,过渡态Ⅱ的活化能大,由Ⅳ→Ⅰ步骤为反应的决速步骤,最大能垒为43.5 kJ/mol -(-42.6 kJ/mol) =86.1kJ/mol,A错误;
B.反应过程存在甲酸电离出氢离子,然后氢离子再生成氢气的过程,浓度先增大,后减小,B错误;
C.为反应的催化剂,为中间产物,C错误;
D.由能垒图可以看出,生成物的总能量低于反应物的总能量,该反应为放热反应,D正确;
故选D。
9.B
【详解】A.反应2SO2(g)+O2(g) 2SO3(g)是气体体积减小的反应,反应过程中压强不断减小,当压强保持不变时,说明反应达到平衡,故A不选;
B.平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故B选;
C.SO2的消耗速率和SO2的生成速率相等,证明化学反应中正逆反应速率相等,达到了平衡状态,故C不选;
D.SO2的百分含量保持不变,即SO3的质量保持不变,即浓度不变,说明反应达到化学平衡状态,故D不选;
故选B。
10.C
【详解】A.时反应自发进行,不能根据是否加热判断反应的自发进行情况,A错误;
B.反应 ,其,该反应的,则不能自发进行,B错误;
C.100mL2mol/L的盐酸与锌片反应,加入少量NaCl固体,溶液中氢离子浓度几乎不变,则反应速率不变,C正确;
D.反应能否自发与反应速率无关,如自然界中发生的缓慢的氧化还原反应属于自发反应,但反应速率很小,D错误;
故选C。
11.A
【详解】A.0~10min,,由方程式可知,故A错误;
B.CO的体积分数不变时,说明CO的物质的量不变,说明反应达到平衡,故B正确;
C.达到平衡时,=0.9mol,由方程式的系数关系可知,的转化率为=45%,的转化率为=22.5%,的转化率大于的转化率,故C正确;
D.其他条件不变。若加入高效催化剂,反应速率增大,但不影响最终平衡时的转化率,则的转化率达到45%时所用时间小于20min,故D正确;
故选A。
12.D
【详解】A.NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应,根据勒夏特列原理,升高温度,平衡向逆反应方向进行,氨气的平衡转化率降低,故A错误;
B.根据图象,在175~300 ℃范围,随温度的升高,N2的选择率降低,即产生氮气的量减少,故B错误;
C.根据图象,温度高于250℃ N2的选择率降低,且氨气的转化率变化并不大,浪费能源,根据图象,温度应略小于225℃,此时氨气的转化率、氮气的选择率较大,故C错误;
D.氮气对环境无污染,氮的氧化物污染环境,因此高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂,故D正确;
答案为D。
13.(1)AE
(2) > 减小 Kc>Kd=Ke
(3)CE
【详解】(1)A.CO2、H2、CH3OH、H2O的浓度均不再变化,说明该反应已达平衡状态,A符合题意;
B.v生成(CH3OH)、v消耗(CO2)都代表正反应方向的速率,则v生成(CH3OH)=v消耗(CO2),不能说明该反应已达平衡状态,B不符合题意;
C.n(CO2):n(H2) :n(CH3OH) :n(H2O)=1:1:1:1,不能说明该反应已达平衡状态,C不符合题意;
D.在相同温度、容积不变的条件下,体系的总质量和总体积都不变,则容器中混合气体的密度始终不变,故容器中混合气体的密度保持不变,不能说明该反应已达平衡状态,D不符合题意;
E.在相同温度、容积不变的条件下,反应前后,容器中混合气体的总物质的量减小,容器中混合气体的压强减小,故容器内气体压强保持不变,能说明该反应已达平衡状态,E符合题意;
故选AE。
(2)①该反应是气体体积减小的反应,增大压强,平衡正向移动,CO的转化率增大;同一温度,P1条件下的CO的转化率更高,故P1>P2;同一压强下,升高温度,CO的转化率减小,说明该反应是放热反应;平衡时,υ(正)=υ(逆),则k(正)·x(CO)·x2(H2)=k(逆)·x(CH3OH),==K;对于放热反应而言,升高温度,K减小,即减小;
②d点、e点的温度相同,Kd=Ke;对于放热反应而言,升高温度,K减小,则Kc>Ke;故c、d、e三点平衡常数Kc、Kd、Ke三者之间的关系为Kc>Kd=Ke;
(3)A.图1中,升高温度,CO2的平衡转化率减小,说明该反应是放热反应,ΔH<0,A错误;
B.容器甲、乙的体积相同,乙中CO2和H2的初始的总物质的量较多,则容器乙中的压强较大,该反应是气体体积减小的反应,则同一温度下,容器乙中,CO2的平衡转化率较高,故图1中,表示乙容器CO2的平衡转化率随温度变化的是曲线A,B错误;
C.图1中,状态III的温度高于状态I,故图1中,逆反应速率v逆:状态I<状态III,C正确;
D.图2中,T3<T4,该反应是放热反应,升高温度,K减小,故图2中,T3对应的平衡常数大于T4对应的平衡常数,D错误;
E.图2中,在较低温度下,相同时间内CO2的转化率最高的是催化剂I,即催化剂I的催化效果最好,E正确;
故选CE。
14.(1) 0.11
(2)A
【详解】(1)由表格数据可知,从反应开始至时氢气浓度的变化量为,由化学方程式可知;由、时的浓度均为可知,时反应达到平衡状态,由题给数据建立如下三段式:
根据三段式,前内甲烷的平均反应速率为;
(2)A.由表格数据可知,内,甲烷和水蒸气浓度减小,氢气的浓度增大,说明平衡向正反应方向移动。该反应为吸热反应,升高温度,平衡向正反应方向移动,甲烷和水蒸气浓度减小,氢气的浓度增大,故A符合题意;
B.使用催化剂,平衡不移动,反应物和生成物的浓度均不变,故B不符合题意;
C.充入氢气,生成物浓度增大,平衡向逆反应方向移动,甲烷和水蒸气浓度增大,故C不符合题意。
故选A。
15. 大于 75% C
【详解】(1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B点氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的逆反应速率,故v正(CO2)>v逆(CO2);
开始氨气体积分数为50%,设起始时,氨气为50mol,二氧化碳为50mol,氨气消耗的物质的量为x,则可列出三段式为(单位:mol)
,平衡时氨气的体积分数为20%,,解得x=37.5mol,则氨气的平衡转化率为;
(2)A. 因为氨基甲酸铵为固体,分离出少量的氨基甲酸铵,平衡不移动,所以反应物的转化率不变,故A错误;
B. 起始时,NH3和CO2的体积比为2∶1,因为氨基甲酸铵为固体,NH3与CO2按照2∶1消耗,所以NH3和CO2的体积比始终为2∶1,则CO2的体积分数不变,故B错误;
C. 因为起始时,NH3和CO2的体积比为2∶1,NH3与CO2按照2∶1的消耗,所以NH3的转化率始终等于CO2的转化率,故C正确;
D. 催化剂只改变速率,不改变平衡移动,所以加入有效的催化剂不能够提高氨基甲酸铵的产率,故D错误;
故选C。
16. K= K1= 0.5mol/L 20% BD 正向 逆向
【详解】试题分析:(1)化学平衡状态下,平衡常数为气态生成物浓度密之积比上气态反应物浓度密之积,K=,H2(g)+I2(g) 2HI(g)是2HI(g) H2(g)+I2(g)的逆反应,化学平衡常数为原反应平衡常数的倒数,K1=,故答案为K=;K1=;
(2)反应达到平衡时c(I2)=0.5mol/L,根据2HI(气) H2(气)+I2(气)可知,c(H2)= 0.5mol/L,HI分解的浓度为2×0.5mol/L=1mol/L,反应达到平衡时c(HI)=4mol/L,HI 的分解率为×100%=20%,故答案:0.5mol/L;20%;
(3)A.该反应属于气体的物质的量不变的反应,容器中压强始终不变,错误;B.混合气体中c(HI)不变,表示达到了平衡状态,正确;C.c(I2)=c(H2),浓度不一定保持不变,不能说明达到了平衡状态,错误;D.v(HI)正=v(H2)逆,表示达到了平衡状态,正确;故选BD;
(4) 某时刻,Qc===<1,反应向正反应方向进行,该反应正反应为吸热反应,升高温度,平衡逆向移动,故答案为正向,逆向
考点:考查了平衡状态的判断、化学平衡的移动以及平衡常数的相关知识。
17. 第2周期VA族 -3 1:2 深 强 K和Rb是上下相邻的同主族元素,Rb的原子半径大于K,原子核对最外层电子的吸引作用小于K,所以其原子的失电子能力强于K
【分析】(1)短周期元素在周期表中的位置是电子层数和最外层电子数决定,N2是共价分子,按其共用电子对的情况书写电子式,根据化合物中正负价代数和为0确定化合价数值;
(2)结合氧化还原反应的相关定义、找出2N2H4+N2O4=3N2+4H2O中氧化剂和还原剂并填空,将封装有NO2和NO混合气体中,有2NO2 N2O4,升温时平衡向吸热方向移动,红棕色NO2浓度变化导致混合物颜色变化;
(3)同主族金属元素,原子半径大,其原子的失电子能力强,据此回答。
【详解】(1)氮原子序数为7,电子分两层排布,最外层5个电子,在周期表中的位置是第2周期VA族,2个氮原子间通过共用3对电子对形成分子,故N2的电子式是,硅的非金属性比氮弱,化合价是+4价,故化合物Si3N4中N的化合价-3价;
(2)反应:2N2H4+N2O4=3N2+4H2O中,N2O4中氮元素化合价降低,氧化剂为N2O4、N2H4中氮元素化合价升高,还原剂为N2H4,氧化剂与还原剂的物质的量之比为1:2,将封装有NO2和NO混合气体的圆底烧瓶浸入热水中,2NO2 N2O4向逆反应方向移动,红棕色NO2浓度增大,混合物颜色变深;
(3)Rb元素原子的失电子能力大于K,K和Rb是上下相邻的同主族元素,Rb的原子半径大于K,原子核对最外层电子的吸引作用小于K,所以其原子的失电子能力强于K。
18.(1)3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-254kJ/mol
(2) > 反应Ⅱ为气体体积减小的反应,温度和投料比一定时,增大压强,平衡正向移动,H2SO4在平衡体系中物质的量分数增大
(3)4H+
【详解】(1)由图可知,反应Ⅱ为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),根据盖斯定律:-(I+Ⅲ)得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-(+551kJ mol-1)-(-297kJ mol-1)=-254kJ/mol;
(2)该反应为气体系数之和减小的反应,温度和投料比一定时,压强越大,平衡正向移动,H2SO4在平衡体系中物质的量分数越大,所以p2>p1;
(3)根据元素守恒可知反应ii为I2+2H2O+SO2=4H++SO+2I-。
19. a c = 减小 升高温度时,该反应为放热反应,平衡向向左移动,使得体系中CO的量增大; P1>P2>P3 相同温度下,由于该反应为气体分子数减小的反应,加压有利于提升CO的转化率 CH3OH+H2O-6e--═CO2+6H+ O2+4H++4e--═2H2O
【详解】(1)a.该反应前后气体的物质的量发生变化,但质量不变,混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态,故正确;b.反应达到平衡后,通入氩气,压强不变,但反应物和生成物的浓度不变,平衡不移动,CO转化率不变,故错误;c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小,故正确;d.使用催化剂,会改变反应的途径,但反应的焓变不变,故错误;故答案为a c;
(2)此时Qc===K=50L2 mol-2,所以反应处于平衡状态,正、逆反应速率相等,故答案为=;
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大, CO的转化率减小;该反应为气体分子数减小的反应,相同温度下,加压有利于提升CO的转化率,故压强:P1>P2>P3,故答案为减小;该反应为放热反应,升高温度时,平衡向向左移动,使得体系中CO的量增大,CO的转化率减小;P1>P2>P3;相同温度下,正反应为气体分子数减小的反应,增大压强有利于提升CO的转化率;
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,负极上甲醇发生氧化反应,反应式为CH3OH+H2O-6e--═CO2+6H+,正极上氧气发生还原反应,反应式为O2+4H++4e--═2H2O,故答案为CH3OH+H2O-6e--═CO2+6H+;O2+4H++4e--═2H2O。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
