3.3 金属晶体与离子晶体 课时作业 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.3 金属晶体与离子晶体 课时作业 2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 172.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 00:28:21 | ||
图片预览




文档简介
3.3 金属晶体与离子晶体 课时作业
一、单选题
1.下列物质中,有离子键的是( )
A.N2 B.CH4 C.NaCl D.HCl
2.下列有关金属的说法正确的是()
A.金属原子的核外电子在金属晶体中都是自由电子
B.金属导电的实质是金属阳离子在外电场作用下的定向移动
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2
3.下列物质既含离子键又含共价键的是( )
A.CaCl2 B.H2O2 C.MgF2 D.NH4Cl
4.澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫直径约6到9纳米,内含有约4000个碳原子,在低于-183℃时,泡沫具有永久磁性,下列叙述正确的是( )
A.“碳纳米泡沫”是一种新型的碳的化合物
B.“碳纳米泡沫”中的碳原子是胶体
C.“碳纳米泡沫”是胶体
D.“碳纳米泡沫”既不是电解质也不是非电解质
5.2014年12月科学家发现了迄今为止最轻的冰﹣﹣“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构.下列有关叙述中错误的是( )
A.“冰十六”的密度比液态水小
B.“冰十六”与干冰由不同分子构成
C.“冰十六”可以包合气体分子
D.液态水转变成“冰十六”是化学变化
6.下列物质中既含有离子键又含有共价键的是( )
A.Na2O B.H2O C.Na2O2 D.Na2S
7.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.含有离子键的化合物一定是离子化合物
C.所有金属与所有非金属之间都能形成离子键
D.在化合物Na2O2中,阴、阳离子的个数比为1:1
8.下列物质发生变化时,所克服的粒子间相互作用力完全相同的是( )
A.石墨和二氧化硅分别受热熔化 B.干冰和苯分别受热变为气体
C.硫酸钠和镁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
9.下列两种物质在变化过程中克服的作用力相同的是( )
A.食盐、氯化氢溶于水 B.固体碘、氯化铵受热产生气体
C.液溴、酒精挥发 D.生石灰、浓硫酸干燥吸水
10.下列物质中,不含离子键的是( )
A.HNO3 B.NaCl C.MgCl2 D.NaOH
11.下列化学用语对事实的表述错误的是( )
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218O
B.常温时,0.1mol·L-1氨水的pH=11.1:NH3·H2O NH4++OH-
C.由Na和Cl形成离子键的过程:
D.电解精炼铜的阴极反应:Cu2+ +2e=Cu
12.下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.使阴阳离子结合成化合物的静电引力就是离子键
C.多电子原子中,在离核较近的区域内运动的电子能量较低
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
13.AB是A离子和B离子构成的化合物,其中A离子和B离子的电子层结构相同,A、B原子核外最外层电子数A比B少4个,而次外层电子数则A是比B多6个,则该化合物可以是( )
A.MgO B.CaO C.KF D.MgS
14.下列判断中错误的是( )
A.熔融态能够导电的晶体一定是离子晶体
B.不同族元素氧化物可形成同类晶体
C.同族元素氧化物可形成不同类型晶体
D.氯化铵固体属于离子晶体,加热使其分解时破坏了离子键和共价键
15.下列各组物质中化学键的类型相同的是( )
A.HCl、MgCl2 B.Na2O、CO2 C.CaCl2、CH4 D.NH3、H2O
16.下列说法中正确的是( )
①离子化合物中一定有离子键,可能有共价键
②NaHSO4固体中阳离子和阴离子的个数比是1:1
③非金属单质中不含离子键,一定只含共价键
④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl和HCl溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A.①②⑥ B.①③④⑥ C.①⑥ D.①④⑤
二、综合题
17.有下列物质:①Cl2②Na2O2③NaOH
④HCl ⑤H2O2⑥MgF2⑦NH4Cl
(1)只由离子键构成的物质是
(2)只由极性键构成的物质是
(3)只由非极性键构成的物质是
(4)只由非金属元素组成的离子化合物是
(5)由极性键和非极性键构成的物质是
(6)由离子键和极性键构成的物质是 、
(7)由离子键和非极性键构成的物质是
18.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 HIO4(填“>”“<”或“=”).
(2)图为碘晶体晶胞结构.有关说法中正确的是 .
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力.
19.M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为 ,其中M原子的配位数为 。
(2)元素Y基态原子的核外电子排布式为 ,其同周期元素中,第一电离能最大的是 (写元素符号)。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为 ,已知晶胞参数a=0.542 nm,此晶体的密度为 g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②此化合物的氨水溶液遇到空气被氧化为深蓝色,其中阳离子的化学式为 。
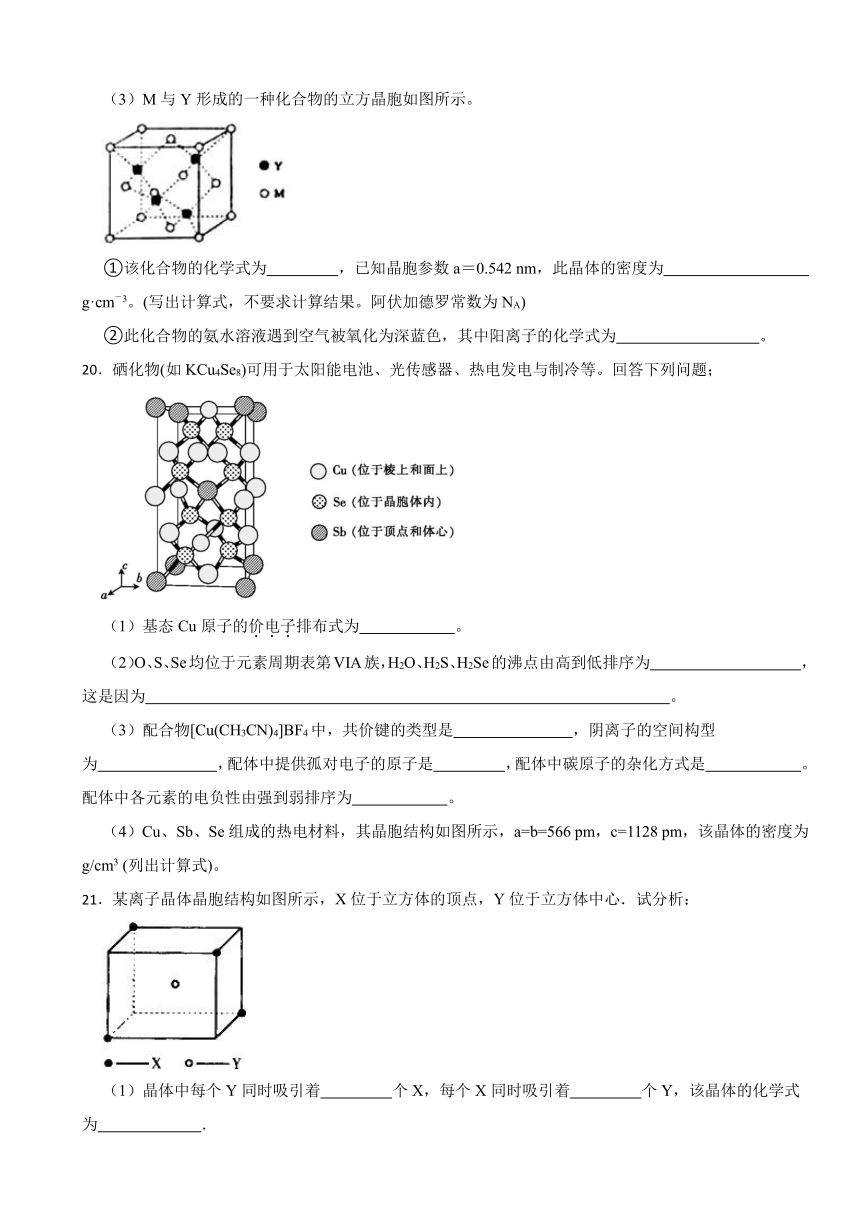
20.硒化物(如KCu4Se8)可用于太阳能电池、光传感器、热电发电与制冷等。回答下列问题;
(1)基态Cu原子的价电子排布式为 。
(2)O、S、Se均位于元素周期表第VIA族,H2O、H2S、H2Se的沸点由高到低排序为 ,这是因为 。
(3)配合物[Cu(CH3CN)4]BF4中,共价键的类型是 ,阴离子的空间构型为 ,配体中提供孤对电子的原子是 ,配体中碳原子的杂化方式是 。配体中各元素的电负性由强到弱排序为 。
(4)Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566 pm,c=1128 pm,该晶体的密度为 g/cm3 (列出计算式)。
21.某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心.试分析:
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体的化学式为 .
(2)晶体中在每个X周围与它最接近且距离相等的X共有 个.
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为 .
答案解析部分
1.【答案】C
【解析】【解答】A、N2中含有同种非金属元素形成的非极性共价键,故A不符合题意;
B、CH4中只有C、H元素之间形成的极性共价键,故B不符合题意;
C、NaCl中钠离子与氯离子以离子键结合,故C符合题意;
D、HCl中只有H、Cl元素之间形成的极性共价键,故D不符合题意;
故答案为:C。
【分析】(1)离子键是原子间得、失电子而生成阴、阳离子,然后阴、阳离子通过静电作用而形成的化学键;
(2)离子化合物中一定含有离子键,注意:氯化铵为典型的离子化合物。
2.【答案】D
【解析】【解答】A、因金属的最外层电子受原子核的吸引小,则金属原子中的最外层电子在晶体中为自由电子,而不是所有的核外电子,A不符合题意;
B、金属导电的实质是自由电子定向移动而产生电流的结果,B不符合题意;
C、金属原子在化学变化中失去电子越容易,其还原性越强,C不符合题意;
D、体心立方晶胞中原子在顶点和体心,则原子个数为1+8×1/8=2,面心立方晶胞中原子在顶点和面心,原子个数为8×1/8+6×1/2=4,原子的个数之比为2:4=1:2,D符合题意。
故答案为:D。
【分析】A.注意区分核外电子和最外层电子的区别;
B.金属导电是自由电子的定向移动;
C.金属性强弱与得失电子的多少无关,只与的是电子的难易有关;
D.根据提心立方和面心立方晶胞进行计算。
3.【答案】D
【解析】【解答】CaCl2只含有离子键,无共价键,A错误;
H2O2为共价化合物,只含有共价键,无离子键,B错误;
MgF2只含有离子键、无共价键,C错误;
NH4Cl中铵根离子中氮原子与氢原子间存在共价键,铵根离子和氯离子间为离子键,D正确;正确选项D。
【分析】离子键:一般有金属元素和非金属元素组成,但铵盐除外
共价键:一般由非金属与非金属元素构成
4.【答案】D
【解析】【解答】A.“碳纳米泡沫”中,每个泡沫含有约4000个碳原子,一种新型的碳单质,A不符合题意;
B.“碳纳米泡沫”中的碳原子颗粒直径约6到9nm,溶于水形成的分散系是胶体,B不符合题意;
C.“碳纳米泡沫”是单质,C不符合题意;
D.“碳纳米泡沫”为单质,既不是电解质也不是非电解质,D符合题意;
故答案为:D。
【分析】A、只有一种元素为单质;
B、胶体为混合物;
C、碳纳米泡沫是单质;
D、电解质和非电解质都是化合物。
5.【答案】D
【解析】【解答】A.冰中存在氢键,具有方向性和饱和性,其体积变大,则相同质量时冰的密度比液态水的密度小,A不符合题意;
B.冰的成分为水,干冰的成分为二氧化碳,则冰与干冰由不同分子构成,B不符合题意;
C.“冰十六”具有笼子一样的结构,可以困住其他分子,所以“冰十六”可以包合气体分子,C不符合题意;
D.液态水转变成“冰十六”分子没有变化,没有产生新物质,分子的结合方式不同,属于物理变化,D符合题意;
故答案为:D
【分析】A、冰的密度比水小;
B、冰为H2O,干冰为CO2;
C、仔细分析题干信息;
D、液态水和冰十六均由H2O构成;
6.【答案】C
【解析】【解答】钠离子和氧负离子间只含有离子键,A不符合题意;
氢原子和氧原子之间只含有共价键,B不符合题意;
Na2O2中钠离子与过氧根离子间为离子键,两个氧原子间为共价键,C正确;
钠离子和硫离子之间只存在离子键,D不符合题意;故答案为:C。
【分析】过氧化钠中,钠离子与过氧根离子之间是离子键,过氧根离子中两个氧原子为共价键。
7.【答案】B
【解析】【解答】A.离子键就是使阴、阳离子结合成化合物的静电作用,包括引力和斥力,故A不符合题意;
B.根据离子化合物的定义,含有离子键的化合物一定是离子化合物,故B符合题意;
C.氯化铝是根据化合物,金属与所有非金属之间不一定形成离子键,故C不符合题意;
D.在化合物Na2O2中,阴离子是,阴、阳离子的个数比为1∶2,故D不符合题意。
故答案为:B。
【分析】A.离子键就是使阴、阳离子结合成化合物的静电引力;
B.含有离子键的化合物一定是离子化合物;
C.金属与非金属之间也能形成共价键,如氯化铝;
D.Na2O2中阴、阳离子的个数比为1∶2。
8.【答案】B
【解析】【解答】A.石墨为混合晶体,受热熔化时克服共价键和分子间作用力,二氧化硅为原子晶体,受热熔化克服共价键,故A不符合题意;
B.干冰和苯均为分子晶体,受热熔化变为气体均克服分子间作用力,故B符合题意;
C.硫酸钠为离子晶体,受热熔化克服离子键,镁为金属晶体,受热熔化克服金属键,故C不符合题意;
D.氯化钠为离子晶体,受热熔化克服离子键,葡萄糖为分子晶体,受热熔化克服分子间作用力,故D不符合题意;
故答案为:B。
【分析】A.石墨为混合晶体,二氧化硅为原子晶体;
B.干冰和苯均为分子晶体;
C.硫酸钠为离子晶体,镁为金属晶体;
D.氯化钠为离子晶体,葡萄糖为分子晶体。
9.【答案】C
【解析】【解答】A.食盐、氯化氢溶于水克服的作用力分别是离子键、共价键,故A不符合题意;
B.固体碘、氯化铵受热产生气体克服的作用力分别是分子间作用力、化学键,故B不符合题意;
C.液溴、酒精挥发克服的作用力均为分子间作用力,故C符合题意;
D.生石灰、浓硫酸干燥吸水克服的作用力分别是水分子中的共价键、水分子间的作用力,故D不符合题意;
故答案为:C。
【分析】常见的的作用力是:离子键、共价键、分子键作用力、氢键等等
A.氯化钠是离子化合物,溶于水破坏的是离子键,氯化氢是共价化合物,溶于水破坏的是共价键
B.固体碘升华,主要克服的分子间作用力,而氯化铵加热时主要破坏的是共价键
C.液溴和酒精挥发破坏的是分子间作用力
D.生石灰与水反应,产生氢氧化钙,破坏的是共价键,浓硫酸吸水主要是克服分子间作用力
10.【答案】A
【解析】【解答】A.HNO3属于酸,HNO3溶于水也能电离出H+和硝酸根离子,但HNO3是共价化合物,分子中只含共价键,不含离子键,故A选;
B.NaCl是盐,属于离子化合物,含有离子键,故B不选;
C.MgCl2是盐,属于离子化合物, 含有离子键,故C不选;
D.NaOH是碱,属于离子化合物,含有离子键,氢氧根中H和O之间还存在共价键,故D不选;
故答案为:A。
【分析】酸是共价化合物,不含离子键。
11.【答案】A
【解析】【解答】A.酯化反应的机理是“酸脱羟基醇脱氢”,硬脂酸与乙醇反应的化学方程式为C17H35COOH+C2H518OH C17H35CO18OC2H5+H2O,A项符合题意;
B.常温下0.1mol·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9mol·L-1<0.1mol·L-1,氨水为弱碱水溶液,电离方程式为NH3·H2O NH4++OH-,B项不符合题意;
C.Na原子最外层有1个电子,Na易失电子形成Na+,Cl原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-间形成离子键,C项不符合题意;
D.电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项不符合题意;
故答案为:A
【分析】A中根据有机反应机理,元素跟踪法进行判读。B中根据水的离子积进行计算,考查水的离子积的基本计算方法。
12.【答案】C
【解析】【解答】A. 元素原子的最外层电子数不一定等于元素的最高化合价,例如O、F等,A不符合题意;
B. 使阴阳离子结合成化合物的静电作用就是离子键,B不符合题意;
C. 多电子原子中,在离核较近的区域内运动的电子能量较低,C符合题意;
D. 元素周期表中位于金属和非金属分界线附近的元素往往具有金属性和非金属性,但不属于过渡元素,D不符合题意;
故答案为:C
【分析】A.氧元素、氟元素无最高正化合价;
B.根据离子键的概念进行分析判断;
C.离核越近的电子,其能量越低;
D.处于金属和非金属分界线附近的元素具有金属性和非金属性;
13.【答案】A
【解析】【解答】解:设A的最外层电子数为x,则B的最外层电子数为x+4,
由次外层电子数则A是比B多6个,则A的次外层为8,B的次外层为2,
A离子和B离子的电子层结构相同,则A在下一周期,B在上一周期,则
2+8=2+(x+4)+x,
解得x=2,
即A为Mg,B为O,
则该化合物为MgO,
故选A.
【分析】A离子和B离子的电子层结构相同,则A在下一周期,B在上一周期,设A的最外层电子数为x,则B的最外层电子数为x+4,次外层电子数则A是比B多6个,则A的次外层为8,B的次外层为2,以此来解答.
14.【答案】A
【解析】【解答】A.熔融态能够导电的晶体不一定是离子晶体,可能是金属晶体,A符合题意;
B.不同族元素氧化物可形成同类晶体,例如氧化钠、氧化镁等均是离子晶体,B不符合题意;
C.同族元素氧化物可形成不同类型晶体,例如二氧化硅是共价晶体,二氧化碳是分子晶体,C不符合题意;
D.氯化铵是离子化合物,氯化铵固体属于离子晶体,氯化铵中存在离子键和共价键,加热使其分解时生成氨气和氯化氢,破坏了离子键和共价键,D不符合题意;
故答案为:A。
【分析】离子晶体和金属晶体在熔融状态下均可导电,因此熔融状态下可以导电的晶体是离子晶体和金属晶体,其他选项均正确
15.【答案】D
【解析】【解答】A.HCl为共价化合物,只含共价键;MgCl2为离子化合物,只含离子键,故A不符合题意;
B.Na2O为离子化合物,只含离子键;CO2为共价化合物,只含共价键,故B不符合题意;
C.CaCl2为离子化合物,只含离子键,CH4为共价化合物,只含共价键,故C不符合题意;
D.NH3、H2O两种物质都是共价化合物,含有的化学键都是共价键,所以化学键类型相同,故D符合题意。
故答案为:D
【分析】根据共价化合物中只含有共价键,离子化合物中一定含有离子键,可能含有共价键进行含有的化学键类型进行判断及可。
16.【答案】A
【解析】【解答】①离子化合物中一定有离子键,若阴离子、阳离子为复杂离子,还可能有共价键,①符合题意;
②NaHSO4是盐,由阳离子Na+与阴离子HSO4-构成,因此固体中阳离子和阴离子的个数比是1:1,②符合题意;
③非金属元素的原子容易获得电子,或原子之间形成共用电子对,因此非金属单质中不可能含离子键,若为双原子分子或多原子分子,则含有共价键,若为单原子分子,如惰性气体,就不含共价键,③不符合题意;
④元素的非金属性O>S,所以氢化物的稳定性:H2O>H2S;由于水分子之间存在氢键,增加了分子之间的吸引力,因此物质的沸点:H2O>H2S,④不符合题意;
⑤NaCl溶于水破坏的是离子键;而HCl溶于水破坏的是共价键,因此破坏的作用力不相同,⑤不符合题意;
⑥非极性键可能存在于多原子或双原子的非金属单质中,也可能存在于离子化合物,如Na2O2,或存在于共价化合物中如H2O2等中,⑥符合题意;
可见说法正确的为①②⑥,因此合理选项为A。
【分析】①离子化合物是阴阳离子通过离子键构成的化合物②NaHSO4=Na++HSO4-③非金属单质包括多原子单质和单原子单质,多原子单质中含有共价键,单原子单质不含有共价键④稳定性和金属性有关系,金属性越强,氢化物稳定性越强,沸点和氢键有很大的关系⑤氯化钠是离子构成的,而氯化氢是共价化合物⑥非极性键是相同原子形成的键,可呢个存在于离子化合物或或者共价化合物
17.【答案】(1)⑥
(2)④
(3)①
(4)⑦
(5)⑤
(6)③;⑦
(7)②
【解析】【解答】一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,据此可知:
(1)只由离子键构成的物质是氟化镁,故答案为:⑥。
(2)只由极性键构成的物质是氯化氢,故答案为:④。
(3)只由非极性键构成的物质是氯气,故答案为:①。
(4)只由非金属元素组成的离子化合物是氯化铵,故答案为:⑦。
(5)由极性键和非极性键构成的物质是双氧水,故答案为:⑤。
(6)由离子键和极性键构成的物质是氢氧化钠和氯化铵,故答案为:③⑦。
(7)由离子键和非极性键构成的物质是过氧化钠,故答案为:②。
【分析】该题主要是考查学生灵活运用化学键知识解决实际问题的能力。解题的关键是明确离子键、共价键的含义和判断依据,然后结合题意灵活运用即可。
18.【答案】(1)<
(2)A;D
【解析】【解答】解:(1)H5IO6( )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4;故答案为:<;(2)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;D.碘晶体中的碘原子间存在I﹣I非极性键,且晶体中分子之间存在范德华力,故D正确;故答案为:AD.
【分析】(1)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;(2)同种非金属元素之间形成非极性共价键,碘为分子晶体,碘晶体中的碘原子间存在非极性键和范德华力,晶胞中占据顶点和面心,碘分子的排列有2种不同的取向.
19.【答案】(1)金属晶体;12
(2)1s22s22p63s23p5;Ar
(3)CuCl; 或 ;[Cu(NH3)4]2+
【解析】【解答】(1)铜为金属原子,晶体中金属阳离子与电子之间通过金属键结合在一起,铜晶体属于金属晶体;铜晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法知,每个平面上铜原子的配位数是4,三个面共有4×3=12个铜原子,所以铜原子的配位数是12,故答案为:金属晶体;12;
(2)氯是17号元素,其基态原子的电子排布式为:1s22s22p63s23p5;氯为第三周期元素,同周期元素中,Ar是稀有气体元素,第一电离能最大的是Ar,故答案为:1s22s22p63s23p5;Ar;
(3)①依据晶胞结构,每个晶胞中含有铜原子个数为:8× +6× =4,氯原子个数为4,则化学式为CuCl;1mol晶胞中含有4mol CuCl,1mol晶胞的质量为M(CuCl)×4,晶胞参数a=0.542nm,则晶体密度为 g·cm-3= g·cm-3,故答案为:CuCl; 或 ;
②Cu+可与氨形成易溶于水的配合物,所以CuCl难溶于水但易溶于氨水,该配合物中Cu+被氧化为Cu2+,所以深蓝色溶液中阳离子为[Cu(NH3)4]2+,故答案为: [Cu(NH3)4]2+。
【分析】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,则M为铜元素;元素Y的负一价离子的最外层电子数与次外层的相同,则Y为氯元素。据此结合题干设问分析作答。
20.【答案】(1)3d104s1
(2)H2O>H2Se>H2S;三者都是分子晶体,水分子之间存在氢键,H2Se相对分子质量大于H2S
(3)σ键和π键;正四面体形;N;sp和sp3;N>C>H
(4)
【解析】【解答】(1)Cu是29号元素,根据构造原理,可知基态Cu原子的价电子排布式是3d104s1;
(2)O、S、Se均位于元素周期表第VIA族,H2O、H2S、H2Se都是由分子构成的物质,一般情况下,物质的相对分子质量越大,分子间作用力越大,物质的熔沸点就越高。但H2O分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的吸引作用,使H2O的沸点比H2Se还高,故物质的沸点由高到低排序为:H2O>H2Se>H2S;
(3)配位化合物[Cu(CH3CN)4]BF4中,共价键的类型有共价单键和共价三键,共价单键都是σ键,共价三键中含有σ键和π键,故物质中所含共价键类型为σ键和π键;
阴离子中中心B原子价层电子对数为4+=4,孤电子对数为0,所以的空间构型为正四面体形;
在络合物[Cu(CH3CN)4]BF4中,与Cu2+结合的配位体CN-中提供孤对电子的原子是N原子;
配体CN-中碳原子与N原子形成共价三键,因此该C原子的杂化方式是sp杂化;其中-CH3中C原子与其它原子形成四个共价键,该C原子采用sp3杂化,因此在该络合物中的C原子杂化类型是sp和sp3;
在晶胞的配位体中含有的元素有C、H、N,元素的非金属性越强,其电负性就越大,故三种元素的电负性由强到弱的的顺序为:N>C>H;
(4)根据晶胞结构可知:晶胞中含有Sb原子数目为:8×+1=2;含有的Cu原子数目为:4×+10×=6;Se原子数目为:8,故一个晶胞的质量m=;a=b=566 pm,c=1128 pm,该晶体的体积V=(566×10-10)2×(1128×10-10)cm3,则该晶胞的密度ρ== g/cm3。
【分析】(1)书写Cu的电子排布式要注意全满规则
(2)比较氢化物沸点,要注意H2O含有氢键,沸点异常高
(3)利用VSEPR进行计算孤对电子,然后判断空间构型,其中N原子还有孤对电子,可以给出电子,与Cu2+形成配位键
(4)利用均摊法算出一个晶胞里每个原子个数,算出一个晶胞质量,然后算出一个晶胞体积,利用密度,然后计算密度
21.【答案】(1)4;8;XY2或Y2X
(2)12
(3)109°28′
【解析】【解答】解:(1.)由离子晶体晶胞图,X位于立方体的顶点,Y位于立方体中心,则每个Y同时吸引着4个X,空间有8个晶胞无隙并置,则每个X同时吸引着8个Y,1个晶胞中含X为4× = ,含Y为1,X、Y的离子个数之比为1:2,则晶体的化学式为XY2或Y2X,故答案为:4;8;XY2或Y2X;
(2.)由图可知,X在顶点,则一个晶胞中最近的X有3个,为面上的距离,晶体中在每个X周围与它最接近且距离相等的X共有 =12个,故答案为:12;
(3.)1个Y与4个X形成空间正四面体结构,则晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为109°28′,故答案为:109°28′.
【分析】由离子晶体晶胞图,X位于立方体的顶点,Y位于立方体中心,则1个晶胞中含X为4× = ,含Y为1,X、Y的离子个数之比为1:2,1个Y与4个X形成空间正四面体结构,以此来解答.
一、单选题
1.下列物质中,有离子键的是( )
A.N2 B.CH4 C.NaCl D.HCl
2.下列有关金属的说法正确的是()
A.金属原子的核外电子在金属晶体中都是自由电子
B.金属导电的实质是金属阳离子在外电场作用下的定向移动
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2
3.下列物质既含离子键又含共价键的是( )
A.CaCl2 B.H2O2 C.MgF2 D.NH4Cl
4.澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫直径约6到9纳米,内含有约4000个碳原子,在低于-183℃时,泡沫具有永久磁性,下列叙述正确的是( )
A.“碳纳米泡沫”是一种新型的碳的化合物
B.“碳纳米泡沫”中的碳原子是胶体
C.“碳纳米泡沫”是胶体
D.“碳纳米泡沫”既不是电解质也不是非电解质
5.2014年12月科学家发现了迄今为止最轻的冰﹣﹣“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构.下列有关叙述中错误的是( )
A.“冰十六”的密度比液态水小
B.“冰十六”与干冰由不同分子构成
C.“冰十六”可以包合气体分子
D.液态水转变成“冰十六”是化学变化
6.下列物质中既含有离子键又含有共价键的是( )
A.Na2O B.H2O C.Na2O2 D.Na2S
7.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.含有离子键的化合物一定是离子化合物
C.所有金属与所有非金属之间都能形成离子键
D.在化合物Na2O2中,阴、阳离子的个数比为1:1
8.下列物质发生变化时,所克服的粒子间相互作用力完全相同的是( )
A.石墨和二氧化硅分别受热熔化 B.干冰和苯分别受热变为气体
C.硫酸钠和镁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
9.下列两种物质在变化过程中克服的作用力相同的是( )
A.食盐、氯化氢溶于水 B.固体碘、氯化铵受热产生气体
C.液溴、酒精挥发 D.生石灰、浓硫酸干燥吸水
10.下列物质中,不含离子键的是( )
A.HNO3 B.NaCl C.MgCl2 D.NaOH
11.下列化学用语对事实的表述错误的是( )
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218O
B.常温时,0.1mol·L-1氨水的pH=11.1:NH3·H2O NH4++OH-
C.由Na和Cl形成离子键的过程:
D.电解精炼铜的阴极反应:Cu2+ +2e=Cu
12.下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.使阴阳离子结合成化合物的静电引力就是离子键
C.多电子原子中,在离核较近的区域内运动的电子能量较低
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
13.AB是A离子和B离子构成的化合物,其中A离子和B离子的电子层结构相同,A、B原子核外最外层电子数A比B少4个,而次外层电子数则A是比B多6个,则该化合物可以是( )
A.MgO B.CaO C.KF D.MgS
14.下列判断中错误的是( )
A.熔融态能够导电的晶体一定是离子晶体
B.不同族元素氧化物可形成同类晶体
C.同族元素氧化物可形成不同类型晶体
D.氯化铵固体属于离子晶体,加热使其分解时破坏了离子键和共价键
15.下列各组物质中化学键的类型相同的是( )
A.HCl、MgCl2 B.Na2O、CO2 C.CaCl2、CH4 D.NH3、H2O
16.下列说法中正确的是( )
①离子化合物中一定有离子键,可能有共价键
②NaHSO4固体中阳离子和阴离子的个数比是1:1
③非金属单质中不含离子键,一定只含共价键
④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl和HCl溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A.①②⑥ B.①③④⑥ C.①⑥ D.①④⑤
二、综合题
17.有下列物质:①Cl2②Na2O2③NaOH
④HCl ⑤H2O2⑥MgF2⑦NH4Cl
(1)只由离子键构成的物质是
(2)只由极性键构成的物质是
(3)只由非极性键构成的物质是
(4)只由非金属元素组成的离子化合物是
(5)由极性键和非极性键构成的物质是
(6)由离子键和极性键构成的物质是 、
(7)由离子键和非极性键构成的物质是
18.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 HIO4(填“>”“<”或“=”).
(2)图为碘晶体晶胞结构.有关说法中正确的是 .
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力.
19.M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为 ,其中M原子的配位数为 。
(2)元素Y基态原子的核外电子排布式为 ,其同周期元素中,第一电离能最大的是 (写元素符号)。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为 ,已知晶胞参数a=0.542 nm,此晶体的密度为 g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②此化合物的氨水溶液遇到空气被氧化为深蓝色,其中阳离子的化学式为 。
20.硒化物(如KCu4Se8)可用于太阳能电池、光传感器、热电发电与制冷等。回答下列问题;
(1)基态Cu原子的价电子排布式为 。
(2)O、S、Se均位于元素周期表第VIA族,H2O、H2S、H2Se的沸点由高到低排序为 ,这是因为 。
(3)配合物[Cu(CH3CN)4]BF4中,共价键的类型是 ,阴离子的空间构型为 ,配体中提供孤对电子的原子是 ,配体中碳原子的杂化方式是 。配体中各元素的电负性由强到弱排序为 。
(4)Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566 pm,c=1128 pm,该晶体的密度为 g/cm3 (列出计算式)。
21.某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心.试分析:
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体的化学式为 .
(2)晶体中在每个X周围与它最接近且距离相等的X共有 个.
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为 .
答案解析部分
1.【答案】C
【解析】【解答】A、N2中含有同种非金属元素形成的非极性共价键,故A不符合题意;
B、CH4中只有C、H元素之间形成的极性共价键,故B不符合题意;
C、NaCl中钠离子与氯离子以离子键结合,故C符合题意;
D、HCl中只有H、Cl元素之间形成的极性共价键,故D不符合题意;
故答案为:C。
【分析】(1)离子键是原子间得、失电子而生成阴、阳离子,然后阴、阳离子通过静电作用而形成的化学键;
(2)离子化合物中一定含有离子键,注意:氯化铵为典型的离子化合物。
2.【答案】D
【解析】【解答】A、因金属的最外层电子受原子核的吸引小,则金属原子中的最外层电子在晶体中为自由电子,而不是所有的核外电子,A不符合题意;
B、金属导电的实质是自由电子定向移动而产生电流的结果,B不符合题意;
C、金属原子在化学变化中失去电子越容易,其还原性越强,C不符合题意;
D、体心立方晶胞中原子在顶点和体心,则原子个数为1+8×1/8=2,面心立方晶胞中原子在顶点和面心,原子个数为8×1/8+6×1/2=4,原子的个数之比为2:4=1:2,D符合题意。
故答案为:D。
【分析】A.注意区分核外电子和最外层电子的区别;
B.金属导电是自由电子的定向移动;
C.金属性强弱与得失电子的多少无关,只与的是电子的难易有关;
D.根据提心立方和面心立方晶胞进行计算。
3.【答案】D
【解析】【解答】CaCl2只含有离子键,无共价键,A错误;
H2O2为共价化合物,只含有共价键,无离子键,B错误;
MgF2只含有离子键、无共价键,C错误;
NH4Cl中铵根离子中氮原子与氢原子间存在共价键,铵根离子和氯离子间为离子键,D正确;正确选项D。
【分析】离子键:一般有金属元素和非金属元素组成,但铵盐除外
共价键:一般由非金属与非金属元素构成
4.【答案】D
【解析】【解答】A.“碳纳米泡沫”中,每个泡沫含有约4000个碳原子,一种新型的碳单质,A不符合题意;
B.“碳纳米泡沫”中的碳原子颗粒直径约6到9nm,溶于水形成的分散系是胶体,B不符合题意;
C.“碳纳米泡沫”是单质,C不符合题意;
D.“碳纳米泡沫”为单质,既不是电解质也不是非电解质,D符合题意;
故答案为:D。
【分析】A、只有一种元素为单质;
B、胶体为混合物;
C、碳纳米泡沫是单质;
D、电解质和非电解质都是化合物。
5.【答案】D
【解析】【解答】A.冰中存在氢键,具有方向性和饱和性,其体积变大,则相同质量时冰的密度比液态水的密度小,A不符合题意;
B.冰的成分为水,干冰的成分为二氧化碳,则冰与干冰由不同分子构成,B不符合题意;
C.“冰十六”具有笼子一样的结构,可以困住其他分子,所以“冰十六”可以包合气体分子,C不符合题意;
D.液态水转变成“冰十六”分子没有变化,没有产生新物质,分子的结合方式不同,属于物理变化,D符合题意;
故答案为:D
【分析】A、冰的密度比水小;
B、冰为H2O,干冰为CO2;
C、仔细分析题干信息;
D、液态水和冰十六均由H2O构成;
6.【答案】C
【解析】【解答】钠离子和氧负离子间只含有离子键,A不符合题意;
氢原子和氧原子之间只含有共价键,B不符合题意;
Na2O2中钠离子与过氧根离子间为离子键,两个氧原子间为共价键,C正确;
钠离子和硫离子之间只存在离子键,D不符合题意;故答案为:C。
【分析】过氧化钠中,钠离子与过氧根离子之间是离子键,过氧根离子中两个氧原子为共价键。
7.【答案】B
【解析】【解答】A.离子键就是使阴、阳离子结合成化合物的静电作用,包括引力和斥力,故A不符合题意;
B.根据离子化合物的定义,含有离子键的化合物一定是离子化合物,故B符合题意;
C.氯化铝是根据化合物,金属与所有非金属之间不一定形成离子键,故C不符合题意;
D.在化合物Na2O2中,阴离子是,阴、阳离子的个数比为1∶2,故D不符合题意。
故答案为:B。
【分析】A.离子键就是使阴、阳离子结合成化合物的静电引力;
B.含有离子键的化合物一定是离子化合物;
C.金属与非金属之间也能形成共价键,如氯化铝;
D.Na2O2中阴、阳离子的个数比为1∶2。
8.【答案】B
【解析】【解答】A.石墨为混合晶体,受热熔化时克服共价键和分子间作用力,二氧化硅为原子晶体,受热熔化克服共价键,故A不符合题意;
B.干冰和苯均为分子晶体,受热熔化变为气体均克服分子间作用力,故B符合题意;
C.硫酸钠为离子晶体,受热熔化克服离子键,镁为金属晶体,受热熔化克服金属键,故C不符合题意;
D.氯化钠为离子晶体,受热熔化克服离子键,葡萄糖为分子晶体,受热熔化克服分子间作用力,故D不符合题意;
故答案为:B。
【分析】A.石墨为混合晶体,二氧化硅为原子晶体;
B.干冰和苯均为分子晶体;
C.硫酸钠为离子晶体,镁为金属晶体;
D.氯化钠为离子晶体,葡萄糖为分子晶体。
9.【答案】C
【解析】【解答】A.食盐、氯化氢溶于水克服的作用力分别是离子键、共价键,故A不符合题意;
B.固体碘、氯化铵受热产生气体克服的作用力分别是分子间作用力、化学键,故B不符合题意;
C.液溴、酒精挥发克服的作用力均为分子间作用力,故C符合题意;
D.生石灰、浓硫酸干燥吸水克服的作用力分别是水分子中的共价键、水分子间的作用力,故D不符合题意;
故答案为:C。
【分析】常见的的作用力是:离子键、共价键、分子键作用力、氢键等等
A.氯化钠是离子化合物,溶于水破坏的是离子键,氯化氢是共价化合物,溶于水破坏的是共价键
B.固体碘升华,主要克服的分子间作用力,而氯化铵加热时主要破坏的是共价键
C.液溴和酒精挥发破坏的是分子间作用力
D.生石灰与水反应,产生氢氧化钙,破坏的是共价键,浓硫酸吸水主要是克服分子间作用力
10.【答案】A
【解析】【解答】A.HNO3属于酸,HNO3溶于水也能电离出H+和硝酸根离子,但HNO3是共价化合物,分子中只含共价键,不含离子键,故A选;
B.NaCl是盐,属于离子化合物,含有离子键,故B不选;
C.MgCl2是盐,属于离子化合物, 含有离子键,故C不选;
D.NaOH是碱,属于离子化合物,含有离子键,氢氧根中H和O之间还存在共价键,故D不选;
故答案为:A。
【分析】酸是共价化合物,不含离子键。
11.【答案】A
【解析】【解答】A.酯化反应的机理是“酸脱羟基醇脱氢”,硬脂酸与乙醇反应的化学方程式为C17H35COOH+C2H518OH C17H35CO18OC2H5+H2O,A项符合题意;
B.常温下0.1mol·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9mol·L-1<0.1mol·L-1,氨水为弱碱水溶液,电离方程式为NH3·H2O NH4++OH-,B项不符合题意;
C.Na原子最外层有1个电子,Na易失电子形成Na+,Cl原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-间形成离子键,C项不符合题意;
D.电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项不符合题意;
故答案为:A
【分析】A中根据有机反应机理,元素跟踪法进行判读。B中根据水的离子积进行计算,考查水的离子积的基本计算方法。
12.【答案】C
【解析】【解答】A. 元素原子的最外层电子数不一定等于元素的最高化合价,例如O、F等,A不符合题意;
B. 使阴阳离子结合成化合物的静电作用就是离子键,B不符合题意;
C. 多电子原子中,在离核较近的区域内运动的电子能量较低,C符合题意;
D. 元素周期表中位于金属和非金属分界线附近的元素往往具有金属性和非金属性,但不属于过渡元素,D不符合题意;
故答案为:C
【分析】A.氧元素、氟元素无最高正化合价;
B.根据离子键的概念进行分析判断;
C.离核越近的电子,其能量越低;
D.处于金属和非金属分界线附近的元素具有金属性和非金属性;
13.【答案】A
【解析】【解答】解:设A的最外层电子数为x,则B的最外层电子数为x+4,
由次外层电子数则A是比B多6个,则A的次外层为8,B的次外层为2,
A离子和B离子的电子层结构相同,则A在下一周期,B在上一周期,则
2+8=2+(x+4)+x,
解得x=2,
即A为Mg,B为O,
则该化合物为MgO,
故选A.
【分析】A离子和B离子的电子层结构相同,则A在下一周期,B在上一周期,设A的最外层电子数为x,则B的最外层电子数为x+4,次外层电子数则A是比B多6个,则A的次外层为8,B的次外层为2,以此来解答.
14.【答案】A
【解析】【解答】A.熔融态能够导电的晶体不一定是离子晶体,可能是金属晶体,A符合题意;
B.不同族元素氧化物可形成同类晶体,例如氧化钠、氧化镁等均是离子晶体,B不符合题意;
C.同族元素氧化物可形成不同类型晶体,例如二氧化硅是共价晶体,二氧化碳是分子晶体,C不符合题意;
D.氯化铵是离子化合物,氯化铵固体属于离子晶体,氯化铵中存在离子键和共价键,加热使其分解时生成氨气和氯化氢,破坏了离子键和共价键,D不符合题意;
故答案为:A。
【分析】离子晶体和金属晶体在熔融状态下均可导电,因此熔融状态下可以导电的晶体是离子晶体和金属晶体,其他选项均正确
15.【答案】D
【解析】【解答】A.HCl为共价化合物,只含共价键;MgCl2为离子化合物,只含离子键,故A不符合题意;
B.Na2O为离子化合物,只含离子键;CO2为共价化合物,只含共价键,故B不符合题意;
C.CaCl2为离子化合物,只含离子键,CH4为共价化合物,只含共价键,故C不符合题意;
D.NH3、H2O两种物质都是共价化合物,含有的化学键都是共价键,所以化学键类型相同,故D符合题意。
故答案为:D
【分析】根据共价化合物中只含有共价键,离子化合物中一定含有离子键,可能含有共价键进行含有的化学键类型进行判断及可。
16.【答案】A
【解析】【解答】①离子化合物中一定有离子键,若阴离子、阳离子为复杂离子,还可能有共价键,①符合题意;
②NaHSO4是盐,由阳离子Na+与阴离子HSO4-构成,因此固体中阳离子和阴离子的个数比是1:1,②符合题意;
③非金属元素的原子容易获得电子,或原子之间形成共用电子对,因此非金属单质中不可能含离子键,若为双原子分子或多原子分子,则含有共价键,若为单原子分子,如惰性气体,就不含共价键,③不符合题意;
④元素的非金属性O>S,所以氢化物的稳定性:H2O>H2S;由于水分子之间存在氢键,增加了分子之间的吸引力,因此物质的沸点:H2O>H2S,④不符合题意;
⑤NaCl溶于水破坏的是离子键;而HCl溶于水破坏的是共价键,因此破坏的作用力不相同,⑤不符合题意;
⑥非极性键可能存在于多原子或双原子的非金属单质中,也可能存在于离子化合物,如Na2O2,或存在于共价化合物中如H2O2等中,⑥符合题意;
可见说法正确的为①②⑥,因此合理选项为A。
【分析】①离子化合物是阴阳离子通过离子键构成的化合物②NaHSO4=Na++HSO4-③非金属单质包括多原子单质和单原子单质,多原子单质中含有共价键,单原子单质不含有共价键④稳定性和金属性有关系,金属性越强,氢化物稳定性越强,沸点和氢键有很大的关系⑤氯化钠是离子构成的,而氯化氢是共价化合物⑥非极性键是相同原子形成的键,可呢个存在于离子化合物或或者共价化合物
17.【答案】(1)⑥
(2)④
(3)①
(4)⑦
(5)⑤
(6)③;⑦
(7)②
【解析】【解答】一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,据此可知:
(1)只由离子键构成的物质是氟化镁,故答案为:⑥。
(2)只由极性键构成的物质是氯化氢,故答案为:④。
(3)只由非极性键构成的物质是氯气,故答案为:①。
(4)只由非金属元素组成的离子化合物是氯化铵,故答案为:⑦。
(5)由极性键和非极性键构成的物质是双氧水,故答案为:⑤。
(6)由离子键和极性键构成的物质是氢氧化钠和氯化铵,故答案为:③⑦。
(7)由离子键和非极性键构成的物质是过氧化钠,故答案为:②。
【分析】该题主要是考查学生灵活运用化学键知识解决实际问题的能力。解题的关键是明确离子键、共价键的含义和判断依据,然后结合题意灵活运用即可。
18.【答案】(1)<
(2)A;D
【解析】【解答】解:(1)H5IO6( )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4;故答案为:<;(2)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;D.碘晶体中的碘原子间存在I﹣I非极性键,且晶体中分子之间存在范德华力,故D正确;故答案为:AD.
【分析】(1)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;(2)同种非金属元素之间形成非极性共价键,碘为分子晶体,碘晶体中的碘原子间存在非极性键和范德华力,晶胞中占据顶点和面心,碘分子的排列有2种不同的取向.
19.【答案】(1)金属晶体;12
(2)1s22s22p63s23p5;Ar
(3)CuCl; 或 ;[Cu(NH3)4]2+
【解析】【解答】(1)铜为金属原子,晶体中金属阳离子与电子之间通过金属键结合在一起,铜晶体属于金属晶体;铜晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法知,每个平面上铜原子的配位数是4,三个面共有4×3=12个铜原子,所以铜原子的配位数是12,故答案为:金属晶体;12;
(2)氯是17号元素,其基态原子的电子排布式为:1s22s22p63s23p5;氯为第三周期元素,同周期元素中,Ar是稀有气体元素,第一电离能最大的是Ar,故答案为:1s22s22p63s23p5;Ar;
(3)①依据晶胞结构,每个晶胞中含有铜原子个数为:8× +6× =4,氯原子个数为4,则化学式为CuCl;1mol晶胞中含有4mol CuCl,1mol晶胞的质量为M(CuCl)×4,晶胞参数a=0.542nm,则晶体密度为 g·cm-3= g·cm-3,故答案为:CuCl; 或 ;
②Cu+可与氨形成易溶于水的配合物,所以CuCl难溶于水但易溶于氨水,该配合物中Cu+被氧化为Cu2+,所以深蓝色溶液中阳离子为[Cu(NH3)4]2+,故答案为: [Cu(NH3)4]2+。
【分析】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,则M为铜元素;元素Y的负一价离子的最外层电子数与次外层的相同,则Y为氯元素。据此结合题干设问分析作答。
20.【答案】(1)3d104s1
(2)H2O>H2Se>H2S;三者都是分子晶体,水分子之间存在氢键,H2Se相对分子质量大于H2S
(3)σ键和π键;正四面体形;N;sp和sp3;N>C>H
(4)
【解析】【解答】(1)Cu是29号元素,根据构造原理,可知基态Cu原子的价电子排布式是3d104s1;
(2)O、S、Se均位于元素周期表第VIA族,H2O、H2S、H2Se都是由分子构成的物质,一般情况下,物质的相对分子质量越大,分子间作用力越大,物质的熔沸点就越高。但H2O分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的吸引作用,使H2O的沸点比H2Se还高,故物质的沸点由高到低排序为:H2O>H2Se>H2S;
(3)配位化合物[Cu(CH3CN)4]BF4中,共价键的类型有共价单键和共价三键,共价单键都是σ键,共价三键中含有σ键和π键,故物质中所含共价键类型为σ键和π键;
阴离子中中心B原子价层电子对数为4+=4,孤电子对数为0,所以的空间构型为正四面体形;
在络合物[Cu(CH3CN)4]BF4中,与Cu2+结合的配位体CN-中提供孤对电子的原子是N原子;
配体CN-中碳原子与N原子形成共价三键,因此该C原子的杂化方式是sp杂化;其中-CH3中C原子与其它原子形成四个共价键,该C原子采用sp3杂化,因此在该络合物中的C原子杂化类型是sp和sp3;
在晶胞的配位体中含有的元素有C、H、N,元素的非金属性越强,其电负性就越大,故三种元素的电负性由强到弱的的顺序为:N>C>H;
(4)根据晶胞结构可知:晶胞中含有Sb原子数目为:8×+1=2;含有的Cu原子数目为:4×+10×=6;Se原子数目为:8,故一个晶胞的质量m=;a=b=566 pm,c=1128 pm,该晶体的体积V=(566×10-10)2×(1128×10-10)cm3,则该晶胞的密度ρ== g/cm3。
【分析】(1)书写Cu的电子排布式要注意全满规则
(2)比较氢化物沸点,要注意H2O含有氢键,沸点异常高
(3)利用VSEPR进行计算孤对电子,然后判断空间构型,其中N原子还有孤对电子,可以给出电子,与Cu2+形成配位键
(4)利用均摊法算出一个晶胞里每个原子个数,算出一个晶胞质量,然后算出一个晶胞体积,利用密度,然后计算密度
21.【答案】(1)4;8;XY2或Y2X
(2)12
(3)109°28′
【解析】【解答】解:(1.)由离子晶体晶胞图,X位于立方体的顶点,Y位于立方体中心,则每个Y同时吸引着4个X,空间有8个晶胞无隙并置,则每个X同时吸引着8个Y,1个晶胞中含X为4× = ,含Y为1,X、Y的离子个数之比为1:2,则晶体的化学式为XY2或Y2X,故答案为:4;8;XY2或Y2X;
(2.)由图可知,X在顶点,则一个晶胞中最近的X有3个,为面上的距离,晶体中在每个X周围与它最接近且距离相等的X共有 =12个,故答案为:12;
(3.)1个Y与4个X形成空间正四面体结构,则晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为109°28′,故答案为:109°28′.
【分析】由离子晶体晶胞图,X位于立方体的顶点,Y位于立方体中心,则1个晶胞中含X为4× = ,含Y为1,X、Y的离子个数之比为1:2,1个Y与4个X形成空间正四面体结构,以此来解答.
