6.1.化学反应与能量变化 (含解析)课后练习 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.化学反应与能量变化 (含解析)课后练习 2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 875.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 00:22:55 | ||
图片预览




文档简介
6.1.化学反应与能量变化课后练习-2023-2024学年高一下学期化学人教版(2019)必修第二册
一、单选题
1.下列装置中,能构成原电池的是
A. B.
C. D.
2.下图表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
A.等质量的白磷与红磷充分燃烧,红磷放出的热量多
B.红磷比白磷稳定
C.白磷转化为红磷是吸热反应
D.红磷比白磷更容易与氧气反应生成P4O10
3.在盛有稀硫酸的烧杯中,放入用导线连接的铜片和锌片,下列说法正确的是( )
A.负极发生还原反应
B.电子通过导线由铜片流向锌片
C.正极上有氢气逸出,正极电极反应式为:2H++2e-=H2↑
D.负极附近的SO离子浓度逐渐减小
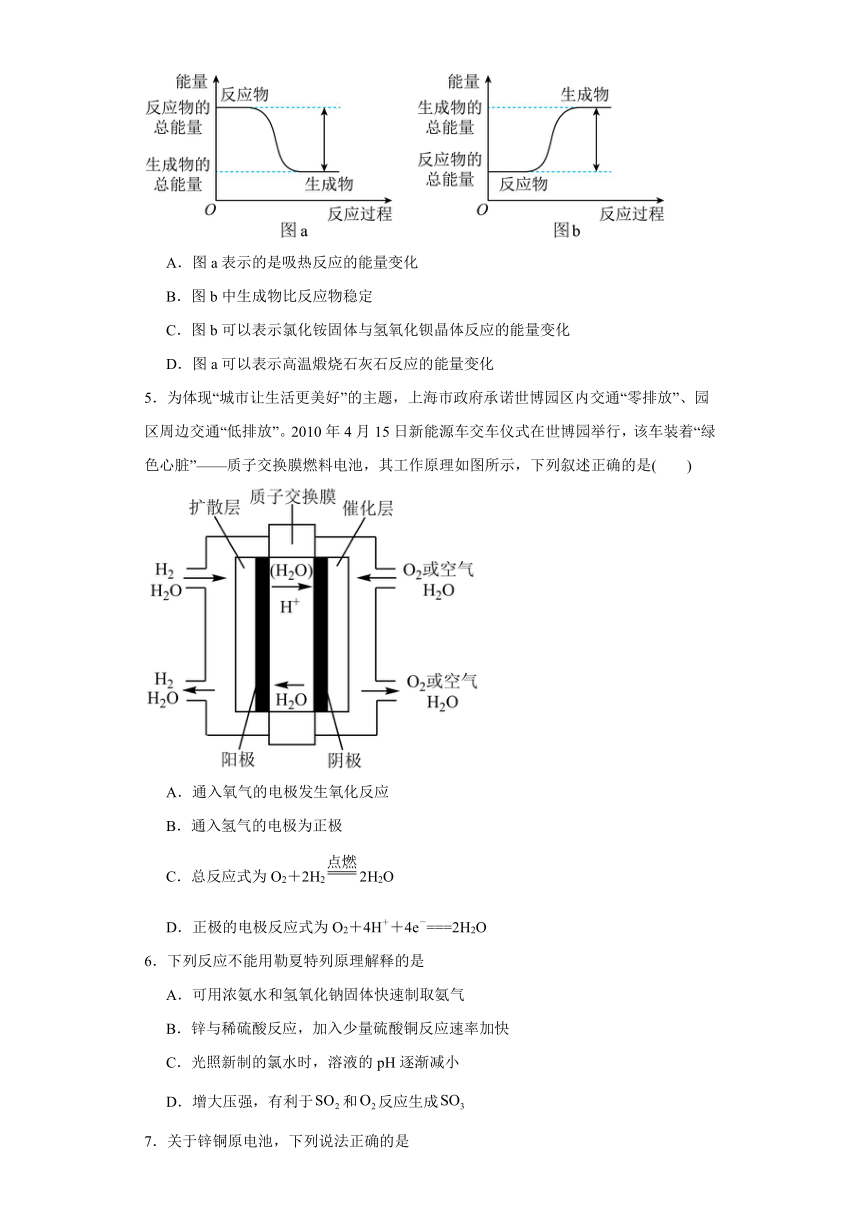
4.如图所示,有关化学反应和能量变化的说法正确的是
A.图a表示的是吸热反应的能量变化
B.图b中生成物比反应物稳定
C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D.图a可以表示高温煅烧石灰石反应的能量变化
5.为体现“城市让生活更美好”的主题,上海市政府承诺世博园区内交通“零排放”、园区周边交通“低排放”。2010年4月15日新能源车交车仪式在世博园举行,该车装着“绿色心脏”——质子交换膜燃料电池,其工作原理如图所示,下列叙述正确的是( )
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H22H2O
D.正极的电极反应式为O2+4H++4e-===2H2O
6.下列反应不能用勒夏特列原理解释的是
A.可用浓氨水和氢氧化钠固体快速制取氨气
B.锌与稀硫酸反应,加入少量硫酸铜反应速率加快
C.光照新制的氯水时,溶液的pH逐渐减小
D.增大压强,有利于和反应生成
7.关于锌铜原电池,下列说法正确的是
A.电解质溶液中阳离子向Zn极移动
B.电解质Y是硫酸锌溶液
C.电子从Zn电极→外电路流→Cu电极→电解质溶液→Zn电极
D.若电解质Y是硫酸铜溶液,正极上的电极反应式为:Cu2++2e-=Cu
8.2019年4月28日晚,中国北京世界园艺博览会以“绿色生活、美丽家园”为主题正式拉开序幕,中国植被增加量占全球植被总增量25%以上。保护环境、减少污染、节能减排成为社会发展过程中不可回避的课题。下列有关说法正确的是
①推广乙醇汽油可以减少环境污染
②太阳能、生物质能、风能、氢能,均可再生
③工业上利用电解水获得大量清洁能源——氢能源
④用过量的空气与煤燃烧,可以提高煤燃烧时产生能量的利用率
A.①② B.②③ C.③④ D.①④
9.习近平总书记指出“绿水青山就是金山银山”。下列观点合理的是( )
A.将工业废液排入海洋以减少河道污染
B.为了减少火电厂产生的大气污染,应将燃煤粉碎并鼓入尽可能多的空气
C.习总书记2018年4月2日参加北京植树节体现了绿色化学的思想
D.与2017年相比2018年某地区降水pH平均值增加了0.27,说明酸雨情况有所改善
10.以下关于能量变化的说法正确的是
A.凡是能量变化一定发生在化学变化中
B.盐酸与碳酸氢钠的反应为放热反应
C.吸热反应都需要加热
D.植物的光合作用是将光能转变为化学能
11.下列诗句中能体现吸热反应的是( )
A.野火烧不尽,春风吹又生 B.千锤万凿出深山,烈火焚烧若等闲
C.暖暖远人村,依依墟里烟 D.春蚕到死丝方尽,蜡炬成灰泪始干
12.铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO 2PbSO4+2H2O,下列说法错误的是( )
A.充电时,阴极反应式为:SO+4H++PbO2+2e﹣═PbSO4+2H2O
B.充电时,两个电极的质量均减轻
C.电池放电时,电解质溶液的pH增大
D.电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑
13.如图所示原电池装置中,溶液为稀硫酸,电子流向如图所示。下列说法正确的是
A.电极X为正极
B.X电极上发生氧化反应,Y电极上发生还原反应
C.氢气产生在X电极上,移向X电极
D.电子流动方向为:X电极→导线→Y电极→溶液→X电极
14.利用ZnFe2O4/(Fe3O4,Zn)两步热化学循环制氢气系统如图所示,下列说法不正确的是
A.图中能量转化方式只有1种
B.两步总反应为2H2O2=H2↑+O2↑
C.氢能是一种清洁、高效、安全、可持续的新能源
D.H2生成步骤反应为3Zn+2Fe3O4+4H2O=ZnFe2O4+4H2↑
15.锌—空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时,下列说法正确的是
A.Zn电极是该电池的正极
B.Zn电极的电极反应:Zn+H2O-2e =ZnO+2H+
C.OH 向石墨电极移动
D.标准状况下,当消耗11.2LO2时,电路中流过2mol电子
16.下列图示中铜电极的连接或铜电极电极类型的判断错误的是( )
A. B. C. D.
17.习近平总书记提出:“绿水青山就是金山银山”。现利用如图所示装置对工业废气、垃圾渗透液进行综合治理并实现发电。下列有关说法正确的是
A.M为正极 B.高温下有利于原电池工作
C.NO在N极上失去电子 D.放电过程中,H+由M极区向N极区移动
18.我国规定含碘盐中添加来补充碘元素,工业上可采用电解法制备。某小组以石墨、铜为电极,电解溶液制备,装置如图所示。下列说法正确的是
A.为石墨,为铜
B.被反应式为
C.电子由极经电解质溶液流向极
D.电解过程中,两个电极的质量均不变
19.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。下列叙述错误的是
A.正极电极反应式:O2+2H2O+4e— = 4OH—
B.电池工作时,电解质溶液的pH增大
C.负极电极反应式 :CH3OH+8OH——6e— = CO32—+6H2O
D.当外电路通过1.2mol电子时,理论上消耗甲醇6.4g
20.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
A.上述燃料电池的负极反应物是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-=2CO2↑+3H2O
D.以KOH溶液作电解质溶液,甲烷燃料电池的正极反应O2+2H2O+4e-=4OH-
21.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.放电时正极反应为FeO+4H2O+3e-=Fe(OH)3+5OH-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
22.已知:H2(g) + Br2(g) = 2HBr(g) ΔH= —72 kJ/mol,1mol Br2(g)液化放出的能量为30 kJ,其它相关数据如下表:则上述表格中的a值为
一定状态的分子 H2(g) Br2(l) HBr(g)
1 mol该分子中的化学键断裂吸收的能量/kJ 436 a 369
A.404 B.344 C.260 D.200
23.一种HCOONa-O2、H2O化学电池工作原理如图所示:
下列说法正确的是
A.电极M为正极,发生氧化反应
B.M电极反应式为HCOO-+3OH--2e- = CO+2H2O
C.电子由电极M经电解质(CEM)流向电极N
D.N电极每生成1molNaOH,理论上电路中有4mol电子转移
24.从古至今化学与生产、生活密切相关。下列说法不正确的是
A.“纷纷灿烂如星陨,赫赫喧虺似火攻”,红色的烟花与铝在空气中燃烧的现象有关。
B.“人间四月芳菲尽,山寺桃花始盛开”,体现了温度对酶活性的影响。
C.“阳春布德泽,万物生光辉”,包含太阳能转化为化学能的过程。
D.“雷蟠电掣云滔滔,夜半载雨输亭皋”,蕴藏着雷雨天自然界氮的固定。
25.我国某科研机构研究表明,利用K2Cr2O7可实现含苯酚废水的有效处理,其工作原理如图所示。下列说法错误的是
A.该电池不可以在高温下使用
B.Na+通过阳离子交换膜移向M电极,Cl-通过阴离子交换膜移向N电极
C.一段时间后,中间室中NaCl溶液的浓度减小
D.M的电极反应式为C6H5OH-28e-+11H2O=6CO2↑+28H+
二、填空题
26.如图所示的烧杯中盛放的都是稀硫酸
(1)其中能形成原电池的是: ;
(2)该原电池的正极是: ;正极反应式: ;负极是: ;负极反应式: 。
27.下列变化属于①放热反应 ②吸热反应
A:分解反应 B:化合反应C:置换反应
(1)氯酸钾分解制氧气,既是 (填①或②)又是 。(填A或B或C,下同)
(2)生石灰跟水反应生成熟石灰,既是 又是 。
(3)锌粒与稀硫酸的反应,既是 又是 。
28.回答下列问题:
(1)新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子(O2-)在其间通过。如图所示,其中多孔电极不参与电极反应。写出该反应的负极电极反应式: ,当有16 g甲醇发生反应时,则理论上提供的电量表达式为 (1个电子的电量为1.6×10-19C)。
(2)一氧化氮—空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式: ,若过程中产生2 mol HNO3,则消耗标准状况下O2的体积为 L。
(3)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。负极电极反应式: 。
(4)以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2SO4作电解质溶液,写出该电池正极电极反应式: ,已知该电池的能量转换效率为86.4%,1mol甲烷燃烧释放的热量为890.3 kJ,则该电池的比能量为 kW·h·kg-1[结果保留1位小数,比能量= ,1 kW·h=3. 6×106 J]。
试卷第1页,共3页
参考答案:
1.C
【分析】原电池的形成条件为两个活动性不同的电极放入到电解质溶液中形成闭合回路,并能够发生自发的氧化还原反应。
【详解】A.未形成闭合回路,不能形成原电池,A错误;
B.两个电极活动性相同,不能产生电势差,不能形成原电池,B错误;
C.Zn和Cu为活动性不同的电极,番茄汁有自由移动的氢离子,Zn与番茄汁能够发生自发的氧化还原反应,且能够形成闭合回路,可以形成原电池,C正确;
D.酒精不是电解质溶液,不能导电,D错误;
故选C。
2.B
【详解】A.依据图象分析,等质量的白磷与红磷充分燃烧,白磷放出的热量多,故A错误;
B.白磷能量高于红磷,物质具有的能量越低越稳定,红磷比白磷稳定故B正确;
C.白磷能量高于红磷,白磷转化为红磷是放热反应,故C错误;
D.白磷能量高于红磷,物质具有的能量越低越稳定,白磷比红磷活泼,更容易与氧气反应生成P4O10,故D错误;
答案选B。
【点睛】本题主要考查物质所具有的能量与物质的稳定性、反应的的热效应之间的关系。
3.C
【详解】A. 负极发生氧化反应,A错误;
B. 电子通过导线由锌片流向铜片,B错误;
C. 正极上有氢气逸出,因为氢离子在正极电极被还原,反应式为:2H++2e-=H2↑,C正确;
D. SO离子移向负极,负极附近的SO离子浓度逐渐增大,D错误;
答案选C。
4.C
【详解】A.图a所示反应物的能量高于生成物,所以为放热反应,故A错误;
B.图b所示反应物的能量低于生成物,则反应物更稳定,故B错误;
C.图b所示反应物的能量低于生成物,为吸热反应,氯化铵固体和氢氧化钡晶体的反应为吸热反应,故C正确;
D.图a所示反应为放热反应,高温煅烧石灰石的反应为吸热反应,故D错误;
故选C。
5.D
【详解】A.通入氧气的一极为正极,发生还原反应,错误,不选A;
B.通入氢气的一极为负极,错误,不选B;
C.总反应为氢气和氧气反应生成水,但不是在点燃条件下,错误,不选C;
D.氧气得到电子结合质子即氢离子生成水,正确,选D。
6.B
【详解】A.一水合氨电离出铵根离子和氢氧根离子,存在电离平衡,NaOH溶于水电离出氢氧根离子,促进平衡逆向移动,同时NaOH溶于水放出热量,相当于加热,所以促进氨气逸出,故A正确;
B.锌与稀硫酸反应,加入少量硫酸铜反应速率加快,形成了原电池,不属于可逆反应,故B错误;
C.氯水中存在化学平衡,光照使氯水中的次氯酸分解,次氯酸浓度减小,使得平衡向右移动,氢离子浓度变大,溶液的pH值减小,能用勒夏特列原理解释,故C正确;
D.存在平衡,正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成,能用勒夏特利原理解释,故D正确。
答案:B。
【点睛】根据勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动。使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。
7.D
【分析】该装置是原电池,锌作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流的方向与电子方向相反,以此解答。
【详解】A.锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,电解质溶液中阳离子向正极移动,故A错误;
B.若电解质Y是硫酸锌溶液,Zn和Cu不能和硫酸锌发生氧化还原反应,不可能构成原电池,电解质Y应该是稀硫酸等,故B错误;
C.锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,电流由铜片流到锌片,电子不能在电解质溶液中移动,故C错误;
D.若电解质Y是硫酸铜溶液,该装置是原电池,锌作负极,铜作正极,正极上得电子发生还原反应,电极方程式为:Cu2++2e-=Cu,故D正确;
故选D。
8.A
【详解】①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量,有利于改善大气环境,故①正确;
②太阳能、生物质能、风能、氢能都属于可再生能源,故②正确;
③氢能是清洁能源,电解水法制氢气不符合节能减排理念,要消耗大量电能,成本太高,故③错误;
④用过量的空气与煤燃烧,过多的空气会带走能量,降低反应温度,降低煤燃烧时产生能量的利用率,④错误;
①②正确,故选A。
【点睛】空气过多,多余的空气会带走热量,燃烧程度减小,通入的空气要适当过量,而不是越多越好是解答关键,也是易错点。
9.D
【详解】A.工业废液排入海洋中会污染海洋,会危害渔业资源,人如果食用了被污染的鱼,对人体也会产生危害,A项不合理;
B. 将燃煤粉碎并鼓入尽可能多的空气,并不能减少SO2的排放,不能减少空气污染,B项不合理;
C. 植树不能从源头上杜绝污染物的排放,不是绿色化学的核心体现,C项不合理;
D. pH值增加,雨水酸性减弱,说明酸雨情况有所改善,D项合理;
答案选D。
10.D
【详解】A.浓硫酸溶于水放出热量,不属于化学变化,故A错误;
B.盐酸与碳酸氢钠反应时,反应体系温度降低,是吸热反应,故B错误;
C.吸热反应不一定需要加热,如氢氧化钡晶体和氯化铵的反应吸收热量,常温就可以发生,故C错误;
D.植物的光合作用把CO2、H2O等物质转化为有机物,将光能转变为化学能,故D正确;
故选:D。
11.B
【详解】A、野火烧不尽,春风吹又生,涉及物质的燃烧,为放热反应,故A错误;
B、千锤万凿出深山,烈火焚烧若等闲,涉及碳酸钙的分解,为吸热反应,故B正确;
C、暖暖远人村,依依墟里烟,涉及物质的燃烧,为放热反应,故C错误;
D.春蚕到死丝方尽,蜡炬成灰泪始干,涉及物质的燃烧,为放热反应,故D错误;
故选B。
12.A
【详解】A.充电时,阴极电极反应式与原电池负极反应式相反,所以阴极反应式为PbSO4 +2e-=Pb+SO42-,故A错误;
B.充电时,阴极电极反应式与原电池负极反应式相反,所以阴极反应式为PbSO4 +2e-=Pb+SO42-,阳极电极反应式与原电池正极反应式相反,所以阳极反应式为PbSO4+2H2O-2e﹣═ SO+4H++PbO2,电极质量均减轻,故B正确;
C.放电时,负极上Pb失电子发生氧化反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上二氧化铅得电子发生还原反应,电极反应式为SO+4H++PbO2+2e﹣═PbSO4+2H2O,氢离子浓度减小了,所以电解质溶液的pH增大,故C正确;
D.铅和稀硫酸能发生反应,负极可能会发生副反应: Pb+ H2SO4=PbSO4+H2↑,故D正确;
故答案:A。
13.B
【分析】原电池中电子由负极流出,则X为负极、Y为正极。
【详解】A.由分析可知,电极X为负极,A错误;
B.由分析可知,X为负极、Y为正极,故X电极上发生氧化反应,Y电极上发生还原反应,B正确;
C.氢得到电子发生还原反应,则氢气产生在Y电极上;阴离子向负极迁移,则移向X电极,C错误;
D.电子不能进入电解质溶液中,D错误;
故选B。
14.A
【详解】A.利用ZnFe2O4/(Fe3O4,Zn)两步热化学循环制氢气和氧气,能量转化形式有两种,制氧气过程太阳能转化为化学能,制氢气过程热能转化为化学能,选项A错误;
B.ZnFe2O4/(Fe3O4,Zn)可以看成催化剂,总反应是水分解反应,选项B正确;
C.氢气燃烧热量高、无污染、可再生,选项C正确;
D.氢气是由Fe3O4、Zn还原水制得,配平方程式可得3Zn+2Fe3O4+4H2O=ZnFe2O4+4H2↑,选项D正确;
答案选A。
15.D
【详解】A.氧气得电子发生还原反应,石墨电极是正极,锌是负极,故A错误;
B.锌作负极,碱性条件下,负极上电极反应式为:Zn+2OH--2e-═ZnO+H2O,故B错误;
C.原电池工作时,溶液中的阴离子向负极移动,即OH-向Zn极移动,故C错误;
D.正极反应为O2+4e-+2H2O═4OH-,所以标准状况下,当消耗11.2LO2时,电路中流过2mol电子,故D正确;
故选D。
【点睛】本题考查了原电池原理,会根据电池反应式中元素化合价变化来确定正负极上发生的电极反应,注意电极反应式的书写与电解质溶液的酸碱性有关。
16.C
【详解】A.锌比铜的活泼性强,铜为原电池的正极,故A正确;
B.电解精炼铜时,粗铜作阳极,铜离子在阴极上析出,故B正确;
C.电镀池中,镀件应作阴极,镀层金属作阳极,故C错误;
D.电解食盐水时,若用铜作电极,铜只能作阴极,故D正确;
答案选C。
【点睛】电解精炼铜时,粗铜做阳极,精铜做阴极;电镀时,镀层金属做阳极,镀件金属做阴极。
17.D
【详解】NH3在M极上失电子生成N2,故M极为负极,硝酸根在N极上的电子生成N2,故N极为原电池的正极,原电池中阳离子向正极移动,故H+由M极区向N极区移动。
A.根据分析两电极的物质转化,可判断电极M为负极,电极N为正极,故A错误;
B.该治理过程有硝化细菌的参与,不能在高温下进行,故B错误;
C.NO在N极上得电子,故C错误;
D.放电过程中,H+由M极区向N极区移动,故D正确;
故答案为D。
18.D
【详解】A.如果阳极是铜,则发生Cu-2e-=Cu2+,而不是碘离子转化为碘酸根离子,故阳极是石墨,阴极是铜,故A错误;
B.Y极为铜,为阴极,发生氧化反应:,故B错误;
C.电子从阳极流入阴极,所以由Y→X,故C错误;
D.在电解过程中,石墨与铜均不反应,故质量不变,故D正确;
故选D。
19.B
【分析】燃料电池中,负极为燃料失电子发生氧化反应,正极上发生的反应是氧气得电子的还原反应,据此分析解答。
【详解】A.正极上发生的反应是氧气得电子的还原反应,在碱性环境下的电极反应为:O2+4e-+2H2O═4OH-,故A正确;
B.电池反应为2CH3OH+3O2+4OH-=2CO32-+6H2O,所以使用过程中,电解质溶液的碱性减弱,pH降低,故B错误;
C.燃料电池中,负极为燃料失电子发生氧化反应,电极反应式为CH3OH+8OH--6e-═CO32-+6H2O,故C正确;
D.根据CH3OH+8OH--6e-═CO32-+6H2O,则当外电路通过1.2mole-时,消耗甲醇0.2mol,质量为0.2mol×32g/mol= 6.4g,故D正确;
故选B。
【点睛】正确书写电极反应式是解答本题的关键。本题的易错点为D,要注意结合电极反应式或总方程式,根据氧化还原反应的规律计算。
20.C
【详解】A.燃料电池中,燃料做负极,负极反应物可以是氢气、甲烷、乙醇等物质,A正确;
B、航天飞行器中氢氧燃料电池的总反应为O2+2H2=2H2O,反应产物是水,经过处理之后可供宇航员使用,B正确;
C、乙醇燃料电池的电解质用KOH时,生成的二氧化碳会和其反应生成碳酸盐,负极发生反应C2H5OH-12e-+16OH-=2+11H2O,C错误;
D、燃料电池中正极上氧气得电子,碱性环境下,正极上电极反应式为:O2+2H2O+4e-=4OH-,D正确;
故答案为:C。
21.C
【详解】A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2,A正确;
B.放电时正极反应为+4H2O+3e-=Fe(OH)3+5OH-,B正确;
C.放电时,K2FeO4作氧化剂,每转移3mol电子,正极有1mol K2FeO4被还原,C错误;
D.放电时,正极附近生成OH-,则正极附近溶液的碱性增强,D正确;
故选C。
22.C
【详解】H2(g) + Br2(g) → 2HBr(g) ΔH=-72 kJ/mol,1mol Br2(g)液化放出的能量为30 kJ,则H2(g) + Br2(g) → 2HBr(g) ΔH=-42 kJ/mol,由于反应热就是断裂化学键吸收的热量与形成化学键释放的热量的差,所以Br-Br的键能是436+a-369×2=-42 kJ,解得a=+260KJ/mol,故选项是C。
23.B
【详解】A.根据图中信息,钠离子向右移动,根据“同性相吸”,因此N极为正极,电极M为负极,发生氧化反应,故A错误;
B.根据图中信息,M电极发生氧化反应,生成碳酸根,因此M电极反应式为HCOO-+3OH--2e-=CO+2H2O,故B正确;
C.电子由负极(M)经导线流向正极(N),不能通过电解质,故C错误;
D.根据O2+4e-+2H2O=4OH-,因此N电极每生成1mol NaOH,理论上电路中有1 mol电子转移,故D错误。
综上所述,答案为B。
24.A
【详解】A.节日燃放的灿烂的烟花,是因某些金属元素(如锶、钡等)的焰色反应所呈现的各种艳丽色彩,红色的烟花与锂,锶的焰色反应有关,焰色反应是物理变化,它并未生成新物质,与铝在空气中燃烧的现象无关,故A错误;
B.“人间四月芳菲尽,山寺桃花始盛开”,描述的是环境温度对植物影响的自然现象,主要体现了温度对酶活性的影响,故B正确;
C.“阳春布德泽,万物生光辉”,指的是光合作用,在光照的条件下,二氧化碳的水生成葡萄糖和氧气,描述的是包含太阳能转化为化学能的过程,故C正确;
D.“雷蟠电掣云滔滔,夜半载雨输亭皋”,描述的是雷雨天发生的自然现象,雷雨天大气中氮气与氧气反应生成一氧化氮,氮由游离态转化为化合态,实现了氮的固定,故D正确;
答案选A。
【点睛】焰色反应是物理变化,是有些具体的金属元素特有的性质,铝等金属的焰色反应颜色不在可见光范围内,更不是铝的燃烧现象。
25.B
【分析】M极苯酚发生氧化反应转化为CO2,电极反应式为C6H5OH-28e-+11H2O=6CO2↑+28H+,M极为负极,负极附近阳离子增多;N极Cr2O转化为Cr(OH)3,发生还原反应,电极反应式为Cr2O+6e-+7H2O=2Cr(OH)3+8OH-,N极为正极,正极附近阴离子增多。
【详解】A.该电池用微生物进行发酵反应,微生物的主要成分是蛋白质,高温会失去活性,因此该电池不可以在高温下使用,故A正确;
B.根据图示可知M电极的苯酚转化为CO2为氧化反应,M极为负极,附近溶液中阳离子浓度增大,N极为正极,附近溶液中阴离子浓度增大,由于NaCl溶液被阳离子交换膜和阴离子交换膜隔离,Na+不能移向N极,Cl-不能移向M极,电池工作时,负极生成的H+透过阳离子交换膜进入NaCl溶液,正极生成的OH-透过阴离子交换膜进入NaCl溶液,故B错误;
C.负极生成的H+透过阳离子交换膜进入NaCl溶液,正极生成的OH-透过阴离子交换膜进入NaCl溶液,与H+反应生产水,使NaCl溶液浓度减小,故C正确;
D.在M极上苯酚发生氧化反应,做原电池的负极,电极反应式为C6H5OH-28e-+11H2O=6CO2↑+28H+,故D正确。
故答案为B。
26. A Cu 2H++2e-=H2↑ Zn Zn-2e-=Zn2+
【分析】原电池的构成条件:①一般为活泼性不同的两个电极;②形成闭合回路;③能够发生自发的氧化还原反应,据此分析解答。
【详解】(1)A.符合原电池的构成条件,A正确;
B.不能发生自发的氧化还原反应,不能构成原电池,B错误;
C.不能发生自发的氧化还原反应,不能构成原电池,C错误;
D.没有形成闭合回路,D错误;
故答案为:A;
(2)该原电池中,Zn的活泼性大于Cu,故Zn作负极,Zn失去电子变为Zn2+,发生氧化反应,电极反应式为Zn-2e-=Zn2+,Cu作正极,H+得到电子变为H2,发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:Cu;2H++2e-=H2↑;Zn;Zn-2e-=Zn2+。
27. ② A ① B ① C
【分析】根据反应过程中能量变化判断反应的热效应;根据反应物、生成物种类的多少及反应物与生成物所述类别判断反应的基本类型,据此解答。
【详解】(1)氯酸钾在MnO2作催化剂,在加热条件下分解产生氯化钾和氧气,反应方程式为:2KClO32KCl+3O2↑,反应过程中吸收热量,因此属于吸热反应,用序号②表示;由于反应物只有一种,生成物是两种,因此反应的基本类型为分解反应,用序号A表示;
(2)生石灰与水反应生成熟石灰,反应方程式为CaO+H2O=Ca(OH)2,发生反应放出热量,使溶液温度升高,因此属于放热反应,用序号①表示;由于反应物是两种,生成物只有一种,因此反应的基本类型为化合反应,用序号B表示;
(3)锌粒与稀硫酸反应产生硫酸锌和氢气,反应方程式为:Zn+H2SO4=ZnSO4+H2↑,该反应发生放出热量,使溶液温度升高,因此反应属于放热反应,用序号①表示;该反应从物质方面分析,是由单质与化合物反应产生新的单质和新的化合物,因此反应的基本类型是置换反应,用序号C表示。
【点睛】本题从物质变化角度和能量变化角度对常见化学反应进行了分类。物质发生化学反应,既有物质变化,也有能量变化,分类标准不同,反应所属类别不同,了解分类标准,掌握化学反应基本特点是正确判断的基础。
28.(1) CH3OH-6e-+3O2-=CO2+2H2O 2.89×105C
(2) NO-3e-+2H2O=+4H+ 33.6
(3)LixC6 - xe- = xLi+ + C6
(4) O2+4e-+4H+=2H2O 13.4
【详解】(1)原电池中负极发生氧化反应,由图知,燃料电池中的燃料为甲醇,在负极上反应失去电子转化为水和二氧化碳,由题知反应离子为氧离子,因此可写出负极反应式为CH3OH-6e-+3O2-=CO2+2H2O;
16g甲醇物质的量为32g/ mol1,由负极反应式可知,1mol甲醇反应时,转移6mol电子,1个电子的电量为1.60-19C,则所求电量表达式为66.021023mol-11.60-19C =2.89×105C;
(2)由原电池的工作原理图示可知,左端的铂电极为负极,其电极反应式为NO-3e-+2H2O=+4H+,当过程中产生2molHNO3时转移6mole-,而1molO2参与反应转移4mol e- ,故需要 1.5 mol O2参与反应,标准状况下的体积为33.6 L;
(3)放电时,负极上LixC6失电子产生Li+,电极反应式为LixC6 - xe- = xLi+ + C6;
(4)甲烷燃料电池中,氧气在正极被还原,电解质为硫酸,正极反应式为O2+4e-+4H+=2H2O;
该电池的能量转换效率为86.4%,甲烷的燃烧热为- 890.3kJ/mol,1mol甲烷燃烧输出的电能约为=0.214kW·h,比能量= =13.4kW·h·kg-1
一、单选题
1.下列装置中,能构成原电池的是
A. B.
C. D.
2.下图表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
A.等质量的白磷与红磷充分燃烧,红磷放出的热量多
B.红磷比白磷稳定
C.白磷转化为红磷是吸热反应
D.红磷比白磷更容易与氧气反应生成P4O10
3.在盛有稀硫酸的烧杯中,放入用导线连接的铜片和锌片,下列说法正确的是( )
A.负极发生还原反应
B.电子通过导线由铜片流向锌片
C.正极上有氢气逸出,正极电极反应式为:2H++2e-=H2↑
D.负极附近的SO离子浓度逐渐减小
4.如图所示,有关化学反应和能量变化的说法正确的是
A.图a表示的是吸热反应的能量变化
B.图b中生成物比反应物稳定
C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D.图a可以表示高温煅烧石灰石反应的能量变化
5.为体现“城市让生活更美好”的主题,上海市政府承诺世博园区内交通“零排放”、园区周边交通“低排放”。2010年4月15日新能源车交车仪式在世博园举行,该车装着“绿色心脏”——质子交换膜燃料电池,其工作原理如图所示,下列叙述正确的是( )
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H22H2O
D.正极的电极反应式为O2+4H++4e-===2H2O
6.下列反应不能用勒夏特列原理解释的是
A.可用浓氨水和氢氧化钠固体快速制取氨气
B.锌与稀硫酸反应,加入少量硫酸铜反应速率加快
C.光照新制的氯水时,溶液的pH逐渐减小
D.增大压强,有利于和反应生成
7.关于锌铜原电池,下列说法正确的是
A.电解质溶液中阳离子向Zn极移动
B.电解质Y是硫酸锌溶液
C.电子从Zn电极→外电路流→Cu电极→电解质溶液→Zn电极
D.若电解质Y是硫酸铜溶液,正极上的电极反应式为:Cu2++2e-=Cu
8.2019年4月28日晚,中国北京世界园艺博览会以“绿色生活、美丽家园”为主题正式拉开序幕,中国植被增加量占全球植被总增量25%以上。保护环境、减少污染、节能减排成为社会发展过程中不可回避的课题。下列有关说法正确的是
①推广乙醇汽油可以减少环境污染
②太阳能、生物质能、风能、氢能,均可再生
③工业上利用电解水获得大量清洁能源——氢能源
④用过量的空气与煤燃烧,可以提高煤燃烧时产生能量的利用率
A.①② B.②③ C.③④ D.①④
9.习近平总书记指出“绿水青山就是金山银山”。下列观点合理的是( )
A.将工业废液排入海洋以减少河道污染
B.为了减少火电厂产生的大气污染,应将燃煤粉碎并鼓入尽可能多的空气
C.习总书记2018年4月2日参加北京植树节体现了绿色化学的思想
D.与2017年相比2018年某地区降水pH平均值增加了0.27,说明酸雨情况有所改善
10.以下关于能量变化的说法正确的是
A.凡是能量变化一定发生在化学变化中
B.盐酸与碳酸氢钠的反应为放热反应
C.吸热反应都需要加热
D.植物的光合作用是将光能转变为化学能
11.下列诗句中能体现吸热反应的是( )
A.野火烧不尽,春风吹又生 B.千锤万凿出深山,烈火焚烧若等闲
C.暖暖远人村,依依墟里烟 D.春蚕到死丝方尽,蜡炬成灰泪始干
12.铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO 2PbSO4+2H2O,下列说法错误的是( )
A.充电时,阴极反应式为:SO+4H++PbO2+2e﹣═PbSO4+2H2O
B.充电时,两个电极的质量均减轻
C.电池放电时,电解质溶液的pH增大
D.电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑
13.如图所示原电池装置中,溶液为稀硫酸,电子流向如图所示。下列说法正确的是
A.电极X为正极
B.X电极上发生氧化反应,Y电极上发生还原反应
C.氢气产生在X电极上,移向X电极
D.电子流动方向为:X电极→导线→Y电极→溶液→X电极
14.利用ZnFe2O4/(Fe3O4,Zn)两步热化学循环制氢气系统如图所示,下列说法不正确的是
A.图中能量转化方式只有1种
B.两步总反应为2H2O2=H2↑+O2↑
C.氢能是一种清洁、高效、安全、可持续的新能源
D.H2生成步骤反应为3Zn+2Fe3O4+4H2O=ZnFe2O4+4H2↑
15.锌—空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时,下列说法正确的是
A.Zn电极是该电池的正极
B.Zn电极的电极反应:Zn+H2O-2e =ZnO+2H+
C.OH 向石墨电极移动
D.标准状况下,当消耗11.2LO2时,电路中流过2mol电子
16.下列图示中铜电极的连接或铜电极电极类型的判断错误的是( )
A. B. C. D.
17.习近平总书记提出:“绿水青山就是金山银山”。现利用如图所示装置对工业废气、垃圾渗透液进行综合治理并实现发电。下列有关说法正确的是
A.M为正极 B.高温下有利于原电池工作
C.NO在N极上失去电子 D.放电过程中,H+由M极区向N极区移动
18.我国规定含碘盐中添加来补充碘元素,工业上可采用电解法制备。某小组以石墨、铜为电极,电解溶液制备,装置如图所示。下列说法正确的是
A.为石墨,为铜
B.被反应式为
C.电子由极经电解质溶液流向极
D.电解过程中,两个电极的质量均不变
19.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。下列叙述错误的是
A.正极电极反应式:O2+2H2O+4e— = 4OH—
B.电池工作时,电解质溶液的pH增大
C.负极电极反应式 :CH3OH+8OH——6e— = CO32—+6H2O
D.当外电路通过1.2mol电子时,理论上消耗甲醇6.4g
20.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
A.上述燃料电池的负极反应物是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-=2CO2↑+3H2O
D.以KOH溶液作电解质溶液,甲烷燃料电池的正极反应O2+2H2O+4e-=4OH-
21.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.放电时正极反应为FeO+4H2O+3e-=Fe(OH)3+5OH-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
22.已知:H2(g) + Br2(g) = 2HBr(g) ΔH= —72 kJ/mol,1mol Br2(g)液化放出的能量为30 kJ,其它相关数据如下表:则上述表格中的a值为
一定状态的分子 H2(g) Br2(l) HBr(g)
1 mol该分子中的化学键断裂吸收的能量/kJ 436 a 369
A.404 B.344 C.260 D.200
23.一种HCOONa-O2、H2O化学电池工作原理如图所示:
下列说法正确的是
A.电极M为正极,发生氧化反应
B.M电极反应式为HCOO-+3OH--2e- = CO+2H2O
C.电子由电极M经电解质(CEM)流向电极N
D.N电极每生成1molNaOH,理论上电路中有4mol电子转移
24.从古至今化学与生产、生活密切相关。下列说法不正确的是
A.“纷纷灿烂如星陨,赫赫喧虺似火攻”,红色的烟花与铝在空气中燃烧的现象有关。
B.“人间四月芳菲尽,山寺桃花始盛开”,体现了温度对酶活性的影响。
C.“阳春布德泽,万物生光辉”,包含太阳能转化为化学能的过程。
D.“雷蟠电掣云滔滔,夜半载雨输亭皋”,蕴藏着雷雨天自然界氮的固定。
25.我国某科研机构研究表明,利用K2Cr2O7可实现含苯酚废水的有效处理,其工作原理如图所示。下列说法错误的是
A.该电池不可以在高温下使用
B.Na+通过阳离子交换膜移向M电极,Cl-通过阴离子交换膜移向N电极
C.一段时间后,中间室中NaCl溶液的浓度减小
D.M的电极反应式为C6H5OH-28e-+11H2O=6CO2↑+28H+
二、填空题
26.如图所示的烧杯中盛放的都是稀硫酸
(1)其中能形成原电池的是: ;
(2)该原电池的正极是: ;正极反应式: ;负极是: ;负极反应式: 。
27.下列变化属于①放热反应 ②吸热反应
A:分解反应 B:化合反应C:置换反应
(1)氯酸钾分解制氧气,既是 (填①或②)又是 。(填A或B或C,下同)
(2)生石灰跟水反应生成熟石灰,既是 又是 。
(3)锌粒与稀硫酸的反应,既是 又是 。
28.回答下列问题:
(1)新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子(O2-)在其间通过。如图所示,其中多孔电极不参与电极反应。写出该反应的负极电极反应式: ,当有16 g甲醇发生反应时,则理论上提供的电量表达式为 (1个电子的电量为1.6×10-19C)。
(2)一氧化氮—空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式: ,若过程中产生2 mol HNO3,则消耗标准状况下O2的体积为 L。
(3)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。负极电极反应式: 。
(4)以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2SO4作电解质溶液,写出该电池正极电极反应式: ,已知该电池的能量转换效率为86.4%,1mol甲烷燃烧释放的热量为890.3 kJ,则该电池的比能量为 kW·h·kg-1[结果保留1位小数,比能量= ,1 kW·h=3. 6×106 J]。
试卷第1页,共3页
参考答案:
1.C
【分析】原电池的形成条件为两个活动性不同的电极放入到电解质溶液中形成闭合回路,并能够发生自发的氧化还原反应。
【详解】A.未形成闭合回路,不能形成原电池,A错误;
B.两个电极活动性相同,不能产生电势差,不能形成原电池,B错误;
C.Zn和Cu为活动性不同的电极,番茄汁有自由移动的氢离子,Zn与番茄汁能够发生自发的氧化还原反应,且能够形成闭合回路,可以形成原电池,C正确;
D.酒精不是电解质溶液,不能导电,D错误;
故选C。
2.B
【详解】A.依据图象分析,等质量的白磷与红磷充分燃烧,白磷放出的热量多,故A错误;
B.白磷能量高于红磷,物质具有的能量越低越稳定,红磷比白磷稳定故B正确;
C.白磷能量高于红磷,白磷转化为红磷是放热反应,故C错误;
D.白磷能量高于红磷,物质具有的能量越低越稳定,白磷比红磷活泼,更容易与氧气反应生成P4O10,故D错误;
答案选B。
【点睛】本题主要考查物质所具有的能量与物质的稳定性、反应的的热效应之间的关系。
3.C
【详解】A. 负极发生氧化反应,A错误;
B. 电子通过导线由锌片流向铜片,B错误;
C. 正极上有氢气逸出,因为氢离子在正极电极被还原,反应式为:2H++2e-=H2↑,C正确;
D. SO离子移向负极,负极附近的SO离子浓度逐渐增大,D错误;
答案选C。
4.C
【详解】A.图a所示反应物的能量高于生成物,所以为放热反应,故A错误;
B.图b所示反应物的能量低于生成物,则反应物更稳定,故B错误;
C.图b所示反应物的能量低于生成物,为吸热反应,氯化铵固体和氢氧化钡晶体的反应为吸热反应,故C正确;
D.图a所示反应为放热反应,高温煅烧石灰石的反应为吸热反应,故D错误;
故选C。
5.D
【详解】A.通入氧气的一极为正极,发生还原反应,错误,不选A;
B.通入氢气的一极为负极,错误,不选B;
C.总反应为氢气和氧气反应生成水,但不是在点燃条件下,错误,不选C;
D.氧气得到电子结合质子即氢离子生成水,正确,选D。
6.B
【详解】A.一水合氨电离出铵根离子和氢氧根离子,存在电离平衡,NaOH溶于水电离出氢氧根离子,促进平衡逆向移动,同时NaOH溶于水放出热量,相当于加热,所以促进氨气逸出,故A正确;
B.锌与稀硫酸反应,加入少量硫酸铜反应速率加快,形成了原电池,不属于可逆反应,故B错误;
C.氯水中存在化学平衡,光照使氯水中的次氯酸分解,次氯酸浓度减小,使得平衡向右移动,氢离子浓度变大,溶液的pH值减小,能用勒夏特列原理解释,故C正确;
D.存在平衡,正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成,能用勒夏特利原理解释,故D正确。
答案:B。
【点睛】根据勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动。使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。
7.D
【分析】该装置是原电池,锌作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流的方向与电子方向相反,以此解答。
【详解】A.锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,电解质溶液中阳离子向正极移动,故A错误;
B.若电解质Y是硫酸锌溶液,Zn和Cu不能和硫酸锌发生氧化还原反应,不可能构成原电池,电解质Y应该是稀硫酸等,故B错误;
C.锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,电流由铜片流到锌片,电子不能在电解质溶液中移动,故C错误;
D.若电解质Y是硫酸铜溶液,该装置是原电池,锌作负极,铜作正极,正极上得电子发生还原反应,电极方程式为:Cu2++2e-=Cu,故D正确;
故选D。
8.A
【详解】①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量,有利于改善大气环境,故①正确;
②太阳能、生物质能、风能、氢能都属于可再生能源,故②正确;
③氢能是清洁能源,电解水法制氢气不符合节能减排理念,要消耗大量电能,成本太高,故③错误;
④用过量的空气与煤燃烧,过多的空气会带走能量,降低反应温度,降低煤燃烧时产生能量的利用率,④错误;
①②正确,故选A。
【点睛】空气过多,多余的空气会带走热量,燃烧程度减小,通入的空气要适当过量,而不是越多越好是解答关键,也是易错点。
9.D
【详解】A.工业废液排入海洋中会污染海洋,会危害渔业资源,人如果食用了被污染的鱼,对人体也会产生危害,A项不合理;
B. 将燃煤粉碎并鼓入尽可能多的空气,并不能减少SO2的排放,不能减少空气污染,B项不合理;
C. 植树不能从源头上杜绝污染物的排放,不是绿色化学的核心体现,C项不合理;
D. pH值增加,雨水酸性减弱,说明酸雨情况有所改善,D项合理;
答案选D。
10.D
【详解】A.浓硫酸溶于水放出热量,不属于化学变化,故A错误;
B.盐酸与碳酸氢钠反应时,反应体系温度降低,是吸热反应,故B错误;
C.吸热反应不一定需要加热,如氢氧化钡晶体和氯化铵的反应吸收热量,常温就可以发生,故C错误;
D.植物的光合作用把CO2、H2O等物质转化为有机物,将光能转变为化学能,故D正确;
故选:D。
11.B
【详解】A、野火烧不尽,春风吹又生,涉及物质的燃烧,为放热反应,故A错误;
B、千锤万凿出深山,烈火焚烧若等闲,涉及碳酸钙的分解,为吸热反应,故B正确;
C、暖暖远人村,依依墟里烟,涉及物质的燃烧,为放热反应,故C错误;
D.春蚕到死丝方尽,蜡炬成灰泪始干,涉及物质的燃烧,为放热反应,故D错误;
故选B。
12.A
【详解】A.充电时,阴极电极反应式与原电池负极反应式相反,所以阴极反应式为PbSO4 +2e-=Pb+SO42-,故A错误;
B.充电时,阴极电极反应式与原电池负极反应式相反,所以阴极反应式为PbSO4 +2e-=Pb+SO42-,阳极电极反应式与原电池正极反应式相反,所以阳极反应式为PbSO4+2H2O-2e﹣═ SO+4H++PbO2,电极质量均减轻,故B正确;
C.放电时,负极上Pb失电子发生氧化反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上二氧化铅得电子发生还原反应,电极反应式为SO+4H++PbO2+2e﹣═PbSO4+2H2O,氢离子浓度减小了,所以电解质溶液的pH增大,故C正确;
D.铅和稀硫酸能发生反应,负极可能会发生副反应: Pb+ H2SO4=PbSO4+H2↑,故D正确;
故答案:A。
13.B
【分析】原电池中电子由负极流出,则X为负极、Y为正极。
【详解】A.由分析可知,电极X为负极,A错误;
B.由分析可知,X为负极、Y为正极,故X电极上发生氧化反应,Y电极上发生还原反应,B正确;
C.氢得到电子发生还原反应,则氢气产生在Y电极上;阴离子向负极迁移,则移向X电极,C错误;
D.电子不能进入电解质溶液中,D错误;
故选B。
14.A
【详解】A.利用ZnFe2O4/(Fe3O4,Zn)两步热化学循环制氢气和氧气,能量转化形式有两种,制氧气过程太阳能转化为化学能,制氢气过程热能转化为化学能,选项A错误;
B.ZnFe2O4/(Fe3O4,Zn)可以看成催化剂,总反应是水分解反应,选项B正确;
C.氢气燃烧热量高、无污染、可再生,选项C正确;
D.氢气是由Fe3O4、Zn还原水制得,配平方程式可得3Zn+2Fe3O4+4H2O=ZnFe2O4+4H2↑,选项D正确;
答案选A。
15.D
【详解】A.氧气得电子发生还原反应,石墨电极是正极,锌是负极,故A错误;
B.锌作负极,碱性条件下,负极上电极反应式为:Zn+2OH--2e-═ZnO+H2O,故B错误;
C.原电池工作时,溶液中的阴离子向负极移动,即OH-向Zn极移动,故C错误;
D.正极反应为O2+4e-+2H2O═4OH-,所以标准状况下,当消耗11.2LO2时,电路中流过2mol电子,故D正确;
故选D。
【点睛】本题考查了原电池原理,会根据电池反应式中元素化合价变化来确定正负极上发生的电极反应,注意电极反应式的书写与电解质溶液的酸碱性有关。
16.C
【详解】A.锌比铜的活泼性强,铜为原电池的正极,故A正确;
B.电解精炼铜时,粗铜作阳极,铜离子在阴极上析出,故B正确;
C.电镀池中,镀件应作阴极,镀层金属作阳极,故C错误;
D.电解食盐水时,若用铜作电极,铜只能作阴极,故D正确;
答案选C。
【点睛】电解精炼铜时,粗铜做阳极,精铜做阴极;电镀时,镀层金属做阳极,镀件金属做阴极。
17.D
【详解】NH3在M极上失电子生成N2,故M极为负极,硝酸根在N极上的电子生成N2,故N极为原电池的正极,原电池中阳离子向正极移动,故H+由M极区向N极区移动。
A.根据分析两电极的物质转化,可判断电极M为负极,电极N为正极,故A错误;
B.该治理过程有硝化细菌的参与,不能在高温下进行,故B错误;
C.NO在N极上得电子,故C错误;
D.放电过程中,H+由M极区向N极区移动,故D正确;
故答案为D。
18.D
【详解】A.如果阳极是铜,则发生Cu-2e-=Cu2+,而不是碘离子转化为碘酸根离子,故阳极是石墨,阴极是铜,故A错误;
B.Y极为铜,为阴极,发生氧化反应:,故B错误;
C.电子从阳极流入阴极,所以由Y→X,故C错误;
D.在电解过程中,石墨与铜均不反应,故质量不变,故D正确;
故选D。
19.B
【分析】燃料电池中,负极为燃料失电子发生氧化反应,正极上发生的反应是氧气得电子的还原反应,据此分析解答。
【详解】A.正极上发生的反应是氧气得电子的还原反应,在碱性环境下的电极反应为:O2+4e-+2H2O═4OH-,故A正确;
B.电池反应为2CH3OH+3O2+4OH-=2CO32-+6H2O,所以使用过程中,电解质溶液的碱性减弱,pH降低,故B错误;
C.燃料电池中,负极为燃料失电子发生氧化反应,电极反应式为CH3OH+8OH--6e-═CO32-+6H2O,故C正确;
D.根据CH3OH+8OH--6e-═CO32-+6H2O,则当外电路通过1.2mole-时,消耗甲醇0.2mol,质量为0.2mol×32g/mol= 6.4g,故D正确;
故选B。
【点睛】正确书写电极反应式是解答本题的关键。本题的易错点为D,要注意结合电极反应式或总方程式,根据氧化还原反应的规律计算。
20.C
【详解】A.燃料电池中,燃料做负极,负极反应物可以是氢气、甲烷、乙醇等物质,A正确;
B、航天飞行器中氢氧燃料电池的总反应为O2+2H2=2H2O,反应产物是水,经过处理之后可供宇航员使用,B正确;
C、乙醇燃料电池的电解质用KOH时,生成的二氧化碳会和其反应生成碳酸盐,负极发生反应C2H5OH-12e-+16OH-=2+11H2O,C错误;
D、燃料电池中正极上氧气得电子,碱性环境下,正极上电极反应式为:O2+2H2O+4e-=4OH-,D正确;
故答案为:C。
21.C
【详解】A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2,A正确;
B.放电时正极反应为+4H2O+3e-=Fe(OH)3+5OH-,B正确;
C.放电时,K2FeO4作氧化剂,每转移3mol电子,正极有1mol K2FeO4被还原,C错误;
D.放电时,正极附近生成OH-,则正极附近溶液的碱性增强,D正确;
故选C。
22.C
【详解】H2(g) + Br2(g) → 2HBr(g) ΔH=-72 kJ/mol,1mol Br2(g)液化放出的能量为30 kJ,则H2(g) + Br2(g) → 2HBr(g) ΔH=-42 kJ/mol,由于反应热就是断裂化学键吸收的热量与形成化学键释放的热量的差,所以Br-Br的键能是436+a-369×2=-42 kJ,解得a=+260KJ/mol,故选项是C。
23.B
【详解】A.根据图中信息,钠离子向右移动,根据“同性相吸”,因此N极为正极,电极M为负极,发生氧化反应,故A错误;
B.根据图中信息,M电极发生氧化反应,生成碳酸根,因此M电极反应式为HCOO-+3OH--2e-=CO+2H2O,故B正确;
C.电子由负极(M)经导线流向正极(N),不能通过电解质,故C错误;
D.根据O2+4e-+2H2O=4OH-,因此N电极每生成1mol NaOH,理论上电路中有1 mol电子转移,故D错误。
综上所述,答案为B。
24.A
【详解】A.节日燃放的灿烂的烟花,是因某些金属元素(如锶、钡等)的焰色反应所呈现的各种艳丽色彩,红色的烟花与锂,锶的焰色反应有关,焰色反应是物理变化,它并未生成新物质,与铝在空气中燃烧的现象无关,故A错误;
B.“人间四月芳菲尽,山寺桃花始盛开”,描述的是环境温度对植物影响的自然现象,主要体现了温度对酶活性的影响,故B正确;
C.“阳春布德泽,万物生光辉”,指的是光合作用,在光照的条件下,二氧化碳的水生成葡萄糖和氧气,描述的是包含太阳能转化为化学能的过程,故C正确;
D.“雷蟠电掣云滔滔,夜半载雨输亭皋”,描述的是雷雨天发生的自然现象,雷雨天大气中氮气与氧气反应生成一氧化氮,氮由游离态转化为化合态,实现了氮的固定,故D正确;
答案选A。
【点睛】焰色反应是物理变化,是有些具体的金属元素特有的性质,铝等金属的焰色反应颜色不在可见光范围内,更不是铝的燃烧现象。
25.B
【分析】M极苯酚发生氧化反应转化为CO2,电极反应式为C6H5OH-28e-+11H2O=6CO2↑+28H+,M极为负极,负极附近阳离子增多;N极Cr2O转化为Cr(OH)3,发生还原反应,电极反应式为Cr2O+6e-+7H2O=2Cr(OH)3+8OH-,N极为正极,正极附近阴离子增多。
【详解】A.该电池用微生物进行发酵反应,微生物的主要成分是蛋白质,高温会失去活性,因此该电池不可以在高温下使用,故A正确;
B.根据图示可知M电极的苯酚转化为CO2为氧化反应,M极为负极,附近溶液中阳离子浓度增大,N极为正极,附近溶液中阴离子浓度增大,由于NaCl溶液被阳离子交换膜和阴离子交换膜隔离,Na+不能移向N极,Cl-不能移向M极,电池工作时,负极生成的H+透过阳离子交换膜进入NaCl溶液,正极生成的OH-透过阴离子交换膜进入NaCl溶液,故B错误;
C.负极生成的H+透过阳离子交换膜进入NaCl溶液,正极生成的OH-透过阴离子交换膜进入NaCl溶液,与H+反应生产水,使NaCl溶液浓度减小,故C正确;
D.在M极上苯酚发生氧化反应,做原电池的负极,电极反应式为C6H5OH-28e-+11H2O=6CO2↑+28H+,故D正确。
故答案为B。
26. A Cu 2H++2e-=H2↑ Zn Zn-2e-=Zn2+
【分析】原电池的构成条件:①一般为活泼性不同的两个电极;②形成闭合回路;③能够发生自发的氧化还原反应,据此分析解答。
【详解】(1)A.符合原电池的构成条件,A正确;
B.不能发生自发的氧化还原反应,不能构成原电池,B错误;
C.不能发生自发的氧化还原反应,不能构成原电池,C错误;
D.没有形成闭合回路,D错误;
故答案为:A;
(2)该原电池中,Zn的活泼性大于Cu,故Zn作负极,Zn失去电子变为Zn2+,发生氧化反应,电极反应式为Zn-2e-=Zn2+,Cu作正极,H+得到电子变为H2,发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:Cu;2H++2e-=H2↑;Zn;Zn-2e-=Zn2+。
27. ② A ① B ① C
【分析】根据反应过程中能量变化判断反应的热效应;根据反应物、生成物种类的多少及反应物与生成物所述类别判断反应的基本类型,据此解答。
【详解】(1)氯酸钾在MnO2作催化剂,在加热条件下分解产生氯化钾和氧气,反应方程式为:2KClO32KCl+3O2↑,反应过程中吸收热量,因此属于吸热反应,用序号②表示;由于反应物只有一种,生成物是两种,因此反应的基本类型为分解反应,用序号A表示;
(2)生石灰与水反应生成熟石灰,反应方程式为CaO+H2O=Ca(OH)2,发生反应放出热量,使溶液温度升高,因此属于放热反应,用序号①表示;由于反应物是两种,生成物只有一种,因此反应的基本类型为化合反应,用序号B表示;
(3)锌粒与稀硫酸反应产生硫酸锌和氢气,反应方程式为:Zn+H2SO4=ZnSO4+H2↑,该反应发生放出热量,使溶液温度升高,因此反应属于放热反应,用序号①表示;该反应从物质方面分析,是由单质与化合物反应产生新的单质和新的化合物,因此反应的基本类型是置换反应,用序号C表示。
【点睛】本题从物质变化角度和能量变化角度对常见化学反应进行了分类。物质发生化学反应,既有物质变化,也有能量变化,分类标准不同,反应所属类别不同,了解分类标准,掌握化学反应基本特点是正确判断的基础。
28.(1) CH3OH-6e-+3O2-=CO2+2H2O 2.89×105C
(2) NO-3e-+2H2O=+4H+ 33.6
(3)LixC6 - xe- = xLi+ + C6
(4) O2+4e-+4H+=2H2O 13.4
【详解】(1)原电池中负极发生氧化反应,由图知,燃料电池中的燃料为甲醇,在负极上反应失去电子转化为水和二氧化碳,由题知反应离子为氧离子,因此可写出负极反应式为CH3OH-6e-+3O2-=CO2+2H2O;
16g甲醇物质的量为32g/ mol1,由负极反应式可知,1mol甲醇反应时,转移6mol电子,1个电子的电量为1.60-19C,则所求电量表达式为66.021023mol-11.60-19C =2.89×105C;
(2)由原电池的工作原理图示可知,左端的铂电极为负极,其电极反应式为NO-3e-+2H2O=+4H+,当过程中产生2molHNO3时转移6mole-,而1molO2参与反应转移4mol e- ,故需要 1.5 mol O2参与反应,标准状况下的体积为33.6 L;
(3)放电时,负极上LixC6失电子产生Li+,电极反应式为LixC6 - xe- = xLi+ + C6;
(4)甲烷燃料电池中,氧气在正极被还原,电解质为硫酸,正极反应式为O2+4e-+4H+=2H2O;
该电池的能量转换效率为86.4%,甲烷的燃烧热为- 890.3kJ/mol,1mol甲烷燃烧输出的电能约为=0.214kW·h,比能量= =13.4kW·h·kg-1
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
