题型九 化学反应的热效应(含解析)——2023届高考化学高频题型专项训练
文档属性
| 名称 | 题型九 化学反应的热效应(含解析)——2023届高考化学高频题型专项训练 |  | |
| 格式 | docx | ||
| 文件大小 | 460.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 00:24:44 | ||
图片预览




文档简介
题型九 化学反应的热效应(2)——2023届高考化学高频题型专项训练
1.已知共价键的键能与热化学方程式信息如下表:
共价键 H—H H—O
键能/() 436 463
热化学方程式
则的为( )
A.428 B.-428 C.498 D.-498
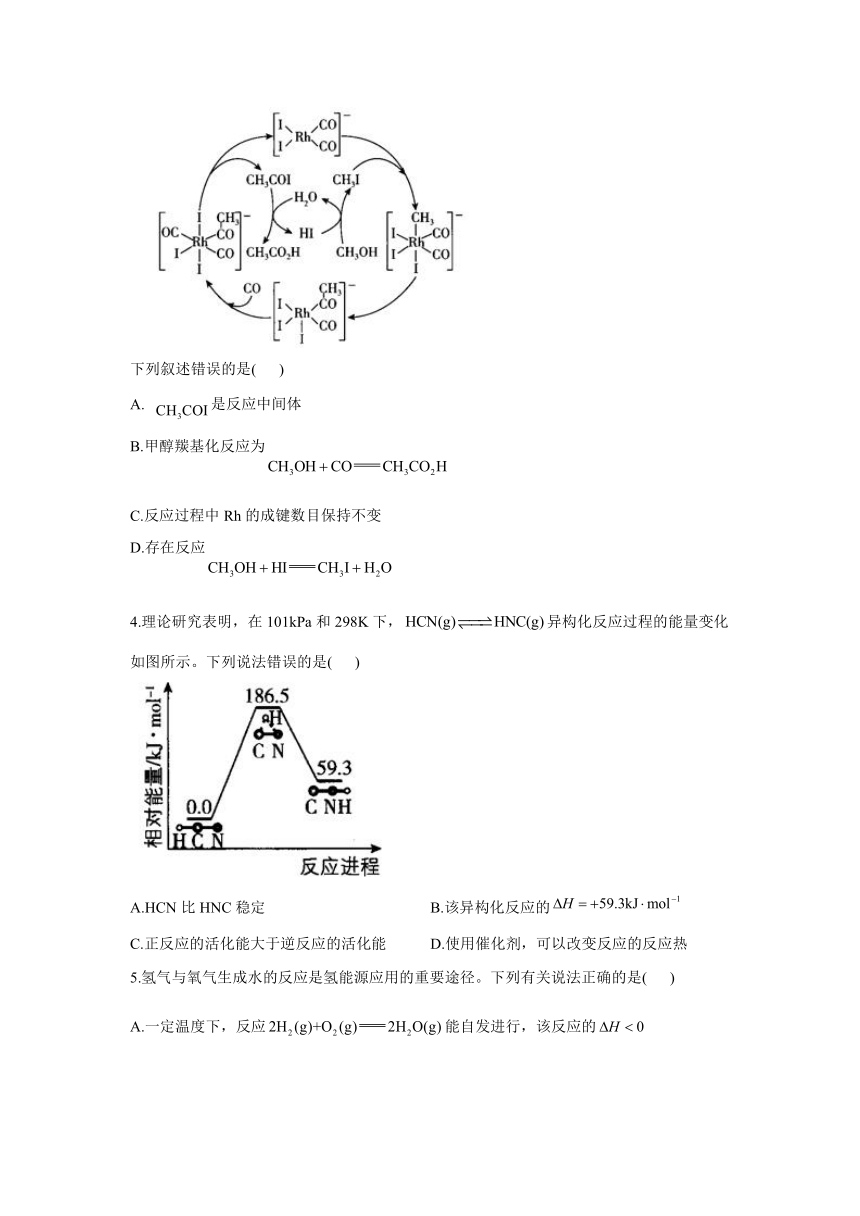
2.据文献报道:催化某反应的一种反应机理如图所示。下列叙述错误的是( )
A. 参与了该催化循环 B.该反应可产生清洁燃料
C.该反应可消耗温室气体 D.该催化循环中Fe的成键数目发生变化
3.铑的配合物离子可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是( )
A. 是反应中间体
B.甲醇羰基化反应为
C.反应过程中Rh的成键数目保持不变
D.存在反应
4.理论研究表明,在101kPa和298K下,异构化反应过程的能量变化如图所示。下列说法错误的是( )
A.HCN比HNC稳定 B.该异构化反应的
C.正反应的活化能大于逆反应的活化能 D.使用催化剂,可以改变反应的反应热
5.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是( )
A.一定温度下,反应能自发进行,该反应的
B.氢氧燃料电池的负极反应为:
C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L ,转移电子的数目为
D.反应的可通过下式估算:=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和
6.通过以下反应均可获取。下列有关说法正确的是( )
①太阳光催化分解水制氢:
②焦炭与水反应制氢:
③甲烷与水反应制氢:
A.反应①中电能转化为化学能
B. 反应②为放热反应
C.反应③使用催化剂,减小
D. 反应的
7.回答下列问题:
(1)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是的催化氧化:。回答下列问题:
钒催化剂参与反应的能量变化如图所示,与反应生成和的热化学方程式:__________。
(2)探究合成反应化学平衡的影响因素,有利于提高的产率。以、为原料合成涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
________。
8.溶液与 1.95 g 锌粉在量热计中充分反应。测得反应前温度为20. 1℃,反应后最高温度为30.1℃。已知:反应前后,溶液的比热容均近似为、溶液的密度均近似为,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量=_______J。
(2)反应的_______ (列式计算)。
9.回答下列问题:
(1)Deacon直接氧化法可按下列催化过程进行:
则的=_____________。
(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_________、_________,制得等量所需能量较少的是_________。
(3)已知:
①
②
③
④
上述反应热效应之间的关系式为________,联氨()和可作为火箭推进剂的主要原因为___________。
(4)已知下列反应:
则反应的________。
10.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为和,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是________。
②已知反应器中还存在如下反应:
ⅰ.
ⅱ.
ⅲ.
……
ⅲ为积炭反应,利用和计算时,还需要利用_____反应的。
③反应物投料比采用,大于初始反应的化学计量数之比,目的是_______(填序号)。
a.促进转化
b.促进CO转化为
c.减少积炭生成
④用CaO可以去除。体积分数和CaO消耗率随时间变化关系如图所示。
从时开始,体积分数显著降低,单位时间CaO消耗率_______(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方式解释原因:_______。
答案以及解析
1.答案:D
解析:本题考查键能与反应热的关系。反应热=反应物的总键能之和-生成物的总键能之和,由热化学方程式可知键的键能为表示化学键的形成,为放热反应,则其为-498 ,答案选D。
2.答案:C
解析:本题考查催化某反应的反应机理。催化循环中,转化为的过程中消耗了,转化为的过程中生成了,可知参与了该催化循环,A项正确;转化为的过程中产生了清洁燃料,且整个催化循环中不被消耗,B项正确;转化为过程中生成了,且整个反应过程中没有消耗的步骤,C项错误;催化循环中,Fe的成键数目有4(如)、5如()或6(如),成键数目发生变化,D项正确。
3.答案:C
解析:本题通过甲醇羰基化反应过程图考查考生观察理解能力,体现宏观辨识与微观探析的化学学科核心素养。初始反应物中没有,反应过程中生成的与水反应生成目标产物,说明是反应中间体,A正确;根据题图可知,反应物是甲醇和CO,目标产物为,故甲醇羰基化反应为,B正确;循环过程中Rh的成键数目由中的4,依次变为6、5、6,最终又变为4,C错误;由反应过程图可知,甲醇发生的初始反应为,D正确。
4.答案:D
解析:本题考查化学反应与能量。能量越低越稳定,由图可知HCN比HNC能量低,则HCN更稳定,A项正确;该反应的生成物总能量比反应物总能量高,为吸热反应,由题图可知,,B项正确;正反应的活化能为186.5,逆反应的活化能为,则正反应的活化能大于逆反应的活化能,C项正确:反应热只与反应的始态和终态有关,与是否使用催化剂无关,D项错误。
5.答案:A
解析:本题考查反应进行的方向、原电池原理、氧化还原反应计算、化学反应中的能量变化。当时,反应能自发进行,该反应是气体分子数减小的反应,即,所以一定温度下反应能自发进行说明,A正确;氢氧燃料电池为原电池,负极上发生失去电子的氧化反应,B错误;不能根据标准状况下的气体摩尔体积计算常温常压下11.2L 的物质的量,因而也无法计算出转移电子的数目,C错误;反应中断裂旧化学键的键能之和-反应中形成新化学键的键能之和,D错误。
6.答案:D
解析:反应①中是太阳能转化为化学能,A错误。反应②中,为吸热反应,B错误。催化剂只降低反应的活化能,不影响反应的焓变,C错误。目标反应可由反应③-②获得,,D正确。
7.答案:(1)
(2)+40.9
解析:(1)由题中信息可知:①;②;③。根据盖斯定律,由②-③×2得。
(2)Ⅰ.;Ⅱ.;Ⅲ.。根据盖斯定律,Ⅰ-Ⅱ可得反应Ⅲ:。
8.答案:(1)
(2)
解析:(1)本题考查化学反应中能量变化的计算。溶液中Zn和发生置换反应,忽略溶液体积和质量变化,则认为溶液的质量为,反应放出的热量。
(2)根据题中数据可知,,根据,可知反应中Zn过量,应根据计算,每消耗0.020 mol,反应放热,则。
9.答案:(1)-116
(2);;系统(Ⅱ)
(3);反应放热量大,产生大量气体
(4)
解析:(1)将题给三个热化学方程式分别编号为①、②、③,根据盖斯定律由①×2+②×2+③×2可得目标热化学方程式,则反应热。
(2)将题给四个热化学方程式依次编号为①、②、③、④,系统(Ⅰ)中制氢的反应为,根据盖斯定律,由①+②+③可得: 。系统(Ⅱ)中制氢反应为,根据盖斯定律,由②+③+④可得: 。分析系统(Ⅰ)和系统(Ⅱ)制氢反应的热化学方程式可知,制取等量的时,系统(Ⅱ)消耗的能量少。
(3)反应④可由2×③-2×②-①求得,根据盖斯定律,热效应之间的关系可表示为;联氨有强还原性,有强氧化性,两者反应时放出大量的热量,且产生大量气体,故联氨和可作为火箭推进剂。
(4)根据盖斯定律,由①+②-③可得,故该反应的。
10.答案:(1)①
②或
③abc
④降低;,覆盖在CaO表面,减少了与CaO的接触面积
解析:(1)①甲烷与水蒸气反应,初始反应的生成物为和,其物质的量之比为4:1,结合得失电子守恒和原子守恒写出化学方程式:。②分析反应ⅰ、ⅱ、ⅲ中涉及的物质,根据盖斯定律,由ⅰ+ⅱ-ⅲ可得:,则可由得到,也可由ⅰ-ⅱ-ⅲ得:,则可由得到。③反应物投料比采用,大于初始反应的化学计量数之比,使过量,促使反应ⅰ和ⅱ正向进行,促进和CO的转化,同时使体系中增多,减小反应ⅲ正向进行程度,从而减少积炭生成,a、b、c正确。④由图可知,从时开始,CaO消耗率的变化曲线斜率减小,说明单位时间内CaO消耗率降低。此时CaO消耗率约为35%,但已失效,因为反应生成的覆盖在CaO表面,减少了CaO与的接触面积,阻碍CaO与反应
1.已知共价键的键能与热化学方程式信息如下表:
共价键 H—H H—O
键能/() 436 463
热化学方程式
则的为( )
A.428 B.-428 C.498 D.-498
2.据文献报道:催化某反应的一种反应机理如图所示。下列叙述错误的是( )
A. 参与了该催化循环 B.该反应可产生清洁燃料
C.该反应可消耗温室气体 D.该催化循环中Fe的成键数目发生变化
3.铑的配合物离子可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是( )
A. 是反应中间体
B.甲醇羰基化反应为
C.反应过程中Rh的成键数目保持不变
D.存在反应
4.理论研究表明,在101kPa和298K下,异构化反应过程的能量变化如图所示。下列说法错误的是( )
A.HCN比HNC稳定 B.该异构化反应的
C.正反应的活化能大于逆反应的活化能 D.使用催化剂,可以改变反应的反应热
5.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是( )
A.一定温度下,反应能自发进行,该反应的
B.氢氧燃料电池的负极反应为:
C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L ,转移电子的数目为
D.反应的可通过下式估算:=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和
6.通过以下反应均可获取。下列有关说法正确的是( )
①太阳光催化分解水制氢:
②焦炭与水反应制氢:
③甲烷与水反应制氢:
A.反应①中电能转化为化学能
B. 反应②为放热反应
C.反应③使用催化剂,减小
D. 反应的
7.回答下列问题:
(1)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是的催化氧化:。回答下列问题:
钒催化剂参与反应的能量变化如图所示,与反应生成和的热化学方程式:__________。
(2)探究合成反应化学平衡的影响因素,有利于提高的产率。以、为原料合成涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
________。
8.溶液与 1.95 g 锌粉在量热计中充分反应。测得反应前温度为20. 1℃,反应后最高温度为30.1℃。已知:反应前后,溶液的比热容均近似为、溶液的密度均近似为,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量=_______J。
(2)反应的_______ (列式计算)。
9.回答下列问题:
(1)Deacon直接氧化法可按下列催化过程进行:
则的=_____________。
(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_________、_________,制得等量所需能量较少的是_________。
(3)已知:
①
②
③
④
上述反应热效应之间的关系式为________,联氨()和可作为火箭推进剂的主要原因为___________。
(4)已知下列反应:
则反应的________。
10.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为和,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是________。
②已知反应器中还存在如下反应:
ⅰ.
ⅱ.
ⅲ.
……
ⅲ为积炭反应,利用和计算时,还需要利用_____反应的。
③反应物投料比采用,大于初始反应的化学计量数之比,目的是_______(填序号)。
a.促进转化
b.促进CO转化为
c.减少积炭生成
④用CaO可以去除。体积分数和CaO消耗率随时间变化关系如图所示。
从时开始,体积分数显著降低,单位时间CaO消耗率_______(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方式解释原因:_______。
答案以及解析
1.答案:D
解析:本题考查键能与反应热的关系。反应热=反应物的总键能之和-生成物的总键能之和,由热化学方程式可知键的键能为表示化学键的形成,为放热反应,则其为-498 ,答案选D。
2.答案:C
解析:本题考查催化某反应的反应机理。催化循环中,转化为的过程中消耗了,转化为的过程中生成了,可知参与了该催化循环,A项正确;转化为的过程中产生了清洁燃料,且整个催化循环中不被消耗,B项正确;转化为过程中生成了,且整个反应过程中没有消耗的步骤,C项错误;催化循环中,Fe的成键数目有4(如)、5如()或6(如),成键数目发生变化,D项正确。
3.答案:C
解析:本题通过甲醇羰基化反应过程图考查考生观察理解能力,体现宏观辨识与微观探析的化学学科核心素养。初始反应物中没有,反应过程中生成的与水反应生成目标产物,说明是反应中间体,A正确;根据题图可知,反应物是甲醇和CO,目标产物为,故甲醇羰基化反应为,B正确;循环过程中Rh的成键数目由中的4,依次变为6、5、6,最终又变为4,C错误;由反应过程图可知,甲醇发生的初始反应为,D正确。
4.答案:D
解析:本题考查化学反应与能量。能量越低越稳定,由图可知HCN比HNC能量低,则HCN更稳定,A项正确;该反应的生成物总能量比反应物总能量高,为吸热反应,由题图可知,,B项正确;正反应的活化能为186.5,逆反应的活化能为,则正反应的活化能大于逆反应的活化能,C项正确:反应热只与反应的始态和终态有关,与是否使用催化剂无关,D项错误。
5.答案:A
解析:本题考查反应进行的方向、原电池原理、氧化还原反应计算、化学反应中的能量变化。当时,反应能自发进行,该反应是气体分子数减小的反应,即,所以一定温度下反应能自发进行说明,A正确;氢氧燃料电池为原电池,负极上发生失去电子的氧化反应,B错误;不能根据标准状况下的气体摩尔体积计算常温常压下11.2L 的物质的量,因而也无法计算出转移电子的数目,C错误;反应中断裂旧化学键的键能之和-反应中形成新化学键的键能之和,D错误。
6.答案:D
解析:反应①中是太阳能转化为化学能,A错误。反应②中,为吸热反应,B错误。催化剂只降低反应的活化能,不影响反应的焓变,C错误。目标反应可由反应③-②获得,,D正确。
7.答案:(1)
(2)+40.9
解析:(1)由题中信息可知:①;②;③。根据盖斯定律,由②-③×2得。
(2)Ⅰ.;Ⅱ.;Ⅲ.。根据盖斯定律,Ⅰ-Ⅱ可得反应Ⅲ:。
8.答案:(1)
(2)
解析:(1)本题考查化学反应中能量变化的计算。溶液中Zn和发生置换反应,忽略溶液体积和质量变化,则认为溶液的质量为,反应放出的热量。
(2)根据题中数据可知,,根据,可知反应中Zn过量,应根据计算,每消耗0.020 mol,反应放热,则。
9.答案:(1)-116
(2);;系统(Ⅱ)
(3);反应放热量大,产生大量气体
(4)
解析:(1)将题给三个热化学方程式分别编号为①、②、③,根据盖斯定律由①×2+②×2+③×2可得目标热化学方程式,则反应热。
(2)将题给四个热化学方程式依次编号为①、②、③、④,系统(Ⅰ)中制氢的反应为,根据盖斯定律,由①+②+③可得: 。系统(Ⅱ)中制氢反应为,根据盖斯定律,由②+③+④可得: 。分析系统(Ⅰ)和系统(Ⅱ)制氢反应的热化学方程式可知,制取等量的时,系统(Ⅱ)消耗的能量少。
(3)反应④可由2×③-2×②-①求得,根据盖斯定律,热效应之间的关系可表示为;联氨有强还原性,有强氧化性,两者反应时放出大量的热量,且产生大量气体,故联氨和可作为火箭推进剂。
(4)根据盖斯定律,由①+②-③可得,故该反应的。
10.答案:(1)①
②或
③abc
④降低;,覆盖在CaO表面,减少了与CaO的接触面积
解析:(1)①甲烷与水蒸气反应,初始反应的生成物为和,其物质的量之比为4:1,结合得失电子守恒和原子守恒写出化学方程式:。②分析反应ⅰ、ⅱ、ⅲ中涉及的物质,根据盖斯定律,由ⅰ+ⅱ-ⅲ可得:,则可由得到,也可由ⅰ-ⅱ-ⅲ得:,则可由得到。③反应物投料比采用,大于初始反应的化学计量数之比,使过量,促使反应ⅰ和ⅱ正向进行,促进和CO的转化,同时使体系中增多,减小反应ⅲ正向进行程度,从而减少积炭生成,a、b、c正确。④由图可知,从时开始,CaO消耗率的变化曲线斜率减小,说明单位时间内CaO消耗率降低。此时CaO消耗率约为35%,但已失效,因为反应生成的覆盖在CaO表面,减少了CaO与的接触面积,阻碍CaO与反应
同课章节目录
