题型四 氧化还原反应中守恒法的应用(含解析)——2024届高考化学高频题型专项训练
文档属性
| 名称 | 题型四 氧化还原反应中守恒法的应用(含解析)——2024届高考化学高频题型专项训练 |  | |
| 格式 | docx | ||
| 文件大小 | 339.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 00:21:54 | ||
图片预览




文档简介
题型四 氧化还原反应中守恒法的应用(1)
——2024届高考化学高频题型专项训练
1.宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,银针验毒的原理为,下列说法正确的是( )
A.的化学式为AgS
B.反应中X是氧化产物
C.反应中Ag和均是还原剂
D.1mol参加反应时,转移4mol电子
2.已知氧化性:。向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加的物质的量的关系如图所示。下列有关说法错误的是( )
A.b点时KI恰好反应完全
B.b→c过程中,被氧化的为
C.当时,对应含碘物质为
D.该过程最多消耗7.2 mol
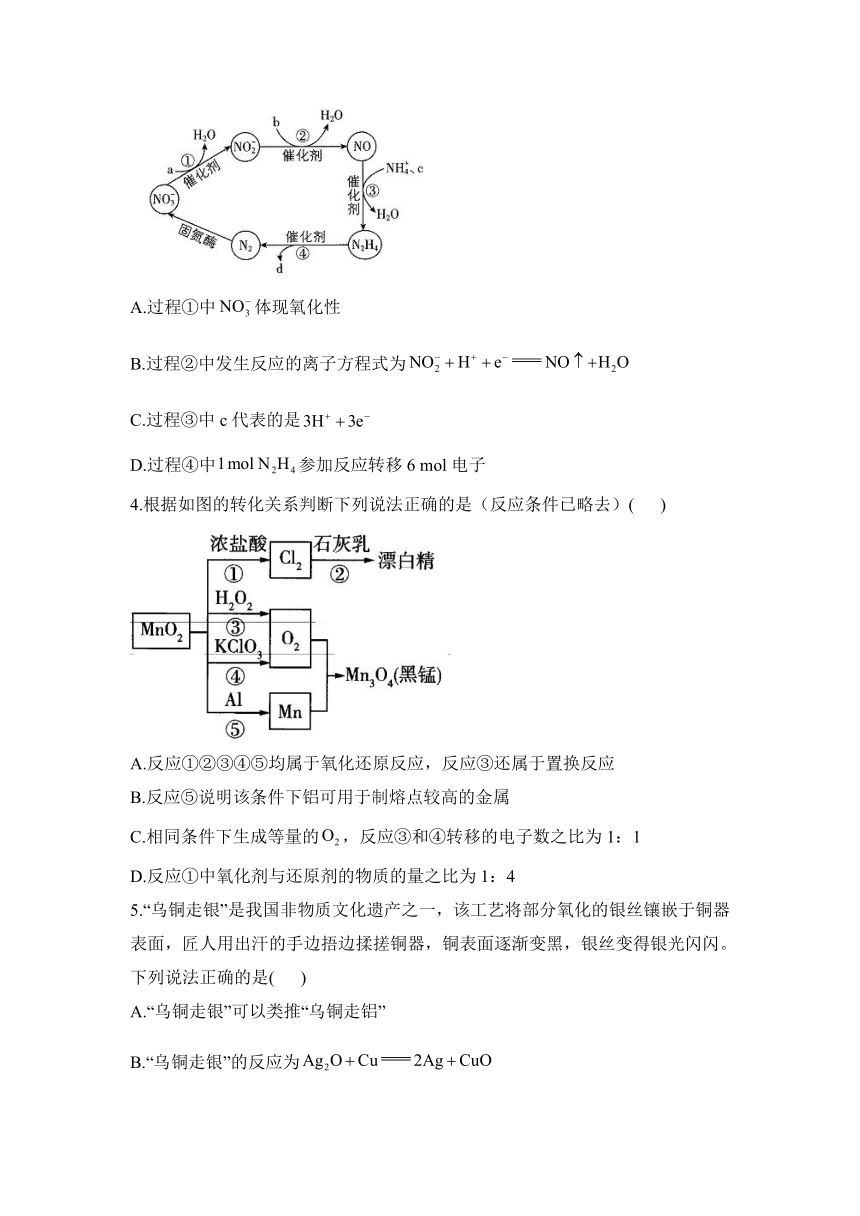
3.氮元素在自然界的某种转化示意图如图所示(a、b、c和d代表一定比例的和)。下列说法正确的是( )
A.过程①中体现氧化性
B.过程②中发生反应的离子方程式为
C.过程③中c代表的是
D.过程④中参加反应转移6 mol电子
4.根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的,反应③和④转移的电子数之比为1:1
D.反应①中氧化剂与还原剂的物质的量之比为1:4
5.“乌铜走银”是我国非物质文化遗产之一,该工艺将部分氧化的银丝镶嵌于铜器表面,匠人用出汗的手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪。下列说法正确的是( )
A.“乌铜走银”可以类推“乌铜走铝”
B.“乌铜走银”的反应为
C.负极反应式为
D.每生成40 g CuO时转移2 mol电子
6.是国际上公认的安全绿色消毒剂。工业上利用甲醇还原的方法制备的反应原理为(未配平),下列说法错误的是( )
A.HCOOH为该反应的氧化产物
B.生成2.24 L 时,转移的电子数是0.1
C.反应中氧化剂和还原剂物质的量之比为4:1
D.能漂白纸张
7.科学研究发现过二硫酸盐的溶液中存在一定量的过氧化氢,加热会促进过二硫酸盐的水解,某兴趣小组为探究过二硫酸钠()的性质进行了以下实验:
第一步:将少量的与过量的混合,加入蒸馏水;
第二步:加热上述混合液,30 s后开始出现大量的无色气泡,经验证该气体能使带火星的木条复燃;
第三步:取加热煮沸3 min后的溶液,观察发现溶液呈深棕色,里面明显看到悬浮的小颗粒;
……
下列观点正确的是( )
A.中硫元素的化合价为+7价
B.过二硫酸钠的水解产物中有
C.3 min后的溶液呈深棕色是由于被氧化成
D.悬浮的小颗粒直径介于1~100 nm之间
8.向盛有溶液的试管中加入过量的溶液,产生黑色沉淀,溶液由紫红色变为无色;过滤,向滤液中加入少量的铋酸钠()粉末,溶液又变为紫红色。已知,水溶液呈墨绿色。下列推断错误的是( )
A.氧化性:
B.生成8.7 g黑色沉淀,转移0.2 mol电子
C.利用可以检验溶液中的
D.可与浓盐酸发生反应:(浓)
9.由下列实验及现象推出相应结论错误的是( )
选项 实验 现象 结论
A 向淀粉-KI溶液中滴入溶液 溶液变蓝 具有氧化性
B 将乙醇蒸气通过盛有炽热CuO的反应管 固体由黑色变为红色 乙醇具有还原性
C 向盛有的试管中加入稀硫酸 溶液变蓝,管底有紫红色固体 在强酸中能发生自身氧化还原反应
D 用稀盐酸洗净的铂丝蘸取某溶液进行焰色试验,透过蓝色钴玻璃观察 火焰呈紫色 该溶液一定为钾盐溶液
A.A B.B C.C D.D
10.根据溶液中发生的两个反应:①;②。下列说法不正确的是( )
A.反应①中氧化剂和还原剂的物质的量之比为5:2
B.酸性条件下,氧化性:
C.实验室将高锰酸钾溶液酸化时,常用稀硫酸酸化而不用盐酸酸化
D.反应②中每生成1.12 L的气体,转移电子的物质的量为0.1 mol
11.碘可以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下:
(未配平)
(1)配平上述化学方程式,用单线桥标出电子转移的方向和数目________。
(2)该反应实质上分两步进行,第一步反应为,则第二步反应的离子方程式为________;若要使碘酸钠的利用率最高,碘酸钠在第一步和第二步反应中的用量之比是________。
12.硫代硫酸钠是一种常用的滴定剂,利用硫化亚铜制取硫代硫酸钠晶体的步骤如图所示。
(1)反应釜中发生反应的化学方程式为_______。
(2)=_______时,固体A和气体B的利用率最高。若高于该比值,则产品中会混有_______杂质。
(3)的应用——测定的纯度(杂质不参与反应)。取mg样品溶于适量水中,加入稀硫酸酸化,加入过量KI,将反应后溶液稀释为250mL。取25mL置于锥形瓶中,加入指示剂,用的溶液滴定,重复实验3次,平均消耗溶液的体积为VmL(已知:)。
①向溶液中加入过量KI,发生反应的离子方程式为_______。
②滴定过程中所用的指示剂为样品的纯度为_______%。
答案以及解析
1.答案:B
解析:根据原子守恒,X的化学式为,A错误;Ag→为Ag失电子,故为氧化产物,B正确;中元素化合价没有变化,不是还原剂,C错误;由反应原理知,2mol参加反应时转移4mol电子,D错误。
2.答案:C
解析:由图象可知,b点时参加反应的为1mol,则KI恰好反应完全生成3 mol碘单质,A正确;b→c过程中,含碘物质的物质的量不变,发生的为和之间的氧化还原反应,被氧化为溴单质,B正确;由图可知,时,部分被氧化生成,对应的含碘物质为和,C错误;整个过程的总反应为,则含6mol KI的硫酸溶液最多消耗的,D正确。
3.答案:A
解析:过程①中转化为,N元素由+5价下降到+3价,体现氧化性,A正确;过程②中转化为NO,反应的离子方程式为,B错误;过程③中NO转化为,N元素化合价由+2价下降到-2价,反应的离子方程式为,c代表的是,C错误;过程④中转化为,N元素化合价由-2价上升到0价,参加反应转移4 mol电子,D错误。
4.答案:B
解析:①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水和氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰发生铝热反应生成Mn和氧化铝,均存在元素的化合价变化,均属于氧化还原反应,但③不属于置换反应,A错误;⑤为铝热反应,放出大量的热,可用于制熔点较高的金属,B正确;③中O元素由-1价升高为0价,④中O元素由-2价升高为0价,则相同条件下生成等量的,反应③和④转移的电子数之比为1:2,C错误;反应①中,Mn元素由+4价降低为+2价,Cl元素由-1价升高为0价,由得失电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,D错误。
5.答案:B
解析:“乌铜走银”的原理是铜、氧化银在汗液中构成原电池,Cu的金属活动性强于Ag,使氧化银转化为银,而铝的金属活动性强于铜,氧化铝不能被铜还原,A项错误;“乌铜走银”反应的化学方程式为,B项正确;负极上,Cu被氧化为CuO,电极反应式为,C项错误;40 g CuO的物质的量为,根据负极的电极反应式可知,每生成0.5 mol CuO时,转移1 mol电子,D项错误。
6.答案:B
解析:根据得失电子守恒和质量守恒配平该反应得,反应中甲醇被氧化,其氧化产物为甲酸,A正确;未说明二氧化氯气体是否处在标准状况下,故的物质的量无法求出,B错误;反应中氯酸钠作氧化剂,甲醇作还原剂,则氧化剂和还原剂物质的量之比为4:1,C正确;二氧化氯能漂白纸张,它能将有色物质氧化为无色物质,D正确。
7.答案:B
解析:S元素为第ⅥA族元素,最高正价为+6价,A错误;根据第二步的实验现象可知,水解产物中有,则过二硫酸钠的水解反应为,故水解产物中有,B正确;第三步中溶液呈深棕色,里面明显看到悬浮的小颗粒,溶液呈深棕色是由于被氧化成,C错误;悬浮的小颗粒直径大于100 nm,粒子直径介于1~100 nm之间的为胶体,看不到悬浮颗粒,D错误。
8.答案:B
解析:同一氧化还原反应中,氧化剂氧化性强于氧化产物的氧化性。在盛有溶液的试管中加入过量的溶液,产生黑色沉淀,溶液由紫红色变为无色,说明可将氧化成,故氧化性:,向滤液中加入少量的铋酸钠()粉末,溶液又变为紫红色,说明可将氧化成,故氧化性:,A正确;可将氧化成,自身也被还原为,反应的离子方程式为的物质的量为,根据得失电子守恒,转移电子的物质的量为,B错误;由题意知,向含的溶液加入,溶液会变为紫红色,则利用可以检验溶液中的,C正确;因为可与浓盐酸发生氧化还原反应,HCl被氧化,转化成,由于氧化性:,则也可与浓盐酸发生氧化还原反应,化学方程式为(浓),D正确。
9.答案:D
解析:向淀粉-KI溶液中滴入溶液,溶液变蓝,说明将氧化为,A项正确;固体由黑色变为红色,说明CuO被还原为Cu,乙醇具有还原性,B项正确;向盛有的试管中加入稀硫酸,溶液变蓝,管底有紫红色固体生成,说明在强酸中能发生自身氧化还原反应,发生反应为,C项正确;用稀盐酸洗净的铂丝蘸取某溶液进行焰色试验,透过蓝色钴玻璃观察火焰呈紫色,说明该溶液中存在钾元素,该溶液也可能是KOH溶液,D项错误。
10.答案:D
解析:反应①中Pb元素的化合价降低,作氧化剂,Mn元素的化合价升高,作还原剂,氧化剂和还原剂的物质的量之比为5:2,A项正确;氧化剂的氧化性大于氧化产物的氧化性,则酸性条件下,反应①中氧化性:,反应②中氧化性:,则氧化性:,B项正确;中S为+6价,是最高正价,因此硫酸不能被高锰酸钾氧化,HCl中Cl为-1价,处于最低价态,具有还原性,能被高锰酸钾氧化,故实验室将高锰酸钾溶液酸化时,常用稀硫酸酸化而不用盐酸酸化,C项正确;未指明标准状况,无法计算1.12 L气体的物质的量,D项错误。
11.答案:(1)2;5;2;1;1;
(2);5:1
解析:(1)根据氧化还原反应中元素化合价升降总数相等进行配平,该反应中碘元素由+5价得电子变为0价,一个得5个电子,硫元素由+4价失电子变为+6价,一个失去2个电子,得失电子数的最小公倍数是10,所以碘酸钠的化学计量数是2,亚硫酸氢钠的化学计量数是5,其他未变价元素根据原子守恒进行配平,可得该化学方程式为。
(2)根据总反应可知,最终转变成了碘单质,第一步反应中部分I03被还原成碘离子,则第二步反应中碘离子应被氧化成碘单质,离子方程式为;若要使碘酸钠的利用率最高,则第一步生成的在第二步应恰好完全被碘酸根离子氧化,根据第一、二步反应中量的关系知,碘酸钠在第一步和第二步反应中用量比应为5:1。
12.答案:(1)
(2);亚硫酸钠
(3)①;②淀粉溶液;
解析:(1)在空气中煅烧可以发生反应
,则黄色固体A为S,气体产物B为,反应中S和与过量的反应,生成和。
(2)由可知,当为1:1时,S与的利用率最高,由可知,当时,S和的利用率最高,若高于此值,可与S反应产生,二氧化硫与碳酸氢钠反应生成亚硫酸钠。
(3)①由滴定原理知,向溶液中加入过量KI,发生氧化还原反应生成和。②滴定过程中所用指示剂为淀粉溶液,因为淀粉遇碘变蓝。滴定所消耗的物质的量为,根据滴定原理可得关系式,则250 mL溶液中的物质的量为,样品纯度为
——2024届高考化学高频题型专项训练
1.宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,银针验毒的原理为,下列说法正确的是( )
A.的化学式为AgS
B.反应中X是氧化产物
C.反应中Ag和均是还原剂
D.1mol参加反应时,转移4mol电子
2.已知氧化性:。向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加的物质的量的关系如图所示。下列有关说法错误的是( )
A.b点时KI恰好反应完全
B.b→c过程中,被氧化的为
C.当时,对应含碘物质为
D.该过程最多消耗7.2 mol
3.氮元素在自然界的某种转化示意图如图所示(a、b、c和d代表一定比例的和)。下列说法正确的是( )
A.过程①中体现氧化性
B.过程②中发生反应的离子方程式为
C.过程③中c代表的是
D.过程④中参加反应转移6 mol电子
4.根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的,反应③和④转移的电子数之比为1:1
D.反应①中氧化剂与还原剂的物质的量之比为1:4
5.“乌铜走银”是我国非物质文化遗产之一,该工艺将部分氧化的银丝镶嵌于铜器表面,匠人用出汗的手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪。下列说法正确的是( )
A.“乌铜走银”可以类推“乌铜走铝”
B.“乌铜走银”的反应为
C.负极反应式为
D.每生成40 g CuO时转移2 mol电子
6.是国际上公认的安全绿色消毒剂。工业上利用甲醇还原的方法制备的反应原理为(未配平),下列说法错误的是( )
A.HCOOH为该反应的氧化产物
B.生成2.24 L 时,转移的电子数是0.1
C.反应中氧化剂和还原剂物质的量之比为4:1
D.能漂白纸张
7.科学研究发现过二硫酸盐的溶液中存在一定量的过氧化氢,加热会促进过二硫酸盐的水解,某兴趣小组为探究过二硫酸钠()的性质进行了以下实验:
第一步:将少量的与过量的混合,加入蒸馏水;
第二步:加热上述混合液,30 s后开始出现大量的无色气泡,经验证该气体能使带火星的木条复燃;
第三步:取加热煮沸3 min后的溶液,观察发现溶液呈深棕色,里面明显看到悬浮的小颗粒;
……
下列观点正确的是( )
A.中硫元素的化合价为+7价
B.过二硫酸钠的水解产物中有
C.3 min后的溶液呈深棕色是由于被氧化成
D.悬浮的小颗粒直径介于1~100 nm之间
8.向盛有溶液的试管中加入过量的溶液,产生黑色沉淀,溶液由紫红色变为无色;过滤,向滤液中加入少量的铋酸钠()粉末,溶液又变为紫红色。已知,水溶液呈墨绿色。下列推断错误的是( )
A.氧化性:
B.生成8.7 g黑色沉淀,转移0.2 mol电子
C.利用可以检验溶液中的
D.可与浓盐酸发生反应:(浓)
9.由下列实验及现象推出相应结论错误的是( )
选项 实验 现象 结论
A 向淀粉-KI溶液中滴入溶液 溶液变蓝 具有氧化性
B 将乙醇蒸气通过盛有炽热CuO的反应管 固体由黑色变为红色 乙醇具有还原性
C 向盛有的试管中加入稀硫酸 溶液变蓝,管底有紫红色固体 在强酸中能发生自身氧化还原反应
D 用稀盐酸洗净的铂丝蘸取某溶液进行焰色试验,透过蓝色钴玻璃观察 火焰呈紫色 该溶液一定为钾盐溶液
A.A B.B C.C D.D
10.根据溶液中发生的两个反应:①;②。下列说法不正确的是( )
A.反应①中氧化剂和还原剂的物质的量之比为5:2
B.酸性条件下,氧化性:
C.实验室将高锰酸钾溶液酸化时,常用稀硫酸酸化而不用盐酸酸化
D.反应②中每生成1.12 L的气体,转移电子的物质的量为0.1 mol
11.碘可以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下:
(未配平)
(1)配平上述化学方程式,用单线桥标出电子转移的方向和数目________。
(2)该反应实质上分两步进行,第一步反应为,则第二步反应的离子方程式为________;若要使碘酸钠的利用率最高,碘酸钠在第一步和第二步反应中的用量之比是________。
12.硫代硫酸钠是一种常用的滴定剂,利用硫化亚铜制取硫代硫酸钠晶体的步骤如图所示。
(1)反应釜中发生反应的化学方程式为_______。
(2)=_______时,固体A和气体B的利用率最高。若高于该比值,则产品中会混有_______杂质。
(3)的应用——测定的纯度(杂质不参与反应)。取mg样品溶于适量水中,加入稀硫酸酸化,加入过量KI,将反应后溶液稀释为250mL。取25mL置于锥形瓶中,加入指示剂,用的溶液滴定,重复实验3次,平均消耗溶液的体积为VmL(已知:)。
①向溶液中加入过量KI,发生反应的离子方程式为_______。
②滴定过程中所用的指示剂为样品的纯度为_______%。
答案以及解析
1.答案:B
解析:根据原子守恒,X的化学式为,A错误;Ag→为Ag失电子,故为氧化产物,B正确;中元素化合价没有变化,不是还原剂,C错误;由反应原理知,2mol参加反应时转移4mol电子,D错误。
2.答案:C
解析:由图象可知,b点时参加反应的为1mol,则KI恰好反应完全生成3 mol碘单质,A正确;b→c过程中,含碘物质的物质的量不变,发生的为和之间的氧化还原反应,被氧化为溴单质,B正确;由图可知,时,部分被氧化生成,对应的含碘物质为和,C错误;整个过程的总反应为,则含6mol KI的硫酸溶液最多消耗的,D正确。
3.答案:A
解析:过程①中转化为,N元素由+5价下降到+3价,体现氧化性,A正确;过程②中转化为NO,反应的离子方程式为,B错误;过程③中NO转化为,N元素化合价由+2价下降到-2价,反应的离子方程式为,c代表的是,C错误;过程④中转化为,N元素化合价由-2价上升到0价,参加反应转移4 mol电子,D错误。
4.答案:B
解析:①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水和氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰发生铝热反应生成Mn和氧化铝,均存在元素的化合价变化,均属于氧化还原反应,但③不属于置换反应,A错误;⑤为铝热反应,放出大量的热,可用于制熔点较高的金属,B正确;③中O元素由-1价升高为0价,④中O元素由-2价升高为0价,则相同条件下生成等量的,反应③和④转移的电子数之比为1:2,C错误;反应①中,Mn元素由+4价降低为+2价,Cl元素由-1价升高为0价,由得失电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,D错误。
5.答案:B
解析:“乌铜走银”的原理是铜、氧化银在汗液中构成原电池,Cu的金属活动性强于Ag,使氧化银转化为银,而铝的金属活动性强于铜,氧化铝不能被铜还原,A项错误;“乌铜走银”反应的化学方程式为,B项正确;负极上,Cu被氧化为CuO,电极反应式为,C项错误;40 g CuO的物质的量为,根据负极的电极反应式可知,每生成0.5 mol CuO时,转移1 mol电子,D项错误。
6.答案:B
解析:根据得失电子守恒和质量守恒配平该反应得,反应中甲醇被氧化,其氧化产物为甲酸,A正确;未说明二氧化氯气体是否处在标准状况下,故的物质的量无法求出,B错误;反应中氯酸钠作氧化剂,甲醇作还原剂,则氧化剂和还原剂物质的量之比为4:1,C正确;二氧化氯能漂白纸张,它能将有色物质氧化为无色物质,D正确。
7.答案:B
解析:S元素为第ⅥA族元素,最高正价为+6价,A错误;根据第二步的实验现象可知,水解产物中有,则过二硫酸钠的水解反应为,故水解产物中有,B正确;第三步中溶液呈深棕色,里面明显看到悬浮的小颗粒,溶液呈深棕色是由于被氧化成,C错误;悬浮的小颗粒直径大于100 nm,粒子直径介于1~100 nm之间的为胶体,看不到悬浮颗粒,D错误。
8.答案:B
解析:同一氧化还原反应中,氧化剂氧化性强于氧化产物的氧化性。在盛有溶液的试管中加入过量的溶液,产生黑色沉淀,溶液由紫红色变为无色,说明可将氧化成,故氧化性:,向滤液中加入少量的铋酸钠()粉末,溶液又变为紫红色,说明可将氧化成,故氧化性:,A正确;可将氧化成,自身也被还原为,反应的离子方程式为的物质的量为,根据得失电子守恒,转移电子的物质的量为,B错误;由题意知,向含的溶液加入,溶液会变为紫红色,则利用可以检验溶液中的,C正确;因为可与浓盐酸发生氧化还原反应,HCl被氧化,转化成,由于氧化性:,则也可与浓盐酸发生氧化还原反应,化学方程式为(浓),D正确。
9.答案:D
解析:向淀粉-KI溶液中滴入溶液,溶液变蓝,说明将氧化为,A项正确;固体由黑色变为红色,说明CuO被还原为Cu,乙醇具有还原性,B项正确;向盛有的试管中加入稀硫酸,溶液变蓝,管底有紫红色固体生成,说明在强酸中能发生自身氧化还原反应,发生反应为,C项正确;用稀盐酸洗净的铂丝蘸取某溶液进行焰色试验,透过蓝色钴玻璃观察火焰呈紫色,说明该溶液中存在钾元素,该溶液也可能是KOH溶液,D项错误。
10.答案:D
解析:反应①中Pb元素的化合价降低,作氧化剂,Mn元素的化合价升高,作还原剂,氧化剂和还原剂的物质的量之比为5:2,A项正确;氧化剂的氧化性大于氧化产物的氧化性,则酸性条件下,反应①中氧化性:,反应②中氧化性:,则氧化性:,B项正确;中S为+6价,是最高正价,因此硫酸不能被高锰酸钾氧化,HCl中Cl为-1价,处于最低价态,具有还原性,能被高锰酸钾氧化,故实验室将高锰酸钾溶液酸化时,常用稀硫酸酸化而不用盐酸酸化,C项正确;未指明标准状况,无法计算1.12 L气体的物质的量,D项错误。
11.答案:(1)2;5;2;1;1;
(2);5:1
解析:(1)根据氧化还原反应中元素化合价升降总数相等进行配平,该反应中碘元素由+5价得电子变为0价,一个得5个电子,硫元素由+4价失电子变为+6价,一个失去2个电子,得失电子数的最小公倍数是10,所以碘酸钠的化学计量数是2,亚硫酸氢钠的化学计量数是5,其他未变价元素根据原子守恒进行配平,可得该化学方程式为。
(2)根据总反应可知,最终转变成了碘单质,第一步反应中部分I03被还原成碘离子,则第二步反应中碘离子应被氧化成碘单质,离子方程式为;若要使碘酸钠的利用率最高,则第一步生成的在第二步应恰好完全被碘酸根离子氧化,根据第一、二步反应中量的关系知,碘酸钠在第一步和第二步反应中用量比应为5:1。
12.答案:(1)
(2);亚硫酸钠
(3)①;②淀粉溶液;
解析:(1)在空气中煅烧可以发生反应
,则黄色固体A为S,气体产物B为,反应中S和与过量的反应,生成和。
(2)由可知,当为1:1时,S与的利用率最高,由可知,当时,S和的利用率最高,若高于此值,可与S反应产生,二氧化硫与碳酸氢钠反应生成亚硫酸钠。
(3)①由滴定原理知,向溶液中加入过量KI,发生氧化还原反应生成和。②滴定过程中所用指示剂为淀粉溶液,因为淀粉遇碘变蓝。滴定所消耗的物质的量为,根据滴定原理可得关系式,则250 mL溶液中的物质的量为,样品纯度为
同课章节目录
