2.2.化学平衡 (含解析)专项训练 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.化学平衡 (含解析)专项训练 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 682.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 00:18:54 | ||
图片预览




文档简介
2.2.化学平衡专项训练-2023-2024学年高二上学期化学人教版(2019)选择性必修1
一、单选题
1.在下列反应中:A2(g)+B2(g) 2AB(g) ΔH<0当其达到平衡时,在下图所示的曲线中,符合勒夏特列原理的是
A.①② B.③④ C.① D.①⑤
2.对可逆反应,下列叙述正确的是
A.达到化学平衡时,
B.加入合适的催化剂,可使平衡正向移动
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.保持容器容积不变,向其中加入1molHe,化学反应速率增大
3.下列事实不能用勒夏特列原理解释的是
A.对于平衡体系,增大压强(缩小容积)可使颜色变深
B.合成氨工业上,采用高压以提高的产率
C.氯水宜保存在低温、避光条件下
D.向氯水中加入适量石灰石,可增强漂白效果。
4.温度为T时,将NH4HS(s)置于抽成真空的容器中,当NH4HS(s) NH3(g)+H2S(g)达到平衡时,测得体系的总压强为6 kpa,则该反应的平衡常数Kp为
A.6 (kpa)2 B.9(kpa)2 C.8 (kpa)2 D.36 (kpa)2
5.如表是几种物质在指定温度下的溶解度。工业上将相同物质的量的NaCl、CO2、NH3在30℃时配成溶液,此时溶液中无晶体析出。当降温至某温度时,开始析出晶体,此晶体是
温度/℃ 溶解度/g 盐 0 10 20 30
NH4Cl 29.4 33.3 37.2 41.1
NH4HCO3 11.9 15.9 21.0 27.0
NaHCO3 6.9 8.15 9.6 11.1
NaCl 35.7 35.8 36.0 36.4
A.NH4Cl B.NH4HCO3 C.NaHCO3 D.NaCl
6.反应Ⅰ:H2(g) + I2(g) 2HI(g)的平衡常数为 K1;反应Ⅱ:HI(g) 1/2 H2(g) +1/2 I2(g) 的平衡常数为K2,上述反应的平衡常数为同温度下的测定值,则 K1、K2的关系为
A.K1=1/K2 B.K1 = 1/2 K2 C.1/2K1 = K2 D.K1=1/K
7.下列说法正确的是
A.升高温度,会使单位体积内分子数增多,从而加快化学反应速率
B.(蓝色)(黄色) ,稀溶液受热颜色变黄
C.达平衡后,加入少量KCl固体,溶液红色变浅
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,溶液变为黄色
8.—定条件下,合成乙烯的反应为6H2(g)+2CO2(g)C2H4(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
A.该反应的逆反应为放热反应
B.生成乙烯的速率:(N)一定大于(M)
C.增大压强,平衡正向移动,平衡常数K的值将增大
D.当温度高于250℃,升高温度,催化剂的催化效率会降低
9.已知反应:2X(1)Y(1),取等量X,分别在0℃和20℃下,测得其转化率随时间变化的关系曲线(α-t)如图所示。下列说法正确的是
A.曲线Ⅰ代表0℃下X的α-t曲线
B.反应进行到66min时,Y的物质的量为0.113mol
C.该反应ΔH>0
D.加入催化剂,X的平衡转化率升高
10.下列说法不正确的是
A.平衡移动,平衡常数不一定改变;平衡常数改变,平衡一定移动
B.对于任何化学反应来说,反应速率加快,反应进行的程度不一定越大
C.工业合成氨中,升温有利于提高反应速率和原料平衡转化率
D.实验室用铁片和稀硫酸制备H2时,滴入几滴CuSO4溶液,能加快反应速率
11.下列各组两个反应互为可逆反应的是( )
①2H2+O22H2O与2H2O2H2↑+O2↑
②H2SO4(浓)+2HBr=2H2O+Br2+SO2↑与Br2+SO2+2H2O=2HBr+H2SO4
③2NO2=N2O4与N2O4=2NO2
④2SO2+O22SO3与2SO32SO2+O2
A.①② B.②③ C.③④ D.②④
12.在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明反应已达到化学平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量的浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C和D的反应速率相等 ⑦混合气体总质量
A.②③⑦ B.④⑤⑥ C.①④⑥ D.②④⑦
13.在某温度下,可逆反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K,下列说法不正确的是
A.K越大,达到平衡时,反应进行的程度越大 B.K的表达式是
C.K随反应物浓度的改变而改变 D.K随温度的改变而改变
14.二氧化硫的催化氧化是工业制硫酸的基础:。下列叙述正确的是
A.和充分反应能放出的热量
B.工业上使用催化剂是通过加快反应速率提高生产效率的
C.实际工业选用的温度为,其目的是为了提高的平衡转化率
D.增大压强,正反应速率增大,逆反应速率减小
15.金属Na溶解于液氨中形成蓝色溶液,反应为,蓝色是生成了溶剂合电子(强还原剂)的缘故;向该溶液中加入穴醚类配体L,得到化合物(反应中有生成)。下列说法错误的是
A.Na的液氨溶液具有强还原性 B.该事实说明Na也可表现出非金属性
C.的半径比Na+的大 D.蒸发液氨的钠溶液时,蓝色会逐渐加深
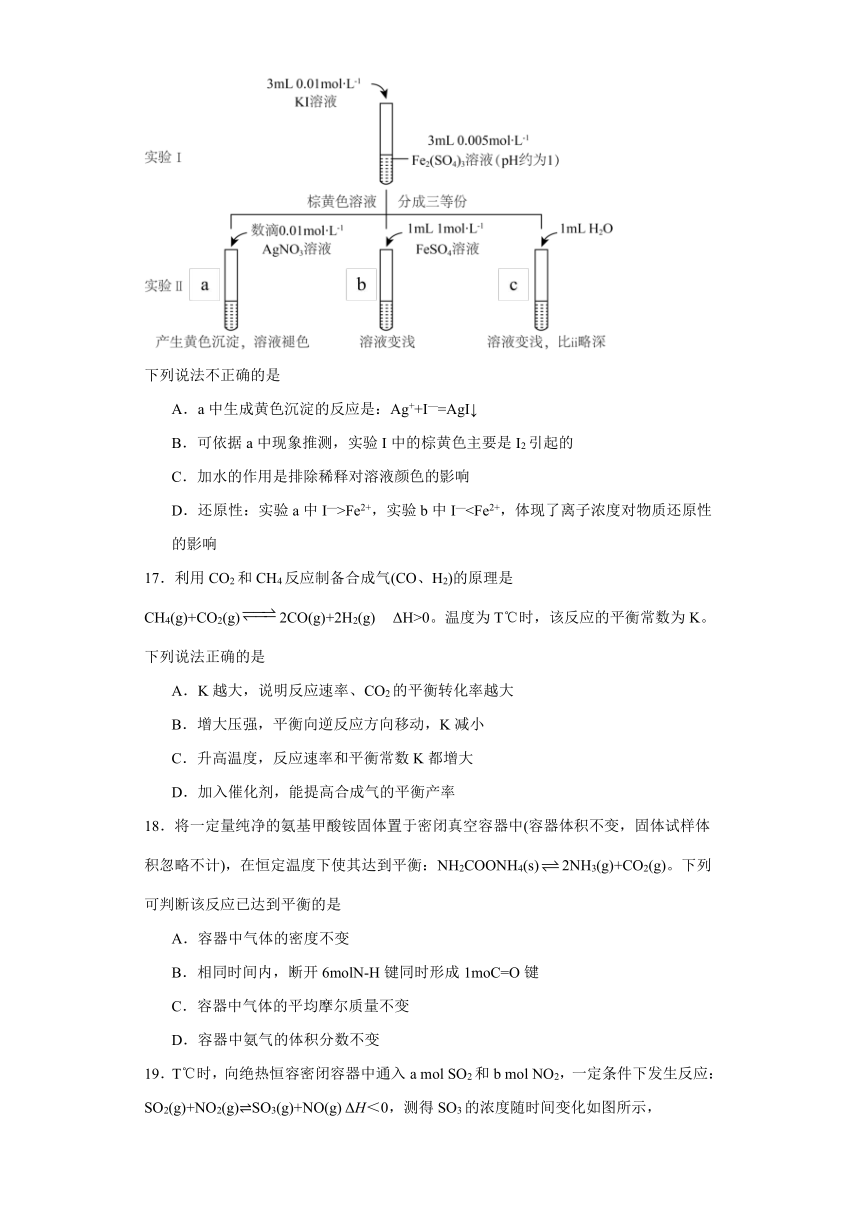
16.研究“2Fe3++2I—2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图:
下列说法不正确的是
A.a中生成黄色沉淀的反应是:Ag++I—=AgI↓
B.可依据a中现象推测,实验I中的棕黄色主要是I2引起的
C.加水的作用是排除稀释对溶液颜色的影响
D.还原性:实验a中I—>Fe2+,实验b中I—17.利用CO2和CH4反应制备合成气(CO、H2)的原理是CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH>0。温度为T℃时,该反应的平衡常数为K。下列说法正确的是
A.K越大,说明反应速率、CO2的平衡转化率越大
B.增大压强,平衡向逆反应方向移动,K减小
C.升高温度,反应速率和平衡常数K都增大
D.加入催化剂,能提高合成气的平衡产率
18.将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:NH2COONH4(s)2NH3(g)+CO2(g)。下列可判断该反应已达到平衡的是
A.容器中气体的密度不变
B.相同时间内,断开6molN-H键同时形成1moC=O键
C.容器中气体的平均摩尔质量不变
D.容器中氨气的体积分数不变
19.T℃时,向绝热恒容密闭容器中通入a mol SO2和b mol NO2,一定条件下发生反应:SO2(g)+NO2(g) SO3(g)+NO(g) ΔH<0,测得SO3的浓度随时间变化如图所示,
下列说法不正确的是
A.容器内压强不再改变说明反应已达平衡
B.SO3在40~50 s内的平均反应速率大于50~60 s内的平均反应速率
C.NO2速率v(正)(t=60 s时)大于v(逆)(t=80 s时)
D.T℃时,若在恒温恒容下,向原容器通入a mol SO2和b mol NO2,达到平衡时c(SO3)>0.33 mol·L 1
20.下列事实不能用勒夏特烈原理解释的是
A.工业合成氨采用400 K的高温 B.用饱和食盐水除去Cl2中的HCl气体
C.可用浓氨水和氢氧化钠固体快速制取氨气 D.对CO中毒病人给予高压氧舱治疗
21.可逆反应mX(g)+nY(g)xZ(g)在不同温度及压强(p1和p2)条件下反应物X的转化率的变化情况如图所示。下列判断正确的是
A.正反应放热,m+nx
C.正反应吸热,m+nx
22.碘硫热化学循环如图所示,该过程由反应Ⅰ、Ⅱ、Ⅲ三步组成,下列说法正确的是
A.该循环实现了水的分解,制取了能源气体氢气
B.一定条件下,将2molHI放在恒容密闭容器中,一定能生成1molH2
C.H2O和SO2属于电解质
D.H2SO4为催化剂
23.化学和生活密切相关,下列生产生活实例中不能用勒夏特列原理解释的是
A.摇晃后的可乐开启后有大量气泡
B.二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
C.酸遇紫色石蕊试剂变红
D.生产硫酸的过程中用过量的空气和二氧化硫反应
24.碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应I ;
反应Ⅱ
在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中随温度变化的关系如图所示。下列说法正确的是
A.压强大小:
B.在如图所示条件下,反应I可表示为
C.选择反应Ⅱ的小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行
D.一定条件下将C与ZnO置于同一密闭容器中反应,当时,增大的值,可减少平衡时气体中的含量
25.已知、下 。在反应器中按投料后,在不同温度下,反应达到平衡时,得到混合物中的质量分数随压强的变化曲线a、b、c如图所示。下列说法正确的是
A.图中M、N、Q点平衡常数K的大小关系为
B.从Q到M,平衡向左移动
C.M、N、Q达到平衡所需时间关系为
D.该条件下,向反应器中充入和,则反应达平衡时放出热量小于
二、填空题
26.一定条件下,在2L恒容密闭容器中投入1molCO和2molH2,发生反应CO(g)+2H2(g) CH3OH(g)。
(1)能说明该反应达到平衡状态的是___________。
A.CH3OH的体积分数保持不变 B.容器内的总压强保持不变
C.混合气体的密度保持不变 D.混合气体的平均摩尔质量保持不变
(2)达平衡后,维持容器的温度不变,将容器的容积扩大一倍,下列说法正确的是___________。
A.平衡向正反应方向移动 B.CO的浓度增大
C.平衡常数不变 D.CO的物质的量增大
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,CO、CH3OH的浓度之比将 (填“增大”“减小”或“不变”)。
27.一定条件下,在容积为5L的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。
甲
(1)该反应的化学方程式 。
(2)该反应的平衡常数的表达式为: ,达到平衡时,A的转化率是: 。
(3)若该反应ΔH <0,升高温度,K会 (填“增大”“减小”或“不变”)。
28.恒温、恒压下,在一个可变容积的容器中发生如下发应:A(g)+B(g)C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若在(2)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
试卷第1页,共3页
参考答案:
1.D
【分析】勒夏特列原理的具体内容为:如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。
【详解】该反应正反应是放热反应,升高温度平衡逆向移动,AB的体积分数降低,由左图可知,曲线①符合变化;
该反应反应前后气体的体积不变,增大压强,平衡不移动,AB的体积分数不变,由右图可知,曲线⑤符合变化;
故答案选D。
2.A
【详解】A. 时,正逆反应速率相等,反应达到平衡状态,故A正确;
B. 加入合适的催化剂,只改变反应速率,不影响平衡移动,故B错误;
C. 达到化学平衡时,若增大容器体积,反应体系中各组分的浓度都减小,则正逆反应速率都减小,故C错误;
D. 保持容器容积不变,向其中加入1molHe,各组分的浓度不变,化学反应速率不变,故D错误;
答案选A。
3.A
【详解】A.反应为气体分子数不变的反应,对于平衡体系,增大压强(缩小容积),物质浓度变大,可使颜色变深,但是平衡不移动,不能用勒夏特列原理解释,A符合题意;
B.合成氨为气体分子数减小的反应,采用高压平衡正向,可以提高的产率,能用勒夏特列原理解释,B不符合题意;
C.低温、避光条件下可以防止平衡向次氯酸分解的方向移动,能用勒夏特列原理解释,C不符合题意;
D.向氯水中加入适量石灰石,碳酸钙和氢离子反应导致氯水和水的反应正向移动,次氯酸浓度变大,可增强漂白效果,能用勒夏特列原理解释,D不符合题意;
故选A。
4.B
【详解】总压强为6kpa,所以P(NH3)=P(H2S)=3kpa。Kp==9(kpa)2,故选B。
5.C
【详解】据表中数据可知,相同温度下,NaHCO3的溶解度最小,故降温时首先析出的物质应是NaHCO3,综上所述C正确;
故答案为:C。
6.D
【详解】反应Ⅰ=反应Ⅱ2,K1=,K2=,则K1=;故答案选D。
7.B
【详解】A.升高温度,分子吸收能量,单位体积内分子总数不变,活化分子总数变多,活化分子百分数变大,碰撞几率增大,从而加快化学反应速率,故A错误;
B.(蓝色)(黄色) ,稀溶液受热,平衡正向移动,因此溶液颜色变黄,故B正确;
C.达平衡后,该反应的实质是,加入少量KCl固体,离子浓度不变,平衡不移动,故C错误;
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,氢离子浓度增大,平衡逆向移动,溶液变为橙色,故D错误;
综上所述,答案为B。
8.D
【详解】A.升高温度二氧化碳转化率减小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,逆反应为吸热反应,A错误;
B.温度越高化学反应速率越快,催化剂的催化效率越高化学反应速率越快,根据图知,M点催化效率大于N点但M点温度小于N点,催化效率大于温度对反应速率影响,则M点反应速率大于N点,B错误;
C.化学平衡常数只与温度有关,温度不变化学平衡常数不变,C错误;
D.根据图知,温度高于250℃,升高温度,催化剂的催化效率会降低,D正确;
故答案为:D。
9.A
【详解】A.据图可知,平衡前反应相同时间,曲线Ⅰ所示条件下转化率更小,即反应速率更慢,温度越低反应速率越小,所以曲线Ⅰ代表0℃下X的α-t曲线,A正确;
B.据图可知反应进行到66min时,X的转化率为0.113,但初始投料未知,所以无法计算此时Y的物质的量,B错误;
C.曲线Ⅱ所示温度更高,但平衡时X的转化率低,说明升高温度平衡逆向移动,正反应为放热反应,ΔH<0,C错误;
D.催化剂可以加快反应速率,但不能改变平衡转化率,D错误;
综上所述答案为A。
10.C
【详解】A.平衡常数仅仅是温度的函数,温度不变,即平衡移动,平衡常数也不改变,温度改变,平衡必然移动,平衡常数也必然改变,而平衡常数改变,说明温度改变,改变温度平衡一定移动,A正确;
B.升高温度任何化学反应速率均增大,但升高温度有的反应平衡正向移动,有的平衡逆向移动,故对于任何化学反应来说,反应速率加快,反应进行的程度不一定越大,B正确;
C.已知工业合成氨正反应为放热反应,故升温有利于提高反应速率,但平衡逆向移动,不利于提高原料平衡转化率,C错误;
D.实验室用铁片和稀硫酸制备H2时,滴入几滴CuSO4溶液,由于铁置换出铜,附在贴片上能够形成许多微小的原电池,从而能加快反应速率,D正确;
故答案为:C。
11.C
【详解】可逆反应必须在同一条件下同时向两个方向进行的反应,①中反应条件不同,不是可逆反应;②中前一个反应物是浓硫酸,后一个反应是生成物为硫酸,不是可逆反应;③④符合要求,属于可逆反应,故选C。
12.C
【详解】①反应前后气体体积相等,压强保持恒定,压强不变不能说明反应达到平衡状态;
②随反应进行,气体的质量增加,容器体积不变,则密度逐渐增大,当密度不变时反应达到平衡状态;
③组份浓度保持不变是化学平衡的重要特征,B的物质的量浓度不变反应达到平衡状态;
④反应前后气体分子数相等,则混合气体总物质的量保持恒定,不能说明反应达到平衡状态;
⑤随反应进行气体的质量逐渐增加,气体的物质的量保持恒定,则混合气体的平均相对分子质量逐渐增大,当平均相对分子质量不变时反应达到平衡状态;
⑥物质C和D的化学计量数之比为1:1,反应速率始终相等,不能说明反应达到平衡状态;
⑦由反应可知随反应进行,气体的质量逐渐增大,当气体质量不变时反应达到平衡状态;
因此不能表明反应达到平衡状态的是:①④⑥;
故选:C。
13.C
【详解】A.反应达到平衡时,化学平衡常数K越大,则反应物生成的生成物的浓度就越大,则反应进行的程度越大,A正确;
B.根据化学平衡常数的含义可知该反应的化学平衡常数K的表达式是K=,B正确;
C.化学平衡常数K只与温度有关,而与反应物浓度无关,C错误;
D.化学平衡常数K随温度的改变而改变,D正确;
故合理选项是C。
14.B
【详解】A. 为可逆反应,和充分反应能放出的热量小于,故A错误;
B. 工业上使用催化剂是通过加快反应速率提高生产效率的,故B正确;
C. 实际工业选用的温度为,是因为此温度下催化剂活性最强,催化剂不能提高的平衡转化率,故C错误;
D. 增大压强,正反应速率增大,逆反应速率也增大,故D错误;
故选B。
15.D
【详解】A. Na的液氨溶液中溶剂合电子是强还原剂,具有强还原性,故A正确;
B. 反应中有生成,该事实说明Na也有一定的吸电子能力,也可表现出非金属性,故B正确;
C. 原子得电子后,半径变大,失电子后半径变不,的半径比Na+的大,故C正确;
D. ,蓝色是生成了溶剂合电子,蒸发液氨的钠溶液时,平衡逆向移动,蓝色会逐渐变浅,故D错误;
故选D。
16.D
【详解】A.由图可知,a中发生的反应为碘离子与银离子反应生成碘化银黄色沉淀,反应是的离子方程式为Ag++I—=AgI↓,故A正确;
B.依据a中现象可知,平衡逆向移动,铁离子浓度增大,但是溶液褪色,说明实验I中的棕黄色可是碘引起的,故B正确;
C.对比b、c实验现象可知,加水的作用是排除稀释对溶液颜色的影响,故C正确;
D.实验a中加入硝酸银溶液生成碘化银沉淀,溶液中碘离子浓度减小,平衡向逆反应方向移动,没有体现碘离子的还原性,故D错误;
故选D。
17.C
【详解】A.K越大,说明反应越完全,CO2的平衡转化率越大,但反应速率受外界因素影响,不一定速率较大,A错误;
B.K只受温度影响,温度不变,则K不变,B错误;
C.升高温度,活化分子百分数增大,反应速率增大,该反应ΔH>0为吸热反应,则升温平衡常数K增大,C正确;
D.加入催化剂,只能改变反应速率,平衡不一移动,则不能提高合成气的平衡产率,D错误;
故选:C。
18.A
【详解】A.NH2COONH4(s)为固体,混合气体的质量为变量,混合气体体积不变,则混合气体的密度为变量,当容器中混合气体的气体密度不变时,表明达到平衡状态,故A正确;
B.铵根和氨分子中均有N-H键,断开6molN-H键则消耗6molNH3,反应物和二氧化碳均含C=O键,形成1moC=O键则生成1molCO2,正逆反应速率不相等,未达到平衡状态,故B错误;
C.只有NH3(g)、CO2(g)为气体,且二者的物质的量之比始终为2:1,则混合气体的平均摩尔质量始终不变,不能判断平衡状态,故C错误;
D.容器中只有NH3和CO2为气体,且NH3和CO2的物质的量之比始终2:1,则NH3的体积分数始终为,不能根据容器中氨气的体积分数判断平衡状态,故D错误;
故选:A。
19.B
【详解】A.该反应在恒容绝热密闭容器中进行,反应前后气体物质的量不变,正反应是放热反应,当容器内压强不再改变时,说明反应放出热量不再发生变化,故可说明反应已达平衡,A正确;
B.在该反应40~50 s内的平均反应速率v(SO3)==0.004 mol/(L·s);反应在50~60 s内的平均反应速率v(SO3)==0.007 mol/(L·s),故反应在40~50 s内的平均反应速率小于50~60 s内的平均反应速率,B错误;
C.由图象可知反应在60 s及80 s时总反应都是正向进行。这两个时刻都是正反应速率大于逆反应速率,又由于t=60 s时比t=80 s反应进行的程度短,反应物浓度大,所以NO2速率v(正)(t=60 s时)大于v(逆)(t=80 s时),C正确;
D.该反应的正反应是放热反应,降低温度,化学平衡向放热的正反应方向移动。根据图象可知:在绝热恒容条件下反应达到平衡时SO3的浓度为0.33 mol·L 1。所以反应若在恒温恒容的容器内进行,反应达到平衡后SO3的浓度大于0.33 mol·L 1,D正确;
故合理选项是B。
20.A
【详解】A.合成氨气的反应为放热反应,升高温度,平衡逆向移动,但升高温度可以加快反应速率,与平衡移动无关,不能用勒夏特烈原理解释,A项选;
B.氯水中存在平衡Cl2+H2OH++Cl-+HClO,用饱和食盐水除去Cl2中的HCl气体,利用的是氯离子浓度增大,使反应Cl2+H2OH++Cl-+HClO的平衡逆向移动,减少氯气的溶解,能用勒夏特烈原理解释,B项不选;
C.NaOH溶于水中放出热量,使溶液温度升高,升高温度促进一水合氨的分解,能用勒夏特烈原理解释,C项不选;
D.煤气中毒病人血液中存在化学平衡:CO(g)+Hb(O2)O2(g)+Hb(CO),CO中毒的病人置于高压氧舱,会使平衡逆向移动,让CO失去和血红蛋白结合的机会,能用勒夏特烈原理解释,D项不选;
答案选A。
21.B
【详解】从第一个图像看出,在p1下先达到平衡,可知p1>p2,则增大压强时,X的转化率增大,说明增大压强平衡正向移动,正反应气体数减小;
根据第二个图像,随着温度的升高,X的转化率减小,说明升温平衡逆向移动,正反应为放热反应;
根据分析,该反应为放热反应;该反应正反应气体数减小,m+n>x;
故答案为:B。
22.A
【解析】由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,反应Ⅱ是硫酸分解为氧气的过程,反应Ⅲ是2HIH2↑+I2↑。
【详解】A.设计该循环是为了制取气体O2和H2,实现了水的分解,制取了能源气体氢气,故A正确;
B.一定条件下,将2molHI放在恒容密闭容器中,该反应为可逆反应,转化率不可能达到100%,生成H2少于1mol,故B错误;
C.H2O属于电解质,但SO2属于非电解质,故C错误;
D.H2SO4、HI为中间产物,二氧化硫和碘为催化剂,故D错误;
故选A。
23.B
【详解】A.开启可乐瓶后,瓶内气体压强减小,平衡向气体体积增大的方向移动,所以泛起大量泡沫,能用勒夏特列原理解释,故A不符合题意;
B.二氧化氮与四氧化二氮的平衡体系:,按勒夏特列原理,加压平衡右移、二氧化氮的物质的量减少、但缩小体积后二氧化氮浓度增大了导致颜色加深,故不能用勒夏特列原理解释,故B符合题意;
C.石蕊是有机弱酸,存在电离平衡,加入酸,增加c(H+),平衡向逆反应方向移动,符合勒夏特列原理,故C不符合题意;
D.使用过量的空气,增大了反应物氧气的量,可以使化学平衡向正反应方向移动,提高SO2的利用率,能用勒夏特列原理解释,故D不符合题意;
故选B。
24.D
【详解】A.已知反应Ⅱ是一个正反应为气体体积增大的方向,即增大压强,平衡逆向移动,则同温下压强越大,越小,结合题干图示信息可知,压强大小:,A错误;
B.由题干图示信息可知,压强相同的情况下,升高温度,减小,说明升高温度,反应I的平衡正向移动,则正反应是一个吸热反应,即在如图所示条件下,反应I可表示为 ,B错误;
C.由题干图示信息可知,选择反应Ⅱ的小于反应I的条件,将C与ZnO置于同一密闭容器中,此时反应I的平衡常数为K=在0.1~10左右,平衡常数很小,即碳热还原氧化锌反应不能顺利进行,C错误;
D.总反应ZnO+C→Zn+CO,一定条件下将C与ZnO置于同一密闭容器中反应,当时,增大的值则主要生成锌和CO,故可减少平衡时气体中的含量,D正确;
故答案为:D。
25.D
【详解】A.平衡常数K只和温度有关,温度不变,K不变,而M、Q的温度相同,所以K(M)=K(Q);对于放热反应而言,升高温度,平衡常数K减小,曲线c的温度比曲线b的温度高,所以K(M)>K(N);综上所述,K(M)=K(Q)>K(N),A错误;
B.从Q到M,压强增大,平衡向右移动,B错误;
C.Q与M的温度相同,但是M的压强更大,所以M的反应速率更快,则达到平衡所需的时间:tQ>tM;该反应是放热反应,升高温度,平衡向左移动,NH3的百分含量会减小,所以曲线b的温度比曲线c的温度低,即压强相同的情况下,N的温度比M的温度高,则N的反应速率更快,所以tM>tN;综上所述,M、N、Q达到平衡所需时间是:tQ>tM>tN,C错误;
D.该反应是可逆反应,不能完全进行,则容器中充入1mol N2和3mol H2时,反应达到平衡时放出的热量小于92.2kJ,D正确;
故选D。
26.(1)ABD
(2)CD
(3)不变
【详解】(1)A.、、的体积分数不再发生变化,说明到达平衡,故A正确;
B.依据方程式可知,体系的压强变小,所以压强保持不变说明是化学平衡,故B正确;
C.混合气体总质量不变,容器容积不变,混合气体的始终密度不变,故C错误;
D.混合气体总质量不变,随反应进行混合气体总物质的量减小,平均相对分子质量减小,混合气体的相对平均分子质量不变,说明到达平衡,故D正确;
故答案选ABD。
(2)平衡后维持容器的温度不变,将容器的容积扩大一倍平衡逆向移动,CO的物质的量增大,由勒夏特列原理可知CO的浓度会减小;平衡常数只与温度有关,温度不变平衡常数不变;
故答案选CD。
(3)加入惰性气体加压,恒温恒容下平衡不移动,维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,CO、CH3OH的浓度之比将不变。
27.(1)A(g)+2B(g)2C(g)
(2) 30%
(3)减小
【详解】(1)根据图知,A、B为反应物,而C为生成物,3min内△n(A)=(1-0.7)mol=0.3mol、△n(B)=(1-0.4)mol=0.6mol、△n(C)=(0.6-0)mol=0.6mol,相同时间内各物质的物质的量变化量之比等于其计量数之比,则A、B、C的计量数之比=0.3mol:0.6mol:0.6mol=1:2:2,则该反应方程式为A(g)+2B(g)2C(g);
(2)该反应方程式为A(g)+2B(g)2C(g),平衡常数表达式K=;达到平衡时,A的转化率是:
(3)若该反应ΔH <0,升高温度,平衡逆向移动,K会减小。
28. 1 a 3a
【分析】(1)根据方程式知,生成amolC消耗amolA;
(2)恒温恒压下,若开始时放入3molA、3molB,与(1)中各物质浓度分别相等,则(1)(2)中转化率相等;
(3)若在(2)的平衡混合物中再加入3mol C,与(1)相比,为(1)的6倍,则平衡时n(C)=6amol,混合气体总物质的量=(6+6-6a)mol。
【详解】(1)根据方程式知,生成amolC消耗amolA,则平衡时A的物质的量为(1 a)mol;
(2)恒温恒压下,若开始时放入3molA、3molB,与(1)中各物质浓度分别相等,则(1)(2)中转化率相等,则生成的C是(1)中3倍,为3amol;
(3)若在(2)的平衡混合物中再加入3mol C,与(1)相比,为(1)的6倍,则平衡时n(C)=6amol,混合气体总物质的量=(6+6 6a)mol,则C的物质的量分数=
=
一、单选题
1.在下列反应中:A2(g)+B2(g) 2AB(g) ΔH<0当其达到平衡时,在下图所示的曲线中,符合勒夏特列原理的是
A.①② B.③④ C.① D.①⑤
2.对可逆反应,下列叙述正确的是
A.达到化学平衡时,
B.加入合适的催化剂,可使平衡正向移动
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.保持容器容积不变,向其中加入1molHe,化学反应速率增大
3.下列事实不能用勒夏特列原理解释的是
A.对于平衡体系,增大压强(缩小容积)可使颜色变深
B.合成氨工业上,采用高压以提高的产率
C.氯水宜保存在低温、避光条件下
D.向氯水中加入适量石灰石,可增强漂白效果。
4.温度为T时,将NH4HS(s)置于抽成真空的容器中,当NH4HS(s) NH3(g)+H2S(g)达到平衡时,测得体系的总压强为6 kpa,则该反应的平衡常数Kp为
A.6 (kpa)2 B.9(kpa)2 C.8 (kpa)2 D.36 (kpa)2
5.如表是几种物质在指定温度下的溶解度。工业上将相同物质的量的NaCl、CO2、NH3在30℃时配成溶液,此时溶液中无晶体析出。当降温至某温度时,开始析出晶体,此晶体是
温度/℃ 溶解度/g 盐 0 10 20 30
NH4Cl 29.4 33.3 37.2 41.1
NH4HCO3 11.9 15.9 21.0 27.0
NaHCO3 6.9 8.15 9.6 11.1
NaCl 35.7 35.8 36.0 36.4
A.NH4Cl B.NH4HCO3 C.NaHCO3 D.NaCl
6.反应Ⅰ:H2(g) + I2(g) 2HI(g)的平衡常数为 K1;反应Ⅱ:HI(g) 1/2 H2(g) +1/2 I2(g) 的平衡常数为K2,上述反应的平衡常数为同温度下的测定值,则 K1、K2的关系为
A.K1=1/K2 B.K1 = 1/2 K2 C.1/2K1 = K2 D.K1=1/K
7.下列说法正确的是
A.升高温度,会使单位体积内分子数增多,从而加快化学反应速率
B.(蓝色)(黄色) ,稀溶液受热颜色变黄
C.达平衡后,加入少量KCl固体,溶液红色变浅
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,溶液变为黄色
8.—定条件下,合成乙烯的反应为6H2(g)+2CO2(g)C2H4(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
A.该反应的逆反应为放热反应
B.生成乙烯的速率:(N)一定大于(M)
C.增大压强,平衡正向移动,平衡常数K的值将增大
D.当温度高于250℃,升高温度,催化剂的催化效率会降低
9.已知反应:2X(1)Y(1),取等量X,分别在0℃和20℃下,测得其转化率随时间变化的关系曲线(α-t)如图所示。下列说法正确的是
A.曲线Ⅰ代表0℃下X的α-t曲线
B.反应进行到66min时,Y的物质的量为0.113mol
C.该反应ΔH>0
D.加入催化剂,X的平衡转化率升高
10.下列说法不正确的是
A.平衡移动,平衡常数不一定改变;平衡常数改变,平衡一定移动
B.对于任何化学反应来说,反应速率加快,反应进行的程度不一定越大
C.工业合成氨中,升温有利于提高反应速率和原料平衡转化率
D.实验室用铁片和稀硫酸制备H2时,滴入几滴CuSO4溶液,能加快反应速率
11.下列各组两个反应互为可逆反应的是( )
①2H2+O22H2O与2H2O2H2↑+O2↑
②H2SO4(浓)+2HBr=2H2O+Br2+SO2↑与Br2+SO2+2H2O=2HBr+H2SO4
③2NO2=N2O4与N2O4=2NO2
④2SO2+O22SO3与2SO32SO2+O2
A.①② B.②③ C.③④ D.②④
12.在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明反应已达到化学平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量的浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C和D的反应速率相等 ⑦混合气体总质量
A.②③⑦ B.④⑤⑥ C.①④⑥ D.②④⑦
13.在某温度下,可逆反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K,下列说法不正确的是
A.K越大,达到平衡时,反应进行的程度越大 B.K的表达式是
C.K随反应物浓度的改变而改变 D.K随温度的改变而改变
14.二氧化硫的催化氧化是工业制硫酸的基础:。下列叙述正确的是
A.和充分反应能放出的热量
B.工业上使用催化剂是通过加快反应速率提高生产效率的
C.实际工业选用的温度为,其目的是为了提高的平衡转化率
D.增大压强,正反应速率增大,逆反应速率减小
15.金属Na溶解于液氨中形成蓝色溶液,反应为,蓝色是生成了溶剂合电子(强还原剂)的缘故;向该溶液中加入穴醚类配体L,得到化合物(反应中有生成)。下列说法错误的是
A.Na的液氨溶液具有强还原性 B.该事实说明Na也可表现出非金属性
C.的半径比Na+的大 D.蒸发液氨的钠溶液时,蓝色会逐渐加深
16.研究“2Fe3++2I—2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图:
下列说法不正确的是
A.a中生成黄色沉淀的反应是:Ag++I—=AgI↓
B.可依据a中现象推测,实验I中的棕黄色主要是I2引起的
C.加水的作用是排除稀释对溶液颜色的影响
D.还原性:实验a中I—>Fe2+,实验b中I—
A.K越大,说明反应速率、CO2的平衡转化率越大
B.增大压强,平衡向逆反应方向移动,K减小
C.升高温度,反应速率和平衡常数K都增大
D.加入催化剂,能提高合成气的平衡产率
18.将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:NH2COONH4(s)2NH3(g)+CO2(g)。下列可判断该反应已达到平衡的是
A.容器中气体的密度不变
B.相同时间内,断开6molN-H键同时形成1moC=O键
C.容器中气体的平均摩尔质量不变
D.容器中氨气的体积分数不变
19.T℃时,向绝热恒容密闭容器中通入a mol SO2和b mol NO2,一定条件下发生反应:SO2(g)+NO2(g) SO3(g)+NO(g) ΔH<0,测得SO3的浓度随时间变化如图所示,
下列说法不正确的是
A.容器内压强不再改变说明反应已达平衡
B.SO3在40~50 s内的平均反应速率大于50~60 s内的平均反应速率
C.NO2速率v(正)(t=60 s时)大于v(逆)(t=80 s时)
D.T℃时,若在恒温恒容下,向原容器通入a mol SO2和b mol NO2,达到平衡时c(SO3)>0.33 mol·L 1
20.下列事实不能用勒夏特烈原理解释的是
A.工业合成氨采用400 K的高温 B.用饱和食盐水除去Cl2中的HCl气体
C.可用浓氨水和氢氧化钠固体快速制取氨气 D.对CO中毒病人给予高压氧舱治疗
21.可逆反应mX(g)+nY(g)xZ(g)在不同温度及压强(p1和p2)条件下反应物X的转化率的变化情况如图所示。下列判断正确的是
A.正反应放热,m+n
C.正反应吸热,m+n
22.碘硫热化学循环如图所示,该过程由反应Ⅰ、Ⅱ、Ⅲ三步组成,下列说法正确的是
A.该循环实现了水的分解,制取了能源气体氢气
B.一定条件下,将2molHI放在恒容密闭容器中,一定能生成1molH2
C.H2O和SO2属于电解质
D.H2SO4为催化剂
23.化学和生活密切相关,下列生产生活实例中不能用勒夏特列原理解释的是
A.摇晃后的可乐开启后有大量气泡
B.二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
C.酸遇紫色石蕊试剂变红
D.生产硫酸的过程中用过量的空气和二氧化硫反应
24.碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应I ;
反应Ⅱ
在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中随温度变化的关系如图所示。下列说法正确的是
A.压强大小:
B.在如图所示条件下,反应I可表示为
C.选择反应Ⅱ的小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行
D.一定条件下将C与ZnO置于同一密闭容器中反应,当时,增大的值,可减少平衡时气体中的含量
25.已知、下 。在反应器中按投料后,在不同温度下,反应达到平衡时,得到混合物中的质量分数随压强的变化曲线a、b、c如图所示。下列说法正确的是
A.图中M、N、Q点平衡常数K的大小关系为
B.从Q到M,平衡向左移动
C.M、N、Q达到平衡所需时间关系为
D.该条件下,向反应器中充入和,则反应达平衡时放出热量小于
二、填空题
26.一定条件下,在2L恒容密闭容器中投入1molCO和2molH2,发生反应CO(g)+2H2(g) CH3OH(g)。
(1)能说明该反应达到平衡状态的是___________。
A.CH3OH的体积分数保持不变 B.容器内的总压强保持不变
C.混合气体的密度保持不变 D.混合气体的平均摩尔质量保持不变
(2)达平衡后,维持容器的温度不变,将容器的容积扩大一倍,下列说法正确的是___________。
A.平衡向正反应方向移动 B.CO的浓度增大
C.平衡常数不变 D.CO的物质的量增大
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,CO、CH3OH的浓度之比将 (填“增大”“减小”或“不变”)。
27.一定条件下,在容积为5L的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。
甲
(1)该反应的化学方程式 。
(2)该反应的平衡常数的表达式为: ,达到平衡时,A的转化率是: 。
(3)若该反应ΔH <0,升高温度,K会 (填“增大”“减小”或“不变”)。
28.恒温、恒压下,在一个可变容积的容器中发生如下发应:A(g)+B(g)C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若在(2)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
试卷第1页,共3页
参考答案:
1.D
【分析】勒夏特列原理的具体内容为:如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。
【详解】该反应正反应是放热反应,升高温度平衡逆向移动,AB的体积分数降低,由左图可知,曲线①符合变化;
该反应反应前后气体的体积不变,增大压强,平衡不移动,AB的体积分数不变,由右图可知,曲线⑤符合变化;
故答案选D。
2.A
【详解】A. 时,正逆反应速率相等,反应达到平衡状态,故A正确;
B. 加入合适的催化剂,只改变反应速率,不影响平衡移动,故B错误;
C. 达到化学平衡时,若增大容器体积,反应体系中各组分的浓度都减小,则正逆反应速率都减小,故C错误;
D. 保持容器容积不变,向其中加入1molHe,各组分的浓度不变,化学反应速率不变,故D错误;
答案选A。
3.A
【详解】A.反应为气体分子数不变的反应,对于平衡体系,增大压强(缩小容积),物质浓度变大,可使颜色变深,但是平衡不移动,不能用勒夏特列原理解释,A符合题意;
B.合成氨为气体分子数减小的反应,采用高压平衡正向,可以提高的产率,能用勒夏特列原理解释,B不符合题意;
C.低温、避光条件下可以防止平衡向次氯酸分解的方向移动,能用勒夏特列原理解释,C不符合题意;
D.向氯水中加入适量石灰石,碳酸钙和氢离子反应导致氯水和水的反应正向移动,次氯酸浓度变大,可增强漂白效果,能用勒夏特列原理解释,D不符合题意;
故选A。
4.B
【详解】总压强为6kpa,所以P(NH3)=P(H2S)=3kpa。Kp==9(kpa)2,故选B。
5.C
【详解】据表中数据可知,相同温度下,NaHCO3的溶解度最小,故降温时首先析出的物质应是NaHCO3,综上所述C正确;
故答案为:C。
6.D
【详解】反应Ⅰ=反应Ⅱ2,K1=,K2=,则K1=;故答案选D。
7.B
【详解】A.升高温度,分子吸收能量,单位体积内分子总数不变,活化分子总数变多,活化分子百分数变大,碰撞几率增大,从而加快化学反应速率,故A错误;
B.(蓝色)(黄色) ,稀溶液受热,平衡正向移动,因此溶液颜色变黄,故B正确;
C.达平衡后,该反应的实质是,加入少量KCl固体,离子浓度不变,平衡不移动,故C错误;
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,氢离子浓度增大,平衡逆向移动,溶液变为橙色,故D错误;
综上所述,答案为B。
8.D
【详解】A.升高温度二氧化碳转化率减小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,逆反应为吸热反应,A错误;
B.温度越高化学反应速率越快,催化剂的催化效率越高化学反应速率越快,根据图知,M点催化效率大于N点但M点温度小于N点,催化效率大于温度对反应速率影响,则M点反应速率大于N点,B错误;
C.化学平衡常数只与温度有关,温度不变化学平衡常数不变,C错误;
D.根据图知,温度高于250℃,升高温度,催化剂的催化效率会降低,D正确;
故答案为:D。
9.A
【详解】A.据图可知,平衡前反应相同时间,曲线Ⅰ所示条件下转化率更小,即反应速率更慢,温度越低反应速率越小,所以曲线Ⅰ代表0℃下X的α-t曲线,A正确;
B.据图可知反应进行到66min时,X的转化率为0.113,但初始投料未知,所以无法计算此时Y的物质的量,B错误;
C.曲线Ⅱ所示温度更高,但平衡时X的转化率低,说明升高温度平衡逆向移动,正反应为放热反应,ΔH<0,C错误;
D.催化剂可以加快反应速率,但不能改变平衡转化率,D错误;
综上所述答案为A。
10.C
【详解】A.平衡常数仅仅是温度的函数,温度不变,即平衡移动,平衡常数也不改变,温度改变,平衡必然移动,平衡常数也必然改变,而平衡常数改变,说明温度改变,改变温度平衡一定移动,A正确;
B.升高温度任何化学反应速率均增大,但升高温度有的反应平衡正向移动,有的平衡逆向移动,故对于任何化学反应来说,反应速率加快,反应进行的程度不一定越大,B正确;
C.已知工业合成氨正反应为放热反应,故升温有利于提高反应速率,但平衡逆向移动,不利于提高原料平衡转化率,C错误;
D.实验室用铁片和稀硫酸制备H2时,滴入几滴CuSO4溶液,由于铁置换出铜,附在贴片上能够形成许多微小的原电池,从而能加快反应速率,D正确;
故答案为:C。
11.C
【详解】可逆反应必须在同一条件下同时向两个方向进行的反应,①中反应条件不同,不是可逆反应;②中前一个反应物是浓硫酸,后一个反应是生成物为硫酸,不是可逆反应;③④符合要求,属于可逆反应,故选C。
12.C
【详解】①反应前后气体体积相等,压强保持恒定,压强不变不能说明反应达到平衡状态;
②随反应进行,气体的质量增加,容器体积不变,则密度逐渐增大,当密度不变时反应达到平衡状态;
③组份浓度保持不变是化学平衡的重要特征,B的物质的量浓度不变反应达到平衡状态;
④反应前后气体分子数相等,则混合气体总物质的量保持恒定,不能说明反应达到平衡状态;
⑤随反应进行气体的质量逐渐增加,气体的物质的量保持恒定,则混合气体的平均相对分子质量逐渐增大,当平均相对分子质量不变时反应达到平衡状态;
⑥物质C和D的化学计量数之比为1:1,反应速率始终相等,不能说明反应达到平衡状态;
⑦由反应可知随反应进行,气体的质量逐渐增大,当气体质量不变时反应达到平衡状态;
因此不能表明反应达到平衡状态的是:①④⑥;
故选:C。
13.C
【详解】A.反应达到平衡时,化学平衡常数K越大,则反应物生成的生成物的浓度就越大,则反应进行的程度越大,A正确;
B.根据化学平衡常数的含义可知该反应的化学平衡常数K的表达式是K=,B正确;
C.化学平衡常数K只与温度有关,而与反应物浓度无关,C错误;
D.化学平衡常数K随温度的改变而改变,D正确;
故合理选项是C。
14.B
【详解】A. 为可逆反应,和充分反应能放出的热量小于,故A错误;
B. 工业上使用催化剂是通过加快反应速率提高生产效率的,故B正确;
C. 实际工业选用的温度为,是因为此温度下催化剂活性最强,催化剂不能提高的平衡转化率,故C错误;
D. 增大压强,正反应速率增大,逆反应速率也增大,故D错误;
故选B。
15.D
【详解】A. Na的液氨溶液中溶剂合电子是强还原剂,具有强还原性,故A正确;
B. 反应中有生成,该事实说明Na也有一定的吸电子能力,也可表现出非金属性,故B正确;
C. 原子得电子后,半径变大,失电子后半径变不,的半径比Na+的大,故C正确;
D. ,蓝色是生成了溶剂合电子,蒸发液氨的钠溶液时,平衡逆向移动,蓝色会逐渐变浅,故D错误;
故选D。
16.D
【详解】A.由图可知,a中发生的反应为碘离子与银离子反应生成碘化银黄色沉淀,反应是的离子方程式为Ag++I—=AgI↓,故A正确;
B.依据a中现象可知,平衡逆向移动,铁离子浓度增大,但是溶液褪色,说明实验I中的棕黄色可是碘引起的,故B正确;
C.对比b、c实验现象可知,加水的作用是排除稀释对溶液颜色的影响,故C正确;
D.实验a中加入硝酸银溶液生成碘化银沉淀,溶液中碘离子浓度减小,平衡向逆反应方向移动,没有体现碘离子的还原性,故D错误;
故选D。
17.C
【详解】A.K越大,说明反应越完全,CO2的平衡转化率越大,但反应速率受外界因素影响,不一定速率较大,A错误;
B.K只受温度影响,温度不变,则K不变,B错误;
C.升高温度,活化分子百分数增大,反应速率增大,该反应ΔH>0为吸热反应,则升温平衡常数K增大,C正确;
D.加入催化剂,只能改变反应速率,平衡不一移动,则不能提高合成气的平衡产率,D错误;
故选:C。
18.A
【详解】A.NH2COONH4(s)为固体,混合气体的质量为变量,混合气体体积不变,则混合气体的密度为变量,当容器中混合气体的气体密度不变时,表明达到平衡状态,故A正确;
B.铵根和氨分子中均有N-H键,断开6molN-H键则消耗6molNH3,反应物和二氧化碳均含C=O键,形成1moC=O键则生成1molCO2,正逆反应速率不相等,未达到平衡状态,故B错误;
C.只有NH3(g)、CO2(g)为气体,且二者的物质的量之比始终为2:1,则混合气体的平均摩尔质量始终不变,不能判断平衡状态,故C错误;
D.容器中只有NH3和CO2为气体,且NH3和CO2的物质的量之比始终2:1,则NH3的体积分数始终为,不能根据容器中氨气的体积分数判断平衡状态,故D错误;
故选:A。
19.B
【详解】A.该反应在恒容绝热密闭容器中进行,反应前后气体物质的量不变,正反应是放热反应,当容器内压强不再改变时,说明反应放出热量不再发生变化,故可说明反应已达平衡,A正确;
B.在该反应40~50 s内的平均反应速率v(SO3)==0.004 mol/(L·s);反应在50~60 s内的平均反应速率v(SO3)==0.007 mol/(L·s),故反应在40~50 s内的平均反应速率小于50~60 s内的平均反应速率,B错误;
C.由图象可知反应在60 s及80 s时总反应都是正向进行。这两个时刻都是正反应速率大于逆反应速率,又由于t=60 s时比t=80 s反应进行的程度短,反应物浓度大,所以NO2速率v(正)(t=60 s时)大于v(逆)(t=80 s时),C正确;
D.该反应的正反应是放热反应,降低温度,化学平衡向放热的正反应方向移动。根据图象可知:在绝热恒容条件下反应达到平衡时SO3的浓度为0.33 mol·L 1。所以反应若在恒温恒容的容器内进行,反应达到平衡后SO3的浓度大于0.33 mol·L 1,D正确;
故合理选项是B。
20.A
【详解】A.合成氨气的反应为放热反应,升高温度,平衡逆向移动,但升高温度可以加快反应速率,与平衡移动无关,不能用勒夏特烈原理解释,A项选;
B.氯水中存在平衡Cl2+H2OH++Cl-+HClO,用饱和食盐水除去Cl2中的HCl气体,利用的是氯离子浓度增大,使反应Cl2+H2OH++Cl-+HClO的平衡逆向移动,减少氯气的溶解,能用勒夏特烈原理解释,B项不选;
C.NaOH溶于水中放出热量,使溶液温度升高,升高温度促进一水合氨的分解,能用勒夏特烈原理解释,C项不选;
D.煤气中毒病人血液中存在化学平衡:CO(g)+Hb(O2)O2(g)+Hb(CO),CO中毒的病人置于高压氧舱,会使平衡逆向移动,让CO失去和血红蛋白结合的机会,能用勒夏特烈原理解释,D项不选;
答案选A。
21.B
【详解】从第一个图像看出,在p1下先达到平衡,可知p1>p2,则增大压强时,X的转化率增大,说明增大压强平衡正向移动,正反应气体数减小;
根据第二个图像,随着温度的升高,X的转化率减小,说明升温平衡逆向移动,正反应为放热反应;
根据分析,该反应为放热反应;该反应正反应气体数减小,m+n>x;
故答案为:B。
22.A
【解析】由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,反应Ⅱ是硫酸分解为氧气的过程,反应Ⅲ是2HIH2↑+I2↑。
【详解】A.设计该循环是为了制取气体O2和H2,实现了水的分解,制取了能源气体氢气,故A正确;
B.一定条件下,将2molHI放在恒容密闭容器中,该反应为可逆反应,转化率不可能达到100%,生成H2少于1mol,故B错误;
C.H2O属于电解质,但SO2属于非电解质,故C错误;
D.H2SO4、HI为中间产物,二氧化硫和碘为催化剂,故D错误;
故选A。
23.B
【详解】A.开启可乐瓶后,瓶内气体压强减小,平衡向气体体积增大的方向移动,所以泛起大量泡沫,能用勒夏特列原理解释,故A不符合题意;
B.二氧化氮与四氧化二氮的平衡体系:,按勒夏特列原理,加压平衡右移、二氧化氮的物质的量减少、但缩小体积后二氧化氮浓度增大了导致颜色加深,故不能用勒夏特列原理解释,故B符合题意;
C.石蕊是有机弱酸,存在电离平衡,加入酸,增加c(H+),平衡向逆反应方向移动,符合勒夏特列原理,故C不符合题意;
D.使用过量的空气,增大了反应物氧气的量,可以使化学平衡向正反应方向移动,提高SO2的利用率,能用勒夏特列原理解释,故D不符合题意;
故选B。
24.D
【详解】A.已知反应Ⅱ是一个正反应为气体体积增大的方向,即增大压强,平衡逆向移动,则同温下压强越大,越小,结合题干图示信息可知,压强大小:,A错误;
B.由题干图示信息可知,压强相同的情况下,升高温度,减小,说明升高温度,反应I的平衡正向移动,则正反应是一个吸热反应,即在如图所示条件下,反应I可表示为 ,B错误;
C.由题干图示信息可知,选择反应Ⅱ的小于反应I的条件,将C与ZnO置于同一密闭容器中,此时反应I的平衡常数为K=在0.1~10左右,平衡常数很小,即碳热还原氧化锌反应不能顺利进行,C错误;
D.总反应ZnO+C→Zn+CO,一定条件下将C与ZnO置于同一密闭容器中反应,当时,增大的值则主要生成锌和CO,故可减少平衡时气体中的含量,D正确;
故答案为:D。
25.D
【详解】A.平衡常数K只和温度有关,温度不变,K不变,而M、Q的温度相同,所以K(M)=K(Q);对于放热反应而言,升高温度,平衡常数K减小,曲线c的温度比曲线b的温度高,所以K(M)>K(N);综上所述,K(M)=K(Q)>K(N),A错误;
B.从Q到M,压强增大,平衡向右移动,B错误;
C.Q与M的温度相同,但是M的压强更大,所以M的反应速率更快,则达到平衡所需的时间:tQ>tM;该反应是放热反应,升高温度,平衡向左移动,NH3的百分含量会减小,所以曲线b的温度比曲线c的温度低,即压强相同的情况下,N的温度比M的温度高,则N的反应速率更快,所以tM>tN;综上所述,M、N、Q达到平衡所需时间是:tQ>tM>tN,C错误;
D.该反应是可逆反应,不能完全进行,则容器中充入1mol N2和3mol H2时,反应达到平衡时放出的热量小于92.2kJ,D正确;
故选D。
26.(1)ABD
(2)CD
(3)不变
【详解】(1)A.、、的体积分数不再发生变化,说明到达平衡,故A正确;
B.依据方程式可知,体系的压强变小,所以压强保持不变说明是化学平衡,故B正确;
C.混合气体总质量不变,容器容积不变,混合气体的始终密度不变,故C错误;
D.混合气体总质量不变,随反应进行混合气体总物质的量减小,平均相对分子质量减小,混合气体的相对平均分子质量不变,说明到达平衡,故D正确;
故答案选ABD。
(2)平衡后维持容器的温度不变,将容器的容积扩大一倍平衡逆向移动,CO的物质的量增大,由勒夏特列原理可知CO的浓度会减小;平衡常数只与温度有关,温度不变平衡常数不变;
故答案选CD。
(3)加入惰性气体加压,恒温恒容下平衡不移动,维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,CO、CH3OH的浓度之比将不变。
27.(1)A(g)+2B(g)2C(g)
(2) 30%
(3)减小
【详解】(1)根据图知,A、B为反应物,而C为生成物,3min内△n(A)=(1-0.7)mol=0.3mol、△n(B)=(1-0.4)mol=0.6mol、△n(C)=(0.6-0)mol=0.6mol,相同时间内各物质的物质的量变化量之比等于其计量数之比,则A、B、C的计量数之比=0.3mol:0.6mol:0.6mol=1:2:2,则该反应方程式为A(g)+2B(g)2C(g);
(2)该反应方程式为A(g)+2B(g)2C(g),平衡常数表达式K=;达到平衡时,A的转化率是:
(3)若该反应ΔH <0,升高温度,平衡逆向移动,K会减小。
28. 1 a 3a
【分析】(1)根据方程式知,生成amolC消耗amolA;
(2)恒温恒压下,若开始时放入3molA、3molB,与(1)中各物质浓度分别相等,则(1)(2)中转化率相等;
(3)若在(2)的平衡混合物中再加入3mol C,与(1)相比,为(1)的6倍,则平衡时n(C)=6amol,混合气体总物质的量=(6+6-6a)mol。
【详解】(1)根据方程式知,生成amolC消耗amolA,则平衡时A的物质的量为(1 a)mol;
(2)恒温恒压下,若开始时放入3molA、3molB,与(1)中各物质浓度分别相等,则(1)(2)中转化率相等,则生成的C是(1)中3倍,为3amol;
(3)若在(2)的平衡混合物中再加入3mol C,与(1)相比,为(1)的6倍,则平衡时n(C)=6amol,混合气体总物质的量=(6+6 6a)mol,则C的物质的量分数=
=
