4.1.1原子结构 课件 (共24张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.1原子结构 课件 (共24张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-09 22:24:57 | ||
图片预览





文档简介
(共24张PPT)
第一节 原子结构与元素周期表
第四章 物质结构 元素周期律
第1课时.原子的构成
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.知道原子的结构及构成原子的微粒间的关系。
2.根据原子核外电子的排布规律,能画出1~20号元素的原子结构示意图。
1.了解预测、假没、模型等方法在科学家研究原子结构中的作用。
2.通过原子结构的微观模型的建立,形成原子核外电子排布的初步模型
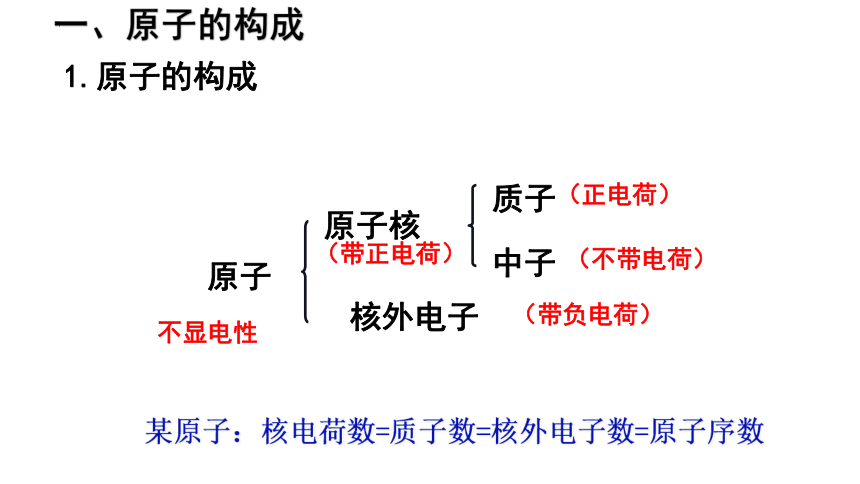
原子
原子核
核外电子
质子
中子
(带正电荷)
不显电性
(带负电荷)
(正电荷)
(不带电荷)
某原子:核电荷数=质子数=核外电子数=原子序数
一、原子的构成
1.原子的构成
1、质量数:原子的质量主要集中在原子核上,质子和中子的相
对质量都近似为1,忽略电子的质量,将原子核内所有质子和中子
的相对质量取近似整数值相加,所得的数值叫做质量数,符号为 A.
质量数(A) = 质子数(Z) + 中子数(N)
质量数 ≈ 原子的相对原子质量
2.质量数
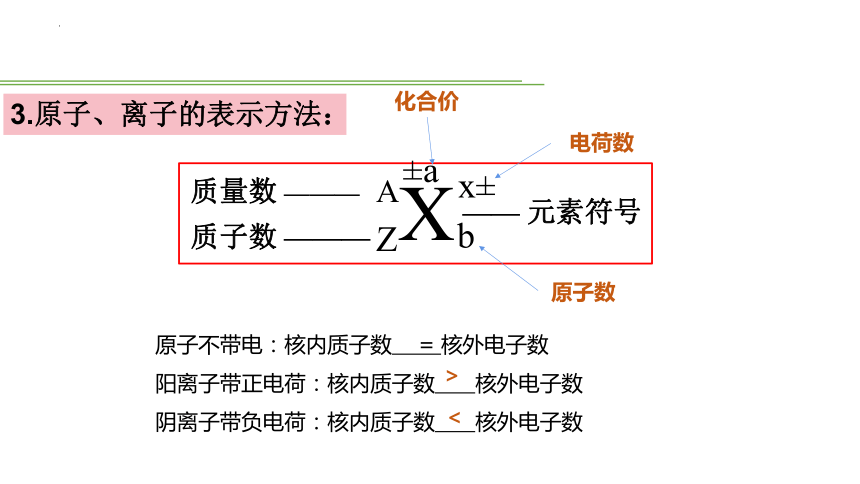
X
A
Z
—— 元素符号
质量数 ———
质子数 ———
3.原子、离子的表示方法:
±a
化合价
x±
电荷数
b
原子数
原子不带电:核内质子数 = 核外电子数
阳离子带正电荷:核内质子数 核外电子数
阴离子带负电荷:核内质子数 核外电子数
>
<
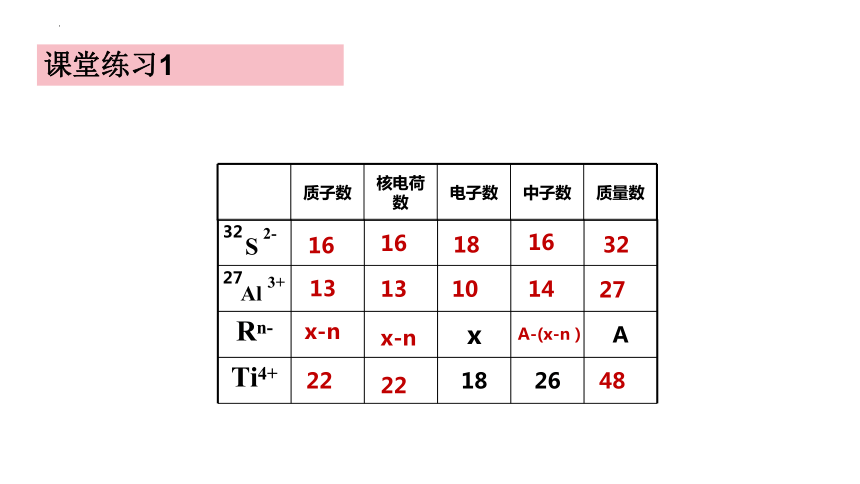
32
27
Rn- x A
Ti4+ 18 26
S
Al
2-
3+
质子数 核电荷数 电子数 中子数 质量数
16
13
22
16
18
16
32
13
10
14
27
x-n
A-(x-n)
x-n
22
48
课堂练习1
1、电子层: 电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,称之为电子层;电子层用“n”表示
二、原子核外电子的排布
N
M
L
K
原子核
+11
2
8
1
K L M
Na
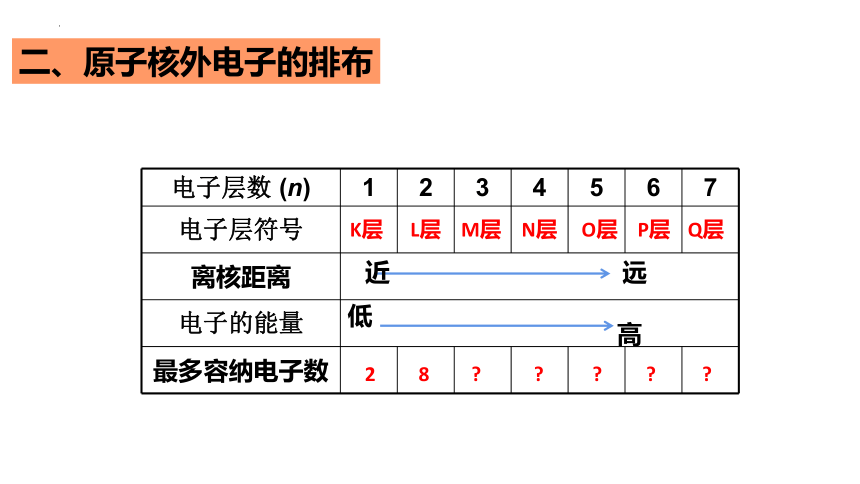
二、原子核外电子的排布
电子层数 (n) 1 2 3 4 5 6 7
电子层符号
离核距离 电子的能量 最多容纳电子数
K层
L层
M层
N层
O层
P层
Q层
2
8
远
近
高
低
2.核外电子的分层排布
(1)在多电子的原子中,电子的能量是不相同。
在离原子核远的电子,能量较高。
(2)在离原子核近的电子,能量较低。
(3)核外电子的分层排布:由于核外电子的能量不同,
在不区域运动,即核外电子的分层运动。
2n2
(1)当K层为最外层时,最多能容纳的电子数是多少?
(2)除了K层,其他各层为最外层时,最多能容纳的电子数时多少?
(3)次外层最多能容纳的电子数时多少?
(4)你能归纳出第n层最多能容纳的电子数吗?
思考与讨论:探究原子核外电子排布规律
【问题与讨论 】下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?请思考并讨论下列问题。
2
2n2
8
最多不超过18个
3.原子核外电子的排布规律(阅读P87表,总结)
(1)最外层电子数不超过_____个(当K层为最外层时不超过____个)。
(2)次外层电子数不超过_____个。
(3)倒数第三层电子数不超过 32个。
(4)各电子层最多能容纳_______个电子(n为电子层数)。
(5)核外电子总是尽可能先从_____ 排起,当一层_____后再填充下一层,即按K→L→M……由里向外(能量由低到高)的顺序排列。
2n2
8
2
18
能量最低内层
充满
三.原子核外电子排布的表示方法
1.原子结构示意图
(1)钠的原子结构示意图:
画出下列原子或离子的结构示意图。
①S______,S2-_______ ;②Ca______ ,Ca2+______。
课堂练习2
根据1-20号元素的原子或离子核外电子的排布特征→元素推断
核外电子数总数等于电子层数的元素 H
最外层电子数是次外层电子数的2倍的元素:C
最外层电子数是电子层数的3倍的元素:O
电子层数是最外层电子数3倍的元素:Na
与Ne原子电子层结构相同的离子:F- O2- N3- Na+ Mg2+ Al3+
与Ar原子电子层结构相同的离子:Cl- S2- P3- K+ Ca2+
3.元素推断
(1)“10电子”微粒
4.核外电子数总数相同的微粒可以是分子,原子,也可以是离子;可以是单核微粒,也可以是多核微粒。
原子结构
电子排布
课堂练习三
1:依据前20号元素的原子结构特点,回答下列问题:
内层电子数之和是最外层电子数2倍的元素:________。
L层与K层电子数之差是电子层数的2.5倍的元素:_____。
最外层电子数是电子层数2倍的元素:____________。
电子层数与最外层电子数相等的元素:_____________。
次外层电子数是最外层电子数的2倍的元素:_________。
最外层电子数是次外层电子数的2倍的元素:_____;是次外层3倍的是:_____ ;是次外层1.5倍的是:_____。
最外层电子数等于次外层电子数的元素:__________。
最外层有1个电子的元素:________________;最外层有2个电子的元素:____________________。
H Li Na K
Be Mg Ca He
Be Ar
C
O
B
Li Si
H Be Al
He C S
F
Li P
(1)原子呈电中性是因为中子不带电( )
(2)质子数和中子数决定原子的质量( )
(3)原子的质量数就是原子的相对原子质量( )
(4)微粒中的质子数与核外电子数一定相等( )
(5)某种氯原子的中子数是18,则其质量数是35,核外电子数是17( )
×
√
×
×
√
2.判断下列说法是否正确
课堂练习三
课堂练习三
3.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是( )
A.硅原子和钠原子 B.硼原子和氢原子
C.氮原子和碳原子 D.碳原子和铝原子
4.三种元素x、y、z的原子,最外层电子数之和为17,核内质子数之和为31,这三种元素是( )
A.N、P、Cl B.P、O、S
C.N、O、S D.O、F、Cl
D
C
5.有A、B两种元素,已知元素A的核电荷数为a,且A3 与Bn+的电子排布完全相同,则元素B的质子数为( )
A.a n 3 B.a+n+3 C.a+n 3 D.a n+3
B
第一节 原子结构与元素周期表
第四章 物质结构 元素周期律
第1课时.原子的构成
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.知道原子的结构及构成原子的微粒间的关系。
2.根据原子核外电子的排布规律,能画出1~20号元素的原子结构示意图。
1.了解预测、假没、模型等方法在科学家研究原子结构中的作用。
2.通过原子结构的微观模型的建立,形成原子核外电子排布的初步模型
原子
原子核
核外电子
质子
中子
(带正电荷)
不显电性
(带负电荷)
(正电荷)
(不带电荷)
某原子:核电荷数=质子数=核外电子数=原子序数
一、原子的构成
1.原子的构成
1、质量数:原子的质量主要集中在原子核上,质子和中子的相
对质量都近似为1,忽略电子的质量,将原子核内所有质子和中子
的相对质量取近似整数值相加,所得的数值叫做质量数,符号为 A.
质量数(A) = 质子数(Z) + 中子数(N)
质量数 ≈ 原子的相对原子质量
2.质量数
X
A
Z
—— 元素符号
质量数 ———
质子数 ———
3.原子、离子的表示方法:
±a
化合价
x±
电荷数
b
原子数
原子不带电:核内质子数 = 核外电子数
阳离子带正电荷:核内质子数 核外电子数
阴离子带负电荷:核内质子数 核外电子数
>
<
32
27
Rn- x A
Ti4+ 18 26
S
Al
2-
3+
质子数 核电荷数 电子数 中子数 质量数
16
13
22
16
18
16
32
13
10
14
27
x-n
A-(x-n)
x-n
22
48
课堂练习1
1、电子层: 电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,称之为电子层;电子层用“n”表示
二、原子核外电子的排布
N
M
L
K
原子核
+11
2
8
1
K L M
Na
二、原子核外电子的排布
电子层数 (n) 1 2 3 4 5 6 7
电子层符号
离核距离 电子的能量 最多容纳电子数
K层
L层
M层
N层
O层
P层
Q层
2
8
远
近
高
低
2.核外电子的分层排布
(1)在多电子的原子中,电子的能量是不相同。
在离原子核远的电子,能量较高。
(2)在离原子核近的电子,能量较低。
(3)核外电子的分层排布:由于核外电子的能量不同,
在不区域运动,即核外电子的分层运动。
2n2
(1)当K层为最外层时,最多能容纳的电子数是多少?
(2)除了K层,其他各层为最外层时,最多能容纳的电子数时多少?
(3)次外层最多能容纳的电子数时多少?
(4)你能归纳出第n层最多能容纳的电子数吗?
思考与讨论:探究原子核外电子排布规律
【问题与讨论 】下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?请思考并讨论下列问题。
2
2n2
8
最多不超过18个
3.原子核外电子的排布规律(阅读P87表,总结)
(1)最外层电子数不超过_____个(当K层为最外层时不超过____个)。
(2)次外层电子数不超过_____个。
(3)倒数第三层电子数不超过 32个。
(4)各电子层最多能容纳_______个电子(n为电子层数)。
(5)核外电子总是尽可能先从_____ 排起,当一层_____后再填充下一层,即按K→L→M……由里向外(能量由低到高)的顺序排列。
2n2
8
2
18
能量最低内层
充满
三.原子核外电子排布的表示方法
1.原子结构示意图
(1)钠的原子结构示意图:
画出下列原子或离子的结构示意图。
①S______,S2-_______ ;②Ca______ ,Ca2+______。
课堂练习2
根据1-20号元素的原子或离子核外电子的排布特征→元素推断
核外电子数总数等于电子层数的元素 H
最外层电子数是次外层电子数的2倍的元素:C
最外层电子数是电子层数的3倍的元素:O
电子层数是最外层电子数3倍的元素:Na
与Ne原子电子层结构相同的离子:F- O2- N3- Na+ Mg2+ Al3+
与Ar原子电子层结构相同的离子:Cl- S2- P3- K+ Ca2+
3.元素推断
(1)“10电子”微粒
4.核外电子数总数相同的微粒可以是分子,原子,也可以是离子;可以是单核微粒,也可以是多核微粒。
原子结构
电子排布
课堂练习三
1:依据前20号元素的原子结构特点,回答下列问题:
内层电子数之和是最外层电子数2倍的元素:________。
L层与K层电子数之差是电子层数的2.5倍的元素:_____。
最外层电子数是电子层数2倍的元素:____________。
电子层数与最外层电子数相等的元素:_____________。
次外层电子数是最外层电子数的2倍的元素:_________。
最外层电子数是次外层电子数的2倍的元素:_____;是次外层3倍的是:_____ ;是次外层1.5倍的是:_____。
最外层电子数等于次外层电子数的元素:__________。
最外层有1个电子的元素:________________;最外层有2个电子的元素:____________________。
H Li Na K
Be Mg Ca He
Be Ar
C
O
B
Li Si
H Be Al
He C S
F
Li P
(1)原子呈电中性是因为中子不带电( )
(2)质子数和中子数决定原子的质量( )
(3)原子的质量数就是原子的相对原子质量( )
(4)微粒中的质子数与核外电子数一定相等( )
(5)某种氯原子的中子数是18,则其质量数是35,核外电子数是17( )
×
√
×
×
√
2.判断下列说法是否正确
课堂练习三
课堂练习三
3.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是( )
A.硅原子和钠原子 B.硼原子和氢原子
C.氮原子和碳原子 D.碳原子和铝原子
4.三种元素x、y、z的原子,最外层电子数之和为17,核内质子数之和为31,这三种元素是( )
A.N、P、Cl B.P、O、S
C.N、O、S D.O、F、Cl
D
C
5.有A、B两种元素,已知元素A的核电荷数为a,且A3 与Bn+的电子排布完全相同,则元素B的质子数为( )
A.a n 3 B.a+n+3 C.a+n 3 D.a n+3
B
