4.1.3卤族元素的性质 课件(共24张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.3卤族元素的性质 课件(共24张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 00:04:31 | ||
图片预览







文档简介
(共24张PPT)
第四章 物质结构 元素周期律
第一节原子结构与元素周期表
第4课时原子结构与元素性质
卤族元素的性质
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解卤族元素的原子结构特点及原子结构与元素性质的关系。
2.了解卤族元素性质的相似性和递变性,并能运用原子结构理论进行解释。
3.能利用原子结构理论预测陌生元素的性质。
通过卤族元素单质的性质的学习培养学生论据推理与模型认知的化学核心素养;运用原子结构理论解释元素性质,培养学生宏观辨识与微观探析的化学核心素养。
Cl2
Br2
卤族元素(简称卤素)是典型的非金属元素,它们在自然界中都以化合态存在。
卤族元素
问题思考
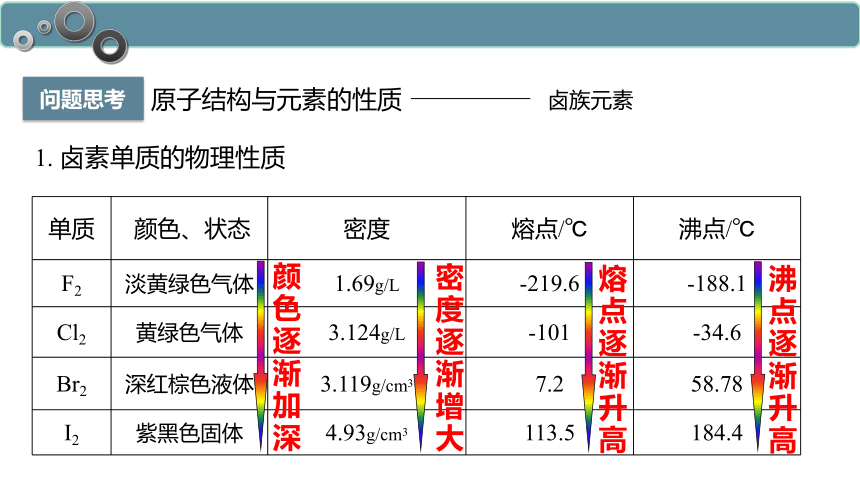
1. 卤素单质的物理性质
单质 颜色、状态 密度 熔点/℃ 沸点/℃
F2 淡黄绿色气体 1.69g/L -219.6 -188.1
Cl2 黄绿色气体 3.124g/L -101 -34.6
Br2 深红棕色液体 3.119g/cm3 7.2 58.78
I2 紫黑色固体 4.93g/cm3 113.5 184.4
密度逐渐增大
熔点逐渐升高
沸点逐渐升高
颜色逐渐加深
原子结构与元素的性质
卤族元素
(1).相似性:均有颜色,难溶于水易溶有机溶剂(四氯化碳CCl4), 熔沸点低。
卤族单质的物理性质(课本101页)
(2).递变性(F2→I2):状态:气态→液态→固态,颜色逐渐加深,密度逐渐增大,熔沸点逐渐升高。
知识总结
特殊性:
1.氟无正价,无含氧酸,氢氟酸能腐蚀玻璃,AgF易溶于水,无感光性。
2.氯气易液化,次氯酸具有漂白作用,且能杀菌消毒。
3.溴是常温下唯一呈液态的非金属单质,溴易挥发,少量溴保存要加水液封。
4.碘为紫黑色固件,易升华,碘单质遇淀粉变蓝。
氟原子
氯原子
溴原子
碘原子
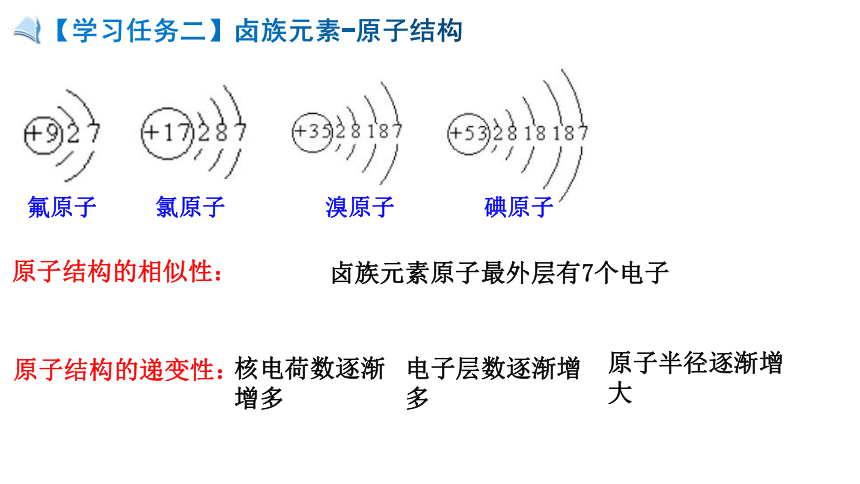
【学习任务二】卤族元素-原子结构
原子结构的相似性:
卤族元素原子最外层有7个电子
原子结构的递变性:
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
根据卤素的原子结构,推测氟、氯、溴、碘在化学性质上表现出来的相似性和递变性?
实验探究
3.1卤素单质与氢气反应
暗处剧烈化合并爆炸;HF很稳定
光照或点燃反应;HCl较稳定
加热500℃ ;HBr不稳定
需不断加热,HI同时分解
A条件越来越苛刻
B剧烈程度越来越弱
C产物稳定性变差
H2+F2 === 2HF
H2+Cl2 ==== 2HCl
H2+Br2 === 2HBr
H2+I2 2HI
光照或点燃
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
如何设计实验方案证明氯气、溴单质、碘单质的氧化性依次减弱?
氢化物(HX)的稳定性:HF>HCI>HBr>HI
知识延伸
逐渐困难
X2 + H2O = HX + HXO(X≠F)
I2 + H2O HI + HIO
Br2 + H2O HBr + HBrO
Cl2 + H2O HCl + HClO
2F2 + 2H2O = 4HF + O2 (剧烈反应)
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
3.2卤素单质与水反应
F2能否置换出氯化钠中的氯?
酸性:
HF(弱酸)< HCl < HBr < HI
HF是弱酸,HCl,HBr,HI都是强酸
实验探究
KBr溶液
氯水
溶液由无色变为橙色
Cl2 + 2KBr = 2KCl +Br2
KI溶液
氯水
溶液由无色变为褐色(棕黄色)
Cl2 + 2KI = 2KCl + I2
氧化性: Cl2>Br2
3.3单质间的置换反应
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
氧化性: Cl2>I2
②如何验证氧化性: Br2>I2 ?
①反应2I-+ Br2= I2+2Br- 能否发生?
预测
KI溶液
溴水
溶液变为褐色
Br2 + 2KI = 2KBr + I2
氧化性: Br2>I2
单质氧化性:F2>Cl2>Br2>I2
阴离子还原性:F-<Cl-<Br-<I-
元素非金属性:F>Cl > Br > I
知识延伸
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
F2能否置换出氯化钠中的氯?
注意:
氟气不能将氯、溴、碘从它的卤化物溶液(盐溶液)
中置换出来 ,是因为F2先与水反应)
2F2 + 2H2O = 4HF + O2
总结提升
1.卤素元素单质化学性质的相似性和递变性
(1)相似性(用X代表卤族元素):
单质X2
常温:X2+2NaOH=NaX+NaXO+H2O (X为Cl、Br、I)
与氢气反应
与水反应
共性
X2 + H2O HX + HXO(X为Cl、Br、I)
2F2 + 2H2O = 4HF + O2
特例
H2+X2 = 2HX
原子结构与元素的性质
卤族元素
总结提升
①与H2反应越来越难,对应氢化物的稳定性逐渐减弱、还原性逐渐增强、水溶液的酸性逐渐增强,即:
(2)递变性
酸 性: HF②最高价氧化物对应水化物的酸性逐渐减弱,即:HClO4>HBrO4>HIO4。
原子结构与元素的性质
卤族元素
稳定性:HF>HCl>HBr>HI
还原性:F- < Cl- < Br - < I-
总结提升
元素非金属性强弱比较:
①单质与氢气反应越容易,元素的非金属性越强
②气态氢化物越稳定,对应元素的非金属性越强
③最高价氧化物对应的水化物的酸性越强,对应元素的非金属性越强
④相互间的置换,即活泼置换不活泼
⑤非金属阴离子的还原性 如:Cl- < Br- < I-
原因:同主族元素的性质具有相似性和递变性, 是由同主族元素的原子结构的相似性和递变性决定的。
结论:同主族元素从上往下电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。所以金属性逐渐增强、非金属性逐渐减弱。
结构
性质
决定
【小结】同主族元素的性质与原子结构的关系
形成方法
卤族元素
F2
Br2
I2
化学性质相似
(1)易得电子,表现强氧化性
核电荷数增多
电子层数增多
原子半
径增大
最外层上
有7个电子
非金属性
减弱
氧化性
减弱
得电子能
力减弱
原子核对最外层电子的引力减小
(2)最低化合价为 -1价
相似性
递变性
形成方法
1. 关于卤素X(依次为Cl、Br、I)的下列叙述正确的是( )
c
A、卤素单质与水反应均可用 X2+H2O===HXO+HX 表示
B、HX都极易溶于水,它们的热稳定性随核电荷数增加而增强
C、卤素单质的颜色随相对分子质量增大而加深
D、相对分子质量小的卤素单质都可将相对分子质量大的卤素从它的卤化物溶液里置换出来
形成方法
2. 下列不能说明氯元素的非金属性比硫元素强的事实是( )
A
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
形成方法
3. 砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )
A、砹的非金属性在卤素中是最弱的,At-易被氧化
B、砹化氢不稳定,易分解
C、砹化银不溶于水或稀HNO3
D、砹在常温下是白色固体
D
4. 下列对卤素的说法不符合递变规律的是( )
A. F2、Cl2、Br2、I2的氧化性逐渐减弱
B. HF、HCl、HBr、HI的热稳定性逐渐减弱
C. F-、Cl-、Br-、I-的还原性逐渐增强
D. 卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大
D
学习评价
5. 以下关于锂、钠、钾、铷、铯的叙述不正确的是( )
①氢氧化物中碱性最强的是CsOH;②单质熔点最高的是铯;③单质都是热的良导体;④单质的密度依次增大,且都比水小;⑤单质的还原性依次增强;⑥对应阳离子的氧化性依次增强。
A. ①③ B. ②⑤ C. ②④⑥ D. ①③⑤
学习评价
C
第四章 物质结构 元素周期律
第一节原子结构与元素周期表
第4课时原子结构与元素性质
卤族元素的性质
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解卤族元素的原子结构特点及原子结构与元素性质的关系。
2.了解卤族元素性质的相似性和递变性,并能运用原子结构理论进行解释。
3.能利用原子结构理论预测陌生元素的性质。
通过卤族元素单质的性质的学习培养学生论据推理与模型认知的化学核心素养;运用原子结构理论解释元素性质,培养学生宏观辨识与微观探析的化学核心素养。
Cl2
Br2
卤族元素(简称卤素)是典型的非金属元素,它们在自然界中都以化合态存在。
卤族元素
问题思考
1. 卤素单质的物理性质
单质 颜色、状态 密度 熔点/℃ 沸点/℃
F2 淡黄绿色气体 1.69g/L -219.6 -188.1
Cl2 黄绿色气体 3.124g/L -101 -34.6
Br2 深红棕色液体 3.119g/cm3 7.2 58.78
I2 紫黑色固体 4.93g/cm3 113.5 184.4
密度逐渐增大
熔点逐渐升高
沸点逐渐升高
颜色逐渐加深
原子结构与元素的性质
卤族元素
(1).相似性:均有颜色,难溶于水易溶有机溶剂(四氯化碳CCl4), 熔沸点低。
卤族单质的物理性质(课本101页)
(2).递变性(F2→I2):状态:气态→液态→固态,颜色逐渐加深,密度逐渐增大,熔沸点逐渐升高。
知识总结
特殊性:
1.氟无正价,无含氧酸,氢氟酸能腐蚀玻璃,AgF易溶于水,无感光性。
2.氯气易液化,次氯酸具有漂白作用,且能杀菌消毒。
3.溴是常温下唯一呈液态的非金属单质,溴易挥发,少量溴保存要加水液封。
4.碘为紫黑色固件,易升华,碘单质遇淀粉变蓝。
氟原子
氯原子
溴原子
碘原子
【学习任务二】卤族元素-原子结构
原子结构的相似性:
卤族元素原子最外层有7个电子
原子结构的递变性:
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
根据卤素的原子结构,推测氟、氯、溴、碘在化学性质上表现出来的相似性和递变性?
实验探究
3.1卤素单质与氢气反应
暗处剧烈化合并爆炸;HF很稳定
光照或点燃反应;HCl较稳定
加热500℃ ;HBr不稳定
需不断加热,HI同时分解
A条件越来越苛刻
B剧烈程度越来越弱
C产物稳定性变差
H2+F2 === 2HF
H2+Cl2 ==== 2HCl
H2+Br2 === 2HBr
H2+I2 2HI
光照或点燃
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
如何设计实验方案证明氯气、溴单质、碘单质的氧化性依次减弱?
氢化物(HX)的稳定性:HF>HCI>HBr>HI
知识延伸
逐渐困难
X2 + H2O = HX + HXO(X≠F)
I2 + H2O HI + HIO
Br2 + H2O HBr + HBrO
Cl2 + H2O HCl + HClO
2F2 + 2H2O = 4HF + O2 (剧烈反应)
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
3.2卤素单质与水反应
F2能否置换出氯化钠中的氯?
酸性:
HF(弱酸)< HCl < HBr < HI
HF是弱酸,HCl,HBr,HI都是强酸
实验探究
KBr溶液
氯水
溶液由无色变为橙色
Cl2 + 2KBr = 2KCl +Br2
KI溶液
氯水
溶液由无色变为褐色(棕黄色)
Cl2 + 2KI = 2KCl + I2
氧化性: Cl2>Br2
3.3单质间的置换反应
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
氧化性: Cl2>I2
②如何验证氧化性: Br2>I2 ?
①反应2I-+ Br2= I2+2Br- 能否发生?
预测
KI溶液
溴水
溶液变为褐色
Br2 + 2KI = 2KBr + I2
氧化性: Br2>I2
单质氧化性:F2>Cl2>Br2>I2
阴离子还原性:F-<Cl-<Br-<I-
元素非金属性:F>Cl > Br > I
知识延伸
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
F2能否置换出氯化钠中的氯?
注意:
氟气不能将氯、溴、碘从它的卤化物溶液(盐溶液)
中置换出来 ,是因为F2先与水反应)
2F2 + 2H2O = 4HF + O2
总结提升
1.卤素元素单质化学性质的相似性和递变性
(1)相似性(用X代表卤族元素):
单质X2
常温:X2+2NaOH=NaX+NaXO+H2O (X为Cl、Br、I)
与氢气反应
与水反应
共性
X2 + H2O HX + HXO(X为Cl、Br、I)
2F2 + 2H2O = 4HF + O2
特例
H2+X2 = 2HX
原子结构与元素的性质
卤族元素
总结提升
①与H2反应越来越难,对应氢化物的稳定性逐渐减弱、还原性逐渐增强、水溶液的酸性逐渐增强,即:
(2)递变性
酸 性: HF
原子结构与元素的性质
卤族元素
稳定性:HF>HCl>HBr>HI
还原性:F- < Cl- < Br - < I-
总结提升
元素非金属性强弱比较:
①单质与氢气反应越容易,元素的非金属性越强
②气态氢化物越稳定,对应元素的非金属性越强
③最高价氧化物对应的水化物的酸性越强,对应元素的非金属性越强
④相互间的置换,即活泼置换不活泼
⑤非金属阴离子的还原性 如:Cl- < Br- < I-
原因:同主族元素的性质具有相似性和递变性, 是由同主族元素的原子结构的相似性和递变性决定的。
结论:同主族元素从上往下电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。所以金属性逐渐增强、非金属性逐渐减弱。
结构
性质
决定
【小结】同主族元素的性质与原子结构的关系
形成方法
卤族元素
F2
Br2
I2
化学性质相似
(1)易得电子,表现强氧化性
核电荷数增多
电子层数增多
原子半
径增大
最外层上
有7个电子
非金属性
减弱
氧化性
减弱
得电子能
力减弱
原子核对最外层电子的引力减小
(2)最低化合价为 -1价
相似性
递变性
形成方法
1. 关于卤素X(依次为Cl、Br、I)的下列叙述正确的是( )
c
A、卤素单质与水反应均可用 X2+H2O===HXO+HX 表示
B、HX都极易溶于水,它们的热稳定性随核电荷数增加而增强
C、卤素单质的颜色随相对分子质量增大而加深
D、相对分子质量小的卤素单质都可将相对分子质量大的卤素从它的卤化物溶液里置换出来
形成方法
2. 下列不能说明氯元素的非金属性比硫元素强的事实是( )
A
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
形成方法
3. 砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )
A、砹的非金属性在卤素中是最弱的,At-易被氧化
B、砹化氢不稳定,易分解
C、砹化银不溶于水或稀HNO3
D、砹在常温下是白色固体
D
4. 下列对卤素的说法不符合递变规律的是( )
A. F2、Cl2、Br2、I2的氧化性逐渐减弱
B. HF、HCl、HBr、HI的热稳定性逐渐减弱
C. F-、Cl-、Br-、I-的还原性逐渐增强
D. 卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大
D
学习评价
5. 以下关于锂、钠、钾、铷、铯的叙述不正确的是( )
①氢氧化物中碱性最强的是CsOH;②单质熔点最高的是铯;③单质都是热的良导体;④单质的密度依次增大,且都比水小;⑤单质的还原性依次增强;⑥对应阳离子的氧化性依次增强。
A. ①③ B. ②⑤ C. ②④⑥ D. ①③⑤
学习评价
C
