2024届高三化学二轮复习 晶体结构大题(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习 晶体结构大题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 00:06:33 | ||
图片预览




文档简介
晶体结构大题练习
1.VIA族的氧、硫、硒(Se)、碲(Te)等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)基态O原子中,未成对电子数与成对电子数之比为 。
(2)亚硫酰氯在有机合成中有重要应用,分子中S原子的杂化轨道类型为 ,分子的空间结构为 。
(3)气态电中性基态原子得到一个电子转化为气态基态负离子所放出的能量叫做第一电子亲和能。S、Se、Te三种元素的第一电子亲和能由大到小的顺序是 ,、和键角最小的是 ,稳定性最强的是 。
(4)黄铁矿是工业生产硫酸的原料,其晶胞结构如图所示,晶胞参数为anm,该晶体的电子式为 ,的配位数为 ,晶体的密度为 ,在1个晶胞中,由围成的正八面体的个数为 。
2.Ⅰ.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550
硅晶体:1410
硼晶体:2300
二氧化硅:1732
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,据此回答:A组属于 晶体,硅晶体的熔点低于二氧化硅,是由于 。
(2)B组晶体共同的物理性质是具有良好的延展性和导电性,可用 (填序号)理论解释。
①价层电子对互斥理论 ②电子气理论 ③电子云理论
(3)C组中相对分子质量小于但熔点却高于,是由于 。
(4)D组晶体中、、、的熔点由高到低的顺序为 。
Ⅱ.下图表示一些常见晶体的微观结构:
(5)其中代表的是 (填字母),在干冰晶体中,每个CO2分子周围紧邻的分子有 个。
(6)晶体在的高压下和反应生成如图所示的晶胞结构,则该晶体的化学式为 。
(7)的晶胞如图所示,密度为,相邻的两个的最近核间距为,则的摩尔质量为 (列出代数式,设为阿伏加德罗常数的值)。
3.铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氧原子的价电子排布图为 ;
(2)已知:2UO2+5NH4HF22UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的化学键类型是 (填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是 (填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3]3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①分解产物中属于极性分子的有 。
②反应物中的的空间构型为 。分子中的大π键可用符号表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则中的大π键应表示为 。
(4)用Mg或Ca还原UF4可得金属铀,其Mg的熔点高于Ca,原因 ;
(5)UO2的晶胞结构如图所示:
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的 空隙中。
②若晶胞参数为apm,UO2摩尔质量为M,晶体的密度为 g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
4.硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子IV的合成路线如下:
(1)与互为等电子体的分子有 (填化学式,任写一种)。
(2)的沸点低于,其原因是 。
(3)关于I~III三种反应物,下列说法正确的有 。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有sp与sp2
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有 。
(5)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
①X的化学式为 。
②设X的最简式的式量为,晶体密度为,则X中相邻K之间的最短距离为 nm(列出计算式,为阿伏加德罗常数的值)。
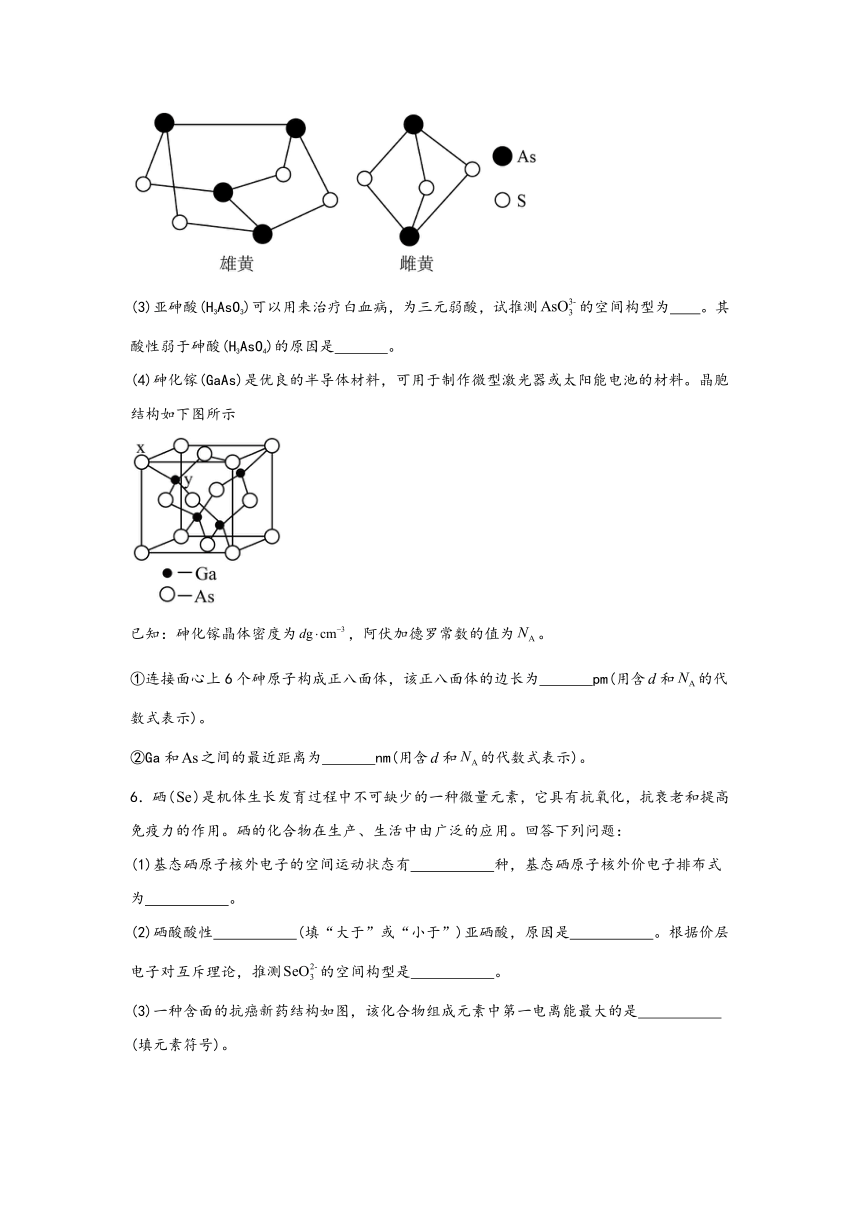
5.砷是生命的第七元素,可形成多种重要的化合物。回答下列问题:
(1)基态砷原子N电子层中的成对电子与单电子的数量比为 。As的第一电离能(I1)比Se大的原因是 。
(2)雄黄(As4S4)和雌黄(As2S3)在自然界中共生,是提取砷的主要矿物原料,其结构如下图所示,1mol雄黄与O2反应生成As2O3,转移28mol电子,则另一种产物为 。雌黄中As的杂化方式为 。
(3)亚砷酸(H3AsO3)可以用来治疗白血病,为三元弱酸,试推测的空间构型为 。其酸性弱于砷酸(H3AsO4)的原因是 。
(4)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。晶胞结构如下图所示
已知:砷化镓晶体密度为,阿伏加德罗常数的值为。
①连接面心上6个砷原子构成正八面体,该正八面体的边长为 pm(用含和的代数式表示)。
②Ga和之间的最近距离为 nm(用含和的代数式表示)。
6.硒()是机体生长发育过程中不可缺少的一种微量元素,它具有抗氧化,抗衰老和提高免疫力的作用。硒的化合物在生产、生活中由广泛的应用。回答下列问题:
(1)基态硒原子核外电子的空间运动状态有 种,基态硒原子核外价电子排布式为 。
(2)硒酸酸性 (填“大于”或“小于”)亚硒酸,原因是 。根据价层电子对互斥理论,推测的空间构型是 。
(3)一种含面的抗癌新药结构如图,该化合物组成元素中第一电离能最大的是 (填元素符号)。
(4)人体代谢甲硒醇()后可增加抗癌活性,甲硒醇的熔沸点低于甲醇,原因是 。
(5)的晶体结构如下图所示,其晶胞参数为,阿伏加德罗常数值为。M原子的分数坐标为 ,的晶胞密度为 (列出计算式)。
7.含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态原子的电子所占据的最高能层符号为 ,基态较基态心稳定的原因是 ;
(2)稀溶液中存在的空间构型为八面体形:下列对中杂化方式推断合理的是_______(填标号)。
A. B. C. D.
(3)可形成,其中代表。该化合物分子中,模型为四面体的非金属原子共有 个;C、N、F的电负性由大到小的顺序为 ;
(4)一种由组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中原子填充在围成的四面体空隙中,则四面体空隙的占有率为 ;该晶体的化学式为 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为、,则C点原子的分数坐标为 晶胞中C、D间距离 。
8.虎年春晚上,一段舞蹈诗剧《只此青绿》生动还原了北宋画家王希孟的绝世之作——《千里江山图》。它之所以能够流传千年依旧色彩艳丽,璀璨夺目,与其绘制方法和所用颜料有关。
(1)绘制时,第一遍先用水墨画好山水画,第二遍上红色(赭石色),赭石主含,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有 种,三价铁离子的价电子排布式为 。
(2)第三遍上石绿(孔雀石或绿松石),孔雀石主要成分是碱式碳酸铜,化学式为:。碳酸根离子的空间构型为 。
(3)绿松石是一种含水的铜铝酸盐矿物,属于磷酸盐矿物,化学式为。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为 。
(4)第四遍还要再叠加一层绿,第五遍上青色,石青(蓝铜矿或青金石),蓝铜矿化学式为,青金石是碱性铝硅酸盐矿物,化学式为。
①与结合能生成,中配位原子为 (用元素符号表示) 。
②根据价层电子对互斥理论,、、的气态分子中,中心原子价层电子对数不同于其他分子的是 。的熔沸点比高很多,主要原因是 。
(5)《千里江山图》中还用到了黄色的颜料 黄,雌黄的主要成分是,有剧毒。
①、、的键角由大到小的顺序为 。
②砷化镓晶胞如图所示,若两个镓原子之间的最近距离为d pm,代表阿伏加德罗常数的值,则砷化镓晶体的密度 。(用含d,的代数式表示)
9.“物质的性质、性能,不仅与组成有关,还与晶体结构有关。完成如下有关的问题。
(1)铁有、、三种同素异形体,如图所示,三种晶体在不同温度下能发生转化。
三种晶体中,与每个铁原子等距离且最近的铁原子:有8个、有 个、有 个;将铁缓慢加热到1500℃再降温到常温,缓慢冷却得固体A和急速冷却得固体B,两者密度不同,较大的是固体 (填“A”或“B”)。
(2)金刚石和都由碳元素组成, 晶体中构成微粒的配位数较大,原因是 。
(3)PTC元件(热敏电阻)的主要成分热稳定性好、介电常数高,在小型的变压器、话筒中都有应用。晶体中,Ba在由12个O围成的十四面体(六个正方形、八个正三角形)的中心,Ti在由6个O围成的正八面体的中心,则O在由 围成的立体结构的中心。
(4)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
①若A原子的坐标参数为(0,0.0),C为(l,1,1),则B原子的坐标参数为 。
②三种微粒半径:,,则Cu、Mn原子之间的最短核间距离为 pm。
③将Cu-Mn-Al合金晶胞沿棱投影于垂直面可得如图3。下列属于沿面对角线或体对角线投影于垂直面的是 。(填字母序号)
10.铜及其化合物在科学研究和工业生产中具有许多用途,请回答下列问题:
(1)写出基态Cu原子的价电子排布式 。
(2)已知高温下比CuO稳定,从核外电子排布角度解释高温下更稳定的原因 。
(3)配合物中碳原子的杂化类型是 ,配体的空间构型为 。配合物所含元素的电负性由大到小的顺序是 (用元素符号表示)。
(4)M原子的价电子排布式为,铜与M形成化合物的晶胞如图所示。
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为,则F原子的坐标参数为 。
②已知该晶体的密度为,阿伏加德罗常数的值为,则该晶体中Cu原子和M原子之间的最短距离为 pm(写出计算式)。
11.科学家发现固体电解质Li3SBF4快离子导体具有良好的导电能力,为锂离子电池的发展做出了重要贡献。回答下列问题:
(1)基态F原子的价电子排布图为 。B和F均为第2周期元素,在第2周期元素中,第一电离能介于B与F之间的元素有 种。
(2)一种硼酸盐的阴离子为B3O4n-,其结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O的结构图 (注明所带电荷数)。[B5O6(OH)4]-的结构为 ,则B原子的配位数是 。
(3)L3SBF4可由Li2S与LiBF4按一定比例反应合成。Li2S和LiBF4的熔点如表所示:
物质 Li2S LiBF4
熔点/℃ 938 300
Li2S与LiBF4均属于 晶体;熔点:Li2S>LiBF4,原因是 。
(4)Li3SBF4的晶胞结构如图所示,其中BF位于体心,则Li+位于 (填“顶点”或“棱边”)。设NA为阿伏加德罗常数的值,若该晶胞中Li+与BF间的最近距离为apm,则晶体密度为 g·cm-3,在Li3SBF4晶胞的另一种结构中,BF位于顶点,则S2-位于 (填“体心”“面心”或“棱边”)。
12.六方晶胞是一种常见晶胞,镁、锌和钛的常见晶胞属于六方晶胞。
(1)已知以上三种金属的盐的熔沸点(℃)如下表:
物理性质 氯化物
熔点 712 290 -24.1
沸点 1412 732 136.4
已知:熔融状态下能够导电。请解释三种氯化物熔沸点差异的原因 。的熔沸点明显偏低的另一个原因是该分子空间构型是 ,分子高度对称,没有极性,分子间作用力很弱。
(2)某晶体属于六方晶系,其晶胞参数,。晶胞沿着不同方向投影如下,其中深色小球代表A原子,浅色大球代表B原子(化学环境完全等同)。已知A2原子坐标为,B1原子沿c方向原子坐标参数。
①该物质的化学式为 。
②晶胞中原子A1—A2在ab面投影的距离为 (保留四位有效数字)。
③B1原子坐标参数为 。
13.钛被称为“21世纪的金属”,其单质及化合物具有优异的性能。回答下列问题:
(1)基态钛原子的价电子轨道表示式为 。
(2)钛元素的检验方法如下:
可与形成稳定的,其原因是 。
(3)二氧化钛是良好的光催化剂,可催化转化多种有毒物质,如:可将水中的转化为;将甲基橙、亚甲基蓝、HCHO转化为等。
甲基橙、亚甲基蓝中S原子的杂化类型分别为 、 。
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:
①晶体中与La距离最近的Ba的数目为 ,一个完整晶胞中含有 个Co原子。
②真实的晶体中存在5%的O原子缺陷,从而能让在其中传导,已知La为+3价,则+3价钴与+4价钴的原子个数比为 ;设阿伏加德罗常数的值为,则该晶体的密度为 (列出计算式即可)。
14.过渡元素用途广泛。回答下列问题:
(1)基态的价电子排布式为 。
(2)Co与Ca位于同一周期、且最外层电子数相等,但Co的熔点、沸点均比Ca高,原因是 。
(3) 1mol中含有的σ键数目为 ,分子与形成配合物后键角 (填“变大”“变小”或“不变”)。
(4)中配体的空间结构为 ,N、O原子相比,第二电离能与第一电离能差值更大的是 (填元素符号)。
(5)一种铁基超导材料晶胞结构如图a所示,铁原子沿z轴方向的投影如图b所示。该材料的化学式为 ,已知体心与顶点的Ca原子有着相同的化学环境,晶胞中As原子1分数坐标为(0,0,0.628),则As原子2的分数坐标为 ,体心Ca原子与As原子1之间的距离为 pm。
15.现代科技的发展离不开材料的开发与应用,而物质结构理论是材料研究的基础,请回答Ⅰ-Ⅳ的问题。
Ⅰ.使用作原科的电合成技术,为减少排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
(1)和中碳原子的杂化类型分别是 和 。
(2)1个分子中存在 个键。
(3)易溶于水的原因是 。
Ⅱ.硒()与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
(4)在基态K原子中,能量最低的空轨道的符号是 ,原子的价电子排布式为 。
(5)的空间构型为 ,写出一个与互为等电子体的分子 (填分子式)。
(6)是一种超导材料,是由足球烯()与金属钾反应生成的盐。在晶胞中,堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,填充在空隙中。晶胞中被占据的空隙百分比为 。
Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:
(7)上述三种物质中,沸点最高的是 (填化学名称)。
(8)已知咪唑中存在大键,则在咪唑分子的两个氮原子中,更容易与形成配位键的是 (填“①”或“②”)号氮原子。
Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(、原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为,该合金的密度为。
(9)列出 cm的计算式,设为阿伏加德罗常数的值。
16.铁在工业中有重要作用,也是人体必需的微量元素。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式 。
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为 ,配离子中Fe3+为d2sp3杂化,写出配位前后Fe3+3d轨道表示式 。
(2)邻二氮菲的结构简式为,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
①中心离子的配位数为 ,配位原子的杂化方式为 。
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。
①Fe3O4晶胞中有 个Fe离子,代表 。
②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为 g/cm3。
17.锗石是自然界中含有锗元素的一类矿石的统称,锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)基态Ge原子核外简化电子排布式为 ,Ge原子的电子发生跃迁时会吸收或发出不同的光,可用光谱分析仪获得 光谱(填“连续”或 “线状”),鉴定Ge元素的存在。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是 。
②推测 1molGenH2n+2中含有的σ键的数目是 (用NA表示阿伏加德罗常数值)。
(3)利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中EMIM+ 结构如图所示。
①该物质的晶体类型是 。
②EMIM+ 离子中组成元素的电负性由小到大的顺序是 。
(4)独立的NH3分子中H-N-H 的键角为 107.3 ,[Zn(NH3)6]2+离子中H-N-H的键角 107.3° ( 填“大于”、“小于”或“等于” )。
(5)硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是 ;已知晶胞边长为a pm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为(,1,) ,则 D原子坐标为 ;若该晶胞密度为ρ g·cm-3,则阿伏加德罗常数NA为 。
18.锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用、、LiCl及苯胺()为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为 ,其在元素周期表中的位置为 ,O、N、P的电负性由大到小的顺序为 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
化合物Ⅰ中碳原子的杂化轨道类型为 ,1mol化合物Ⅰ中含有 个σ键;化合物Ⅱ中阳离子的空间构型为 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
该锰的氧化物中Mn的化合价为 ,请画出z方向投影图 。
19.研究压电材料对于自动化技术具有重要意义。一种有机—无机复合压电材料的单斜晶体结构沿晶轴方向投影如图所示(H原子未画出),晶胞内总共含有84个原子。晶胞参数为,,。回答下列问题:
(1)基态Mn原子的价电子轨道表示式为 。在元素周期表中位置为 。
(2)1 mol 晶胞中含有Cl原子 mol,含有杂化的中心原子 mol;该晶体中提供电子对形成配位键的原子是 。
(3)TMCM性质活泼,一定条件下可分解生成三甲胺[],中N原子的价层电子对构型为 ;的沸点高于,主要原因是 。
20.氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
O—O键长 121 148
(1)基态F原子的核外电子排布式为 。
(2)氟氧化物、的结构已经确定。
①依据数据推测O—O键的稳定性: (填“>”或“<”)。
②中F—O—F键角小于中H—O—H键角,解释原因: 。
(3)是一种有特殊性质的氢化物。
①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明,固体中分子排列为锯齿形,画出含2个的重复单元结构: 。
②溶剂中加入可以解离出和具有正四面体形结构的阴离子,写出该过程的离子方程式: 。
(4)工业上用萤石(主要成分)制备。晶体的一种立方晶胞如图所示。
①晶体中距离最近的有 个。
②晶体中与的最近距离为),阿伏加德罗常数值为。该晶体的密度 (列出计算式)。
21.第IIIA元素硼及其化合物在能源、材料、医药、环保等领域具有重要应用。回答下列问题:
(1)基态B原子价层电子的轨道表示式: 。
(2)已知:有空轨道,可以与分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。
①下列卤化物不易发生水解的是 。
A. B. C. D.
②写出水解的化学方程式 。
③写出与NaOH溶液反应的离子方程式 。
(3)硼砂的阴离子的结构如图1,1mol该离子中有 个硼氧四面体,含有配位键数目为 ,其中硼原子的杂化轨道类型为 。
(4)硼化镁在39K温度下具有超导性,硼原子和镁原子分层排布,一层硼一层镁相间,部分原子沿垂直片层方向投影如图2,则硼化镁的化学式为 。
22.普鲁士蓝的化学式为,其结构如图1(可能位于中心的未标出)或图2(、未标出)所示。
请回答:
(1)基态Fe价电子轨道表示式为 。
(2)已知铁的电离能数据如下:
电离能/() ……
Fe 759 1561 2597 5290 ……
则,铁的第四电离能()大于第三电离能()的可能原因是: 。
(3)关于晶体下列说法不正确的是_______(填序号)。
A.存在的化学键有σ键、π键、配位键、离子键等
B.Fe、N、C的电负性由大到小的顺序:
C.晶体中的键能>KCN中的键能
D.晶胞中、原子均参与形成配位键,其配位数之比为6:6
(4)可溶性氰化物(如KCN)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是 。
(5)图2晶胞中的个数为 ,设普鲁士蓝的最简式的式量为Mr,晶体密度为,则相邻之间的最短距离为 nm。(列出计算式,为阿伏加德罗常数的值)
23.铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅶ族的元素,其化合物在生产生活中应用广泛。
(1)基态Fe的价层电子排布式为 。
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。
①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为 。
②色胺酮分子中N原子的杂化类型为 。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过 作用与色胺酮钴配合物相结合,CH3OH分子内 π键。(填“有”或“没有”)
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:
①距离Mg原子最近的Ni原子有 个。
②已知该晶胞的边长为anm,阿伏加德罗常数为NA,该晶体的密度为 g cm-3。(1nm=10-9m)
24.太阳能的开发利用在新能源研究中占据重要地位。
(1)我国科学家制备了一种太阳能电池,其结构示意图如下,其中是光电转换层,ITO玻璃为导电玻璃。
①基态的价电子排布式为 。
②C、N、O、F的第一电离能从大到小的顺序为 。
(2)钙钛矿材料是与钛酸钙()具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式一般为,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA()、FA()、,等,其中MA中N原子的杂化轨道类型是 ,1molFA中存在 个σ键(表示阿伏加德罗常数的值)。
(3)一种立方钙钛矿型晶体有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。
①图a晶胞中O的位置为 (填“体心”“顶点”“面心”“棱心”,下同);图b晶胞中O的位置为 。图a的晶胞参数为393.9pm,则O与O的最小核间距为 pm。
②晶胞经掺杂后能提高红外辐射效率。若图a晶胞的超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为 ;掺杂Sr后O与O的最小核间距略有减小,其可能的原因是 。
25.半导体芯片的关键材料是我国优先发展的新材料。经过半个多世纪的发展,硅基材料的半导体器件性能已经接近其物理极限,以碳化硅、氮化镓等为代表的第二代半导体材料成为当今热点。回答下列问题:
(1)基态镓原子的价电子排布式为: ,它位于元素周期表的位置是 。
(2)上述材料所涉及的四种元素中,原子半径最小的是 (填元素符号,下同),第一电离能I1最大的是 。
(3)原硅酸根SiO的空间构型是 ,其中Si的杂化轨道类型为 。
(4)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是 (填序号),原因是 。
(5)GaN被誉为21世纪引领5G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数:α=β=90°,γ=120°。已知:该晶体的密度为ρg cm-3,晶胞底边边长为acm,高为bcm,则阿伏伽德罗常数为 mol-1(用含a、b、ρ的代数式表示,MGa=70g/mol)。
(6)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的层与带负电的层交替堆叠。据此推断硒氧化铋的化学式为 。晶胞棱边夹角均为90°,则晶体密度的计算式为 g·cm-3(NA为阿伏伽德罗常数的值)
26.冶炼铝时常用的某种助熔剂,其晶胞如图a所示,晶胞中钠离子的俯视投影如图b所示,晶胞底边边长为apm,高为cpm,。回答下列问题:
(1)基态Al原子核外电子有 种不同的空间运动状态,铝的超原子结构有和等,这类超原子具有40个价电子时最稳定,则与 族元素的性质相似。
(2)Al原子的第一电离能低于Mg,原因是 。
(3)该助熔剂的化学式为 ,若阿伏加德罗常数值为,晶体密度为 (写出计算式即可)
(4)该助熔剂的另一种晶胞是由大阴离子构成的面心立方晶胞,可看作是填充在晶胞的空隙中,其中大阴离子中一个在体对角线上,该的坐标为 (该所配位的原子为原点,保留3位有效数字,已知Al-F键长181pm,晶胞边长为780pm,)。
27.砷原子成键的多样性,使砷元素形成了结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)基态砷原子核外价电子排布式为 ,同周期中第一电离能大于砷的元素有 种。
(2)砷可以形成多种酸和盐。与两种含砷有机酸中沸点较高的是 (填化学式),原因为 。和均可用于制农药,其阴离子的键角大小: (填“>”或“<”)。
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体,其立方晶胞结构如图2所示。
①M点原子分数坐标为 。
②m= ,n= 。
③已知NA为阿伏伽德罗常数的值,的摩尔质量为,晶体密度为。晶胞中As原子与Mn原子之间的最短距离为 nm(列出计算式)。
④图1所示晶胞在,0.5和1三个截面上Zn和Li按图3所示分布,请在图4中As原子所在的截面上用“△”补画出As原子的位置 ,并说明x= 。
28.卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)时,与冰反应生成和。常温常压下,为无色气体,固态的晶体类型为 ,水解反应的产物为 (填化学式)。
(2)中心原子为,中心原子为,二者均为形结构,但中存在大键。中原子的轨道杂化方式 ;为键角 键角(填“>”“ <”或“=”)。比较与中键的键长并说明原因 。
(3)一定条件下,和反应生成和化合物。已知属于四方晶系,晶胞结构如图所示(晶胞参数),其中化合价为。上述反应的化学方程式为 。若阿伏伽德罗常数的值为,化合物的密度 (用含的代数式表示)。
29.氮化亚铜用于制备P型半导体,其可用、、2-吡咯甲醛作氮源制取。回答下列问题:
(1)基态N原子核外电子的电子排布图(轨道表示式)为 。
(2)、均位于第ⅠB族,基态Ag原子的价电子排布式为 ;但铜的熔点和沸点均比银的高,这是由于 。
(3)的空间结构和相同,则的空间结构为 ,的价电子数为 。
(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:
①配合物Y中,Cu的配位数为 。
②基态中未成对电子数为 。
(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为。则F原子与邻近的N原子间的距离为 pm,设为阿伏加德罗常数的值,则该晶体的密度为 。
30.物质世界的神奇莫测,常常超乎人们的想象。掌握晶体的结构与性质之间的关系,也许能使你想象的翅膀变得更有力。请回答下列问题:
(1)是目前市场上流行的补锌剂。写出基态电子排布式: 。
(2)已知高温下比更稳定,试从铜原子核外电子变化角度解释其原因: 。
(3)镍能与类卤素反应生成。中硫原子的杂化方式是 ,键和键数目之比为 ;类卤素对应的酸有两种,理论上硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS)的沸点,其原因是 。
(4)氮化硼(BN)晶体存在两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方氮化硼的结构与金刚石类似,可作研磨剂。六方氮化硼的晶体类型为 。
(5)中所含元素的电负性由大到小的顺序为 ,晶体中存在的相互作用有 (填标号)。
a.离子键 B.共价键 C.金属键 D.氢键 E.范德华力
(6)的结构如图所示,已知键角为,为,则的原因主要是 。
(7)酸性: (填“>”“<”或“=”)。
(8)已知可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成皆为。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。绿色晶体配合物的化学式为 。
(9)的晶胞如图所示。
①已知A的坐标为(0,0,0),B的坐标为 。
②设阿伏加德罗常数的值为,则晶体的密度为 (用含a、的代数式表示)。
31.铁、钻、镍、铜及其化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。
(1)磷酸铁锂可用作电池的正极材料。
①基态Fe2+与Fe3+中未成对的电子数之比为 。
②PO的空间结构为 。
(2)高密度磁记录材料纳米钻(Co)可通过亚册(N2H2)还原氯化亚钴来制备。亚肼(N2H2)分子中四个原子都在一个平面上,和是亚肼的两种同分异构体,其中分子的极性:前者 后者(填“>”或“<”)。
(3)实验室常用镍试剂检验Ni2+,可观察到鲜红色沉淀。该沉淀的结构如图所示:
①该沉淀中不存在的作用力类型为 (填选项字母)。
A.配位键 B.氢键 C.金属键 D.σ键 E.π键
②该沉淀中Ni2+的配位数为 。
(4)向CuSO4溶液中逐滴加入氨水,最后可得到深蓝色的[Cu(NH3)4]SO4溶液。
①比较NH3和[Cu(NH3)4]2+中H-N-H键角的大小:NH3 [Cu(NH3)4]2+填“>”“=”或“<”)。
②1mol[Cu(NH3)4]2+中σ键的数目为 。
(5)NiO、FeO的晶胞结构相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“>”或“<”);已知NiO晶体结构中阴阳离子的配位数均为6,则NiO晶胞的俯视图可能是 (填选项字母)。
A. B. C. D.
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如图所示)属于四方晶系(晶胞底面为正方形)。此矿物的化学式为 ;若晶胞的底面边长为apm,高为bpm,阿伏加德罗常数为NA,则该晶体的密度为 g cm3(写出表达式)。
32.卤素元素比较活泼,能形成种类繁多的化合物,回答下列问题:
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为: 。
(2)卤素可形成很多酸根离子,如、、、等,的空间结构为 。
(3)卤素元素之间还能形成很多卤素互化物,如,,,等,根据I与Cl原子的电负性大小关系写成在水中水解的化学方程式: 。
(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式 ,在石墨六元环中心正上方的元素为 。(填元素符号)
(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为,高为,高分为两段,分别为和,的相对分子质量为M,回答下列问题:
①如果与相等,和构成 晶胞。
②金(Au)离子和的配位数分别为 和 。
③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标 。
33.配合物在许多尖端领域如超导材料、催化剂研制、自组装超分子等方面有广泛的应用。回答下列问题:
(1)某配合物的阳离子[Cu(NH3)4(H2O) 2]2+结构如图所示,铜离子的配位数为 ,其中与铜离子形成配位键更强的配体是 (填化学式)。
(2)《诗经》“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的Al3+,Ca2+生成的红色配合物X是最早的媒染染料之一。
基态Al原子中自旋状态相反的两种电子的个数比为 ,配合物X中Al3+的配体除外还有 ,Al3+杂化轨道的空间构型为 ;茜素的熔点比1-羟基蒽醌 (填“高”或“低”)。
(3)向FeSO4溶液中滴加K3[Fe(CN)6]溶液后,经提纯、结晶可得到KFe[Fe(CN)6]蓝色晶体,实验表明,CN-、Fe2+、Fe3+通过配位键构成了晶体骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞如图2,记为Ⅱ型立方结构(注:下层左后的小立方体g未标出)。
K+填充在Ⅰ型立方结构的体心,则在图1结构中K+的填充率为 ;图2晶胞中,Fe(不区分Fe2+,Fe3+)有 种原子分数坐标;若KFe[Fe(CN)6]的摩尔质量为Mg·mol-1,阿伏加德罗常数的值用NA表示,Ⅱ型立方结构的边长为anm,该蓝色晶体密度为 g·cm-3。
34.铁元素单质及其化合物应用广泛,回答下列问题:
(1)纳米铁粉与高温水蒸气反应的化学方程式为 。
(2)血红素是血红蛋白的组成部分,结构如图所示。
①血红素与珠蛋白利用 官能团形成血红蛋白(填名称)
②血红素中N的杂化方式为 ;
③CO、与血红蛋白形成配位健更牢固的是 。
(3)射线衍射得知四氧化三铁是反式尖晶石结构,可表示为,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是 。
a.四氧化三铁是金属晶体,Fe原子失去价电子形成遍布整块晶体、自由移动的“电子气”
b.四氧化三铁是分子晶体,两种FeO和分子能自由移动
c.、在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移
(4)如图所示,晶体中,采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。中有一半的填充在正四而体空隙中,和另一半填充在正八面体空隙中。有 %的正八面体空隙没有填充阳离子。
(5)将鲁士蓝[](其摩尔质量为)晶胞的1/8如下[未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为,则和的最短距离为 cm(为阿伏伽德罗常数的值,写表达式)。
参考答案:
1.(1)1:3
(2) 三角锥形
(3) S>Se>Te
(4) 6 4
【详解】(1)O原子的核外电子排布式为1s22s22p4,2p轨道上有2个未成对电子,其余六个电子成三对,所以未成对电子与成对电子个数比为1﹕3;
(2)SOCl2的结构式是,S原子有三条σ键,孤电子对数量为,所以价层电子对数目是3+1=4,所以S原子是sp3杂化;由于结构中S原子有一个孤电子对,所以SOCl2分子构型是三角锥形;
(3)根据元素周期律,元素非金属性越强,同主族原子半径越小,原子得电子能力越强,形成的阴离子越稳定,释放能量越多,所以三种元素的第一电子亲和能由大到小排序是S>Se>Te;同主族元素电负性由上到下依次减弱,所以H—S键共用电子对在S原子周围出现概率最高,H—Te键共用电子对在Te原子周围出现概率最低,所以两条H—Te键互斥力最弱,键角最小,键角最小的是H2Te;三种原子中S原子半径最小,电负性最大,故H—S键键能最大,所以H2S最稳定;
(4)根据题目所给晶胞模型图,Fe2+有个,有个,所以该晶胞中阴阳离子之比为1﹕1,结构应类似过氧根,所以FeS2的电子式为;取晶胞顶点的粒子,距其最近且等距的Fe2+是三条棱上的粒子,所以每个晶胞对于该顶点粒子最近且等距的Fe2+拥有个,顶点粒子是八个晶胞共有,故距一个完整的最近且等距的Fe2+有个,所以的配位数是6;晶体密度;晶胞中与1个最近且等距的6个Fe2+所围成的空间区域是题目所描述的八面体,一个晶胞含有4个,所以一个晶胞中由Fe2+围成的八面体有4个。
2.(1) 共价 键键能小于键键能
(2)②
(3)分子间能形成氢键,其熔化时需要消耗的能量更多
(4)
(5) C 12
(6)
(7)
【详解】(1)共价键键能普遍较大,直接由原子构成的共价晶体其熔沸点普遍比离子晶体、金属晶体等的熔沸点更高;共价晶体熔沸点高低由晶体共价键键能大小决定,键能大小又与键长相关,所以Si—Si键键长长于Si—O键键长,故Si—Si键键能更低,所以硅单质熔沸点低于二氧化硅;
(2)B组物质均是金属单质,其晶体结构应是金属晶体,其晶体形成及物理性质特点应用电子气理论解释,即②;
(3)HF分子间会形成分子间氢键,破坏这些分子间作用力需要更高的能量,所以HF熔沸点更高,即分子间能形成氢键,其熔化时需要消耗的能量更多;
(4)碱金属离子从上到下半径增大,离子键强度减弱,四种化合物的晶格能逐渐降低,因此熔点:;
(5)A.A晶胞是以NaCl为典型例子的离子晶体晶胞,A不符题意;
B.B晶胞是CO2的分子晶体晶胞,B不符题意;
C.C晶体部分结构是SiO2共价晶体的部分结构,C符合题意;
D.D晶体部分应是单层石墨的晶体的部分结构,D不符题意;
答案选C;
由干冰晶胞可知每一个CO2分子周围有最近且等距的12个CO2分子;
(6)该晶胞中两种离子半径应是r(Cl-) > r(Na+),所以顶点及体心的粒子是Na+,面心上的粒子是Cl-,晶胞中Na+有个,Cl-有个,所以Na+与Cl-个数比为1﹕3,故该晶体化学式为NaCl3;
(7)CaF2晶胞中相邻Ca2+距离是顶点至面心之间距离,所以晶胞面对角线长2a nm,所以晶胞棱长是nm,根据晶体密度计算式,将数据代入,得到。
3.(1)
(2) ABC F>N>O>H
(3) H2O,NH3 正四面体形
(4)两者都是金属晶体,Mg的半径小于Ca的半径,金属键强,熔点高
(5) 正四面体
【详解】(1)O元素位于元素周期表第二周期VIA族,核外电子排布式是1s22s22p4,所以价电子排布图是“”;
(2)①NH4NF2中与之间是离子键,离子内存在着N—H共价键和N→H配位键,所以本问第一空应选填“ABC”;
②该反应中涉及到的非金属元素有:H、N、O、F,H位于第一周期,非金属性最弱,第一电离能最小,N、O、F分别位于第二周期的VA族、VIA族和VIIA族,非金属性逐渐增大,F元素的第一电离能最高,N元素由于原子核外电子排布2p能级处于半满结构,基态原子能量更低,第一电离能高于O元素,所以四种元素第一电离能由大到小排序为“F>N>O>H”;
(3)①反应产物中,NH3、CO2、N2、H2O是分子结构,N2分子内N≡N是非极性键,CO2中C=O是极性键,但分子空间结构中心对称,所以这两种分子均为非极性分子;NH3中N—H是极性键,分子空间构型呈轴对称,H2O中H—O是极性键,且分子空间构型也是轴对称,所以“H2O、NH3”是极性分子;
②中心原子N原子有4条σ键,孤电子对为,离子构型为“正四面体形”;离子中心原子C原子有3条σ键,孤电子对为,离子的空间构型是平面三角形,C原子、O原子均是sp2杂化,均有垂直于离子所在平面的p轨道,离子中价电子总数是,单电子数=,所以离子中的大π键是由4个原子、6个电子形成,表示为“”;
(4)两种单质均是金属,金属晶体熔沸点由其金属键强弱决定,金属键大小由金属阳离子所带电荷量及金属阳离子半径决定,带电荷越多、金属阳离子半径越小,金属键越强,熔沸点越高;
(5)观察晶胞结构,可以看到等距且最近的U原子位于晶胞六个面心上,其所围成的空间结构为正四面体,所以任何六个等距且最近的U原子均能围成正四面体结构,则O原子正好是嵌入这些U原子间隙,即在“正四面体”空间中;根据晶胞模型可以分析出,U原子在顶点和面心,一个晶胞含U原子个,O原子均在晶胞内部,共8个,所以NA个晶胞中UO2的物质的量是4mol,故UO2晶体密度是。
4.(1) 或、等其他合理答案
(2)两者都是分子晶体,由于水存在分子间氢键,沸点高
(3)BDE
(4)O、Se
(5)
【分析】本题主要考查选修三的物质结构与性质,需要对知识理解透彻之后再做好迁移,掌握晶胞的相关计算的一般方法很重要。
【详解】(1)要寻找与互为等电子体的分子,可以如下思考:一个氧原子的6个电子再加一个电子等于7个电子,就可以换成F或Cl,这里一共是三个氧原子,就需要三个电子,除掉本身得到的两个电子之外,再从Se里拿一个电子出来,那Se就换成P或N即可,所以等电子体的分子可以是PCl3、NF3等。
(2)水中含有氢键,所以沸点较高。
(3)A.I中含有苯环,除了有σ键之外还有其它化学键,A错误;
B.I中的Se-Se键是相同原子形成的共价键,为非极性共价键,B正确;
C.II为相对分子较大的有机物,一般不易溶于水,C错误
D.II的主要结构是苯环、碳碳双键和碳碳三键,其中原子的杂化轨道类型只有sp与sp2,D正确;
E.I~III含有的元素包括:H、C、N、O、S、Se,O电负性最大,E正确;
故选BDE。
(4)从结构中可以看出只有O、Se有孤对电子。
(5)①该晶胞主要由K和SeBr6构成,观察晶胞结构图我们可以发现,K位于晶胞内部,一共有8个K;SeBr6分别位于顶点和面心,顶点处的SeBr6有8个,面心处的SeBr6有6个,所以一个晶胞中含有的SeBr6数目为:。所以其化学式为:
K2SeBr6。
②X最简式的式量为Mr,则一个晶胞的式量为4Mr,设晶胞棱长为acm,则
,即,从图2可以看出,两个K原子之间最短的距离为棱长的一半,即相邻K之间的最短距离为:cm=nm。
5.(1) 2:3 As的4p轨道半充满,稳定,I1较大
(2) SO2 sp3
(3) 三角锥 H3AsO4结构中有1个非羟基氧原子而H3AsO3没有,非羟基氧原子越多,酸性越强
(4)
【详解】(1)基态砷原子电子排布式为,N层电子为第四层电子,成对电子为2个;未成对电子3个,则成对电子与单电子的数量比为;Se的价层电子排布式为,As的4p轨道为半充满结构比Se的相对稳定,所以第一电离能大,故填;As的4p轨道半充满,稳定,I1较大;
(2)1mol雄黄(As4S4)与O2反应生成As2O3,转移28mol电子,由电子守恒可知,共消耗7mol氧气,其反应的化学方程式为;由图中可知,雌黄中As与周围3个S原子形成3个σ键,孤对电子数为,故其价层电子对数为,所以雌黄中As的杂化方式为,故填;;
(3)中心原子As与周围的三个氧原子形成3个σ键,孤对电子数为,故其价层电子对数为,其空间构型为三角锥形;亚砷酸()的结构为,砷酸()的结构为,的结构中含有1个非羟基氧原子,而中没有,非羟基氧原子越多,酸性越强,所以亚砷酸酸性弱于砷酸,故填三角锥形;的结构中含有1个非羟基氧原子,而中没有,非羟基氧原子越多,酸性越强;
(4)①如图晶胞中,Ga原子个数为,根据其化学式,As原子个数也为4,根据已知信息,设晶胞参数为,则,解得,晶胞中,面心上6个砷原子构成正八面体,相邻面心原子之间的距离即为八面体边长,边长为pm,故填;
②如图,根据晶胞结构,As与Ga之间最短距离为立方晶胞对角线的,即nm,故填。
6.(1) 18 4s24p4
(2) 大于 同一元素含氧酸中,元素的价态越高含氧酸的酸性越强,硒酸为最高价的氧化物对应的水化物,则硒酸的酸性比亚硒酸的强 三角锥形
(3)N
(4)甲醇分子间存在氢键
(5) (,,)
【详解】(1)Se为34号元素,原子核外电子数为34,基态Se原子核外电子的排布式为1s22s22p63s23p63d104s24p4,电子的空间运动状态有18种,基态硒原子核外价电子排布式为4s24p4;
(2)Se为第VIA族元素,最高价态为+6,最高价的氧化物对应的水化物即硒酸,一般而言,同一元素含氧酸中,元素的价态越高含氧酸的酸性越强,则硒酸的酸性比亚硒酸的强;中Se原子价层电子对数=3+=4,且含有一个孤电子对,微粒空间结构为三角锥形;
(3)根据图示可知,该物质含有H、C、N、O、Se元素,同主族元素从上往下第一电离能减小,同周期随原子序数增大第一电离能呈增大趋势,但N元素原子2p轨道为半充满稳定状态,则第一电离能最大的是N;
(4)能形成分子间氢键的物质熔沸点较高,甲醇、甲硒醇都是分子晶体,结构相似,相对分子质量越大,沸点越高,但甲醇分子间存在氢键所以沸点较高;
(5)M原子的分数坐标为(,,);黑色球个数=8×+6×=4、白色球个数为8,根据其化学式Na2Se知,白色球表示Na+、黑色球表示Se2-,该晶胞体积=(a×10-10cm)3,Na2Se的晶胞密度=g/cm3。
7.(1) N Cu+的3d轨道全满达到稳定状态
(2)C
(3) 11 F、N、C
(4) 50% CuInTe2
【解析】(1)
Cu元素位于周期表中第四周期,即有4个电子层,其最高能层符号为N;由于亚铜离子的3d轨道为全满状态,故比铜离子稳定。
(2)
六水合铜离子中,铜离子为中心离子,水分子为配位体,配位数为6,由配位键的数目可知,铜离子的杂化方式可能为sp3d2杂化,配离子的空间构型为八面体型,故选C。
(3)
①该化合物中N、C、B原子的价层电子对数为4,VSEPR模型为四面体,其中含有N原子5个,C原子4个,B原子1个,一共11个。
②由于同一周期从左向右电负性依次增强,则C、N、F的电负性由大到小的顺序为F>N>C。
(4)
①从晶胞结构可知,铟原子形成的四面体空隙有8个,形成的八面体空隙也有8个,则四面体空隙的占有率为。
②晶胞中位于顶点、面上、体心的铜原子个数为8、4、1,则一个晶胞中铜原子的个数为;位于棱上、面上的铟原子个数为4、6,则一个晶胞中铟原子的个数为;位于体内的碲原子个数为8,则一个晶胞中碲原子个数为8,则一个晶胞中铜原子、铟原子、碲原子的个数比为1:1:2,则其化学式为CuInTe2。
③根据A、B的坐标,可知晶胞的边长为1,则位于体对角线处,面对角线处的C点原子的坐标为(,,);
④由晶胞中C、D形成的直角三角形直角边长为pm,pm,根据勾股定理,求得C、D之间的距离为
8.(1) 8
(2)平面三角形
(3)
(4) O 的相对分子质量大,分子间范德华力强
(5)
【详解】(1)基态氧原子核外电子的运动状态有8种,铁原子的价电子是3d64s2,三价铁离子的价电子排布式为3d5。
(2)碳酸根离子的价层电子对数=3+(4+2-32)=3, 其空间构型为平面三角形。
(3)含有n个P原子的该磷酸根离子,相当于是n个磷酸根离子中去掉了(n-1)个氧原子,O原子数目为4n-(n-1)=3n+1,所带电荷数为(-2)×(3n+1)+5n=-(n+2),则由n个磷氧四面体形成的这类磷酸根离子的通式为[PnO3n+1](2+n)-。
(4)①中配位原子为O,②根据价层电子对互斥理论,水、二氧化硫、三氧化硫的气态分子中,中心原子价层电子对数分别是:2+(6-21)=4、2+(6-22)=3、3+(6-32)=3,不同于其他分子的是H2O。③的熔沸点比高很多,主要原因是的相对分子质量大,分子间范德华力强。
(5)①As、P与N的氢化物空间构型相似,均是三角锥形,但氮元素的电负性强于磷元素,磷元素强于砷元素,共用电子对偏向电负性强的元素,排斥力增大,所以AsH3键角9.(1) 12 6 B
(2) C60 C60晶体属于面心立方堆积,构成微粒的配位数为12。金刚石的晶体晶胞中每个C原子与其他4个C原子相连,构成微粒的配位数为4。
(3)4个Ba和2个Ti
(4) (,,) 180或或311.76 D
【解析】(1)
γ-Fe晶体属于面心立方最密堆积,γ-Fe晶体中Fe的配位数为12,即每个Fe原子距离相等且最近的Fe原子有12个。α-Fe属于简单立方堆积,α-Fe晶体中Fe的配位数为6,即每个Fe原子距离相等且最近的Fe原子有6个。将铁缓慢加热到1500℃,根据转化关系,将会得到δ-Fe,急速冷却,晶体的类型还来不及转化,即保持不变,因此固体B为δ-Fe;缓慢冷却,晶体的类型发生变化,得到α-Fe,即固体A。体心立方堆积的空间利用率高于简单立方堆积,密度较大的是δ-Fe(固体B)。
(2)
C60晶体属于面心立方堆积,如图所示,,构成微粒的配位数为12。金刚石的晶体晶胞,如图所示,,每个C原子与其他4个C原子相连,构成微粒的配位数为4。
(3)
根据题意,可知BaTiO3晶体的晶胞如图所示,,从晶胞可知,O在由4个Ba和2个Ti围成的立方结构的中心。
(4)
①根据晶胞结构图,可知B原子的坐标为(,,)。
②根据截面图结合几何知识可知[2r(Cu)+2r(Al)]为体对角线的一半,设晶胞的棱长为a,则有a=2[2r(Cu)+2r(Al)]=4×(127+143)pm,所以a=pm;根据晶胞结构可知铜原子之间的最短核间距为棱长的一半,即a=180pm或pm或311.76pm;故答案为:180或或311.76。
③根据晶胞结构图,Mn和Al均位于Cu构成的六面体的中心,沿体对角线投影,Mn和Al的位置均会与Cu的位置重合,只有D符合。答案选D。
10.(1)
(2)亚铜离子核外电子处于稳定的全充满状态
(3) 和 三角锥形
(4)
【详解】(1)(1)Cu在元素周期表中位于第四周期第IB族,原子序数29,根据泡利不相容原理和洪特规则,基态Cu原子的价电子排布式为,故填;
(2)(2)亚铜离子的价层电子排布式为,铜离子的价层电子排布式为,其中亚铜离子价层电子处于全充满状态,比铜离子更稳定,故填亚铜离子核外电子处于稳定的全充满状态;
(3)(3)根据价层电子对互斥理论,该配合物中,中的碳原子的价层电子对数为4,为杂化,中碳原子价层电子对数为3,为杂化;该配合物中配体为NH3,所以配体的空间构型为三角锥形;该配合物中含有的元素有Cu、N、H、C、O,同周期电负性从左到右依次增强,同主族电负性依次减弱,非金属电负性强于金属,故以上几种元素的电负性由大到小的顺序为,故填和、直线形、;
(4)(4)①将晶胞参数看为1,如图F原子的y坐标为,x坐标为,其z坐标为晶胞参数的,所以F原子的坐标参数为,故填;
②由M原子的价电子排布式为可知,该原子为Cl,该晶胞中Cl位于晶胞中,全部属于晶胞,原子个数为4,Cu原子个数为,设该晶胞边长为a cm,根据=,已知该晶体的密度为,阿伏加德罗常数的值为,则,该晶体类似于金刚石,其最短距离为对角线的,对角线长度为,其最短距离为 ,故填。
11.(1) 4
(2) 或 3、4
(3) 离子 两者均为离子晶体,离子半径大于S2-,且所带电荷数小于S2-,Li2S晶格能大于LiBF4
(4) 棱边 体心
【详解】(1)F原子价电子排布式为2s22p5,由泡利原理、洪特规则,价层电子排布图为 ,同周期元素第一电离能从左到右有增大的趋势,第一电离能排序时,有2个“反常”,ⅡA元素电子排布有s轨道全充满结构,第一电离能较高,ⅡA高于ⅢA元素;ⅤA元素电子排布p轨道有半充满结构,第一电离能较高,高于ⅥA,故第 2 周期元素中,第一电离能介于B和F之间的元素有Be、C、O、N,故答案为: ;4;
(2)B为+3价,O为-2价,可知中n=3,结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,因六元环中有3个B原子、3个O原子,B、O原子依次间隔连接,且每个B原子还连接1个不在六元环上的O原子,则结构式为: 或 ;由图所知,[B5O6(OH)4]-离子中B原子所连接的原子数分别为3个和4个,则B原子的配位数是3、4,故答案为: 或 ;3、4;
(3)离子晶体的熔沸点较高,根据熔沸点,都为离子晶体,离子晶体的熔沸点高低取决于离子半径大小和离子所带电荷数,离子半径大于S2-,且所带电荷数小于S2-,Li2S晶格能大于LiBF4,所以Li2S 的熔点大于LiBF4的熔点,故答案为:离子晶体;两者均为离子晶体,离子半径大于S2-,且所带电荷数小于S2-,Li2S晶格能大于LiBF4;
(4)如图所示Li3SBF4的晶胞结构,根据均摊法,含有1个,且位于体心;根据化学式可知,含有3个Li+,则,则Li+位于棱边;晶胞中Li+与间的最近距离为apm,为面对角线的,设晶胞的边长为dpm,则面对角线为d,即d=2a,则晶胞的边长d=a pm,晶胞的体积V=(a×10-10)3cm3,Li3SBF4晶胞的质量m=g=g,根据ρ==g cm-3;在Li3SBF4晶胞的另一种结构中,位于顶点,把晶胞的BF4-向右上移至顶点,则S2-向右上移至于体心,故答案为:棱边;;体心。
12.(1) 与是离子晶体,的晶格能大于;属于分子晶体,熔沸点比离子晶体低得多 正四面体
(2) 0.1407nm (,,0.0630)
【详解】(1)与是离子晶体,的晶格能大于;TiCl4常温下呈液态,可知其属于分子晶体,熔沸点比离子晶体低得多。根据价层电子对互斥理论,TiCl4具有4对成键电子对,中心原子Ti发生sp3杂化,形成正四面体结构的分子。
(2)①A原子处于晶胞顶点,c棱中心和内部,A原子数目为1+1+6=8,而B原子完全处于晶胞内部(从a方向投影图可看出),B原子数为4,故化学式为A2B,化学式在保证化学意义的前提下取最简整数比;
②从图易得晶胞顶点A原子的坐标参数为(0,0,0),棱上A原子的坐标参数为(0,0,0.5)。由A1原子的坐标参数(1,0,0)和A2原子的坐标参数(0.8300,0.1700,0.2500),利用勾股定理和余弦定理易得
da=∣0.8300-1∣×0.4780nm=0.081260nm,
db=∣0.1700-0∣×0.47800nm=0.081260nm,
dc=∣0.2500-0∣×0.7800nm=0.19500nm,
d=nm=0.2405nm,晶胞中原子A1—A2在ab面投影的距离为;
③两种对称性值得我们注意:晶胞的反演中心和z=0.2500=1/4处的镜面,由此易得B1原子的坐标参数为:(1/3,2/3,0.0630)。
13.(1)
(2)TiO2+中的Ti有空轨道,而H2O2中的O有孤电子对,两者能形成配位键
(3) sp3 sp2
(4) 6 8 4:1
【详解】(1)Ti为22号元素,核外电子排布式为[Ar]3d24s2,价电子轨道表示式为;
(2)TiO2+中的Ti有空轨道,而H2O2中的O有孤电子对,两者能形成配位键,从而形成稳定的[TiO(H2O2)]2+;
(3)甲基橙中S原子形成4个σ键,2个π键,所以不含孤电子对,价层电子对数为4,采取sp3杂化;亚甲基蓝中S原子形成2个σ键,1个π键,带一个单位正电荷,所以还有一对孤电子,则价层电子对数为3,为sp2杂化;
(4)①以任一顶点的La原子为例,距离其最近的Ba原子位于该La原子所在棱的另一个顶点,一个La原子被六条棱共用,所以晶体中与La距离最近的Ba的数目为6;
Co原子位于结构单元的体心,每个结构单元含有1个Co原子,观察发现可知,若该结构单元重复排列,则其相邻结构单元的La、Ba原子会与该结构单元中的Ba、La原子重叠,所以该结构单元不是该晶体的晶胞,该晶体的晶胞应是由8个小正方体组成的大正方体,所以一个完整晶胞中含有8个Co原子;
②该结构单元中含有=个La原子、=个Ba原子,存在5%的O原子缺陷,所以含×(1-5%)=2.85个O原子,La为+3价、Ba为+2价,O为-2价,设+3价钴的个数为x,+4价钴的个数为y,则根据化合价之和为0可得3x+4y+×(+3+2)=2×2.85,根据原子守恒可得x+y=1,联立解得x=0.8、y=0.2,所以+3价钴与+4价钴的原子个数比为4:1;
结构单元的质量为g,结构单元的体积为a3pm3=a3×10-30cm3,所以结构单元的密度为=g·cm-3。
14.(1)3d5
(2)两者均为金属晶体,且Co原子半径更小,形成的金属离子半径更小,导致其金属键键能更大
(3) 21NA 变大
(4) 直线形 O
(5) CaFe2As2 (0.5,0.5,0.872)
【详解】(1)锰为25号元素,失去2个电子形成基态,其价电子排布式为3d5;
(2)两者均为金属晶体,且Co原子半径更小,形成的金属离子半径更小,导致其金属键键能更大,故Co的熔点、沸点均比Ca高;
(3)单键均为σ键,双键中含有1个σ键1个π键,叁键含有1个σ键2个π键;1分子含有6个配位键、且氨分子中含有3×5=15个σ键,共21个σ键;故1mol中含有的σ键数目为21NA;分子中存在1对孤对电子,通过孤对电子与形成配合物后孤对电子对数为0,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,故使得键角变大;
(4)与二氧化碳互为等电子体,空间结构相似,为直线形;同一周期随着原子序数变大,第一电离能变大;N原子和O-的2p轨道均为半充满稳定状态,氮原子的第一电离能较大、O第二电离能较大且此时两者失去电子情况相同,但是由于氧原子的半径更小,故导致O第二电离能更大,使得第二电离能与第一电离能差值更大的是氧元素,氮的第一电离能和第二电离能分别为1402.3kJ/mol、2856 kJ/mol,氧的第一电离能和第二电离能分别为1313.9kJ/mol、3388.3kJ/mol,故填O;
(5)由均摊法可在,一个晶胞中Ca数目为、Fe数目为、As数目为,则该材料的化学式为CaFe2As2;晶胞中As原子1分数坐标为(0,0,0.628),已知体心与顶点的Ca原子有着相同的化学环境,体心Ca坐标为(0.5,0.5,0.5),则As原子1与体心Ca在z轴上的坐标差为0.628-0.5=0.128,则As原子2的z轴上距离顶面的坐标差为0.128,故As原子2的z轴上坐标为1-0.128=0.872,故As原子2的分数坐标为(0.5,0.5,0.872);
与底面平行的体心Ca所在平面和As原子1的距离为0.128cpm,体心Ca原子与As原子1所在z轴的距离为,则体心Ca原子与As原子1之间的距离为pm。
15.(1) sp sp2
(2)4
(3)与水分子之间形成氢键,且是极性分子,水是极性溶剂,根据相似相溶原理,可知易溶于水
(4) 3d 5d106s1
(5) 三角锥形 SOCl2、PCl3等
(6)100%
(7)咪唑
(8)①
(9)
【详解】(1)CO2的结构简式为O=C=O,C的杂化类型为sp;HCOO-中C形成三个σ键,C的杂化类型为sp2;
(2)原子之间的单键形成1个σ键,双键形成1个σ键和一个1个π键,HCOOH中含有σ键个数为4;
(3)易溶于水的原因是与水分子之间形成氢键,且是极性分子,水是极性溶剂,根据相似相溶原理,可知易溶于水;
(4)基态K原子价电子排布式为4s1,能量最低的空轨道的符号为3d;为79号元素,核外电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d106s1,原子的价电子排布式为5d106s1;
(5)中Se的价层电子对数=3+=4,有1个孤电子对,空间构型为三角锥形;原子总数相等、价电子总数相等的微粒互为等电子体,则与互为等电子体的分子的化学式为SOCl2、PCl3等;
(6)C堆积方式为面心立方结构,C位于晶胞的顶点和面心,晶体中C数目为,结合化学式K3C60可知晶胞中K+数目为3×4=12,说明晶胞中共4个八面体空隙和8个四面体空隙均被K+填充,即晶胞中K+占据的空隙百分百为100%;
(7)咪唑结构中含有亚胺基=NH,相邻分子间存在氢键,因此咪唑的沸点是三种物质中最高的;
(8)咪唑中②号N原子形成3个σ键,由于存在大π键,说明两个氮原子都是sp2杂化,则②号氮原子没有孤电子对,而①号氮原子形成两个σ键,所以有孤电子对,可以形成配位键,所以更容易与Cu2+形成配位键的是①号氮原子;
(9)Al位于体内和顶点,Ti分别位于晶胞的顶点、面心、体内和棱上,Ti原子个数=,Al原子个数=,所以化学是为Ti11Al5;晶胞的质量m=,晶胞的体积V=S·h =,根据m=ρV,,解得h=(cm)。
16.(1) [Ar]3d5; [Fe(CN)6]3-; ;
(2) 6; sp2; pH太大,Fe2+可能会沉淀,干扰Fe2+与邻二氮菲配位1; pH太小,邻二氮菲中N原子与H+结合,使邻二氮菲配位能力减弱;
(3) 24; Fe2+和Fe3+各一半; 。
【详解】(1)铁位于第族,价电子排布为:3d64s2,失去三个电子后电子排布式为:[Ar] 3d5;配位数为6说明氰根离子的数目为6,故化学式为:[Fe(CN)6]3-;铁离子3d轨道上五个电子,配位后两个电子用于与s轨道和p轨道形成杂化轨道。故配位前后Fe3+3d轨道表示式:;答案为:[Ar]3d5;[Fe(CN)6]3-;;
(2)邻二氮菲中有2个N原子,每一个N原子都能形成配位键,所以在[Fe(phen)3]2+中,Fe2+的配位数为6,配位原子是氮原子,根据图示可知,氮原子形成了3个σ键,1个π键,氮原子的杂化方式为:sp2;用邻二氮菲测定Fe2+浓度时应控制pH在2 ~ 9适宜范围,原因是pH < 2时,H+浓度大,邻二氮菲中的N原子优先与H+形成配位键,导致与Fe2+的配位能力减弱,pH>9时,OH-浓度大,与Fe2+反应生成Fe(OH)2,影响Fe2+与邻二氮菲配位;故答案为:6;sp2;pH太大,Fe2+可能会沉淀,干扰Fe2+与邻二氮菲配位1;pH太小,邻二氮菲中N原子与H+结合,使邻二氮菲配位能力减弱;
(3)Fe3O4晶体是由图1所示的结构平移构成,根据I型和II型两种小立方体的构型可知,Fe3O4的晶胞由4个I型小立方体和4个II型两种小立方体组成,在1个由I型和II型两种小立方体组成结构中,氧离子的个数为8,根据Fe3O4的化学式可知,铁离子共6个,结合二者组成的长方体结构可以计算:Fe3+=,可推知共含有4个铁离子,Fe3O4中Fe2+∶Fe3+=1∶2,故可知:代表Fe2+和Fe3+各一半;一个小立方体中有4个氧离子,一个晶胞包含了8个小立方体,故氧离子为32个,根据化学式Fe3O4,则Fe3O4晶胞中有铁离子为:24个;故Fe3O4的密度=。答案为:24;Fe2+和Fe3+各一半;。
17.(1) [Ar]3d104s24p2 线状
(2) sp2 (3n+1)NA
(3) 离子晶体 H<C<N
(4)大于
(5) 4 (,,)
【详解】(1)Ge是32号元素,位于第四周期第Ⅳ族,基态Ge原子的核外电子排布式为1s22s22p63s23p63d104s24p2,其化简电子排布式为[Ar]3d104s24p2;Ge原子的电子发生跃迁时会吸收或发出不同的光,永光普分析仪获得的是不连续的光谱,应该是线状光谱;
(2)①Na2GeO3中锗原子的价电子数为:,VSEPR模型为平面三角形,则杂化方式是sp2杂化;
②GenH2n+2与烷烃结构相似,分子中的共价键均为σ键,n个Ge原子之间形成(n-1)个σ键,Ge与(2n+2)个H原子形成(2n+2)个σ键,所以1个分子中σ键的数目为(2n+2)+(n-1)=3n+1,1mol GenH2n+2中含有σ键的数目为(3n+1)NA;
(3)①该物质由阳离子EMIM+和阴离子[AlCl4]-构成,所以属于离子晶体;
②EMIM+ 离子中组成元素为H、C、N,非金属性越强,其电负性越大,非金属性由小到大的顺序是H(4)孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,NH3分子中含有1对孤电子对,而[Zn(NH3)6]2+离子中N原子上的孤电子对与Zn2+形成配位键,所以[Zn(NH3)6]2+离子中H-N-H的键角大于107.3°;
(5)该晶胞中Zn原子的配位数是4,则ZnSe晶胞中Se原子的配位数也是4;A的坐标为(0,0,0),B的坐标为(,1,),则A原子位于坐标原点,B原子在坐标轴正方向空间内,由图乙可知D原子也在坐标轴正方向空间内,且到x轴、y轴、z轴的距离分别是,,,即D原子的坐标为(,,);
晶胞的边长为apm,则晶胞的体积V=a3pm3=a×10-30cm3,根据均摊法,1个晶胞中Zn原子个数为4,Se原子个数为,所以由m=nM=,得==。
18.(1) 。 第三周期,第VIIA族。 O>N>P。
(2) sp3。 14。 四面体;。 有机溶剂通过分子间作用力结合而成,而离子液体通过阴阳离子作用形成离子键相,离子键作用力大于分子间作用力,故离子液体相对难挥发。
(3) -2。 。
【详解】(1)氯原子价电子排布式为3s23p5,价电子的轨道表示式为:;氯元素是第三周期,第VIIA族;O、N、P的电负性,同周期元素核电荷数越大电负性越大,O电负性大于N,同主族元素核电荷数越小电负性越大,N电负性大于P,故电负性O>N>P;
故答案为:;第三周期,第VIIA族;O>N>P。
(2)化合物Ⅰ中碳原子价电子对数为4+=4,轨道为sp3杂化;1mol化合物Ⅰ中含有11个极性单键,都为σ键,两个双键,其中含有2个σ键,一个配位键,为σ键,一共有14个σ键;化合物Ⅱ中,中心原子为N原子,价电子对数为4+=4,sp3杂化,空间构型为四面体;传统的有机溶剂都是不带电的分子,通过分子间作用力结合而成,而离子液体通过阴阳离子作用形成离子键相 ,离子键作用力大于分子间作用力,故离子液体相对难挥发;
故答案为:sp3;14;四面体;有机溶剂通过分子间作用力结合而成,而离子液体通过阴阳离子作用形成离子键相,离子键作用力大于分子间作用力,故离子液体相对难挥发。
(3)锰的氧化物晶胞中Mn原子个数为1+×8=2,O原子个数为2+×4=4,则化学式为MnO2,氧的化合价为-2价,则锰的化合价为+4价;沿z方向投影图为:;
故答案为:-2;。
19.(1) 第4周期第ⅦB族
(2) 16 32 Cl、N
(3) (正)四面体(形) 二者均为分子晶体,相对分子质量更大
【详解】(1)基态Mn原子的电子排布式为:,价电子轨道表示式为 ,在周期表中的未知为:第4周期第ⅦB族;
(2)根据晶胞结构图,原子棱上有24个,面心有8个,里面有6个,总个数为:个,含有杂化的中心原子为32,Cl、N含有孤电子对,提供提供电子对形成配位键;
(3)中N价层电子对为4,构型为正四面体结构;相对分子质量较大,所以沸点较高。
20.(1)1s22s22p5
(2) > F电负性大于氧大于氢,故OF2中O周围电子密度相对小于H2O中情形,O周围电子对间斥力较小,键角变小
(3) +2HF=[BF4]-+H2F+
(4) 8
【详解】(1)氟是9号元素,基态氟原子的电子排布式为1s22s22p5。
(2)①键长越长,键能越小,中O—O键的长度小于中O—O键的长度,则中O—O键的键能大于中O—O键的键能,则O—O键的稳定性:>;
②F电负性大于氧大于氢,故OF2中O周围电子密度相对小于H2O中情形,O周围电子对间斥力较小,键角变小,中F—O—F键角小于中H—O—H键角。
(3)①测定结果表明,固体中分子排列为锯齿形,画出含2个的重复单元结构为: ;
②溶剂中加入可以解离出和具有正四面体形结构的阴离子,该阴离子为[BF4]-,离子方程式为:+2HF=[BF4]-+H2F+。
(4)①由晶胞结构可知,Ca2+占据8个顶点和6个面心,8个F-位于晶体的内部,晶体中距离最近的有8个;
②由晶胞结构可知,Ca2+的个数为8 +6 =4,F-的个数为8,晶体中与的最近距离为晶胞体对角线的,设晶胞的边长为a,则a=d,a=d,该晶体的密度。
21.(1)
(2) A
(3) 、
(4)
【详解】(1)基态B原子价层电子的轨道表示式为: ;
(2)①中C原子没有空轨道,不能与分子形成配位键,不能使原有的键削弱、断裂,所以不易发生水解,、、都已发生水解,故选A;
②水解的化学方程式:;
③与NaOH溶液反应的离子方程式为:
(3)由图1可知,1mol该离子中有个硼氧四面体,含有配位键数目为,其中硼原子的杂化轨道类型为:和杂化;
(4)根据投影可知,1个B原子为3个Mg原子共用,故属于1个Mg原子的B原子为;1个Mg原子为6个B原子共用,故属于1个B原子的Mg原子为,由此可知,Mg和B原子个数比为:,所以硼化镁的化学式为:。
22.(1)
(2)Fe失去3个电子后,形成的为半充满,结构稳定,难失去第4个电子,所以第4电离能比第3电离能大很多
(3)C
(4)普鲁士蓝的铁与氰基以配位键结合,剧毒的氰根离子不可能游离出来,因此普鲁士蓝本身是无毒的;
(5) 4
【详解】(1)Fe是26号元素,价层电子排布式为,基态Fe原子价层电子的轨道表示式为: ;
(2)Fe原子价层电子排布式为,Fe失去3个电子后,形成的为半充满,结构稳定,难失去第4个电子,所以第4电离能比第3电离能大很多;
(3)关于晶体
A. 存在的化学键有σ键、π键、配位键、离子键等,A正确;
B. Fe、N、C的电负性由大到小的顺序:,B正确;
C. 在晶体中的键能等于KCN中的键能,C错误;
D. 由图1可知,在晶胞中、 原子均参与形成配位键,其配位数之比为6:6,D正确;故选C;
(4)因为普鲁士蓝的铁与氰基以配位键结合,剧毒的氰根离子不可能游离出来,所以普鲁士蓝本身是无毒的;
(5)晶胞中,个数为:,个数为:,与、比值为1:1,所以个数为4;晶胞的棱长为,图1中位于每个晶胞中心,图2中位于小正方体的中心,则相邻之间的最短距离为nm。
23.(1)3d64s2
(2) O>N>C>H sp2、sp3杂化 氢键 没有
(3) 12
【详解】(1)铁为26号元素,价层电子排布式为:;
(2)①同周期元素的电负性从左到右依次增大,有,而H的最小,故有:。故答案为:;
②单键的N的价层电子对数为,根据杂化轨道理论,中心N原子采取杂化,双键的N原子采用sp2杂化。故答案为:sp2、杂化;
③据图色胺酮钴配合物中O及N原子均有孤对电子,而中羟基上的氢原子上的电子偏向O导致几乎氢核裸露,故两者易形成氢键。甲醇分子中没有π键。
(3)据图色胺酮钴配合物中O及N原子均有孤对电子,而中羟基上的氢原子上的电子偏向O导致几乎氢核裸露,故两者易形成氢键。甲醇分子中没有π键。
(3)依图所示的立方体晶胞中,Mg原子位于顶点,Ni原子位于面心,而C位于体心。
①每个立方体晶胞中,Mg原子最近的Ni原子个数为3,而每个Mg原子被8个立方体占据,故Mg原子最近的Ni原子个数为:。故答案为:12;
②每个立方体晶胞中,各原子的数目为:,,,故化学式应为:。。故答案为:。
24.(1)
(2)
(3) 棱心 面心 (或278.5) (或) Sr原子半径小于La
【详解】(1)基态Zn的价电子排布式为,则基态的价电子排布式为,同周期元素随核电荷数增大,非金属性增强,电负性增强,所以,故答案为:;;
(2)MA是其中N原子为类似于是的形式,的杂化类型是,因此的杂化轨道类型,观察FA的结构中,不难看出,除碳氮之间存在双键,其余的均是σ键,故1个FA中含有7个σ键,1molFA中存在个σ键,故答案为:;;
(3)观察图a可知,图中O原子的位置是棱心,结合图a中La的位置在体心故结合图b可知此时O原子的位置在面心;La的配位数均是12,因此为最密堆积,根据投影可知为面心最密堆积,因此O与O的最小核间距为面对角线的一半,即(或278.5);若图a晶胞的超晶胞中La则共为8个,Cr也为8个,O原子位于面心和棱心共为24个,其中一个La原子被Sr代替,则掺杂后晶体化学式为,也可以写为,掺杂Sr后O与O的最小核间距略有减小,其可能的原因是Sr原子半径小于La,故答案为:棱心;面心;(或278.5);(或);Sr原子半径小于La。
【点睛】本题考查物质结构的综合应用,整体偏难。
25.(1) 4s24p1 第四周期IIIA族
(2) N N
(3) 正四面体 sp3
(4) ②③① 三者结构相似,都是原子晶体,碳原子半径小于硅原子,键能C-C>C-Si>Si-Si
(5)
(6) SeBi2O2
【详解】(1)是31号元素,根据构造原理,可知基态镓原子的核外电子排布式是,则其价电子排布式为。根据核外电子排布式可知原子核外有4个电子层,最外层有3个电子,则由原子结构与元素位置关系可知位于元素周期表第四周期第ⅢA族。
(2)在上述材料所涉及的元素有C、、N、。原子核外电子层数越多原子半径越大;当原子核外电子层数相同时,原子序数越小,原子半径越大。C、N原子核外只有2个电子层,核外有3个电子层,核外有4个电子层,由于原子序数N>C,故上述四种元素中原子半径最小的是N元素。同一周期元素的第一电离能随原子序数的增大而增大,同一主族元素的第一电离能随原子序数的增大而减小,在上述四种元素中原子核外电子层数最少的元素有C、N,由于原子序数N>C,N原子核外电子排布处于半满的稳定状态,所以第一电离能最大的是N元素。
(3)原硅酸根中原子价层电子对数为,且不含孤电子对,根据价层电子对互斥理论可知的空间构型是正四面体形;其中原子杂化类型是杂化。
(4)①金刚石、②晶体硅、③碳化硅三种物质都是共价晶体,原子半径:。原子半径越小,共价键键长就越短,该化学键的键能就越大,断裂该共价键使物质熔化、气化消耗的能量就越多,物质的熔沸点就越高。由于键长:,所以键能:,因此三种物质的熔点由低到高的顺序是②③①,原因为三者结构相似,都是原子晶体,碳原子半径小于硅原子,键能C-C>C-Si>Si-Si。
(5)该晶胞中含有原子数目为,含有N原子数目为,晶胞底面为菱形,锐角为,边长为,则底面面积,则晶胞体积,则其密度,则阿伏伽德罗常数。
(6)根据电荷守恒可知,该晶胞中和的个数比为1:1,则硒氧化铋的化学式为SeBi2O2;该晶胞中,Se的个数为=2,结合化学式可知,该晶胞中含有2个SeBi2O2,晶胞质量为=,晶胞体积为a10-10cma10-10cmc10-10cm=a2c10-30cm3,则晶胞密度为=g·cm-3。
26.(1) 7 ⅡA
(2)镁原子为3s2全满稳定状态,铝原子为3s2sp1结构,容易失去电子变成3p全空的较稳定结构,故第一电离能Al(3) Na3AlF6
(4)(0.134,0.134,0.134)
【详解】(1)把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;基态Al原子核外电子排布为1s22s22p63s23p1,故基态Al原子核外电子有7种不同的空间运动状态;具有40个价电子时最稳定,的价电子为14×3=42,则其容易失去2个电子,故与ⅡA族元素的性质相似。
(2)镁原子为3s2全满稳定状态,铝原子为3s2sp1结构,容易失去电子变成3p全空的较稳定结构,故导致Al原子的第一电离能低于Mg;
(3)由图可知,根据“均摊法”,晶胞中含个小八面体,1个小八面体中含有6个F、1个Al,则共含有12个F、2个Al,根据投影可知,4个钠位于棱、6个为面、2个位于体内,则含个Na,故该助熔剂的化学式为Na3AlF6;晶体密度为;
(4)晶胞边长为780pm,则体对角线为长度为,大阴离子中一个在体对角线上,且Al-F键长181pm,该所配位的原子为原点,则该氟离子到原点距离占体对角线长度的分数为,则该氟离子在x、y、z轴上的投影的分数均为0.134,故该的坐标为(0.134,0.134,0.134)。
27.(1) 2
(2) 与两种含砷有机酸均属于分子晶体,含两个羟基,形成的氢键数目多,沸点高 >
(3) 0.75 0.25 0.25(或0.75)
【详解】(1)砷位于元素周期表的第4周期第ⅤA族,其基态原子核外价电子排布式为:;砷原子p轨道为半充满状态,其第一电离能较大,所以同周期中第一电离能大于砷的元素只有Br和Kr两种;
(2)物质的熔沸点与晶体类型有关,原子晶体>离子晶体>分子晶体,与两种含砷有机酸均属于分子晶体,含两个羟基,形成的氢键数目多,沸点高;和均为sp3杂化,但比多一对孤电子对,杂化方式相同时,孤电子对数越多键角越小,故>;
(3)①把晶胞切割成多个边长为的小正方体,M位于一个顶点,所在的正方体在N所在正方体的正上方,所以M点原子分数坐标为;
②根据均摊法晶胞计算法则可得:,,,,化简即可得中m=0.75,n=0.25;
③将晶胞切割成八个大小相等的正方体,如图 , Mn原子在顶点,As原子在小正方体的体心,即晶胞结构体对角线的处,设棱长为a,一个晶胞中含有4个分子,所以,nm,则As原子与Mn原子之间的最短距离为nm;
④在LiZnAs立方晶胞中,Zn以面心立方形式堆积,Li和As分别填充在Zn原子围成的八面体空隙中,Zn位于顶点、面心,晶胞中Zn原子数目为4,结合化学式可知晶胞中Li、As原子数均为4,结合a=0和1,a=0.5的截面,可知Li位于晶胞的体心、棱心,而As位于晶胞体心,只有其中4个填充As原子的晶胞不共面,根据几何知识可知x=0.25或0.75,在图4中As原子所在的截面上表示为 。
28.(1) 分子晶体 HF 、
(2) > 分子中键的键长小于中键的键长,其原因是:分子中既存在σ键,又存在大键,原子轨道重叠的程度较大,因此其中键的键长较小,而只存在普通的σ键。
(3)
【详解】(1)常温常压下,为无色气体,则的沸点较低,因此,固态HOF的晶体类型为分子晶体。分子中F显-1价,其水解时结合电离的生成HF,则结合电离的,两者反应生成,因此,水解反应的产物为HF 、。
(2)中心原子为,中心原子为,二者均为V形结构,但中存在大键()。由中存在可以推断,其中原子只能提供1对电子,有一个原子提供1个电子,另一个原子提供1对电子,这5个电子处于互相平行的轨道中形成大键,提供孤电子对与其中一个形成配位键,与另一个形成的是普通的共价键(σ键,这个只提供了一个电子参与形成大键), 的价层电子对数为3,则原子的轨道杂化方式为;中心原子为,根据价层电子对的计算公式可知,因此,的杂化方式为;根据价层电子对互斥理论可知,时,价电子对的几何构型为正四面体,时,价电子对的几何构型平面正三角形,杂化的键角一定大于的,因此,虽然和均为形结构,但键角大于键角,孤电子对对成键电子对的排斥作用也改变不了这个结论。分子中键的键长小于中键的键长,其原因是:分子中既存在σ键,又存在大键,原子轨道重叠的程度较大,因此其中键的键长较小,而只存在普通的σ键。
(3)一定条件下,、和反应生成和化合物X。已知X属于四方晶系,其中Cu化合价为+2。由晶胞结构图可知,该晶胞中含有黑球的个数为、白球的个数为、灰色球的个数为,则X中含有3种元素,其个数比为1:2:4,由于其中Cu化合价为+2、的化合价为-1、K的化合价为+1,根据化合价代数和为0,可以推断X为,上述反应的化学方程式为。若阿伏加德罗常数的值为,晶胞的质量为,晶胞的体积为,化合物X的密度。
29.(1)
(2) 铜的原子半径比银的小,金属键比银的强
(3) 直线形 16
(4) 4 0
(5)
【详解】(1)基态N原子核外电子排布为:,电子排布图(轨道表示式)为: ;
(2)基态Ag原子的价电子排布式为:;铜的原子半径比银的小,金属键比银的强,所以铜的熔点和沸点均比银的高;
(3)为直线型分子,的空间结构和相同,则的空间结构为直线型,价电子数为个;
(4)①根据Y的结构简式,在Y分子中,Cu的配位数为4;
②基态电子排布式为:,未成对电子数为0;
(5)根据晶胞图,F原子在体心,N原子在顶点处,F原子与N原子的最近距离为体对角线的一半,为;在该晶胞中,F原子个数为1,N原子为,Cu原子在棱上,个数为,所以晶胞的密度为:。
30.(1)或
(2)的价电子排布是,3d轨道全满稳定
(3) HNCS分子间可形成氢键,而HSCN分子间不能形成氢键
(4)共价晶体
(5) A、B
(6)双键与双键间电子对的斥力大于单键与单键电子对的斥力
(7)>
(8)
(9) (,,)
【详解】(1)基态电子排布式:或;
(2)的价电子排布是,3d轨道全满稳定,所以高温下比更稳定;
(3)的结构式为:,硫原子的杂化方式是;键和键数目之比为:;分子间可形成氢键,而HSCN分子间不能形成氢键,所以硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS)的沸点;
(4)六方氮化硼结构与金刚石相似,晶体类型为共价晶体;
(5)中所含元素的电负性由大到小的顺序为:;该晶体中含有离子键和共价键,故选AB;
(6)双键与双键间电子对的斥力大于单键与单键电子对的斥力,所以键角;
(7)因为F原子的电负性较大,使的H原子不一点力,所以酸性小于;
(8)氯离子和银离子反应生成氯化银白色沉淀,可以通过沉淀的质量推出氯离子的含量,白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的,两种晶体的组成皆为,说明该紫色晶体中有3个自由移动的氯离子,而绿色晶体有2个自由移动的氯离子,即有一个氯原子形成了配合物,因为钛为6配位,即配合物中有5个水分子,绿色晶体配合物的化学式为;
(9)根据A的坐标为(0,0,0),B的坐标为(,,);在该晶胞中,个数为:8,为,所以晶胞的密度为:。
31.(1) 4:5 正四面体形
(2)<
(3) C 4
(4) < 16NA
(5) > CD
(6) FeCuS2(或CuFeS2) 或
【详解】(1)①基态Fe2+价层电子排布式为3d6,有4个成单电子,Fe3+价层电子排布式为3d5,有5个成单电子,基态Fe2+与Fe3+中未成对的电子数之比为4:5,
故答案为:4:5;
②PO中中心P原子的价层电子对数为4+ =4,没有孤电子对,空间构型为正四面体形,
故答案为:正四面体形;
(2)结构对称、正负电荷重心重合,为非极性分子,结构不对称、正负电荷重心不重合,为极性分子,故分子的极性:前者<后者,
故答案为:<;
(3)①N原子与Ni之间形成配位键,碳碳之间形成非极性键,碳与氮、碳与氢、N与O、O与H之间形成极性键,O与H之间存在氢键,单键为σ键,双键含有1个σ键、1个π键,所以不含金属键,
故答案为:C;
②由沉淀的结构图可知,Ni与4个N原子形成配位键,即该沉淀中Ni2+的配位数为4,
故答案为:4;
(4)①NH3提供孤对电子与Cu2+形成配位键后,没有孤电子对,NH3中存在1个孤电子对,孤电子对与成键电子对间存在斥力,所以NH3中H-N-H键角较小,
故答案为:<;
②[Cu(NH3)4]2+中存在12个N-H键,Cu与N之间存在4个配位键,1mol[Cu(NH3)4]2+中σ键的数目为16NA,
故答案为:16NA;
(5)NiO、FeO都是离子晶体,氧离子半径相同,Ni2+半径比Fe2+小,半径越小,离子晶体的晶格能越大,熔点越高,故熔点:NiO>FeO;NiO 晶体结构中阴阳离子的配位数均为 6,可判断Ni2+和O2-占据晶胞的顶点,面心和体心和棱上,所以俯视图中CD符合,
故答案为:>;CD;
(6)根据均摊法可知,1个晶胞中的Cu原子数为,Fe原子数为,S原子数为8,故此矿物的化学式为或;晶胞密度=或g/cm3。答案为:FeCuS2(或CuFeS2); (或)。
32.(1)
(2)三角锥形
(3)
(4) 钙
(5) 面心立方 6 12
【详解】(1)F,Cl,Br,I分别形成简单氢化物为HF、HCl、HBr、HI,均为分子晶体,HF分子间形成氢键,沸点最高,HCl、HBr、HI相对分子质量依次增大,分子间作用力依次增大,沸点依次增大,故沸点由高到低的顺序为:;
(2)的中心原子Br的孤电子对数为:,价层电子对数为:3+1=4,VSEPR模型为四面体形,故其空间结构为三角锥形;
(3)电负性大小:Cl>I,共用电子对偏向Cl,相对显负电性,水解时,元素化合价不变,故在水中水解的化学方程式:;
(4)如图结构所示,根据均摊法:一个六元环中:Cl的个数为:,Ca的个数为:,故该化合物的化学式;r(Ca2+)(5)①如果与相等,和构成的晶胞结构与NaCl型相似,为面心立方;
②该晶胞的化学式为,根据均摊法,Cs的个数为:,则Au的个数为2个,则Au位于两个立方体的体心,离Au最近的为6个,故其配位数为6;与构成面心立方,故离最近的为12个,故其配位数为12;
③分数坐标是指x、y、z三个方向上的距离分别占晶胞长宽高的比例,如图所示,晶胞内部小白球位于
1.VIA族的氧、硫、硒(Se)、碲(Te)等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)基态O原子中,未成对电子数与成对电子数之比为 。
(2)亚硫酰氯在有机合成中有重要应用,分子中S原子的杂化轨道类型为 ,分子的空间结构为 。
(3)气态电中性基态原子得到一个电子转化为气态基态负离子所放出的能量叫做第一电子亲和能。S、Se、Te三种元素的第一电子亲和能由大到小的顺序是 ,、和键角最小的是 ,稳定性最强的是 。
(4)黄铁矿是工业生产硫酸的原料,其晶胞结构如图所示,晶胞参数为anm,该晶体的电子式为 ,的配位数为 ,晶体的密度为 ,在1个晶胞中,由围成的正八面体的个数为 。
2.Ⅰ.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550
硅晶体:1410
硼晶体:2300
二氧化硅:1732
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,据此回答:A组属于 晶体,硅晶体的熔点低于二氧化硅,是由于 。
(2)B组晶体共同的物理性质是具有良好的延展性和导电性,可用 (填序号)理论解释。
①价层电子对互斥理论 ②电子气理论 ③电子云理论
(3)C组中相对分子质量小于但熔点却高于,是由于 。
(4)D组晶体中、、、的熔点由高到低的顺序为 。
Ⅱ.下图表示一些常见晶体的微观结构:
(5)其中代表的是 (填字母),在干冰晶体中,每个CO2分子周围紧邻的分子有 个。
(6)晶体在的高压下和反应生成如图所示的晶胞结构,则该晶体的化学式为 。
(7)的晶胞如图所示,密度为,相邻的两个的最近核间距为,则的摩尔质量为 (列出代数式,设为阿伏加德罗常数的值)。
3.铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氧原子的价电子排布图为 ;
(2)已知:2UO2+5NH4HF22UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的化学键类型是 (填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是 (填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3]3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①分解产物中属于极性分子的有 。
②反应物中的的空间构型为 。分子中的大π键可用符号表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则中的大π键应表示为 。
(4)用Mg或Ca还原UF4可得金属铀,其Mg的熔点高于Ca,原因 ;
(5)UO2的晶胞结构如图所示:
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的 空隙中。
②若晶胞参数为apm,UO2摩尔质量为M,晶体的密度为 g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
4.硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子IV的合成路线如下:
(1)与互为等电子体的分子有 (填化学式,任写一种)。
(2)的沸点低于,其原因是 。
(3)关于I~III三种反应物,下列说法正确的有 。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有sp与sp2
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有 。
(5)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
①X的化学式为 。
②设X的最简式的式量为,晶体密度为,则X中相邻K之间的最短距离为 nm(列出计算式,为阿伏加德罗常数的值)。
5.砷是生命的第七元素,可形成多种重要的化合物。回答下列问题:
(1)基态砷原子N电子层中的成对电子与单电子的数量比为 。As的第一电离能(I1)比Se大的原因是 。
(2)雄黄(As4S4)和雌黄(As2S3)在自然界中共生,是提取砷的主要矿物原料,其结构如下图所示,1mol雄黄与O2反应生成As2O3,转移28mol电子,则另一种产物为 。雌黄中As的杂化方式为 。
(3)亚砷酸(H3AsO3)可以用来治疗白血病,为三元弱酸,试推测的空间构型为 。其酸性弱于砷酸(H3AsO4)的原因是 。
(4)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。晶胞结构如下图所示
已知:砷化镓晶体密度为,阿伏加德罗常数的值为。
①连接面心上6个砷原子构成正八面体,该正八面体的边长为 pm(用含和的代数式表示)。
②Ga和之间的最近距离为 nm(用含和的代数式表示)。
6.硒()是机体生长发育过程中不可缺少的一种微量元素,它具有抗氧化,抗衰老和提高免疫力的作用。硒的化合物在生产、生活中由广泛的应用。回答下列问题:
(1)基态硒原子核外电子的空间运动状态有 种,基态硒原子核外价电子排布式为 。
(2)硒酸酸性 (填“大于”或“小于”)亚硒酸,原因是 。根据价层电子对互斥理论,推测的空间构型是 。
(3)一种含面的抗癌新药结构如图,该化合物组成元素中第一电离能最大的是 (填元素符号)。
(4)人体代谢甲硒醇()后可增加抗癌活性,甲硒醇的熔沸点低于甲醇,原因是 。
(5)的晶体结构如下图所示,其晶胞参数为,阿伏加德罗常数值为。M原子的分数坐标为 ,的晶胞密度为 (列出计算式)。
7.含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态原子的电子所占据的最高能层符号为 ,基态较基态心稳定的原因是 ;
(2)稀溶液中存在的空间构型为八面体形:下列对中杂化方式推断合理的是_______(填标号)。
A. B. C. D.
(3)可形成,其中代表。该化合物分子中,模型为四面体的非金属原子共有 个;C、N、F的电负性由大到小的顺序为 ;
(4)一种由组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中原子填充在围成的四面体空隙中,则四面体空隙的占有率为 ;该晶体的化学式为 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为、,则C点原子的分数坐标为 晶胞中C、D间距离 。
8.虎年春晚上,一段舞蹈诗剧《只此青绿》生动还原了北宋画家王希孟的绝世之作——《千里江山图》。它之所以能够流传千年依旧色彩艳丽,璀璨夺目,与其绘制方法和所用颜料有关。
(1)绘制时,第一遍先用水墨画好山水画,第二遍上红色(赭石色),赭石主含,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有 种,三价铁离子的价电子排布式为 。
(2)第三遍上石绿(孔雀石或绿松石),孔雀石主要成分是碱式碳酸铜,化学式为:。碳酸根离子的空间构型为 。
(3)绿松石是一种含水的铜铝酸盐矿物,属于磷酸盐矿物,化学式为。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为 。
(4)第四遍还要再叠加一层绿,第五遍上青色,石青(蓝铜矿或青金石),蓝铜矿化学式为,青金石是碱性铝硅酸盐矿物,化学式为。
①与结合能生成,中配位原子为 (用元素符号表示) 。
②根据价层电子对互斥理论,、、的气态分子中,中心原子价层电子对数不同于其他分子的是 。的熔沸点比高很多,主要原因是 。
(5)《千里江山图》中还用到了黄色的颜料 黄,雌黄的主要成分是,有剧毒。
①、、的键角由大到小的顺序为 。
②砷化镓晶胞如图所示,若两个镓原子之间的最近距离为d pm,代表阿伏加德罗常数的值,则砷化镓晶体的密度 。(用含d,的代数式表示)
9.“物质的性质、性能,不仅与组成有关,还与晶体结构有关。完成如下有关的问题。
(1)铁有、、三种同素异形体,如图所示,三种晶体在不同温度下能发生转化。
三种晶体中,与每个铁原子等距离且最近的铁原子:有8个、有 个、有 个;将铁缓慢加热到1500℃再降温到常温,缓慢冷却得固体A和急速冷却得固体B,两者密度不同,较大的是固体 (填“A”或“B”)。
(2)金刚石和都由碳元素组成, 晶体中构成微粒的配位数较大,原因是 。
(3)PTC元件(热敏电阻)的主要成分热稳定性好、介电常数高,在小型的变压器、话筒中都有应用。晶体中,Ba在由12个O围成的十四面体(六个正方形、八个正三角形)的中心,Ti在由6个O围成的正八面体的中心,则O在由 围成的立体结构的中心。
(4)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
①若A原子的坐标参数为(0,0.0),C为(l,1,1),则B原子的坐标参数为 。
②三种微粒半径:,,则Cu、Mn原子之间的最短核间距离为 pm。
③将Cu-Mn-Al合金晶胞沿棱投影于垂直面可得如图3。下列属于沿面对角线或体对角线投影于垂直面的是 。(填字母序号)
10.铜及其化合物在科学研究和工业生产中具有许多用途,请回答下列问题:
(1)写出基态Cu原子的价电子排布式 。
(2)已知高温下比CuO稳定,从核外电子排布角度解释高温下更稳定的原因 。
(3)配合物中碳原子的杂化类型是 ,配体的空间构型为 。配合物所含元素的电负性由大到小的顺序是 (用元素符号表示)。
(4)M原子的价电子排布式为,铜与M形成化合物的晶胞如图所示。
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为,则F原子的坐标参数为 。
②已知该晶体的密度为,阿伏加德罗常数的值为,则该晶体中Cu原子和M原子之间的最短距离为 pm(写出计算式)。
11.科学家发现固体电解质Li3SBF4快离子导体具有良好的导电能力,为锂离子电池的发展做出了重要贡献。回答下列问题:
(1)基态F原子的价电子排布图为 。B和F均为第2周期元素,在第2周期元素中,第一电离能介于B与F之间的元素有 种。
(2)一种硼酸盐的阴离子为B3O4n-,其结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O的结构图 (注明所带电荷数)。[B5O6(OH)4]-的结构为 ,则B原子的配位数是 。
(3)L3SBF4可由Li2S与LiBF4按一定比例反应合成。Li2S和LiBF4的熔点如表所示:
物质 Li2S LiBF4
熔点/℃ 938 300
Li2S与LiBF4均属于 晶体;熔点:Li2S>LiBF4,原因是 。
(4)Li3SBF4的晶胞结构如图所示,其中BF位于体心,则Li+位于 (填“顶点”或“棱边”)。设NA为阿伏加德罗常数的值,若该晶胞中Li+与BF间的最近距离为apm,则晶体密度为 g·cm-3,在Li3SBF4晶胞的另一种结构中,BF位于顶点,则S2-位于 (填“体心”“面心”或“棱边”)。
12.六方晶胞是一种常见晶胞,镁、锌和钛的常见晶胞属于六方晶胞。
(1)已知以上三种金属的盐的熔沸点(℃)如下表:
物理性质 氯化物
熔点 712 290 -24.1
沸点 1412 732 136.4
已知:熔融状态下能够导电。请解释三种氯化物熔沸点差异的原因 。的熔沸点明显偏低的另一个原因是该分子空间构型是 ,分子高度对称,没有极性,分子间作用力很弱。
(2)某晶体属于六方晶系,其晶胞参数,。晶胞沿着不同方向投影如下,其中深色小球代表A原子,浅色大球代表B原子(化学环境完全等同)。已知A2原子坐标为,B1原子沿c方向原子坐标参数。
①该物质的化学式为 。
②晶胞中原子A1—A2在ab面投影的距离为 (保留四位有效数字)。
③B1原子坐标参数为 。
13.钛被称为“21世纪的金属”,其单质及化合物具有优异的性能。回答下列问题:
(1)基态钛原子的价电子轨道表示式为 。
(2)钛元素的检验方法如下:
可与形成稳定的,其原因是 。
(3)二氧化钛是良好的光催化剂,可催化转化多种有毒物质,如:可将水中的转化为;将甲基橙、亚甲基蓝、HCHO转化为等。
甲基橙、亚甲基蓝中S原子的杂化类型分别为 、 。
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:
①晶体中与La距离最近的Ba的数目为 ,一个完整晶胞中含有 个Co原子。
②真实的晶体中存在5%的O原子缺陷,从而能让在其中传导,已知La为+3价,则+3价钴与+4价钴的原子个数比为 ;设阿伏加德罗常数的值为,则该晶体的密度为 (列出计算式即可)。
14.过渡元素用途广泛。回答下列问题:
(1)基态的价电子排布式为 。
(2)Co与Ca位于同一周期、且最外层电子数相等,但Co的熔点、沸点均比Ca高,原因是 。
(3) 1mol中含有的σ键数目为 ,分子与形成配合物后键角 (填“变大”“变小”或“不变”)。
(4)中配体的空间结构为 ,N、O原子相比,第二电离能与第一电离能差值更大的是 (填元素符号)。
(5)一种铁基超导材料晶胞结构如图a所示,铁原子沿z轴方向的投影如图b所示。该材料的化学式为 ,已知体心与顶点的Ca原子有着相同的化学环境,晶胞中As原子1分数坐标为(0,0,0.628),则As原子2的分数坐标为 ,体心Ca原子与As原子1之间的距离为 pm。
15.现代科技的发展离不开材料的开发与应用,而物质结构理论是材料研究的基础,请回答Ⅰ-Ⅳ的问题。
Ⅰ.使用作原科的电合成技术,为减少排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
(1)和中碳原子的杂化类型分别是 和 。
(2)1个分子中存在 个键。
(3)易溶于水的原因是 。
Ⅱ.硒()与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
(4)在基态K原子中,能量最低的空轨道的符号是 ,原子的价电子排布式为 。
(5)的空间构型为 ,写出一个与互为等电子体的分子 (填分子式)。
(6)是一种超导材料,是由足球烯()与金属钾反应生成的盐。在晶胞中,堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,填充在空隙中。晶胞中被占据的空隙百分比为 。
Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:
(7)上述三种物质中,沸点最高的是 (填化学名称)。
(8)已知咪唑中存在大键,则在咪唑分子的两个氮原子中,更容易与形成配位键的是 (填“①”或“②”)号氮原子。
Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(、原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为,该合金的密度为。
(9)列出 cm的计算式,设为阿伏加德罗常数的值。
16.铁在工业中有重要作用,也是人体必需的微量元素。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式 。
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为 ,配离子中Fe3+为d2sp3杂化,写出配位前后Fe3+3d轨道表示式 。
(2)邻二氮菲的结构简式为,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
①中心离子的配位数为 ,配位原子的杂化方式为 。
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。
①Fe3O4晶胞中有 个Fe离子,代表 。
②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为 g/cm3。
17.锗石是自然界中含有锗元素的一类矿石的统称,锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)基态Ge原子核外简化电子排布式为 ,Ge原子的电子发生跃迁时会吸收或发出不同的光,可用光谱分析仪获得 光谱(填“连续”或 “线状”),鉴定Ge元素的存在。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是 。
②推测 1molGenH2n+2中含有的σ键的数目是 (用NA表示阿伏加德罗常数值)。
(3)利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中EMIM+ 结构如图所示。
①该物质的晶体类型是 。
②EMIM+ 离子中组成元素的电负性由小到大的顺序是 。
(4)独立的NH3分子中H-N-H 的键角为 107.3 ,[Zn(NH3)6]2+离子中H-N-H的键角 107.3° ( 填“大于”、“小于”或“等于” )。
(5)硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是 ;已知晶胞边长为a pm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为(,1,) ,则 D原子坐标为 ;若该晶胞密度为ρ g·cm-3,则阿伏加德罗常数NA为 。
18.锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用、、LiCl及苯胺()为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为 ,其在元素周期表中的位置为 ,O、N、P的电负性由大到小的顺序为 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
化合物Ⅰ中碳原子的杂化轨道类型为 ,1mol化合物Ⅰ中含有 个σ键;化合物Ⅱ中阳离子的空间构型为 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
该锰的氧化物中Mn的化合价为 ,请画出z方向投影图 。
19.研究压电材料对于自动化技术具有重要意义。一种有机—无机复合压电材料的单斜晶体结构沿晶轴方向投影如图所示(H原子未画出),晶胞内总共含有84个原子。晶胞参数为,,。回答下列问题:
(1)基态Mn原子的价电子轨道表示式为 。在元素周期表中位置为 。
(2)1 mol 晶胞中含有Cl原子 mol,含有杂化的中心原子 mol;该晶体中提供电子对形成配位键的原子是 。
(3)TMCM性质活泼,一定条件下可分解生成三甲胺[],中N原子的价层电子对构型为 ;的沸点高于,主要原因是 。
20.氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
O—O键长 121 148
(1)基态F原子的核外电子排布式为 。
(2)氟氧化物、的结构已经确定。
①依据数据推测O—O键的稳定性: (填“>”或“<”)。
②中F—O—F键角小于中H—O—H键角,解释原因: 。
(3)是一种有特殊性质的氢化物。
①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明,固体中分子排列为锯齿形,画出含2个的重复单元结构: 。
②溶剂中加入可以解离出和具有正四面体形结构的阴离子,写出该过程的离子方程式: 。
(4)工业上用萤石(主要成分)制备。晶体的一种立方晶胞如图所示。
①晶体中距离最近的有 个。
②晶体中与的最近距离为),阿伏加德罗常数值为。该晶体的密度 (列出计算式)。
21.第IIIA元素硼及其化合物在能源、材料、医药、环保等领域具有重要应用。回答下列问题:
(1)基态B原子价层电子的轨道表示式: 。
(2)已知:有空轨道,可以与分子形成配位键,同时使原有的键削弱、断裂,从而发生水解。
①下列卤化物不易发生水解的是 。
A. B. C. D.
②写出水解的化学方程式 。
③写出与NaOH溶液反应的离子方程式 。
(3)硼砂的阴离子的结构如图1,1mol该离子中有 个硼氧四面体,含有配位键数目为 ,其中硼原子的杂化轨道类型为 。
(4)硼化镁在39K温度下具有超导性,硼原子和镁原子分层排布,一层硼一层镁相间,部分原子沿垂直片层方向投影如图2,则硼化镁的化学式为 。
22.普鲁士蓝的化学式为,其结构如图1(可能位于中心的未标出)或图2(、未标出)所示。
请回答:
(1)基态Fe价电子轨道表示式为 。
(2)已知铁的电离能数据如下:
电离能/() ……
Fe 759 1561 2597 5290 ……
则,铁的第四电离能()大于第三电离能()的可能原因是: 。
(3)关于晶体下列说法不正确的是_______(填序号)。
A.存在的化学键有σ键、π键、配位键、离子键等
B.Fe、N、C的电负性由大到小的顺序:
C.晶体中的键能>KCN中的键能
D.晶胞中、原子均参与形成配位键,其配位数之比为6:6
(4)可溶性氰化物(如KCN)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是 。
(5)图2晶胞中的个数为 ,设普鲁士蓝的最简式的式量为Mr,晶体密度为,则相邻之间的最短距离为 nm。(列出计算式,为阿伏加德罗常数的值)
23.铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅶ族的元素,其化合物在生产生活中应用广泛。
(1)基态Fe的价层电子排布式为 。
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。
①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为 。
②色胺酮分子中N原子的杂化类型为 。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过 作用与色胺酮钴配合物相结合,CH3OH分子内 π键。(填“有”或“没有”)
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:
①距离Mg原子最近的Ni原子有 个。
②已知该晶胞的边长为anm,阿伏加德罗常数为NA,该晶体的密度为 g cm-3。(1nm=10-9m)
24.太阳能的开发利用在新能源研究中占据重要地位。
(1)我国科学家制备了一种太阳能电池,其结构示意图如下,其中是光电转换层,ITO玻璃为导电玻璃。
①基态的价电子排布式为 。
②C、N、O、F的第一电离能从大到小的顺序为 。
(2)钙钛矿材料是与钛酸钙()具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式一般为,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA()、FA()、,等,其中MA中N原子的杂化轨道类型是 ,1molFA中存在 个σ键(表示阿伏加德罗常数的值)。
(3)一种立方钙钛矿型晶体有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。
①图a晶胞中O的位置为 (填“体心”“顶点”“面心”“棱心”,下同);图b晶胞中O的位置为 。图a的晶胞参数为393.9pm,则O与O的最小核间距为 pm。
②晶胞经掺杂后能提高红外辐射效率。若图a晶胞的超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为 ;掺杂Sr后O与O的最小核间距略有减小,其可能的原因是 。
25.半导体芯片的关键材料是我国优先发展的新材料。经过半个多世纪的发展,硅基材料的半导体器件性能已经接近其物理极限,以碳化硅、氮化镓等为代表的第二代半导体材料成为当今热点。回答下列问题:
(1)基态镓原子的价电子排布式为: ,它位于元素周期表的位置是 。
(2)上述材料所涉及的四种元素中,原子半径最小的是 (填元素符号,下同),第一电离能I1最大的是 。
(3)原硅酸根SiO的空间构型是 ,其中Si的杂化轨道类型为 。
(4)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是 (填序号),原因是 。
(5)GaN被誉为21世纪引领5G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数:α=β=90°,γ=120°。已知:该晶体的密度为ρg cm-3,晶胞底边边长为acm,高为bcm,则阿伏伽德罗常数为 mol-1(用含a、b、ρ的代数式表示,MGa=70g/mol)。
(6)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的层与带负电的层交替堆叠。据此推断硒氧化铋的化学式为 。晶胞棱边夹角均为90°,则晶体密度的计算式为 g·cm-3(NA为阿伏伽德罗常数的值)
26.冶炼铝时常用的某种助熔剂,其晶胞如图a所示,晶胞中钠离子的俯视投影如图b所示,晶胞底边边长为apm,高为cpm,。回答下列问题:
(1)基态Al原子核外电子有 种不同的空间运动状态,铝的超原子结构有和等,这类超原子具有40个价电子时最稳定,则与 族元素的性质相似。
(2)Al原子的第一电离能低于Mg,原因是 。
(3)该助熔剂的化学式为 ,若阿伏加德罗常数值为,晶体密度为 (写出计算式即可)
(4)该助熔剂的另一种晶胞是由大阴离子构成的面心立方晶胞,可看作是填充在晶胞的空隙中,其中大阴离子中一个在体对角线上,该的坐标为 (该所配位的原子为原点,保留3位有效数字,已知Al-F键长181pm,晶胞边长为780pm,)。
27.砷原子成键的多样性,使砷元素形成了结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)基态砷原子核外价电子排布式为 ,同周期中第一电离能大于砷的元素有 种。
(2)砷可以形成多种酸和盐。与两种含砷有机酸中沸点较高的是 (填化学式),原因为 。和均可用于制农药,其阴离子的键角大小: (填“>”或“<”)。
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体,其立方晶胞结构如图2所示。
①M点原子分数坐标为 。
②m= ,n= 。
③已知NA为阿伏伽德罗常数的值,的摩尔质量为,晶体密度为。晶胞中As原子与Mn原子之间的最短距离为 nm(列出计算式)。
④图1所示晶胞在,0.5和1三个截面上Zn和Li按图3所示分布,请在图4中As原子所在的截面上用“△”补画出As原子的位置 ,并说明x= 。
28.卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)时,与冰反应生成和。常温常压下,为无色气体,固态的晶体类型为 ,水解反应的产物为 (填化学式)。
(2)中心原子为,中心原子为,二者均为形结构,但中存在大键。中原子的轨道杂化方式 ;为键角 键角(填“>”“ <”或“=”)。比较与中键的键长并说明原因 。
(3)一定条件下,和反应生成和化合物。已知属于四方晶系,晶胞结构如图所示(晶胞参数),其中化合价为。上述反应的化学方程式为 。若阿伏伽德罗常数的值为,化合物的密度 (用含的代数式表示)。
29.氮化亚铜用于制备P型半导体,其可用、、2-吡咯甲醛作氮源制取。回答下列问题:
(1)基态N原子核外电子的电子排布图(轨道表示式)为 。
(2)、均位于第ⅠB族,基态Ag原子的价电子排布式为 ;但铜的熔点和沸点均比银的高,这是由于 。
(3)的空间结构和相同,则的空间结构为 ,的价电子数为 。
(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:
①配合物Y中,Cu的配位数为 。
②基态中未成对电子数为 。
(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为。则F原子与邻近的N原子间的距离为 pm,设为阿伏加德罗常数的值,则该晶体的密度为 。
30.物质世界的神奇莫测,常常超乎人们的想象。掌握晶体的结构与性质之间的关系,也许能使你想象的翅膀变得更有力。请回答下列问题:
(1)是目前市场上流行的补锌剂。写出基态电子排布式: 。
(2)已知高温下比更稳定,试从铜原子核外电子变化角度解释其原因: 。
(3)镍能与类卤素反应生成。中硫原子的杂化方式是 ,键和键数目之比为 ;类卤素对应的酸有两种,理论上硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS)的沸点,其原因是 。
(4)氮化硼(BN)晶体存在两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方氮化硼的结构与金刚石类似,可作研磨剂。六方氮化硼的晶体类型为 。
(5)中所含元素的电负性由大到小的顺序为 ,晶体中存在的相互作用有 (填标号)。
a.离子键 B.共价键 C.金属键 D.氢键 E.范德华力
(6)的结构如图所示,已知键角为,为,则的原因主要是 。
(7)酸性: (填“>”“<”或“=”)。
(8)已知可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成皆为。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。绿色晶体配合物的化学式为 。
(9)的晶胞如图所示。
①已知A的坐标为(0,0,0),B的坐标为 。
②设阿伏加德罗常数的值为,则晶体的密度为 (用含a、的代数式表示)。
31.铁、钻、镍、铜及其化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。
(1)磷酸铁锂可用作电池的正极材料。
①基态Fe2+与Fe3+中未成对的电子数之比为 。
②PO的空间结构为 。
(2)高密度磁记录材料纳米钻(Co)可通过亚册(N2H2)还原氯化亚钴来制备。亚肼(N2H2)分子中四个原子都在一个平面上,和是亚肼的两种同分异构体,其中分子的极性:前者 后者(填“>”或“<”)。
(3)实验室常用镍试剂检验Ni2+,可观察到鲜红色沉淀。该沉淀的结构如图所示:
①该沉淀中不存在的作用力类型为 (填选项字母)。
A.配位键 B.氢键 C.金属键 D.σ键 E.π键
②该沉淀中Ni2+的配位数为 。
(4)向CuSO4溶液中逐滴加入氨水,最后可得到深蓝色的[Cu(NH3)4]SO4溶液。
①比较NH3和[Cu(NH3)4]2+中H-N-H键角的大小:NH3 [Cu(NH3)4]2+填“>”“=”或“<”)。
②1mol[Cu(NH3)4]2+中σ键的数目为 。
(5)NiO、FeO的晶胞结构相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“>”或“<”);已知NiO晶体结构中阴阳离子的配位数均为6,则NiO晶胞的俯视图可能是 (填选项字母)。
A. B. C. D.
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如图所示)属于四方晶系(晶胞底面为正方形)。此矿物的化学式为 ;若晶胞的底面边长为apm,高为bpm,阿伏加德罗常数为NA,则该晶体的密度为 g cm3(写出表达式)。
32.卤素元素比较活泼,能形成种类繁多的化合物,回答下列问题:
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为: 。
(2)卤素可形成很多酸根离子,如、、、等,的空间结构为 。
(3)卤素元素之间还能形成很多卤素互化物,如,,,等,根据I与Cl原子的电负性大小关系写成在水中水解的化学方程式: 。
(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式 ,在石墨六元环中心正上方的元素为 。(填元素符号)
(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为,高为,高分为两段,分别为和,的相对分子质量为M,回答下列问题:
①如果与相等,和构成 晶胞。
②金(Au)离子和的配位数分别为 和 。
③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标 。
33.配合物在许多尖端领域如超导材料、催化剂研制、自组装超分子等方面有广泛的应用。回答下列问题:
(1)某配合物的阳离子[Cu(NH3)4(H2O) 2]2+结构如图所示,铜离子的配位数为 ,其中与铜离子形成配位键更强的配体是 (填化学式)。
(2)《诗经》“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的Al3+,Ca2+生成的红色配合物X是最早的媒染染料之一。
基态Al原子中自旋状态相反的两种电子的个数比为 ,配合物X中Al3+的配体除外还有 ,Al3+杂化轨道的空间构型为 ;茜素的熔点比1-羟基蒽醌 (填“高”或“低”)。
(3)向FeSO4溶液中滴加K3[Fe(CN)6]溶液后,经提纯、结晶可得到KFe[Fe(CN)6]蓝色晶体,实验表明,CN-、Fe2+、Fe3+通过配位键构成了晶体骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞如图2,记为Ⅱ型立方结构(注:下层左后的小立方体g未标出)。
K+填充在Ⅰ型立方结构的体心,则在图1结构中K+的填充率为 ;图2晶胞中,Fe(不区分Fe2+,Fe3+)有 种原子分数坐标;若KFe[Fe(CN)6]的摩尔质量为Mg·mol-1,阿伏加德罗常数的值用NA表示,Ⅱ型立方结构的边长为anm,该蓝色晶体密度为 g·cm-3。
34.铁元素单质及其化合物应用广泛,回答下列问题:
(1)纳米铁粉与高温水蒸气反应的化学方程式为 。
(2)血红素是血红蛋白的组成部分,结构如图所示。
①血红素与珠蛋白利用 官能团形成血红蛋白(填名称)
②血红素中N的杂化方式为 ;
③CO、与血红蛋白形成配位健更牢固的是 。
(3)射线衍射得知四氧化三铁是反式尖晶石结构,可表示为,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是 。
a.四氧化三铁是金属晶体,Fe原子失去价电子形成遍布整块晶体、自由移动的“电子气”
b.四氧化三铁是分子晶体,两种FeO和分子能自由移动
c.、在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移
(4)如图所示,晶体中,采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。中有一半的填充在正四而体空隙中,和另一半填充在正八面体空隙中。有 %的正八面体空隙没有填充阳离子。
(5)将鲁士蓝[](其摩尔质量为)晶胞的1/8如下[未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为,则和的最短距离为 cm(为阿伏伽德罗常数的值,写表达式)。
参考答案:
1.(1)1:3
(2) 三角锥形
(3) S>Se>Te
(4) 6 4
【详解】(1)O原子的核外电子排布式为1s22s22p4,2p轨道上有2个未成对电子,其余六个电子成三对,所以未成对电子与成对电子个数比为1﹕3;
(2)SOCl2的结构式是,S原子有三条σ键,孤电子对数量为,所以价层电子对数目是3+1=4,所以S原子是sp3杂化;由于结构中S原子有一个孤电子对,所以SOCl2分子构型是三角锥形;
(3)根据元素周期律,元素非金属性越强,同主族原子半径越小,原子得电子能力越强,形成的阴离子越稳定,释放能量越多,所以三种元素的第一电子亲和能由大到小排序是S>Se>Te;同主族元素电负性由上到下依次减弱,所以H—S键共用电子对在S原子周围出现概率最高,H—Te键共用电子对在Te原子周围出现概率最低,所以两条H—Te键互斥力最弱,键角最小,键角最小的是H2Te;三种原子中S原子半径最小,电负性最大,故H—S键键能最大,所以H2S最稳定;
(4)根据题目所给晶胞模型图,Fe2+有个,有个,所以该晶胞中阴阳离子之比为1﹕1,结构应类似过氧根,所以FeS2的电子式为;取晶胞顶点的粒子,距其最近且等距的Fe2+是三条棱上的粒子,所以每个晶胞对于该顶点粒子最近且等距的Fe2+拥有个,顶点粒子是八个晶胞共有,故距一个完整的最近且等距的Fe2+有个,所以的配位数是6;晶体密度;晶胞中与1个最近且等距的6个Fe2+所围成的空间区域是题目所描述的八面体,一个晶胞含有4个,所以一个晶胞中由Fe2+围成的八面体有4个。
2.(1) 共价 键键能小于键键能
(2)②
(3)分子间能形成氢键,其熔化时需要消耗的能量更多
(4)
(5) C 12
(6)
(7)
【详解】(1)共价键键能普遍较大,直接由原子构成的共价晶体其熔沸点普遍比离子晶体、金属晶体等的熔沸点更高;共价晶体熔沸点高低由晶体共价键键能大小决定,键能大小又与键长相关,所以Si—Si键键长长于Si—O键键长,故Si—Si键键能更低,所以硅单质熔沸点低于二氧化硅;
(2)B组物质均是金属单质,其晶体结构应是金属晶体,其晶体形成及物理性质特点应用电子气理论解释,即②;
(3)HF分子间会形成分子间氢键,破坏这些分子间作用力需要更高的能量,所以HF熔沸点更高,即分子间能形成氢键,其熔化时需要消耗的能量更多;
(4)碱金属离子从上到下半径增大,离子键强度减弱,四种化合物的晶格能逐渐降低,因此熔点:;
(5)A.A晶胞是以NaCl为典型例子的离子晶体晶胞,A不符题意;
B.B晶胞是CO2的分子晶体晶胞,B不符题意;
C.C晶体部分结构是SiO2共价晶体的部分结构,C符合题意;
D.D晶体部分应是单层石墨的晶体的部分结构,D不符题意;
答案选C;
由干冰晶胞可知每一个CO2分子周围有最近且等距的12个CO2分子;
(6)该晶胞中两种离子半径应是r(Cl-) > r(Na+),所以顶点及体心的粒子是Na+,面心上的粒子是Cl-,晶胞中Na+有个,Cl-有个,所以Na+与Cl-个数比为1﹕3,故该晶体化学式为NaCl3;
(7)CaF2晶胞中相邻Ca2+距离是顶点至面心之间距离,所以晶胞面对角线长2a nm,所以晶胞棱长是nm,根据晶体密度计算式,将数据代入,得到。
3.(1)
(2) ABC F>N>O>H
(3) H2O,NH3 正四面体形
(4)两者都是金属晶体,Mg的半径小于Ca的半径,金属键强,熔点高
(5) 正四面体
【详解】(1)O元素位于元素周期表第二周期VIA族,核外电子排布式是1s22s22p4,所以价电子排布图是“”;
(2)①NH4NF2中与之间是离子键,离子内存在着N—H共价键和N→H配位键,所以本问第一空应选填“ABC”;
②该反应中涉及到的非金属元素有:H、N、O、F,H位于第一周期,非金属性最弱,第一电离能最小,N、O、F分别位于第二周期的VA族、VIA族和VIIA族,非金属性逐渐增大,F元素的第一电离能最高,N元素由于原子核外电子排布2p能级处于半满结构,基态原子能量更低,第一电离能高于O元素,所以四种元素第一电离能由大到小排序为“F>N>O>H”;
(3)①反应产物中,NH3、CO2、N2、H2O是分子结构,N2分子内N≡N是非极性键,CO2中C=O是极性键,但分子空间结构中心对称,所以这两种分子均为非极性分子;NH3中N—H是极性键,分子空间构型呈轴对称,H2O中H—O是极性键,且分子空间构型也是轴对称,所以“H2O、NH3”是极性分子;
②中心原子N原子有4条σ键,孤电子对为,离子构型为“正四面体形”;离子中心原子C原子有3条σ键,孤电子对为,离子的空间构型是平面三角形,C原子、O原子均是sp2杂化,均有垂直于离子所在平面的p轨道,离子中价电子总数是,单电子数=,所以离子中的大π键是由4个原子、6个电子形成,表示为“”;
(4)两种单质均是金属,金属晶体熔沸点由其金属键强弱决定,金属键大小由金属阳离子所带电荷量及金属阳离子半径决定,带电荷越多、金属阳离子半径越小,金属键越强,熔沸点越高;
(5)观察晶胞结构,可以看到等距且最近的U原子位于晶胞六个面心上,其所围成的空间结构为正四面体,所以任何六个等距且最近的U原子均能围成正四面体结构,则O原子正好是嵌入这些U原子间隙,即在“正四面体”空间中;根据晶胞模型可以分析出,U原子在顶点和面心,一个晶胞含U原子个,O原子均在晶胞内部,共8个,所以NA个晶胞中UO2的物质的量是4mol,故UO2晶体密度是。
4.(1) 或、等其他合理答案
(2)两者都是分子晶体,由于水存在分子间氢键,沸点高
(3)BDE
(4)O、Se
(5)
【分析】本题主要考查选修三的物质结构与性质,需要对知识理解透彻之后再做好迁移,掌握晶胞的相关计算的一般方法很重要。
【详解】(1)要寻找与互为等电子体的分子,可以如下思考:一个氧原子的6个电子再加一个电子等于7个电子,就可以换成F或Cl,这里一共是三个氧原子,就需要三个电子,除掉本身得到的两个电子之外,再从Se里拿一个电子出来,那Se就换成P或N即可,所以等电子体的分子可以是PCl3、NF3等。
(2)水中含有氢键,所以沸点较高。
(3)A.I中含有苯环,除了有σ键之外还有其它化学键,A错误;
B.I中的Se-Se键是相同原子形成的共价键,为非极性共价键,B正确;
C.II为相对分子较大的有机物,一般不易溶于水,C错误
D.II的主要结构是苯环、碳碳双键和碳碳三键,其中原子的杂化轨道类型只有sp与sp2,D正确;
E.I~III含有的元素包括:H、C、N、O、S、Se,O电负性最大,E正确;
故选BDE。
(4)从结构中可以看出只有O、Se有孤对电子。
(5)①该晶胞主要由K和SeBr6构成,观察晶胞结构图我们可以发现,K位于晶胞内部,一共有8个K;SeBr6分别位于顶点和面心,顶点处的SeBr6有8个,面心处的SeBr6有6个,所以一个晶胞中含有的SeBr6数目为:。所以其化学式为:
K2SeBr6。
②X最简式的式量为Mr,则一个晶胞的式量为4Mr,设晶胞棱长为acm,则
,即,从图2可以看出,两个K原子之间最短的距离为棱长的一半,即相邻K之间的最短距离为:cm=nm。
5.(1) 2:3 As的4p轨道半充满,稳定,I1较大
(2) SO2 sp3
(3) 三角锥 H3AsO4结构中有1个非羟基氧原子而H3AsO3没有,非羟基氧原子越多,酸性越强
(4)
【详解】(1)基态砷原子电子排布式为,N层电子为第四层电子,成对电子为2个;未成对电子3个,则成对电子与单电子的数量比为;Se的价层电子排布式为,As的4p轨道为半充满结构比Se的相对稳定,所以第一电离能大,故填;As的4p轨道半充满,稳定,I1较大;
(2)1mol雄黄(As4S4)与O2反应生成As2O3,转移28mol电子,由电子守恒可知,共消耗7mol氧气,其反应的化学方程式为;由图中可知,雌黄中As与周围3个S原子形成3个σ键,孤对电子数为,故其价层电子对数为,所以雌黄中As的杂化方式为,故填;;
(3)中心原子As与周围的三个氧原子形成3个σ键,孤对电子数为,故其价层电子对数为,其空间构型为三角锥形;亚砷酸()的结构为,砷酸()的结构为,的结构中含有1个非羟基氧原子,而中没有,非羟基氧原子越多,酸性越强,所以亚砷酸酸性弱于砷酸,故填三角锥形;的结构中含有1个非羟基氧原子,而中没有,非羟基氧原子越多,酸性越强;
(4)①如图晶胞中,Ga原子个数为,根据其化学式,As原子个数也为4,根据已知信息,设晶胞参数为,则,解得,晶胞中,面心上6个砷原子构成正八面体,相邻面心原子之间的距离即为八面体边长,边长为pm,故填;
②如图,根据晶胞结构,As与Ga之间最短距离为立方晶胞对角线的,即nm,故填。
6.(1) 18 4s24p4
(2) 大于 同一元素含氧酸中,元素的价态越高含氧酸的酸性越强,硒酸为最高价的氧化物对应的水化物,则硒酸的酸性比亚硒酸的强 三角锥形
(3)N
(4)甲醇分子间存在氢键
(5) (,,)
【详解】(1)Se为34号元素,原子核外电子数为34,基态Se原子核外电子的排布式为1s22s22p63s23p63d104s24p4,电子的空间运动状态有18种,基态硒原子核外价电子排布式为4s24p4;
(2)Se为第VIA族元素,最高价态为+6,最高价的氧化物对应的水化物即硒酸,一般而言,同一元素含氧酸中,元素的价态越高含氧酸的酸性越强,则硒酸的酸性比亚硒酸的强;中Se原子价层电子对数=3+=4,且含有一个孤电子对,微粒空间结构为三角锥形;
(3)根据图示可知,该物质含有H、C、N、O、Se元素,同主族元素从上往下第一电离能减小,同周期随原子序数增大第一电离能呈增大趋势,但N元素原子2p轨道为半充满稳定状态,则第一电离能最大的是N;
(4)能形成分子间氢键的物质熔沸点较高,甲醇、甲硒醇都是分子晶体,结构相似,相对分子质量越大,沸点越高,但甲醇分子间存在氢键所以沸点较高;
(5)M原子的分数坐标为(,,);黑色球个数=8×+6×=4、白色球个数为8,根据其化学式Na2Se知,白色球表示Na+、黑色球表示Se2-,该晶胞体积=(a×10-10cm)3,Na2Se的晶胞密度=g/cm3。
7.(1) N Cu+的3d轨道全满达到稳定状态
(2)C
(3) 11 F、N、C
(4) 50% CuInTe2
【解析】(1)
Cu元素位于周期表中第四周期,即有4个电子层,其最高能层符号为N;由于亚铜离子的3d轨道为全满状态,故比铜离子稳定。
(2)
六水合铜离子中,铜离子为中心离子,水分子为配位体,配位数为6,由配位键的数目可知,铜离子的杂化方式可能为sp3d2杂化,配离子的空间构型为八面体型,故选C。
(3)
①该化合物中N、C、B原子的价层电子对数为4,VSEPR模型为四面体,其中含有N原子5个,C原子4个,B原子1个,一共11个。
②由于同一周期从左向右电负性依次增强,则C、N、F的电负性由大到小的顺序为F>N>C。
(4)
①从晶胞结构可知,铟原子形成的四面体空隙有8个,形成的八面体空隙也有8个,则四面体空隙的占有率为。
②晶胞中位于顶点、面上、体心的铜原子个数为8、4、1,则一个晶胞中铜原子的个数为;位于棱上、面上的铟原子个数为4、6,则一个晶胞中铟原子的个数为;位于体内的碲原子个数为8,则一个晶胞中碲原子个数为8,则一个晶胞中铜原子、铟原子、碲原子的个数比为1:1:2,则其化学式为CuInTe2。
③根据A、B的坐标,可知晶胞的边长为1,则位于体对角线处,面对角线处的C点原子的坐标为(,,);
④由晶胞中C、D形成的直角三角形直角边长为pm,pm,根据勾股定理,求得C、D之间的距离为
8.(1) 8
(2)平面三角形
(3)
(4) O 的相对分子质量大,分子间范德华力强
(5)
【详解】(1)基态氧原子核外电子的运动状态有8种,铁原子的价电子是3d64s2,三价铁离子的价电子排布式为3d5。
(2)碳酸根离子的价层电子对数=3+(4+2-32)=3, 其空间构型为平面三角形。
(3)含有n个P原子的该磷酸根离子,相当于是n个磷酸根离子中去掉了(n-1)个氧原子,O原子数目为4n-(n-1)=3n+1,所带电荷数为(-2)×(3n+1)+5n=-(n+2),则由n个磷氧四面体形成的这类磷酸根离子的通式为[PnO3n+1](2+n)-。
(4)①中配位原子为O,②根据价层电子对互斥理论,水、二氧化硫、三氧化硫的气态分子中,中心原子价层电子对数分别是:2+(6-21)=4、2+(6-22)=3、3+(6-32)=3,不同于其他分子的是H2O。③的熔沸点比高很多,主要原因是的相对分子质量大,分子间范德华力强。
(5)①As、P与N的氢化物空间构型相似,均是三角锥形,但氮元素的电负性强于磷元素,磷元素强于砷元素,共用电子对偏向电负性强的元素,排斥力增大,所以AsH3键角
(2) C60 C60晶体属于面心立方堆积,构成微粒的配位数为12。金刚石的晶体晶胞中每个C原子与其他4个C原子相连,构成微粒的配位数为4。
(3)4个Ba和2个Ti
(4) (,,) 180或或311.76 D
【解析】(1)
γ-Fe晶体属于面心立方最密堆积,γ-Fe晶体中Fe的配位数为12,即每个Fe原子距离相等且最近的Fe原子有12个。α-Fe属于简单立方堆积,α-Fe晶体中Fe的配位数为6,即每个Fe原子距离相等且最近的Fe原子有6个。将铁缓慢加热到1500℃,根据转化关系,将会得到δ-Fe,急速冷却,晶体的类型还来不及转化,即保持不变,因此固体B为δ-Fe;缓慢冷却,晶体的类型发生变化,得到α-Fe,即固体A。体心立方堆积的空间利用率高于简单立方堆积,密度较大的是δ-Fe(固体B)。
(2)
C60晶体属于面心立方堆积,如图所示,,构成微粒的配位数为12。金刚石的晶体晶胞,如图所示,,每个C原子与其他4个C原子相连,构成微粒的配位数为4。
(3)
根据题意,可知BaTiO3晶体的晶胞如图所示,,从晶胞可知,O在由4个Ba和2个Ti围成的立方结构的中心。
(4)
①根据晶胞结构图,可知B原子的坐标为(,,)。
②根据截面图结合几何知识可知[2r(Cu)+2r(Al)]为体对角线的一半,设晶胞的棱长为a,则有a=2[2r(Cu)+2r(Al)]=4×(127+143)pm,所以a=pm;根据晶胞结构可知铜原子之间的最短核间距为棱长的一半,即a=180pm或pm或311.76pm;故答案为:180或或311.76。
③根据晶胞结构图,Mn和Al均位于Cu构成的六面体的中心,沿体对角线投影,Mn和Al的位置均会与Cu的位置重合,只有D符合。答案选D。
10.(1)
(2)亚铜离子核外电子处于稳定的全充满状态
(3) 和 三角锥形
(4)
【详解】(1)(1)Cu在元素周期表中位于第四周期第IB族,原子序数29,根据泡利不相容原理和洪特规则,基态Cu原子的价电子排布式为,故填;
(2)(2)亚铜离子的价层电子排布式为,铜离子的价层电子排布式为,其中亚铜离子价层电子处于全充满状态,比铜离子更稳定,故填亚铜离子核外电子处于稳定的全充满状态;
(3)(3)根据价层电子对互斥理论,该配合物中,中的碳原子的价层电子对数为4,为杂化,中碳原子价层电子对数为3,为杂化;该配合物中配体为NH3,所以配体的空间构型为三角锥形;该配合物中含有的元素有Cu、N、H、C、O,同周期电负性从左到右依次增强,同主族电负性依次减弱,非金属电负性强于金属,故以上几种元素的电负性由大到小的顺序为,故填和、直线形、;
(4)(4)①将晶胞参数看为1,如图F原子的y坐标为,x坐标为,其z坐标为晶胞参数的,所以F原子的坐标参数为,故填;
②由M原子的价电子排布式为可知,该原子为Cl,该晶胞中Cl位于晶胞中,全部属于晶胞,原子个数为4,Cu原子个数为,设该晶胞边长为a cm,根据=,已知该晶体的密度为,阿伏加德罗常数的值为,则,该晶体类似于金刚石,其最短距离为对角线的,对角线长度为,其最短距离为 ,故填。
11.(1) 4
(2) 或 3、4
(3) 离子 两者均为离子晶体,离子半径大于S2-,且所带电荷数小于S2-,Li2S晶格能大于LiBF4
(4) 棱边 体心
【详解】(1)F原子价电子排布式为2s22p5,由泡利原理、洪特规则,价层电子排布图为 ,同周期元素第一电离能从左到右有增大的趋势,第一电离能排序时,有2个“反常”,ⅡA元素电子排布有s轨道全充满结构,第一电离能较高,ⅡA高于ⅢA元素;ⅤA元素电子排布p轨道有半充满结构,第一电离能较高,高于ⅥA,故第 2 周期元素中,第一电离能介于B和F之间的元素有Be、C、O、N,故答案为: ;4;
(2)B为+3价,O为-2价,可知中n=3,结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,因六元环中有3个B原子、3个O原子,B、O原子依次间隔连接,且每个B原子还连接1个不在六元环上的O原子,则结构式为: 或 ;由图所知,[B5O6(OH)4]-离子中B原子所连接的原子数分别为3个和4个,则B原子的配位数是3、4,故答案为: 或 ;3、4;
(3)离子晶体的熔沸点较高,根据熔沸点,都为离子晶体,离子晶体的熔沸点高低取决于离子半径大小和离子所带电荷数,离子半径大于S2-,且所带电荷数小于S2-,Li2S晶格能大于LiBF4,所以Li2S 的熔点大于LiBF4的熔点,故答案为:离子晶体;两者均为离子晶体,离子半径大于S2-,且所带电荷数小于S2-,Li2S晶格能大于LiBF4;
(4)如图所示Li3SBF4的晶胞结构,根据均摊法,含有1个,且位于体心;根据化学式可知,含有3个Li+,则,则Li+位于棱边;晶胞中Li+与间的最近距离为apm,为面对角线的,设晶胞的边长为dpm,则面对角线为d,即d=2a,则晶胞的边长d=a pm,晶胞的体积V=(a×10-10)3cm3,Li3SBF4晶胞的质量m=g=g,根据ρ==g cm-3;在Li3SBF4晶胞的另一种结构中,位于顶点,把晶胞的BF4-向右上移至顶点,则S2-向右上移至于体心,故答案为:棱边;;体心。
12.(1) 与是离子晶体,的晶格能大于;属于分子晶体,熔沸点比离子晶体低得多 正四面体
(2) 0.1407nm (,,0.0630)
【详解】(1)与是离子晶体,的晶格能大于;TiCl4常温下呈液态,可知其属于分子晶体,熔沸点比离子晶体低得多。根据价层电子对互斥理论,TiCl4具有4对成键电子对,中心原子Ti发生sp3杂化,形成正四面体结构的分子。
(2)①A原子处于晶胞顶点,c棱中心和内部,A原子数目为1+1+6=8,而B原子完全处于晶胞内部(从a方向投影图可看出),B原子数为4,故化学式为A2B,化学式在保证化学意义的前提下取最简整数比;
②从图易得晶胞顶点A原子的坐标参数为(0,0,0),棱上A原子的坐标参数为(0,0,0.5)。由A1原子的坐标参数(1,0,0)和A2原子的坐标参数(0.8300,0.1700,0.2500),利用勾股定理和余弦定理易得
da=∣0.8300-1∣×0.4780nm=0.081260nm,
db=∣0.1700-0∣×0.47800nm=0.081260nm,
dc=∣0.2500-0∣×0.7800nm=0.19500nm,
d=nm=0.2405nm,晶胞中原子A1—A2在ab面投影的距离为;
③两种对称性值得我们注意:晶胞的反演中心和z=0.2500=1/4处的镜面,由此易得B1原子的坐标参数为:(1/3,2/3,0.0630)。
13.(1)
(2)TiO2+中的Ti有空轨道,而H2O2中的O有孤电子对,两者能形成配位键
(3) sp3 sp2
(4) 6 8 4:1
【详解】(1)Ti为22号元素,核外电子排布式为[Ar]3d24s2,价电子轨道表示式为;
(2)TiO2+中的Ti有空轨道,而H2O2中的O有孤电子对,两者能形成配位键,从而形成稳定的[TiO(H2O2)]2+;
(3)甲基橙中S原子形成4个σ键,2个π键,所以不含孤电子对,价层电子对数为4,采取sp3杂化;亚甲基蓝中S原子形成2个σ键,1个π键,带一个单位正电荷,所以还有一对孤电子,则价层电子对数为3,为sp2杂化;
(4)①以任一顶点的La原子为例,距离其最近的Ba原子位于该La原子所在棱的另一个顶点,一个La原子被六条棱共用,所以晶体中与La距离最近的Ba的数目为6;
Co原子位于结构单元的体心,每个结构单元含有1个Co原子,观察发现可知,若该结构单元重复排列,则其相邻结构单元的La、Ba原子会与该结构单元中的Ba、La原子重叠,所以该结构单元不是该晶体的晶胞,该晶体的晶胞应是由8个小正方体组成的大正方体,所以一个完整晶胞中含有8个Co原子;
②该结构单元中含有=个La原子、=个Ba原子,存在5%的O原子缺陷,所以含×(1-5%)=2.85个O原子,La为+3价、Ba为+2价,O为-2价,设+3价钴的个数为x,+4价钴的个数为y,则根据化合价之和为0可得3x+4y+×(+3+2)=2×2.85,根据原子守恒可得x+y=1,联立解得x=0.8、y=0.2,所以+3价钴与+4价钴的原子个数比为4:1;
结构单元的质量为g,结构单元的体积为a3pm3=a3×10-30cm3,所以结构单元的密度为=g·cm-3。
14.(1)3d5
(2)两者均为金属晶体,且Co原子半径更小,形成的金属离子半径更小,导致其金属键键能更大
(3) 21NA 变大
(4) 直线形 O
(5) CaFe2As2 (0.5,0.5,0.872)
【详解】(1)锰为25号元素,失去2个电子形成基态,其价电子排布式为3d5;
(2)两者均为金属晶体,且Co原子半径更小,形成的金属离子半径更小,导致其金属键键能更大,故Co的熔点、沸点均比Ca高;
(3)单键均为σ键,双键中含有1个σ键1个π键,叁键含有1个σ键2个π键;1分子含有6个配位键、且氨分子中含有3×5=15个σ键,共21个σ键;故1mol中含有的σ键数目为21NA;分子中存在1对孤对电子,通过孤对电子与形成配合物后孤对电子对数为0,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,故使得键角变大;
(4)与二氧化碳互为等电子体,空间结构相似,为直线形;同一周期随着原子序数变大,第一电离能变大;N原子和O-的2p轨道均为半充满稳定状态,氮原子的第一电离能较大、O第二电离能较大且此时两者失去电子情况相同,但是由于氧原子的半径更小,故导致O第二电离能更大,使得第二电离能与第一电离能差值更大的是氧元素,氮的第一电离能和第二电离能分别为1402.3kJ/mol、2856 kJ/mol,氧的第一电离能和第二电离能分别为1313.9kJ/mol、3388.3kJ/mol,故填O;
(5)由均摊法可在,一个晶胞中Ca数目为、Fe数目为、As数目为,则该材料的化学式为CaFe2As2;晶胞中As原子1分数坐标为(0,0,0.628),已知体心与顶点的Ca原子有着相同的化学环境,体心Ca坐标为(0.5,0.5,0.5),则As原子1与体心Ca在z轴上的坐标差为0.628-0.5=0.128,则As原子2的z轴上距离顶面的坐标差为0.128,故As原子2的z轴上坐标为1-0.128=0.872,故As原子2的分数坐标为(0.5,0.5,0.872);
与底面平行的体心Ca所在平面和As原子1的距离为0.128cpm,体心Ca原子与As原子1所在z轴的距离为,则体心Ca原子与As原子1之间的距离为pm。
15.(1) sp sp2
(2)4
(3)与水分子之间形成氢键,且是极性分子,水是极性溶剂,根据相似相溶原理,可知易溶于水
(4) 3d 5d106s1
(5) 三角锥形 SOCl2、PCl3等
(6)100%
(7)咪唑
(8)①
(9)
【详解】(1)CO2的结构简式为O=C=O,C的杂化类型为sp;HCOO-中C形成三个σ键,C的杂化类型为sp2;
(2)原子之间的单键形成1个σ键,双键形成1个σ键和一个1个π键,HCOOH中含有σ键个数为4;
(3)易溶于水的原因是与水分子之间形成氢键,且是极性分子,水是极性溶剂,根据相似相溶原理,可知易溶于水;
(4)基态K原子价电子排布式为4s1,能量最低的空轨道的符号为3d;为79号元素,核外电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d106s1,原子的价电子排布式为5d106s1;
(5)中Se的价层电子对数=3+=4,有1个孤电子对,空间构型为三角锥形;原子总数相等、价电子总数相等的微粒互为等电子体,则与互为等电子体的分子的化学式为SOCl2、PCl3等;
(6)C堆积方式为面心立方结构,C位于晶胞的顶点和面心,晶体中C数目为,结合化学式K3C60可知晶胞中K+数目为3×4=12,说明晶胞中共4个八面体空隙和8个四面体空隙均被K+填充,即晶胞中K+占据的空隙百分百为100%;
(7)咪唑结构中含有亚胺基=NH,相邻分子间存在氢键,因此咪唑的沸点是三种物质中最高的;
(8)咪唑中②号N原子形成3个σ键,由于存在大π键,说明两个氮原子都是sp2杂化,则②号氮原子没有孤电子对,而①号氮原子形成两个σ键,所以有孤电子对,可以形成配位键,所以更容易与Cu2+形成配位键的是①号氮原子;
(9)Al位于体内和顶点,Ti分别位于晶胞的顶点、面心、体内和棱上,Ti原子个数=,Al原子个数=,所以化学是为Ti11Al5;晶胞的质量m=,晶胞的体积V=S·h =,根据m=ρV,,解得h=(cm)。
16.(1) [Ar]3d5; [Fe(CN)6]3-; ;
(2) 6; sp2; pH太大,Fe2+可能会沉淀,干扰Fe2+与邻二氮菲配位1; pH太小,邻二氮菲中N原子与H+结合,使邻二氮菲配位能力减弱;
(3) 24; Fe2+和Fe3+各一半; 。
【详解】(1)铁位于第族,价电子排布为:3d64s2,失去三个电子后电子排布式为:[Ar] 3d5;配位数为6说明氰根离子的数目为6,故化学式为:[Fe(CN)6]3-;铁离子3d轨道上五个电子,配位后两个电子用于与s轨道和p轨道形成杂化轨道。故配位前后Fe3+3d轨道表示式:;答案为:[Ar]3d5;[Fe(CN)6]3-;;
(2)邻二氮菲中有2个N原子,每一个N原子都能形成配位键,所以在[Fe(phen)3]2+中,Fe2+的配位数为6,配位原子是氮原子,根据图示可知,氮原子形成了3个σ键,1个π键,氮原子的杂化方式为:sp2;用邻二氮菲测定Fe2+浓度时应控制pH在2 ~ 9适宜范围,原因是pH < 2时,H+浓度大,邻二氮菲中的N原子优先与H+形成配位键,导致与Fe2+的配位能力减弱,pH>9时,OH-浓度大,与Fe2+反应生成Fe(OH)2,影响Fe2+与邻二氮菲配位;故答案为:6;sp2;pH太大,Fe2+可能会沉淀,干扰Fe2+与邻二氮菲配位1;pH太小,邻二氮菲中N原子与H+结合,使邻二氮菲配位能力减弱;
(3)Fe3O4晶体是由图1所示的结构平移构成,根据I型和II型两种小立方体的构型可知,Fe3O4的晶胞由4个I型小立方体和4个II型两种小立方体组成,在1个由I型和II型两种小立方体组成结构中,氧离子的个数为8,根据Fe3O4的化学式可知,铁离子共6个,结合二者组成的长方体结构可以计算:Fe3+=,可推知共含有4个铁离子,Fe3O4中Fe2+∶Fe3+=1∶2,故可知:代表Fe2+和Fe3+各一半;一个小立方体中有4个氧离子,一个晶胞包含了8个小立方体,故氧离子为32个,根据化学式Fe3O4,则Fe3O4晶胞中有铁离子为:24个;故Fe3O4的密度=。答案为:24;Fe2+和Fe3+各一半;。
17.(1) [Ar]3d104s24p2 线状
(2) sp2 (3n+1)NA
(3) 离子晶体 H<C<N
(4)大于
(5) 4 (,,)
【详解】(1)Ge是32号元素,位于第四周期第Ⅳ族,基态Ge原子的核外电子排布式为1s22s22p63s23p63d104s24p2,其化简电子排布式为[Ar]3d104s24p2;Ge原子的电子发生跃迁时会吸收或发出不同的光,永光普分析仪获得的是不连续的光谱,应该是线状光谱;
(2)①Na2GeO3中锗原子的价电子数为:,VSEPR模型为平面三角形,则杂化方式是sp2杂化;
②GenH2n+2与烷烃结构相似,分子中的共价键均为σ键,n个Ge原子之间形成(n-1)个σ键,Ge与(2n+2)个H原子形成(2n+2)个σ键,所以1个分子中σ键的数目为(2n+2)+(n-1)=3n+1,1mol GenH2n+2中含有σ键的数目为(3n+1)NA;
(3)①该物质由阳离子EMIM+和阴离子[AlCl4]-构成,所以属于离子晶体;
②EMIM+ 离子中组成元素为H、C、N,非金属性越强,其电负性越大,非金属性由小到大的顺序是H
(5)该晶胞中Zn原子的配位数是4,则ZnSe晶胞中Se原子的配位数也是4;A的坐标为(0,0,0),B的坐标为(,1,),则A原子位于坐标原点,B原子在坐标轴正方向空间内,由图乙可知D原子也在坐标轴正方向空间内,且到x轴、y轴、z轴的距离分别是,,,即D原子的坐标为(,,);
晶胞的边长为apm,则晶胞的体积V=a3pm3=a×10-30cm3,根据均摊法,1个晶胞中Zn原子个数为4,Se原子个数为,所以由m=nM=,得==。
18.(1) 。 第三周期,第VIIA族。 O>N>P。
(2) sp3。 14。 四面体;。 有机溶剂通过分子间作用力结合而成,而离子液体通过阴阳离子作用形成离子键相,离子键作用力大于分子间作用力,故离子液体相对难挥发。
(3) -2。 。
【详解】(1)氯原子价电子排布式为3s23p5,价电子的轨道表示式为:;氯元素是第三周期,第VIIA族;O、N、P的电负性,同周期元素核电荷数越大电负性越大,O电负性大于N,同主族元素核电荷数越小电负性越大,N电负性大于P,故电负性O>N>P;
故答案为:;第三周期,第VIIA族;O>N>P。
(2)化合物Ⅰ中碳原子价电子对数为4+=4,轨道为sp3杂化;1mol化合物Ⅰ中含有11个极性单键,都为σ键,两个双键,其中含有2个σ键,一个配位键,为σ键,一共有14个σ键;化合物Ⅱ中,中心原子为N原子,价电子对数为4+=4,sp3杂化,空间构型为四面体;传统的有机溶剂都是不带电的分子,通过分子间作用力结合而成,而离子液体通过阴阳离子作用形成离子键相 ,离子键作用力大于分子间作用力,故离子液体相对难挥发;
故答案为:sp3;14;四面体;有机溶剂通过分子间作用力结合而成,而离子液体通过阴阳离子作用形成离子键相,离子键作用力大于分子间作用力,故离子液体相对难挥发。
(3)锰的氧化物晶胞中Mn原子个数为1+×8=2,O原子个数为2+×4=4,则化学式为MnO2,氧的化合价为-2价,则锰的化合价为+4价;沿z方向投影图为:;
故答案为:-2;。
19.(1) 第4周期第ⅦB族
(2) 16 32 Cl、N
(3) (正)四面体(形) 二者均为分子晶体,相对分子质量更大
【详解】(1)基态Mn原子的电子排布式为:,价电子轨道表示式为 ,在周期表中的未知为:第4周期第ⅦB族;
(2)根据晶胞结构图,原子棱上有24个,面心有8个,里面有6个,总个数为:个,含有杂化的中心原子为32,Cl、N含有孤电子对,提供提供电子对形成配位键;
(3)中N价层电子对为4,构型为正四面体结构;相对分子质量较大,所以沸点较高。
20.(1)1s22s22p5
(2) > F电负性大于氧大于氢,故OF2中O周围电子密度相对小于H2O中情形,O周围电子对间斥力较小,键角变小
(3) +2HF=[BF4]-+H2F+
(4) 8
【详解】(1)氟是9号元素,基态氟原子的电子排布式为1s22s22p5。
(2)①键长越长,键能越小,中O—O键的长度小于中O—O键的长度,则中O—O键的键能大于中O—O键的键能,则O—O键的稳定性:>;
②F电负性大于氧大于氢,故OF2中O周围电子密度相对小于H2O中情形,O周围电子对间斥力较小,键角变小,中F—O—F键角小于中H—O—H键角。
(3)①测定结果表明,固体中分子排列为锯齿形,画出含2个的重复单元结构为: ;
②溶剂中加入可以解离出和具有正四面体形结构的阴离子,该阴离子为[BF4]-,离子方程式为:+2HF=[BF4]-+H2F+。
(4)①由晶胞结构可知,Ca2+占据8个顶点和6个面心,8个F-位于晶体的内部,晶体中距离最近的有8个;
②由晶胞结构可知,Ca2+的个数为8 +6 =4,F-的个数为8,晶体中与的最近距离为晶胞体对角线的,设晶胞的边长为a,则a=d,a=d,该晶体的密度。
21.(1)
(2) A
(3) 、
(4)
【详解】(1)基态B原子价层电子的轨道表示式为: ;
(2)①中C原子没有空轨道,不能与分子形成配位键,不能使原有的键削弱、断裂,所以不易发生水解,、、都已发生水解,故选A;
②水解的化学方程式:;
③与NaOH溶液反应的离子方程式为:
(3)由图1可知,1mol该离子中有个硼氧四面体,含有配位键数目为,其中硼原子的杂化轨道类型为:和杂化;
(4)根据投影可知,1个B原子为3个Mg原子共用,故属于1个Mg原子的B原子为;1个Mg原子为6个B原子共用,故属于1个B原子的Mg原子为,由此可知,Mg和B原子个数比为:,所以硼化镁的化学式为:。
22.(1)
(2)Fe失去3个电子后,形成的为半充满,结构稳定,难失去第4个电子,所以第4电离能比第3电离能大很多
(3)C
(4)普鲁士蓝的铁与氰基以配位键结合,剧毒的氰根离子不可能游离出来,因此普鲁士蓝本身是无毒的;
(5) 4
【详解】(1)Fe是26号元素,价层电子排布式为,基态Fe原子价层电子的轨道表示式为: ;
(2)Fe原子价层电子排布式为,Fe失去3个电子后,形成的为半充满,结构稳定,难失去第4个电子,所以第4电离能比第3电离能大很多;
(3)关于晶体
A. 存在的化学键有σ键、π键、配位键、离子键等,A正确;
B. Fe、N、C的电负性由大到小的顺序:,B正确;
C. 在晶体中的键能等于KCN中的键能,C错误;
D. 由图1可知,在晶胞中、 原子均参与形成配位键,其配位数之比为6:6,D正确;故选C;
(4)因为普鲁士蓝的铁与氰基以配位键结合,剧毒的氰根离子不可能游离出来,所以普鲁士蓝本身是无毒的;
(5)晶胞中,个数为:,个数为:,与、比值为1:1,所以个数为4;晶胞的棱长为,图1中位于每个晶胞中心,图2中位于小正方体的中心,则相邻之间的最短距离为nm。
23.(1)3d64s2
(2) O>N>C>H sp2、sp3杂化 氢键 没有
(3) 12
【详解】(1)铁为26号元素,价层电子排布式为:;
(2)①同周期元素的电负性从左到右依次增大,有,而H的最小,故有:。故答案为:;
②单键的N的价层电子对数为,根据杂化轨道理论,中心N原子采取杂化,双键的N原子采用sp2杂化。故答案为:sp2、杂化;
③据图色胺酮钴配合物中O及N原子均有孤对电子,而中羟基上的氢原子上的电子偏向O导致几乎氢核裸露,故两者易形成氢键。甲醇分子中没有π键。
(3)据图色胺酮钴配合物中O及N原子均有孤对电子,而中羟基上的氢原子上的电子偏向O导致几乎氢核裸露,故两者易形成氢键。甲醇分子中没有π键。
(3)依图所示的立方体晶胞中,Mg原子位于顶点,Ni原子位于面心,而C位于体心。
①每个立方体晶胞中,Mg原子最近的Ni原子个数为3,而每个Mg原子被8个立方体占据,故Mg原子最近的Ni原子个数为:。故答案为:12;
②每个立方体晶胞中,各原子的数目为:,,,故化学式应为:。。故答案为:。
24.(1)
(2)
(3) 棱心 面心 (或278.5) (或) Sr原子半径小于La
【详解】(1)基态Zn的价电子排布式为,则基态的价电子排布式为,同周期元素随核电荷数增大,非金属性增强,电负性增强,所以,故答案为:;;
(2)MA是其中N原子为类似于是的形式,的杂化类型是,因此的杂化轨道类型,观察FA的结构中,不难看出,除碳氮之间存在双键,其余的均是σ键,故1个FA中含有7个σ键,1molFA中存在个σ键,故答案为:;;
(3)观察图a可知,图中O原子的位置是棱心,结合图a中La的位置在体心故结合图b可知此时O原子的位置在面心;La的配位数均是12,因此为最密堆积,根据投影可知为面心最密堆积,因此O与O的最小核间距为面对角线的一半,即(或278.5);若图a晶胞的超晶胞中La则共为8个,Cr也为8个,O原子位于面心和棱心共为24个,其中一个La原子被Sr代替,则掺杂后晶体化学式为,也可以写为,掺杂Sr后O与O的最小核间距略有减小,其可能的原因是Sr原子半径小于La,故答案为:棱心;面心;(或278.5);(或);Sr原子半径小于La。
【点睛】本题考查物质结构的综合应用,整体偏难。
25.(1) 4s24p1 第四周期IIIA族
(2) N N
(3) 正四面体 sp3
(4) ②③① 三者结构相似,都是原子晶体,碳原子半径小于硅原子,键能C-C>C-Si>Si-Si
(5)
(6) SeBi2O2
【详解】(1)是31号元素,根据构造原理,可知基态镓原子的核外电子排布式是,则其价电子排布式为。根据核外电子排布式可知原子核外有4个电子层,最外层有3个电子,则由原子结构与元素位置关系可知位于元素周期表第四周期第ⅢA族。
(2)在上述材料所涉及的元素有C、、N、。原子核外电子层数越多原子半径越大;当原子核外电子层数相同时,原子序数越小,原子半径越大。C、N原子核外只有2个电子层,核外有3个电子层,核外有4个电子层,由于原子序数N>C,故上述四种元素中原子半径最小的是N元素。同一周期元素的第一电离能随原子序数的增大而增大,同一主族元素的第一电离能随原子序数的增大而减小,在上述四种元素中原子核外电子层数最少的元素有C、N,由于原子序数N>C,N原子核外电子排布处于半满的稳定状态,所以第一电离能最大的是N元素。
(3)原硅酸根中原子价层电子对数为,且不含孤电子对,根据价层电子对互斥理论可知的空间构型是正四面体形;其中原子杂化类型是杂化。
(4)①金刚石、②晶体硅、③碳化硅三种物质都是共价晶体,原子半径:。原子半径越小,共价键键长就越短,该化学键的键能就越大,断裂该共价键使物质熔化、气化消耗的能量就越多,物质的熔沸点就越高。由于键长:,所以键能:,因此三种物质的熔点由低到高的顺序是②③①,原因为三者结构相似,都是原子晶体,碳原子半径小于硅原子,键能C-C>C-Si>Si-Si。
(5)该晶胞中含有原子数目为,含有N原子数目为,晶胞底面为菱形,锐角为,边长为,则底面面积,则晶胞体积,则其密度,则阿伏伽德罗常数。
(6)根据电荷守恒可知,该晶胞中和的个数比为1:1,则硒氧化铋的化学式为SeBi2O2;该晶胞中,Se的个数为=2,结合化学式可知,该晶胞中含有2个SeBi2O2,晶胞质量为=,晶胞体积为a10-10cma10-10cmc10-10cm=a2c10-30cm3,则晶胞密度为=g·cm-3。
26.(1) 7 ⅡA
(2)镁原子为3s2全满稳定状态,铝原子为3s2sp1结构,容易失去电子变成3p全空的较稳定结构,故第一电离能Al
(4)(0.134,0.134,0.134)
【详解】(1)把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;基态Al原子核外电子排布为1s22s22p63s23p1,故基态Al原子核外电子有7种不同的空间运动状态;具有40个价电子时最稳定,的价电子为14×3=42,则其容易失去2个电子,故与ⅡA族元素的性质相似。
(2)镁原子为3s2全满稳定状态,铝原子为3s2sp1结构,容易失去电子变成3p全空的较稳定结构,故导致Al原子的第一电离能低于Mg;
(3)由图可知,根据“均摊法”,晶胞中含个小八面体,1个小八面体中含有6个F、1个Al,则共含有12个F、2个Al,根据投影可知,4个钠位于棱、6个为面、2个位于体内,则含个Na,故该助熔剂的化学式为Na3AlF6;晶体密度为;
(4)晶胞边长为780pm,则体对角线为长度为,大阴离子中一个在体对角线上,且Al-F键长181pm,该所配位的原子为原点,则该氟离子到原点距离占体对角线长度的分数为,则该氟离子在x、y、z轴上的投影的分数均为0.134,故该的坐标为(0.134,0.134,0.134)。
27.(1) 2
(2) 与两种含砷有机酸均属于分子晶体,含两个羟基,形成的氢键数目多,沸点高 >
(3) 0.75 0.25 0.25(或0.75)
【详解】(1)砷位于元素周期表的第4周期第ⅤA族,其基态原子核外价电子排布式为:;砷原子p轨道为半充满状态,其第一电离能较大,所以同周期中第一电离能大于砷的元素只有Br和Kr两种;
(2)物质的熔沸点与晶体类型有关,原子晶体>离子晶体>分子晶体,与两种含砷有机酸均属于分子晶体,含两个羟基,形成的氢键数目多,沸点高;和均为sp3杂化,但比多一对孤电子对,杂化方式相同时,孤电子对数越多键角越小,故>;
(3)①把晶胞切割成多个边长为的小正方体,M位于一个顶点,所在的正方体在N所在正方体的正上方,所以M点原子分数坐标为;
②根据均摊法晶胞计算法则可得:,,,,化简即可得中m=0.75,n=0.25;
③将晶胞切割成八个大小相等的正方体,如图 , Mn原子在顶点,As原子在小正方体的体心,即晶胞结构体对角线的处,设棱长为a,一个晶胞中含有4个分子,所以,nm,则As原子与Mn原子之间的最短距离为nm;
④在LiZnAs立方晶胞中,Zn以面心立方形式堆积,Li和As分别填充在Zn原子围成的八面体空隙中,Zn位于顶点、面心,晶胞中Zn原子数目为4,结合化学式可知晶胞中Li、As原子数均为4,结合a=0和1,a=0.5的截面,可知Li位于晶胞的体心、棱心,而As位于晶胞体心,只有其中4个填充As原子的晶胞不共面,根据几何知识可知x=0.25或0.75,在图4中As原子所在的截面上表示为 。
28.(1) 分子晶体 HF 、
(2) > 分子中键的键长小于中键的键长,其原因是:分子中既存在σ键,又存在大键,原子轨道重叠的程度较大,因此其中键的键长较小,而只存在普通的σ键。
(3)
【详解】(1)常温常压下,为无色气体,则的沸点较低,因此,固态HOF的晶体类型为分子晶体。分子中F显-1价,其水解时结合电离的生成HF,则结合电离的,两者反应生成,因此,水解反应的产物为HF 、。
(2)中心原子为,中心原子为,二者均为V形结构,但中存在大键()。由中存在可以推断,其中原子只能提供1对电子,有一个原子提供1个电子,另一个原子提供1对电子,这5个电子处于互相平行的轨道中形成大键,提供孤电子对与其中一个形成配位键,与另一个形成的是普通的共价键(σ键,这个只提供了一个电子参与形成大键), 的价层电子对数为3,则原子的轨道杂化方式为;中心原子为,根据价层电子对的计算公式可知,因此,的杂化方式为;根据价层电子对互斥理论可知,时,价电子对的几何构型为正四面体,时,价电子对的几何构型平面正三角形,杂化的键角一定大于的,因此,虽然和均为形结构,但键角大于键角,孤电子对对成键电子对的排斥作用也改变不了这个结论。分子中键的键长小于中键的键长,其原因是:分子中既存在σ键,又存在大键,原子轨道重叠的程度较大,因此其中键的键长较小,而只存在普通的σ键。
(3)一定条件下,、和反应生成和化合物X。已知X属于四方晶系,其中Cu化合价为+2。由晶胞结构图可知,该晶胞中含有黑球的个数为、白球的个数为、灰色球的个数为,则X中含有3种元素,其个数比为1:2:4,由于其中Cu化合价为+2、的化合价为-1、K的化合价为+1,根据化合价代数和为0,可以推断X为,上述反应的化学方程式为。若阿伏加德罗常数的值为,晶胞的质量为,晶胞的体积为,化合物X的密度。
29.(1)
(2) 铜的原子半径比银的小,金属键比银的强
(3) 直线形 16
(4) 4 0
(5)
【详解】(1)基态N原子核外电子排布为:,电子排布图(轨道表示式)为: ;
(2)基态Ag原子的价电子排布式为:;铜的原子半径比银的小,金属键比银的强,所以铜的熔点和沸点均比银的高;
(3)为直线型分子,的空间结构和相同,则的空间结构为直线型,价电子数为个;
(4)①根据Y的结构简式,在Y分子中,Cu的配位数为4;
②基态电子排布式为:,未成对电子数为0;
(5)根据晶胞图,F原子在体心,N原子在顶点处,F原子与N原子的最近距离为体对角线的一半,为;在该晶胞中,F原子个数为1,N原子为,Cu原子在棱上,个数为,所以晶胞的密度为:。
30.(1)或
(2)的价电子排布是,3d轨道全满稳定
(3) HNCS分子间可形成氢键,而HSCN分子间不能形成氢键
(4)共价晶体
(5) A、B
(6)双键与双键间电子对的斥力大于单键与单键电子对的斥力
(7)>
(8)
(9) (,,)
【详解】(1)基态电子排布式:或;
(2)的价电子排布是,3d轨道全满稳定,所以高温下比更稳定;
(3)的结构式为:,硫原子的杂化方式是;键和键数目之比为:;分子间可形成氢键,而HSCN分子间不能形成氢键,所以硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS)的沸点;
(4)六方氮化硼结构与金刚石相似,晶体类型为共价晶体;
(5)中所含元素的电负性由大到小的顺序为:;该晶体中含有离子键和共价键,故选AB;
(6)双键与双键间电子对的斥力大于单键与单键电子对的斥力,所以键角;
(7)因为F原子的电负性较大,使的H原子不一点力,所以酸性小于;
(8)氯离子和银离子反应生成氯化银白色沉淀,可以通过沉淀的质量推出氯离子的含量,白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的,两种晶体的组成皆为,说明该紫色晶体中有3个自由移动的氯离子,而绿色晶体有2个自由移动的氯离子,即有一个氯原子形成了配合物,因为钛为6配位,即配合物中有5个水分子,绿色晶体配合物的化学式为;
(9)根据A的坐标为(0,0,0),B的坐标为(,,);在该晶胞中,个数为:8,为,所以晶胞的密度为:。
31.(1) 4:5 正四面体形
(2)<
(3) C 4
(4) < 16NA
(5) > CD
(6) FeCuS2(或CuFeS2) 或
【详解】(1)①基态Fe2+价层电子排布式为3d6,有4个成单电子,Fe3+价层电子排布式为3d5,有5个成单电子,基态Fe2+与Fe3+中未成对的电子数之比为4:5,
故答案为:4:5;
②PO中中心P原子的价层电子对数为4+ =4,没有孤电子对,空间构型为正四面体形,
故答案为:正四面体形;
(2)结构对称、正负电荷重心重合,为非极性分子,结构不对称、正负电荷重心不重合,为极性分子,故分子的极性:前者<后者,
故答案为:<;
(3)①N原子与Ni之间形成配位键,碳碳之间形成非极性键,碳与氮、碳与氢、N与O、O与H之间形成极性键,O与H之间存在氢键,单键为σ键,双键含有1个σ键、1个π键,所以不含金属键,
故答案为:C;
②由沉淀的结构图可知,Ni与4个N原子形成配位键,即该沉淀中Ni2+的配位数为4,
故答案为:4;
(4)①NH3提供孤对电子与Cu2+形成配位键后,没有孤电子对,NH3中存在1个孤电子对,孤电子对与成键电子对间存在斥力,所以NH3中H-N-H键角较小,
故答案为:<;
②[Cu(NH3)4]2+中存在12个N-H键,Cu与N之间存在4个配位键,1mol[Cu(NH3)4]2+中σ键的数目为16NA,
故答案为:16NA;
(5)NiO、FeO都是离子晶体,氧离子半径相同,Ni2+半径比Fe2+小,半径越小,离子晶体的晶格能越大,熔点越高,故熔点:NiO>FeO;NiO 晶体结构中阴阳离子的配位数均为 6,可判断Ni2+和O2-占据晶胞的顶点,面心和体心和棱上,所以俯视图中CD符合,
故答案为:>;CD;
(6)根据均摊法可知,1个晶胞中的Cu原子数为,Fe原子数为,S原子数为8,故此矿物的化学式为或;晶胞密度=或g/cm3。答案为:FeCuS2(或CuFeS2); (或)。
32.(1)
(2)三角锥形
(3)
(4) 钙
(5) 面心立方 6 12
【详解】(1)F,Cl,Br,I分别形成简单氢化物为HF、HCl、HBr、HI,均为分子晶体,HF分子间形成氢键,沸点最高,HCl、HBr、HI相对分子质量依次增大,分子间作用力依次增大,沸点依次增大,故沸点由高到低的顺序为:;
(2)的中心原子Br的孤电子对数为:,价层电子对数为:3+1=4,VSEPR模型为四面体形,故其空间结构为三角锥形;
(3)电负性大小:Cl>I,共用电子对偏向Cl,相对显负电性,水解时,元素化合价不变,故在水中水解的化学方程式:;
(4)如图结构所示,根据均摊法:一个六元环中:Cl的个数为:,Ca的个数为:,故该化合物的化学式;r(Ca2+)
②该晶胞的化学式为,根据均摊法,Cs的个数为:,则Au的个数为2个,则Au位于两个立方体的体心,离Au最近的为6个,故其配位数为6;与构成面心立方,故离最近的为12个,故其配位数为12;
③分数坐标是指x、y、z三个方向上的距离分别占晶胞长宽高的比例,如图所示,晶胞内部小白球位于
同课章节目录
