2023-2024学年福建省莆田十五中高一(上)期末化学模拟试卷(含解析)
文档属性
| 名称 | 2023-2024学年福建省莆田十五中高一(上)期末化学模拟试卷(含解析) |  | |
| 格式 | Docx | ||
| 文件大小 | 106.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 00:11:40 | ||
图片预览




文档简介
2023-2024学年福建省莆田十五中高一(上)期末化学模拟试卷
一.选择题(共16小题,满分48分,每小题3分)
1.(3分)分类是化学学习的重要方法,下列有关物质的分类,正确的是( )
A.化合物:BaCl2、Ca(OH)2、HNO3、HD
B.碱性氧化物:Na2O、CuO、Mn2O7、CaO
C.同素异形体:C60、碳纳米管、金刚石、石墨
D.混合物:漂白粉、冰水混合物、氯水、水玻璃
2.(3分)下列溶液中的氯离子数目与10mL 0.1mol L﹣1的FeCl3溶液中氯离子数目相等的是( )
A.5mL 0.2mol L﹣1的CaCl2溶液
B.15mL 0.2mol L﹣1的KCl溶液
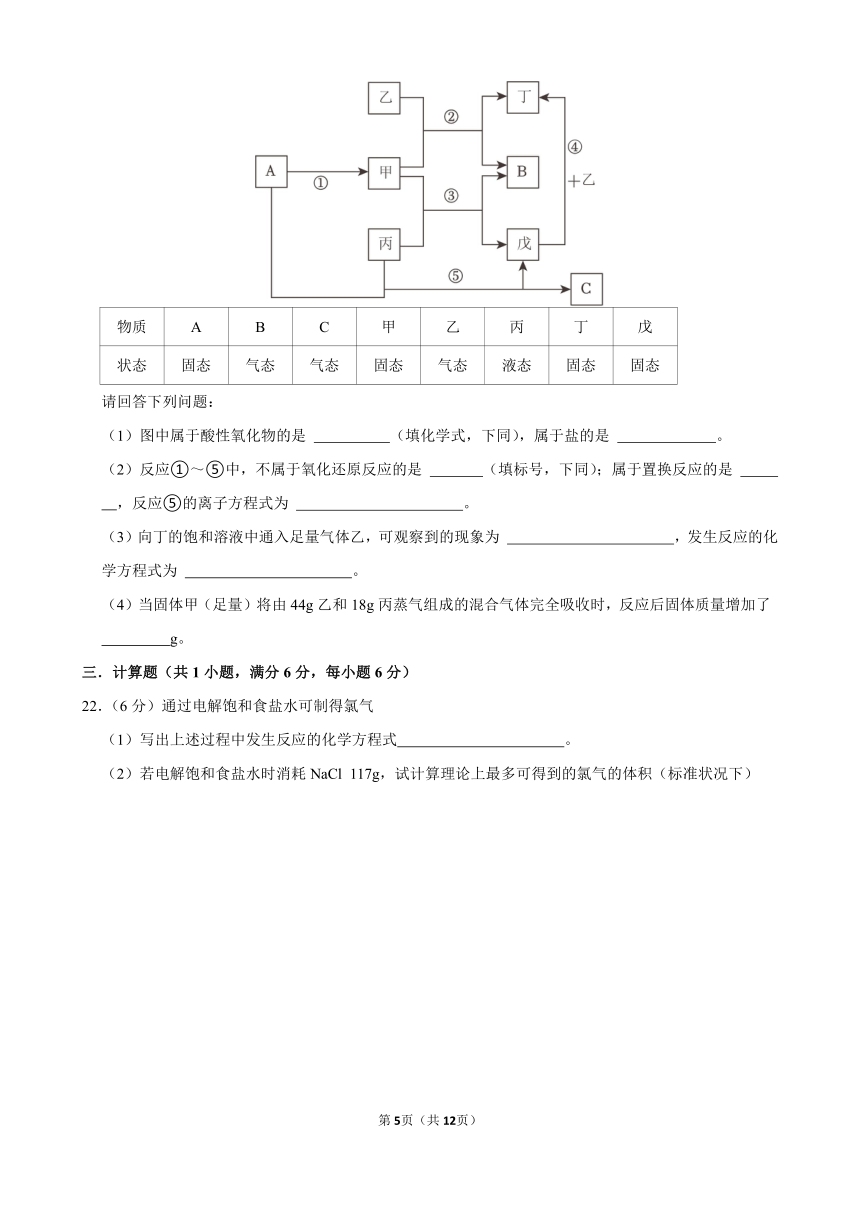
C.20 mL0.1mol L﹣1的AlCl3溶液
D.30 mL 0.1mol L﹣1的BaCl2溶液
3.(3分)下列有关胶体的说法正确的是( )
A.胶体是纯净物
B.胶体的分散质有可能带电,但胶体不带电
C.胶体、溶液与浊液的本质区别在于是否有丁达尔效应
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中,可得氢氧化铁胶体
4.(3分)只用一种试剂即可鉴别氯化镁、氯化铁、氯化亚铁、氯化铵、氯化钠这五种溶液,该试剂是( )
A.KSCN B.BaCl2 C.HCl D.NaOH
5.(3分)当反应条件(如温度、浓度或物质的量等)发生改变时,下列不会引起生成物发生改变的是( )
A.钠和氧气 B.锌和硫酸
C.氢氧化钠和二氧化碳 D.氢气和氯气
6.(3分)空气吹出法是海水提溴的常用方法,其工艺流程如图所示。下列说法错误的是( )
A.热空气吹出Br2,利用了溴的挥发性
B.通Cl2发生的主要反应为Cl2+2Br﹣═2Cl﹣+Br2
C.该流程体现出氧化性强弱:Cl2>SO2>Br2
D.溴水混合物1到溴水混合物2的目的是富集溴元素
7.(3分)某核素的质量数为A,其阴离子Xn﹣核外有x个电子。有关该微粒的描述正确的是( )
A.Xn﹣的原子核内一定有(A﹣x﹣n)个中子
B.Xn﹣的原子核内一定有(x﹣n)个质子
C.Xn﹣的最外层一定具有8电子稳定结构
D.Xn﹣的次外层一定排布了8个电子
8.(3分)下列实验操作和叙述正确的是( )
A.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
B.分液时,先把分液漏斗上口的玻璃塞打开,或使塞上的凹或小孔槽对准分液漏斗口上的小孔,以便与大气相通
C.容量瓶检漏:在容量瓶中加入适量水,用手压紧瓶塞倒立1 min,如不渗漏,即可使用
D.萃取时,必须选用密度比水大的萃取剂
9.(3分)用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A.将0.1molCl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
B.标准状况下,22.4L氢气含有氢原子个数为2NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.标准状况下,22.4L苯中含有碳原子数目为6NA
10.(3分)下列反应中,水作氧化剂的是( )
A.2Na+2H2O═2NaOH+H2↑
B.2Na2O2+2H2O═4NaOH+O2↑
C.CuO+H2 Cu+H2O
D.Na2O+H2O═2NaOH
11.(3分)下列四组物质中,前者属于电解质,后者属于非电解质的是( )
A.二氧化碳碳酸钠 B.硫酸钠乙醇
C.盐酸甲烷 D.蔗糖氢氧化钠
12.(3分)在某溶液中酚酞呈红色.下列离子在该溶液中不能大量存在的是( )
A.K+ B.Na+ C.Ba2+ D.Al3+
13.(3分)将5.21g纯铁粉溶于适量稀H2SO4中,加热条件下,用2.53g KNO3氧化Fe2+,充分反应后还需0.009mol Cl2才能完全氧化Fe2+,则KNO3的还原产物氮元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
14.(3分)下列根据实验现象所得出的结论中,一定正确的是( )
A.无色溶液使蓝色石蕊试纸变红,结论:溶液显酸性
B.无色溶液焰色反应呈黄色,结论:溶液是钠盐溶液
C.无色溶液加入Na2CO3溶液产生白色沉淀,结论:溶液中含Ca(OH)2
D.无色溶液中加入氢氧化钠溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,结论:溶液中含NH3
15.(3分)粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质.
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液:
③加入稍过量的BaCl2溶液:
④过滤;
⑤滴入稀盐酸至无气泡产生.
正确的操作顺序是( )
A.①③②④⑤ B.③②①④⑤ C.②③①⑤④ D.③④②①⑤
16.(3分)下列离子方程式正确的是( )
A.向偏铝酸钠溶液中通入少量CO2气体:2H2OCO2═Al(OH)3↓
B.向稀硫酸中滴加Na2S2O3溶液:2H++S2═S↓+SO2↑+H2O
C.向新制氯水中滴加少量FeBr2溶液:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+2Cl2
D.向NH4Cl溶液中加入小颗粒钠:2Na+2H2O═2Na++2OH﹣+H2↑
二.填空题(共5小题,满分46分)
17.(9分)按要求完成以下方程式:
Ⅰ.写出下列物质在水溶液中的电离方程式:
(1)NaHSO4(水溶液): 。
(2)Ba(OH)2: 。
Ⅱ.完成下列情况下的离子方程式:
(3)金属钠投入水中: 。
(4)澄清石灰水中通入少量二氧化碳: 。
Ⅲ.回答下列问题:
(5)有以下六种物质:①乙醇;②Na2CO3溶液;③NaOH固体;④盐酸;⑤冰醋酸;⑥石墨。上述状态下的物质中,能导电的有 (填序号,下同),属于电解质的有 。
(6)已知H3PO2是一元弱酸,NaH2PO2属于 (填:“酸式盐”、“正盐”或者“碱式盐”)。写出H3PO2与足量NaOH溶液反应的离子方程式: 。
18.(12分)回答下列问题
(1)写出Na2SO4在水中的电离方程式 。
(2)新切开的Na的表面所观察到的现象 。
(3)NaHCO3与NaOH溶液反应的离子方程式 。
(4)写出红热的铁和水蒸气发生反应的化学方程式,并用单线桥法表示出该反应中电子转移的方向和数目 。
19.(9分)(1)用双线桥法表示氧化还原反应2KMnO4K2MnO4+MnO2+O2↑电子转移的方向和数目 。
(2)在这个反应6Fe2++Cr214H+═6Fe3++2Cr3++7H2O中氧化剂为 ,还原剂为 , 元素被还原,氧化产物是 ;氧化性强弱为: > 。
(3)写出下列反应的离子方程式。
①铜与硝酸银溶液的反应: 。
②Na和H2O的反应: 。
20.(10分)用双线桥法表示下列氧化还原反应中化合价变化与电子转移并填空。
(1)Zn+H2SO4(稀)═ZnSO4+H2↑: ,氧化剂 ;还原剂 。
(2)Fe2O3+3CO2Fe+3CO2: ,氧化产物 ;还原产物 。
21.(6分)常见的八种物质间存在如图转化关系,其中仅A、B、C为单质,其他物质均为化合物且由X、Y、Z、W四种元素中的两种或三种组成。A的焰色试验火焰呈黄色,B具有助燃性,固态乙可用于人工降雨,戊和丁的水溶液均呈碱性,甲的相对分子质量为78。常温下,各物质的状态如表所示:
物质 A B C 甲 乙 丙 丁 戊
状态 固态 气态 气态 固态 气态 液态 固态 固态
请回答下列问题:
(1)图中属于酸性氧化物的是 (填化学式,下同),属于盐的是 。
(2)反应①~⑤中,不属于氧化还原反应的是 (填标号,下同);属于置换反应的是 ,反应⑤的离子方程式为 。
(3)向丁的饱和溶液中通入足量气体乙,可观察到的现象为 ,发生反应的化学方程式为 。
(4)当固体甲(足量)将由44g乙和18g丙蒸气组成的混合气体完全吸收时,反应后固体质量增加了 g。
三.计算题(共1小题,满分6分,每小题6分)
22.(6分)通过电解饱和食盐水可制得氯气
(1)写出上述过程中发生反应的化学方程式 。
(2)若电解饱和食盐水时消耗NaCl 117g,试计算理论上最多可得到的氯气的体积(标准状况下)
2023-2024学年福建省莆田十五中高一(上)期末化学模拟试卷
参考答案与试题解析
一.选择题(共16小题,满分48分,每小题3分)
1.【解答】解:A.HD只含一种元素的纯净物,为单质,不是化合物,故A错误;
B.Mn2O7为酸性氧化物,故B错误;
C.C60、碳纳米管、金刚石、石墨都是由碳元素组成的不同单质,互为同素异形体,故C正确;
D.冰水混合物只含一种物质,是纯净物,故D错误。
故选:C。
2.【解答】解:A.5mL 0.2mol L﹣1的CaCl2溶液中氯离子为0.005L×0.2mol/L×2=0.002mol,故A不选;
B.15mL 0.2mol L﹣1的KCl溶液中氯离子为0.015L×0.2mol/L=0.03mol,物质的量相同,个数相同,故B选;
C.20 mL0.1mol L﹣1的AlCl3溶液中氯离子为0.02L×0.1mol/L×3=0.006mol,故C不选;
D.30mL 0.1mol L﹣1的BaCl2溶液中氯离子为0.03L×0.1mol/L×2=0.006mol,故D不选;
故选:B。
3.【解答】解:A.因为分散质粒子在1nm~100nm之间的分散系就是胶体,胶体属于混合物,故A错误;
B.胶体呈电中性,胶粒因吸附带电荷,故B正确;
C.胶体区别于其它分散系的本质是胶体分散质微粒直径的大小,不是有丁达尔效应,故C错误;
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中,可得氢氧化铁沉淀,故D错误。
故选:B。
4.【解答】解:A.加入KSCN只能鉴别氯化铁,故A错误;
B.加入氯化钡,都不反应,不能鉴别,故B错误;
C.加入HHCl,都不反应,不能鉴别,故C错误;
D.取五种溶液分别滴加NaOH溶液时,产生白色沉淀的是氯化镁;产生红褐色沉淀的是氯化铁;产生白色沉淀,后又变灰绿色,最后变成红褐色的是氯化亚铁;生成刺激性气体的为氯化铵,无现象的是氯化钠,可鉴别,故D正确;
故选:D。
5.【解答】解:A.钠和氧气常温下生成氧化钠,加热条件下生成过氧化钠,所以生成物和反应条件温度有关,故A错误;
B.锌与稀硫酸反应生成氢气,锌与浓硫酸反应生成二氧化硫,所以生成物和反应物的浓度有关,故B错误;
C.少量二氧化碳通入氢氧化钠溶液中生成碳酸钠,过量二氧化碳通入氢氧化钠溶液生成碳酸氢钠,所以生成物和反应物的用量有关,故C错误;
D.氢气和氯气反应只能生成氯化氢,所以生成物与反应物的用量或浓度无关,故D正确;
故选:D。
6.【解答】解:A.苦卤与氯气发生Cl2+2Br﹣=Br2+2Cl﹣,热空气吹出Br2,利用了溴的挥发性,故A正确;
B.苦卤与氯气发生Cl2+2Br﹣=Br2+2Cl﹣,故B正确;
C.该流程中氯气氧化溴离子生成溴,溴氧化SO2生成硫酸,体现出氧化性强弱:Cl2>Br2>SO2,故C错误;
D.溴水混合物1到溴水混合物2使溴的浓度增大,目的是富集溴元素,故D正确;
故选:C。
7.【解答】解:A.质子数=x﹣n,中子数=质量数﹣质子数=A﹣(x﹣n),故A错误;
B.阴离子中质子数=阴离子核外电子数﹣所带电荷数=x﹣n,故B正确;
C.最外层可能有2个电子,为2电子稳定结构,故C错误;
D.若该元素为长周期元素,该阴离子Xn﹣次外层电子数也可能为18,故D错误。
故选:B。
8.【解答】解:A.蒸发时不能蒸干,利用余热加热,出现大量固体时停止加热,故A错误;
B.分液时,平衡气压,则先把分液漏斗上口的玻璃塞打开,或使塞上的凹或小孔槽对准分液漏斗口上的小孔,以便与大气相通,故B正确;
C.倒置不漏水,然后将塞子旋转180°,再倒置一次,仍不漏水,可使用,故C错误;
D.萃取时不需要考虑密度,萃取剂不相溶,且不发生反应即可,故D错误;
故选:B。
9.【解答】解:A、氯气和氢氧化钠溶液在常温下反应时,歧化为+1价和﹣1价,故1mol氯气转移1mol电子,则0.1mol氯气转移0.1NA个电子,故A正确;
B、标况下22.4L氢气的物质的量为1mol,而氢气为双原子分子,故1mol氢气中含2NA个H原子,故B正确;
C、二氧化碳和氧气中均含2个氧原子,故NA个混合物分子中含氧原子为2NA个,与两者的比例无关,故C正确;
D、标况下苯为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误。
故选:D。
10.【解答】解:A、2Na+2H2O═2NaOH+H2↑中H元素的化合价降低作氧化剂,故A正确;
B、2Na2O2+2H2O═4NaOH+O2↑中,水中的各元素化合价不变,故B错误;
C、CuO+H2 Cu+H2O中水是生成物,故C错误;
D、Na2O+H2O═2NaOH中无元素化合价的变化,故D错误;
故选:A。
11.【解答】解:A.二氧化碳是非电解质,碳酸钠是电解质,故A错误;
B.硫酸钠是电解质,乙醇是非电解质,故B正确;
C.盐酸是HCl的水溶液,是混合物,既不是电解质也不是非电解质;甲烷在水溶液中和熔融状态下均不能导电,故是非电解质,故C错误;
D.蔗糖是非电解质,氢氧化钠是电解质,故D错误;
故选:B。
12.【解答】解:溶液中酚酞呈红色,该溶液呈碱性,溶液中存在大量氢氧根离子,K+、Na+、Ba2+都不与氢氧根离子反应,能够大量共存,Al3+与氢氧根离子反应,在溶液中不能大量共存,
故选:D。
13.【解答】解:n(Fe)mol=0.093mol,n(KNO3)0.025mol,亚铁离子被硝酸钾和氯气氧化,根据Cl2~2Fe2+,所以氯气氧化了0.018mol的亚铁离子,所以被硝酸钾氧化的亚铁离子是0.093mol﹣0.018mol=0.075mol,根据电子守恒,设KNO3的还原产物氮元素的化合价是x,则0.075(3﹣2)=0.025(5﹣x),解得x=2,故选B。
14.【解答】解:A.酸能使石蕊试液变红色,无色溶液使蓝色石蕊试纸变红,说明该溶液显酸性,故A正确;
B.焰色反应呈黄色的不一定是盐溶液,如可能是NaOH溶液,故B错误;
C.无色溶液加入Na2CO3溶液产生白色沉淀,该溶液可能是可溶性的钙盐、钡盐或Ba(OH)2等,故C错误;
D.无色溶液中加入氢氧化钠溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,则该溶液中含有铵根离子,故D错误;
故选:A。
15.【解答】解:粗盐的提纯中,为了保证杂质离子完全出去,每一次所加试剂都过量,加入NaOH溶液的目的是除去镁离子,加BaCl2溶液的目的是除去硫酸根离子,加Na2CO3溶液的目的是除去钙离子和过量的钡离子,由此可知,Na2CO3溶液的加入一定在BaCl2溶液之后,即①一定在③之后,为了不使产生的沉淀溶解,一定要在过滤后再加盐酸,即④在⑤之后,操作顺序可以为:②③①④⑤或③②①④⑤或③①②④⑤,只有B正确。
故选:B。
16.【解答】解:A.向偏铝酸钠溶液中通入少量的CO2气体,反应生成氢氧化铝沉淀和碳酸根离子,正确的离子方程式为:2CO2+3H2O=2Al(OH)3↓,故A错误;
B.向稀硫酸中滴加Na2S2O3溶液,离子方程式为:2H++S2═S↓+SO2↑+H2O,故B正确;
C.向新制氯水中滴加少量FeBr2溶液,离子方程式为:2Fe2++4Br﹣+3Cl2═2Fe3++2Br2+6Cl﹣,故C错误;
D.向NH4Cl溶液中加入小颗粒钠的离子反应为:2Na+2H2O+22NH3 H2O+2Na++H2↑,故D错误,
故选:B。
二.填空题(共5小题,满分46分)
17.【解答】解:Ⅰ.(1)硫酸氢钠为强电解质,水溶液中完全电离,电离方程式为:NaHSO4=Na++H+,
故答案为:NaHSO4=Na++H+;
(2)氢氧化钡为强电解质,水溶液中完全电离,电离方程式为:Ba(OH)2=Ba2++2OH﹣,
故答案为:Ba(OH)2=Ba2++2OH﹣;
Ⅱ.(3)钠与水反应生成氢氧化钠和氢气,离子方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,
故答案为:2Na+2H2O=2Na++2OH﹣+H2↑;
(4)二氧化碳少量反应生成碳酸钙和水,离子方程式为:Ca2++2OH﹣+CO2=CaCO3↓+H2O,
故答案为:Ca2++2OH﹣+CO2=CaCO3↓+H2O;
Ⅲ.(5)①乙醇为化合物,在水溶液中和熔融状态下不能导电,属于非电解质,没有自由电子,也没有自由移动的离子,不能导电;
②Na2CO3溶液是混合物,既不是电解质也不是非电解质,含自由移动的离子,能导电;
③NaOH固体是化合物,水溶液中或者熔融状态下能导电,属于电解质,没有自由电子,也没有自由移动的离子,不能导电;
④盐酸是混合物,既不是电解质也不是非电解质,含自由移动的离子,能导电;
⑤冰醋酸为化合物,水溶液中能导电,属于电解质;没有自由电子,也没有自由移动的离子,不能导电;
⑥石墨是单质,既不是电解质也不是非电解质,含自由电子,能导电;
上述状态下的物质中,能导电的有:②④⑥;属于电解质的有:③⑤,
故答案为:②④⑥;③⑤;
(6)H3PO2是一元弱酸,1个H3PO2只能电离出1个氢离子,则NaH2PO2属于正盐,H3PO2与足量NaOH溶液反应产生NaH2PO2、H2O,其反应的离子方程式为:H3PO2+OH﹣=H2H2O,
故答案为:正盐;H3PO2+OH﹣=H2H2O。
18.【解答】解:(1)硫酸钠为强电解质,水溶液中完全电离出钠离子和硫酸根离子,电离方程式为:Na2SO4=2Na+,
故答案为:Na2SO4=2Na+;
(2)钠在空气中氧化生成氧化钠,现象新切开的面呈银白色光泽,迅速变暗,
故答案为:新切开的面呈银白色光泽,迅速变暗;
(3)碳酸氢钠与氢氧化钠反应生成碳酸钠和水,离子方程式为:OH﹣H2O,
故答案为:OH﹣H2O;
(4)铁粉与水蒸气在高温下发生的反应中,化合价升高的元素是铁元素,Fe元素被氧化,失去电子,化合价降低元素是氢元素,得到电子,电子转移情况如下所示:,
故答案为:。
19.【解答】解:(1)2KMnO4K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,所以KMnO4即是氧化剂又是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol,电子转移情况如下:,
故答案为:;
(2)反应6Fe2++Cr214H+═6Fe3++2Cr3++7H2O中Cr元素化合价由+6价变为+3价被还原,氧化剂为Cr2,Fe元素化合价由+2价升为+3价被氧化,还原剂为Fe2+,Cr元素被还原,氧化产物是Fe3+;根据氧化剂的氧化性强于氧化产物可知,氧化性强弱为:Cr2Fe3+,
故答案为:Cr2;Fe2+;Cr;Fe3+;Cr2;Fe3+;
(3)①铜与硝酸银溶液反应生成硝酸铜和银,离子方程式为:Cu+2Ag+=2Ag+Cu2+,
故答案为:Cu+2Ag+=2Ag+Cu2+;
②Na和H2O反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,
故答案为:2Na+2H2O=2Na++2OH﹣+H2↑。
20.【解答】解:(1)在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,该反应中转移的电子数为2e﹣,电子转移的方向和数目为,所以还原剂是Zn,氧化剂是H2SO4,
故答案为:;H2SO4;Zn;
(2)Fe2O3+3CO2Fe+3CO2 的反应中,C元素的化合价升高,则该元素的原子失去电子,被氧化,为Fe元素化合价降低,反应中得到电子被还原,Fe2O3 发生了还原反应,CO发生氧化反应,该反应中3molCO参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为,氧化产物为CO2,还原产物为Fe,
故答案为:;CO2;Fe。
21.【解答】解:(1)根据分析可推出A为钠,B为氧气,甲为过氧化钠,乙为二氧化碳,丁为碳酸钠,丙为水,戊为氢氧化钠,C为氢气,其中属于酸性氧化物的是CO2,属于盐的是Na2CO3,
故答案为:CO2;Na2CO3;
(2)反应①为钠与氧气在加热条件下生成过氧化钠的过程,有元素化合价的升降,属于氧化还原反应;
反应②为过氧化钠与二氧化碳反应生成碳酸钠和氧气的过程,有元素化合价的升降,属于氧化还原反应;
反应③为过氧化钠与水反应生成氢氧化钠和氧气的过程,有元素化合价的升降,属于氧化还原反应;
反应④为氢氧化钠与二氧化碳反应生成碳酸钠和水的过程,没有元素化合价的升降,不属于氧化还原反应;
反应⑤为钠与水反应生成氢氧化钠和氢气的过程,有元素化合价的升降,属于氧化还原反应;
综上所述,反应④不属于氧化还原反应;反应⑤为置换反应;其离子方程式为2Na+2H2O=2Na++2OH﹣+H2↑,
故答案为:④;⑤;2Na+2H2O=2Na++2OH﹣+H2↑;
(3)碳酸氢钠的溶解度较低,所以向丁(Na2CO3)的饱和溶液中通入足量气体乙(CO2),会生成溶解度较小的碳酸氢钠,则可观察到的现象为产生白色沉淀(或析出白色晶体);反应的化学方程式为:Na2CO3+H2O+CO2=2NaHCO3↓,
故答案为:产生白色沉淀(或析出白色晶体);Na2CO3+H2O+CO2=2NaHCO3↓;
(4)当过量的过氧化钠吸收44g二氧化碳时固体质量增加28g,吸收18g水蒸气时固体质量增加2g,因此当过量的过氧化钠吸收44g二氧化碳和18g水蒸气时,固体质量增加28g+2g═30g,
故答案为:30。
三.计算题(共1小题,满分6分,每小题6分)
22.【解答】解:(1)电解饱和食盐水制氯气,反应生成氢氧化钠、氢气和氯气,反应的化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O2NaOH+H2↑+Cl2↑;
(2)电解饱和食盐水化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,n(Cl2)n(NaCl)1mol,标准状况下V(Cl2)=nVm=22.4L/mol×1mol=22.4L,
答:理论上最多可得到的氯气的体积22.4L。
第1页(共1页)
一.选择题(共16小题,满分48分,每小题3分)
1.(3分)分类是化学学习的重要方法,下列有关物质的分类,正确的是( )
A.化合物:BaCl2、Ca(OH)2、HNO3、HD
B.碱性氧化物:Na2O、CuO、Mn2O7、CaO
C.同素异形体:C60、碳纳米管、金刚石、石墨
D.混合物:漂白粉、冰水混合物、氯水、水玻璃
2.(3分)下列溶液中的氯离子数目与10mL 0.1mol L﹣1的FeCl3溶液中氯离子数目相等的是( )
A.5mL 0.2mol L﹣1的CaCl2溶液
B.15mL 0.2mol L﹣1的KCl溶液
C.20 mL0.1mol L﹣1的AlCl3溶液
D.30 mL 0.1mol L﹣1的BaCl2溶液
3.(3分)下列有关胶体的说法正确的是( )
A.胶体是纯净物
B.胶体的分散质有可能带电,但胶体不带电
C.胶体、溶液与浊液的本质区别在于是否有丁达尔效应
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中,可得氢氧化铁胶体
4.(3分)只用一种试剂即可鉴别氯化镁、氯化铁、氯化亚铁、氯化铵、氯化钠这五种溶液,该试剂是( )
A.KSCN B.BaCl2 C.HCl D.NaOH
5.(3分)当反应条件(如温度、浓度或物质的量等)发生改变时,下列不会引起生成物发生改变的是( )
A.钠和氧气 B.锌和硫酸
C.氢氧化钠和二氧化碳 D.氢气和氯气
6.(3分)空气吹出法是海水提溴的常用方法,其工艺流程如图所示。下列说法错误的是( )
A.热空气吹出Br2,利用了溴的挥发性
B.通Cl2发生的主要反应为Cl2+2Br﹣═2Cl﹣+Br2
C.该流程体现出氧化性强弱:Cl2>SO2>Br2
D.溴水混合物1到溴水混合物2的目的是富集溴元素
7.(3分)某核素的质量数为A,其阴离子Xn﹣核外有x个电子。有关该微粒的描述正确的是( )
A.Xn﹣的原子核内一定有(A﹣x﹣n)个中子
B.Xn﹣的原子核内一定有(x﹣n)个质子
C.Xn﹣的最外层一定具有8电子稳定结构
D.Xn﹣的次外层一定排布了8个电子
8.(3分)下列实验操作和叙述正确的是( )
A.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
B.分液时,先把分液漏斗上口的玻璃塞打开,或使塞上的凹或小孔槽对准分液漏斗口上的小孔,以便与大气相通
C.容量瓶检漏:在容量瓶中加入适量水,用手压紧瓶塞倒立1 min,如不渗漏,即可使用
D.萃取时,必须选用密度比水大的萃取剂
9.(3分)用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A.将0.1molCl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
B.标准状况下,22.4L氢气含有氢原子个数为2NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.标准状况下,22.4L苯中含有碳原子数目为6NA
10.(3分)下列反应中,水作氧化剂的是( )
A.2Na+2H2O═2NaOH+H2↑
B.2Na2O2+2H2O═4NaOH+O2↑
C.CuO+H2 Cu+H2O
D.Na2O+H2O═2NaOH
11.(3分)下列四组物质中,前者属于电解质,后者属于非电解质的是( )
A.二氧化碳碳酸钠 B.硫酸钠乙醇
C.盐酸甲烷 D.蔗糖氢氧化钠
12.(3分)在某溶液中酚酞呈红色.下列离子在该溶液中不能大量存在的是( )
A.K+ B.Na+ C.Ba2+ D.Al3+
13.(3分)将5.21g纯铁粉溶于适量稀H2SO4中,加热条件下,用2.53g KNO3氧化Fe2+,充分反应后还需0.009mol Cl2才能完全氧化Fe2+,则KNO3的还原产物氮元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
14.(3分)下列根据实验现象所得出的结论中,一定正确的是( )
A.无色溶液使蓝色石蕊试纸变红,结论:溶液显酸性
B.无色溶液焰色反应呈黄色,结论:溶液是钠盐溶液
C.无色溶液加入Na2CO3溶液产生白色沉淀,结论:溶液中含Ca(OH)2
D.无色溶液中加入氢氧化钠溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,结论:溶液中含NH3
15.(3分)粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质.
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液:
③加入稍过量的BaCl2溶液:
④过滤;
⑤滴入稀盐酸至无气泡产生.
正确的操作顺序是( )
A.①③②④⑤ B.③②①④⑤ C.②③①⑤④ D.③④②①⑤
16.(3分)下列离子方程式正确的是( )
A.向偏铝酸钠溶液中通入少量CO2气体:2H2OCO2═Al(OH)3↓
B.向稀硫酸中滴加Na2S2O3溶液:2H++S2═S↓+SO2↑+H2O
C.向新制氯水中滴加少量FeBr2溶液:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+2Cl2
D.向NH4Cl溶液中加入小颗粒钠:2Na+2H2O═2Na++2OH﹣+H2↑
二.填空题(共5小题,满分46分)
17.(9分)按要求完成以下方程式:
Ⅰ.写出下列物质在水溶液中的电离方程式:
(1)NaHSO4(水溶液): 。
(2)Ba(OH)2: 。
Ⅱ.完成下列情况下的离子方程式:
(3)金属钠投入水中: 。
(4)澄清石灰水中通入少量二氧化碳: 。
Ⅲ.回答下列问题:
(5)有以下六种物质:①乙醇;②Na2CO3溶液;③NaOH固体;④盐酸;⑤冰醋酸;⑥石墨。上述状态下的物质中,能导电的有 (填序号,下同),属于电解质的有 。
(6)已知H3PO2是一元弱酸,NaH2PO2属于 (填:“酸式盐”、“正盐”或者“碱式盐”)。写出H3PO2与足量NaOH溶液反应的离子方程式: 。
18.(12分)回答下列问题
(1)写出Na2SO4在水中的电离方程式 。
(2)新切开的Na的表面所观察到的现象 。
(3)NaHCO3与NaOH溶液反应的离子方程式 。
(4)写出红热的铁和水蒸气发生反应的化学方程式,并用单线桥法表示出该反应中电子转移的方向和数目 。
19.(9分)(1)用双线桥法表示氧化还原反应2KMnO4K2MnO4+MnO2+O2↑电子转移的方向和数目 。
(2)在这个反应6Fe2++Cr214H+═6Fe3++2Cr3++7H2O中氧化剂为 ,还原剂为 , 元素被还原,氧化产物是 ;氧化性强弱为: > 。
(3)写出下列反应的离子方程式。
①铜与硝酸银溶液的反应: 。
②Na和H2O的反应: 。
20.(10分)用双线桥法表示下列氧化还原反应中化合价变化与电子转移并填空。
(1)Zn+H2SO4(稀)═ZnSO4+H2↑: ,氧化剂 ;还原剂 。
(2)Fe2O3+3CO2Fe+3CO2: ,氧化产物 ;还原产物 。
21.(6分)常见的八种物质间存在如图转化关系,其中仅A、B、C为单质,其他物质均为化合物且由X、Y、Z、W四种元素中的两种或三种组成。A的焰色试验火焰呈黄色,B具有助燃性,固态乙可用于人工降雨,戊和丁的水溶液均呈碱性,甲的相对分子质量为78。常温下,各物质的状态如表所示:
物质 A B C 甲 乙 丙 丁 戊
状态 固态 气态 气态 固态 气态 液态 固态 固态
请回答下列问题:
(1)图中属于酸性氧化物的是 (填化学式,下同),属于盐的是 。
(2)反应①~⑤中,不属于氧化还原反应的是 (填标号,下同);属于置换反应的是 ,反应⑤的离子方程式为 。
(3)向丁的饱和溶液中通入足量气体乙,可观察到的现象为 ,发生反应的化学方程式为 。
(4)当固体甲(足量)将由44g乙和18g丙蒸气组成的混合气体完全吸收时,反应后固体质量增加了 g。
三.计算题(共1小题,满分6分,每小题6分)
22.(6分)通过电解饱和食盐水可制得氯气
(1)写出上述过程中发生反应的化学方程式 。
(2)若电解饱和食盐水时消耗NaCl 117g,试计算理论上最多可得到的氯气的体积(标准状况下)
2023-2024学年福建省莆田十五中高一(上)期末化学模拟试卷
参考答案与试题解析
一.选择题(共16小题,满分48分,每小题3分)
1.【解答】解:A.HD只含一种元素的纯净物,为单质,不是化合物,故A错误;
B.Mn2O7为酸性氧化物,故B错误;
C.C60、碳纳米管、金刚石、石墨都是由碳元素组成的不同单质,互为同素异形体,故C正确;
D.冰水混合物只含一种物质,是纯净物,故D错误。
故选:C。
2.【解答】解:A.5mL 0.2mol L﹣1的CaCl2溶液中氯离子为0.005L×0.2mol/L×2=0.002mol,故A不选;
B.15mL 0.2mol L﹣1的KCl溶液中氯离子为0.015L×0.2mol/L=0.03mol,物质的量相同,个数相同,故B选;
C.20 mL0.1mol L﹣1的AlCl3溶液中氯离子为0.02L×0.1mol/L×3=0.006mol,故C不选;
D.30mL 0.1mol L﹣1的BaCl2溶液中氯离子为0.03L×0.1mol/L×2=0.006mol,故D不选;
故选:B。
3.【解答】解:A.因为分散质粒子在1nm~100nm之间的分散系就是胶体,胶体属于混合物,故A错误;
B.胶体呈电中性,胶粒因吸附带电荷,故B正确;
C.胶体区别于其它分散系的本质是胶体分散质微粒直径的大小,不是有丁达尔效应,故C错误;
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中,可得氢氧化铁沉淀,故D错误。
故选:B。
4.【解答】解:A.加入KSCN只能鉴别氯化铁,故A错误;
B.加入氯化钡,都不反应,不能鉴别,故B错误;
C.加入HHCl,都不反应,不能鉴别,故C错误;
D.取五种溶液分别滴加NaOH溶液时,产生白色沉淀的是氯化镁;产生红褐色沉淀的是氯化铁;产生白色沉淀,后又变灰绿色,最后变成红褐色的是氯化亚铁;生成刺激性气体的为氯化铵,无现象的是氯化钠,可鉴别,故D正确;
故选:D。
5.【解答】解:A.钠和氧气常温下生成氧化钠,加热条件下生成过氧化钠,所以生成物和反应条件温度有关,故A错误;
B.锌与稀硫酸反应生成氢气,锌与浓硫酸反应生成二氧化硫,所以生成物和反应物的浓度有关,故B错误;
C.少量二氧化碳通入氢氧化钠溶液中生成碳酸钠,过量二氧化碳通入氢氧化钠溶液生成碳酸氢钠,所以生成物和反应物的用量有关,故C错误;
D.氢气和氯气反应只能生成氯化氢,所以生成物与反应物的用量或浓度无关,故D正确;
故选:D。
6.【解答】解:A.苦卤与氯气发生Cl2+2Br﹣=Br2+2Cl﹣,热空气吹出Br2,利用了溴的挥发性,故A正确;
B.苦卤与氯气发生Cl2+2Br﹣=Br2+2Cl﹣,故B正确;
C.该流程中氯气氧化溴离子生成溴,溴氧化SO2生成硫酸,体现出氧化性强弱:Cl2>Br2>SO2,故C错误;
D.溴水混合物1到溴水混合物2使溴的浓度增大,目的是富集溴元素,故D正确;
故选:C。
7.【解答】解:A.质子数=x﹣n,中子数=质量数﹣质子数=A﹣(x﹣n),故A错误;
B.阴离子中质子数=阴离子核外电子数﹣所带电荷数=x﹣n,故B正确;
C.最外层可能有2个电子,为2电子稳定结构,故C错误;
D.若该元素为长周期元素,该阴离子Xn﹣次外层电子数也可能为18,故D错误。
故选:B。
8.【解答】解:A.蒸发时不能蒸干,利用余热加热,出现大量固体时停止加热,故A错误;
B.分液时,平衡气压,则先把分液漏斗上口的玻璃塞打开,或使塞上的凹或小孔槽对准分液漏斗口上的小孔,以便与大气相通,故B正确;
C.倒置不漏水,然后将塞子旋转180°,再倒置一次,仍不漏水,可使用,故C错误;
D.萃取时不需要考虑密度,萃取剂不相溶,且不发生反应即可,故D错误;
故选:B。
9.【解答】解:A、氯气和氢氧化钠溶液在常温下反应时,歧化为+1价和﹣1价,故1mol氯气转移1mol电子,则0.1mol氯气转移0.1NA个电子,故A正确;
B、标况下22.4L氢气的物质的量为1mol,而氢气为双原子分子,故1mol氢气中含2NA个H原子,故B正确;
C、二氧化碳和氧气中均含2个氧原子,故NA个混合物分子中含氧原子为2NA个,与两者的比例无关,故C正确;
D、标况下苯为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误。
故选:D。
10.【解答】解:A、2Na+2H2O═2NaOH+H2↑中H元素的化合价降低作氧化剂,故A正确;
B、2Na2O2+2H2O═4NaOH+O2↑中,水中的各元素化合价不变,故B错误;
C、CuO+H2 Cu+H2O中水是生成物,故C错误;
D、Na2O+H2O═2NaOH中无元素化合价的变化,故D错误;
故选:A。
11.【解答】解:A.二氧化碳是非电解质,碳酸钠是电解质,故A错误;
B.硫酸钠是电解质,乙醇是非电解质,故B正确;
C.盐酸是HCl的水溶液,是混合物,既不是电解质也不是非电解质;甲烷在水溶液中和熔融状态下均不能导电,故是非电解质,故C错误;
D.蔗糖是非电解质,氢氧化钠是电解质,故D错误;
故选:B。
12.【解答】解:溶液中酚酞呈红色,该溶液呈碱性,溶液中存在大量氢氧根离子,K+、Na+、Ba2+都不与氢氧根离子反应,能够大量共存,Al3+与氢氧根离子反应,在溶液中不能大量共存,
故选:D。
13.【解答】解:n(Fe)mol=0.093mol,n(KNO3)0.025mol,亚铁离子被硝酸钾和氯气氧化,根据Cl2~2Fe2+,所以氯气氧化了0.018mol的亚铁离子,所以被硝酸钾氧化的亚铁离子是0.093mol﹣0.018mol=0.075mol,根据电子守恒,设KNO3的还原产物氮元素的化合价是x,则0.075(3﹣2)=0.025(5﹣x),解得x=2,故选B。
14.【解答】解:A.酸能使石蕊试液变红色,无色溶液使蓝色石蕊试纸变红,说明该溶液显酸性,故A正确;
B.焰色反应呈黄色的不一定是盐溶液,如可能是NaOH溶液,故B错误;
C.无色溶液加入Na2CO3溶液产生白色沉淀,该溶液可能是可溶性的钙盐、钡盐或Ba(OH)2等,故C错误;
D.无色溶液中加入氢氧化钠溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,则该溶液中含有铵根离子,故D错误;
故选:A。
15.【解答】解:粗盐的提纯中,为了保证杂质离子完全出去,每一次所加试剂都过量,加入NaOH溶液的目的是除去镁离子,加BaCl2溶液的目的是除去硫酸根离子,加Na2CO3溶液的目的是除去钙离子和过量的钡离子,由此可知,Na2CO3溶液的加入一定在BaCl2溶液之后,即①一定在③之后,为了不使产生的沉淀溶解,一定要在过滤后再加盐酸,即④在⑤之后,操作顺序可以为:②③①④⑤或③②①④⑤或③①②④⑤,只有B正确。
故选:B。
16.【解答】解:A.向偏铝酸钠溶液中通入少量的CO2气体,反应生成氢氧化铝沉淀和碳酸根离子,正确的离子方程式为:2CO2+3H2O=2Al(OH)3↓,故A错误;
B.向稀硫酸中滴加Na2S2O3溶液,离子方程式为:2H++S2═S↓+SO2↑+H2O,故B正确;
C.向新制氯水中滴加少量FeBr2溶液,离子方程式为:2Fe2++4Br﹣+3Cl2═2Fe3++2Br2+6Cl﹣,故C错误;
D.向NH4Cl溶液中加入小颗粒钠的离子反应为:2Na+2H2O+22NH3 H2O+2Na++H2↑,故D错误,
故选:B。
二.填空题(共5小题,满分46分)
17.【解答】解:Ⅰ.(1)硫酸氢钠为强电解质,水溶液中完全电离,电离方程式为:NaHSO4=Na++H+,
故答案为:NaHSO4=Na++H+;
(2)氢氧化钡为强电解质,水溶液中完全电离,电离方程式为:Ba(OH)2=Ba2++2OH﹣,
故答案为:Ba(OH)2=Ba2++2OH﹣;
Ⅱ.(3)钠与水反应生成氢氧化钠和氢气,离子方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,
故答案为:2Na+2H2O=2Na++2OH﹣+H2↑;
(4)二氧化碳少量反应生成碳酸钙和水,离子方程式为:Ca2++2OH﹣+CO2=CaCO3↓+H2O,
故答案为:Ca2++2OH﹣+CO2=CaCO3↓+H2O;
Ⅲ.(5)①乙醇为化合物,在水溶液中和熔融状态下不能导电,属于非电解质,没有自由电子,也没有自由移动的离子,不能导电;
②Na2CO3溶液是混合物,既不是电解质也不是非电解质,含自由移动的离子,能导电;
③NaOH固体是化合物,水溶液中或者熔融状态下能导电,属于电解质,没有自由电子,也没有自由移动的离子,不能导电;
④盐酸是混合物,既不是电解质也不是非电解质,含自由移动的离子,能导电;
⑤冰醋酸为化合物,水溶液中能导电,属于电解质;没有自由电子,也没有自由移动的离子,不能导电;
⑥石墨是单质,既不是电解质也不是非电解质,含自由电子,能导电;
上述状态下的物质中,能导电的有:②④⑥;属于电解质的有:③⑤,
故答案为:②④⑥;③⑤;
(6)H3PO2是一元弱酸,1个H3PO2只能电离出1个氢离子,则NaH2PO2属于正盐,H3PO2与足量NaOH溶液反应产生NaH2PO2、H2O,其反应的离子方程式为:H3PO2+OH﹣=H2H2O,
故答案为:正盐;H3PO2+OH﹣=H2H2O。
18.【解答】解:(1)硫酸钠为强电解质,水溶液中完全电离出钠离子和硫酸根离子,电离方程式为:Na2SO4=2Na+,
故答案为:Na2SO4=2Na+;
(2)钠在空气中氧化生成氧化钠,现象新切开的面呈银白色光泽,迅速变暗,
故答案为:新切开的面呈银白色光泽,迅速变暗;
(3)碳酸氢钠与氢氧化钠反应生成碳酸钠和水,离子方程式为:OH﹣H2O,
故答案为:OH﹣H2O;
(4)铁粉与水蒸气在高温下发生的反应中,化合价升高的元素是铁元素,Fe元素被氧化,失去电子,化合价降低元素是氢元素,得到电子,电子转移情况如下所示:,
故答案为:。
19.【解答】解:(1)2KMnO4K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,所以KMnO4即是氧化剂又是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol,电子转移情况如下:,
故答案为:;
(2)反应6Fe2++Cr214H+═6Fe3++2Cr3++7H2O中Cr元素化合价由+6价变为+3价被还原,氧化剂为Cr2,Fe元素化合价由+2价升为+3价被氧化,还原剂为Fe2+,Cr元素被还原,氧化产物是Fe3+;根据氧化剂的氧化性强于氧化产物可知,氧化性强弱为:Cr2Fe3+,
故答案为:Cr2;Fe2+;Cr;Fe3+;Cr2;Fe3+;
(3)①铜与硝酸银溶液反应生成硝酸铜和银,离子方程式为:Cu+2Ag+=2Ag+Cu2+,
故答案为:Cu+2Ag+=2Ag+Cu2+;
②Na和H2O反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,
故答案为:2Na+2H2O=2Na++2OH﹣+H2↑。
20.【解答】解:(1)在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,该反应中转移的电子数为2e﹣,电子转移的方向和数目为,所以还原剂是Zn,氧化剂是H2SO4,
故答案为:;H2SO4;Zn;
(2)Fe2O3+3CO2Fe+3CO2 的反应中,C元素的化合价升高,则该元素的原子失去电子,被氧化,为Fe元素化合价降低,反应中得到电子被还原,Fe2O3 发生了还原反应,CO发生氧化反应,该反应中3molCO参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为,氧化产物为CO2,还原产物为Fe,
故答案为:;CO2;Fe。
21.【解答】解:(1)根据分析可推出A为钠,B为氧气,甲为过氧化钠,乙为二氧化碳,丁为碳酸钠,丙为水,戊为氢氧化钠,C为氢气,其中属于酸性氧化物的是CO2,属于盐的是Na2CO3,
故答案为:CO2;Na2CO3;
(2)反应①为钠与氧气在加热条件下生成过氧化钠的过程,有元素化合价的升降,属于氧化还原反应;
反应②为过氧化钠与二氧化碳反应生成碳酸钠和氧气的过程,有元素化合价的升降,属于氧化还原反应;
反应③为过氧化钠与水反应生成氢氧化钠和氧气的过程,有元素化合价的升降,属于氧化还原反应;
反应④为氢氧化钠与二氧化碳反应生成碳酸钠和水的过程,没有元素化合价的升降,不属于氧化还原反应;
反应⑤为钠与水反应生成氢氧化钠和氢气的过程,有元素化合价的升降,属于氧化还原反应;
综上所述,反应④不属于氧化还原反应;反应⑤为置换反应;其离子方程式为2Na+2H2O=2Na++2OH﹣+H2↑,
故答案为:④;⑤;2Na+2H2O=2Na++2OH﹣+H2↑;
(3)碳酸氢钠的溶解度较低,所以向丁(Na2CO3)的饱和溶液中通入足量气体乙(CO2),会生成溶解度较小的碳酸氢钠,则可观察到的现象为产生白色沉淀(或析出白色晶体);反应的化学方程式为:Na2CO3+H2O+CO2=2NaHCO3↓,
故答案为:产生白色沉淀(或析出白色晶体);Na2CO3+H2O+CO2=2NaHCO3↓;
(4)当过量的过氧化钠吸收44g二氧化碳时固体质量增加28g,吸收18g水蒸气时固体质量增加2g,因此当过量的过氧化钠吸收44g二氧化碳和18g水蒸气时,固体质量增加28g+2g═30g,
故答案为:30。
三.计算题(共1小题,满分6分,每小题6分)
22.【解答】解:(1)电解饱和食盐水制氯气,反应生成氢氧化钠、氢气和氯气,反应的化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O2NaOH+H2↑+Cl2↑;
(2)电解饱和食盐水化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,n(Cl2)n(NaCl)1mol,标准状况下V(Cl2)=nVm=22.4L/mol×1mol=22.4L,
答:理论上最多可得到的氯气的体积22.4L。
第1页(共1页)
同课章节目录
