化学人教版(2019)必修第一册4.3.1离子键及离子化合物(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.1离子键及离子化合物(共18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 08:21:14 | ||
图片预览





文档简介
(共18张PPT)
第四章章 物质结构 元素周期律
第三节 共价键
课时1 离子键及离子化合物
课标解读 重点难点
1.通过氯化钠的形成过程,认识离子键的概念与形成,了解离子化合物的概念,会判断离子化合物。 2.会用电子式表示常见离子化合物的形成过程,促进“宏观辨识与微观探析”化学核心素养的发展。 1.离子键的概念与形成。
2.离子化合物的判断。
教学目标及重难点分析
贝采里乌斯提出了电化二元学说,为离子键理论的发展奠定了基础。
范霍夫提出了甲烷的四面体假说
路易斯提出了共价键电子对理论
探索微粒间结合方式的百年发展史
19世纪初
19世纪70年代
20世纪20年代
贝采里乌斯(瑞典)
范托夫(荷兰)
路易斯(美国)
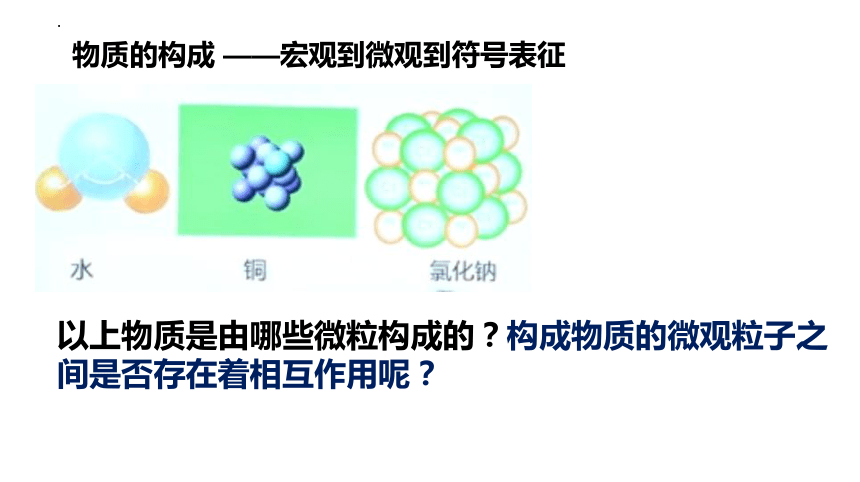
物质的构成 ——宏观到微观到符号表征
以上物质是由哪些微粒构成的?构成物质的微观粒子之间是否存在着相互作用呢?
问题:为什么水沸腾需要加热到100℃,而使水分解需要加热到2200℃以上?
液态水加热变成气态水是物理变化,由于温度升高,水分子间的距离增大,克服了分子间的作用力。分子间的作用力很弱。
水加热分解是化学变化,化学变化的本质分子断裂成原子,原子重新组合成新的分子,说明水分子中H和O之间存在强烈的相互作用,化学上把这种作用力称为化学键。
环节一 化学键及化学反应的实质
1. 定义:
物质内相邻的原子(或离子)间强烈的相互作用
2. 化学反应的实质:
旧化学键的断裂和新化学键的形成过程
(吸收能量) (释放能量)
环节一 化学键及化学反应的实质
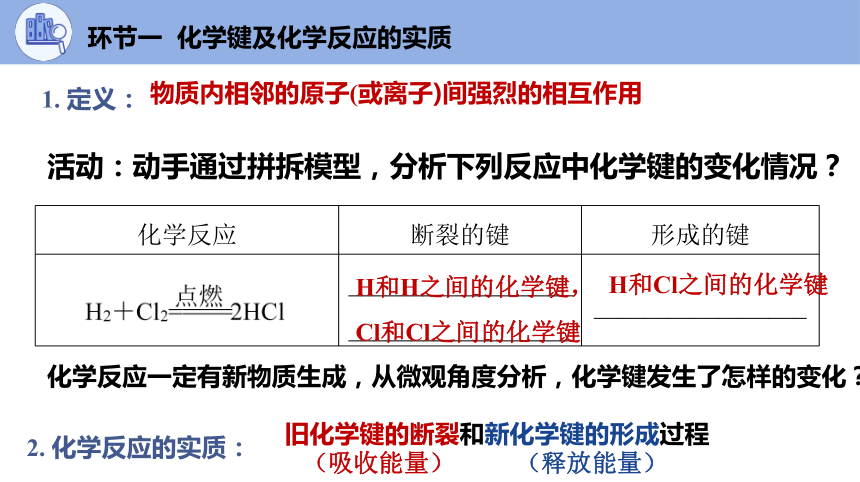
活动:动手通过拼拆模型,分析下列反应中化学键的变化情况?
化学反应 断裂的键 形成的键
__________________ __________________ _________________
H和H之间的化学键,Cl和Cl之间的化学键
H和Cl之间的化学键
化学反应一定有新物质生成,从微观角度分析,化学键发生了怎样的变化?
金属钠在氯气中燃烧能够生成氯化钠,氢气在氯气中燃烧能够生成氯化氢。那么,氯原子与钠原子是如何形成氯化钠的,氯原子与氢原子又是如何形成氯化氢的?二者的形成过程有什么不同,又为什么会有不同?
活动:拼摆小磁铁— 通过小磁铁摆出原子核外电子排布
环节二 离子键及离子化合物
NaCl晶体
NaCl晶体的空间结构模型
NaCl晶体由 与 构成
Na+
Cl-
问:请观察模型,NaCl晶体中Na+与Cl-的排列方式有什么特点?
Na+与Cl-之间存在怎样的相互作用?
Na+离子和Cl-离子间存在静电作用
(包括静电吸引与静电排斥)
1. 概念:
带相反电荷离子之间的相互作用。
2. 成键粒子:
阳离子和阴离子
3. 成键本质:
静电作用
5. 离子键成键的原因:
4.成键元素:
活泼金属与活泼非金属元素
(静电吸引和静电排斥的平衡)
H He
Li Be …… B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca Ga Ge As Se Br Kr
Rb Sr In Sn Sb Te I Xe
Cs Ba Tl Pb Bi Po At Rn
Fr Ra
原子间相互得失电子达到稳定结构,体系的总能量降低。
环节二 离子键及离子化合物
6.离子化合物 :
由离子键构成的化合物。
实例:KCl、MgCl2 、CaCl2
阴、阳离子均为简单离子
复杂离子:
NH4Cl:NH4+与Cl-
NaOH :Na+与OH-
KCl : K+与Cl-
MgCl2 : Mg2+与Cl-
CaCl2 :Ca2+与Cl-
MgSO4 :Mg2+与SO42-
环节二 离子键及离子化合物
练习1:现有下列物质:MgCl2 , CO2 , H2O , H2 , NaOH , Cl2 , NaF , CH4 , CaO , NH4Cl , Na2O2
(1)有离子键的是 。
(2)属于离子化合物是 。
2.离子化合物中一定有金属元素?
1. 判断一个物质中是否存在离子键的方法
①看组成元素 :由活泼金属元素与活泼非金属元素组成。
不一定,如铵盐(NH4Cl)
②看构成微粒 :由阴离子、阳离子构成,如所有铵盐。
MgCl2 ,NaOH ,NaF,CaO,Na2O2
MgCl2 NaOH ,NaF,CaO , Na2O2,NH4Cl
环节二 离子键及离子化合物
NaCl水溶液为何能导电?
NaCl属于离子化合物,离子化合物在水分子的作用下,离子键断裂,阴阳离子变得能自由移动而导电。
熔融状态NaCl为何能导电?
NaCl属于离子化合物,离子化合物在热的作用下,离子键断裂,阴阳离子变得能自由移动而导电。
如何证明离子化合物中离子键的存在?
通过熔融状态下的物质导电性实验
1. 定义:在元素符号周围用“ ”或“×”来表示原子的最外层 电子的式子。
2. 电子式的书写
(1)原子
书写原子的电子式时,一般将原子的最外层电子写在元素符号的上、下、左、右四个位置上。
H
Na
O
Cl
Mg
环节三 电子式的书写
(2)简单阳离子
复杂阳离子
Na+
Mg 2+
Al 3+
[ ]
H
H
H
N
H
+
直接用阳离子符号
(3)简单阴离子
复杂阴离子
[ ]
一般用 表示
R
n-
[ ]
Cl
-
[ ]
O
2-
[ ]
O
H
-
[ ]
O
2-
O
环节三 电子式的书写
AB型
AB2型
A2B型
[ ]
Cl
Na
[ ]
O
2
Na
Na
[ ]
Cl
Mg
2
[ ]
Cl
写出MgO电子式
写出Na2S电子式
写出BaCl2电子式
注意:相同离子不合并(尽量对称), 同性电荷不相邻
离子化合物电子式
环节三 电子式的书写
电子式表示离子化合物的形成过程
AB型
AB2型
A2B型
Na
Cl
+
[ ]
Cl
Na
[ ]
O
2
Na
Na
Na
O
+
Na
+
Mg
Cl
Cl
+
+
[ ]
Cl
Mg
2
[ ]
Cl
书写要点:
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
环节三 电子式的书写
学习小结
活泼金属原子
失去e-
阳离子
活泼非金属原子
得到e-
阴离子
静电作用
离子键
离子化合物
活泼的非金属元素(ⅥA,ⅦA)
活泼的金属元素(ⅠA,ⅡA)
电子式
在元素符号周围用小黑点 · (或×)来表示粒子最外层电子的式子。
形成 过程
学习小结
第四章章 物质结构 元素周期律
第三节 共价键
课时1 离子键及离子化合物
课标解读 重点难点
1.通过氯化钠的形成过程,认识离子键的概念与形成,了解离子化合物的概念,会判断离子化合物。 2.会用电子式表示常见离子化合物的形成过程,促进“宏观辨识与微观探析”化学核心素养的发展。 1.离子键的概念与形成。
2.离子化合物的判断。
教学目标及重难点分析
贝采里乌斯提出了电化二元学说,为离子键理论的发展奠定了基础。
范霍夫提出了甲烷的四面体假说
路易斯提出了共价键电子对理论
探索微粒间结合方式的百年发展史
19世纪初
19世纪70年代
20世纪20年代
贝采里乌斯(瑞典)
范托夫(荷兰)
路易斯(美国)
物质的构成 ——宏观到微观到符号表征
以上物质是由哪些微粒构成的?构成物质的微观粒子之间是否存在着相互作用呢?
问题:为什么水沸腾需要加热到100℃,而使水分解需要加热到2200℃以上?
液态水加热变成气态水是物理变化,由于温度升高,水分子间的距离增大,克服了分子间的作用力。分子间的作用力很弱。
水加热分解是化学变化,化学变化的本质分子断裂成原子,原子重新组合成新的分子,说明水分子中H和O之间存在强烈的相互作用,化学上把这种作用力称为化学键。
环节一 化学键及化学反应的实质
1. 定义:
物质内相邻的原子(或离子)间强烈的相互作用
2. 化学反应的实质:
旧化学键的断裂和新化学键的形成过程
(吸收能量) (释放能量)
环节一 化学键及化学反应的实质
活动:动手通过拼拆模型,分析下列反应中化学键的变化情况?
化学反应 断裂的键 形成的键
__________________ __________________ _________________
H和H之间的化学键,Cl和Cl之间的化学键
H和Cl之间的化学键
化学反应一定有新物质生成,从微观角度分析,化学键发生了怎样的变化?
金属钠在氯气中燃烧能够生成氯化钠,氢气在氯气中燃烧能够生成氯化氢。那么,氯原子与钠原子是如何形成氯化钠的,氯原子与氢原子又是如何形成氯化氢的?二者的形成过程有什么不同,又为什么会有不同?
活动:拼摆小磁铁— 通过小磁铁摆出原子核外电子排布
环节二 离子键及离子化合物
NaCl晶体
NaCl晶体的空间结构模型
NaCl晶体由 与 构成
Na+
Cl-
问:请观察模型,NaCl晶体中Na+与Cl-的排列方式有什么特点?
Na+与Cl-之间存在怎样的相互作用?
Na+离子和Cl-离子间存在静电作用
(包括静电吸引与静电排斥)
1. 概念:
带相反电荷离子之间的相互作用。
2. 成键粒子:
阳离子和阴离子
3. 成键本质:
静电作用
5. 离子键成键的原因:
4.成键元素:
活泼金属与活泼非金属元素
(静电吸引和静电排斥的平衡)
H He
Li Be …… B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca Ga Ge As Se Br Kr
Rb Sr In Sn Sb Te I Xe
Cs Ba Tl Pb Bi Po At Rn
Fr Ra
原子间相互得失电子达到稳定结构,体系的总能量降低。
环节二 离子键及离子化合物
6.离子化合物 :
由离子键构成的化合物。
实例:KCl、MgCl2 、CaCl2
阴、阳离子均为简单离子
复杂离子:
NH4Cl:NH4+与Cl-
NaOH :Na+与OH-
KCl : K+与Cl-
MgCl2 : Mg2+与Cl-
CaCl2 :Ca2+与Cl-
MgSO4 :Mg2+与SO42-
环节二 离子键及离子化合物
练习1:现有下列物质:MgCl2 , CO2 , H2O , H2 , NaOH , Cl2 , NaF , CH4 , CaO , NH4Cl , Na2O2
(1)有离子键的是 。
(2)属于离子化合物是 。
2.离子化合物中一定有金属元素?
1. 判断一个物质中是否存在离子键的方法
①看组成元素 :由活泼金属元素与活泼非金属元素组成。
不一定,如铵盐(NH4Cl)
②看构成微粒 :由阴离子、阳离子构成,如所有铵盐。
MgCl2 ,NaOH ,NaF,CaO,Na2O2
MgCl2 NaOH ,NaF,CaO , Na2O2,NH4Cl
环节二 离子键及离子化合物
NaCl水溶液为何能导电?
NaCl属于离子化合物,离子化合物在水分子的作用下,离子键断裂,阴阳离子变得能自由移动而导电。
熔融状态NaCl为何能导电?
NaCl属于离子化合物,离子化合物在热的作用下,离子键断裂,阴阳离子变得能自由移动而导电。
如何证明离子化合物中离子键的存在?
通过熔融状态下的物质导电性实验
1. 定义:在元素符号周围用“ ”或“×”来表示原子的最外层 电子的式子。
2. 电子式的书写
(1)原子
书写原子的电子式时,一般将原子的最外层电子写在元素符号的上、下、左、右四个位置上。
H
Na
O
Cl
Mg
环节三 电子式的书写
(2)简单阳离子
复杂阳离子
Na+
Mg 2+
Al 3+
[ ]
H
H
H
N
H
+
直接用阳离子符号
(3)简单阴离子
复杂阴离子
[ ]
一般用 表示
R
n-
[ ]
Cl
-
[ ]
O
2-
[ ]
O
H
-
[ ]
O
2-
O
环节三 电子式的书写
AB型
AB2型
A2B型
[ ]
Cl
Na
[ ]
O
2
Na
Na
[ ]
Cl
Mg
2
[ ]
Cl
写出MgO电子式
写出Na2S电子式
写出BaCl2电子式
注意:相同离子不合并(尽量对称), 同性电荷不相邻
离子化合物电子式
环节三 电子式的书写
电子式表示离子化合物的形成过程
AB型
AB2型
A2B型
Na
Cl
+
[ ]
Cl
Na
[ ]
O
2
Na
Na
Na
O
+
Na
+
Mg
Cl
Cl
+
+
[ ]
Cl
Mg
2
[ ]
Cl
书写要点:
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
环节三 电子式的书写
学习小结
活泼金属原子
失去e-
阳离子
活泼非金属原子
得到e-
阴离子
静电作用
离子键
离子化合物
活泼的非金属元素(ⅥA,ⅦA)
活泼的金属元素(ⅠA,ⅡA)
电子式
在元素符号周围用小黑点 · (或×)来表示粒子最外层电子的式子。
形成 过程
学习小结
