河南省濮阳市重点中学2023-2024学年高二上学期第二次质量检测化学考试卷(PDF含答案)
文档属性
| 名称 | 河南省濮阳市重点中学2023-2024学年高二上学期第二次质量检测化学考试卷(PDF含答案) |  | |
| 格式 | |||
| 文件大小 | 488.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 09:17:29 | ||
图片预览




文档简介
濮阳市一高 2022 级高二上学期第二次质量检测
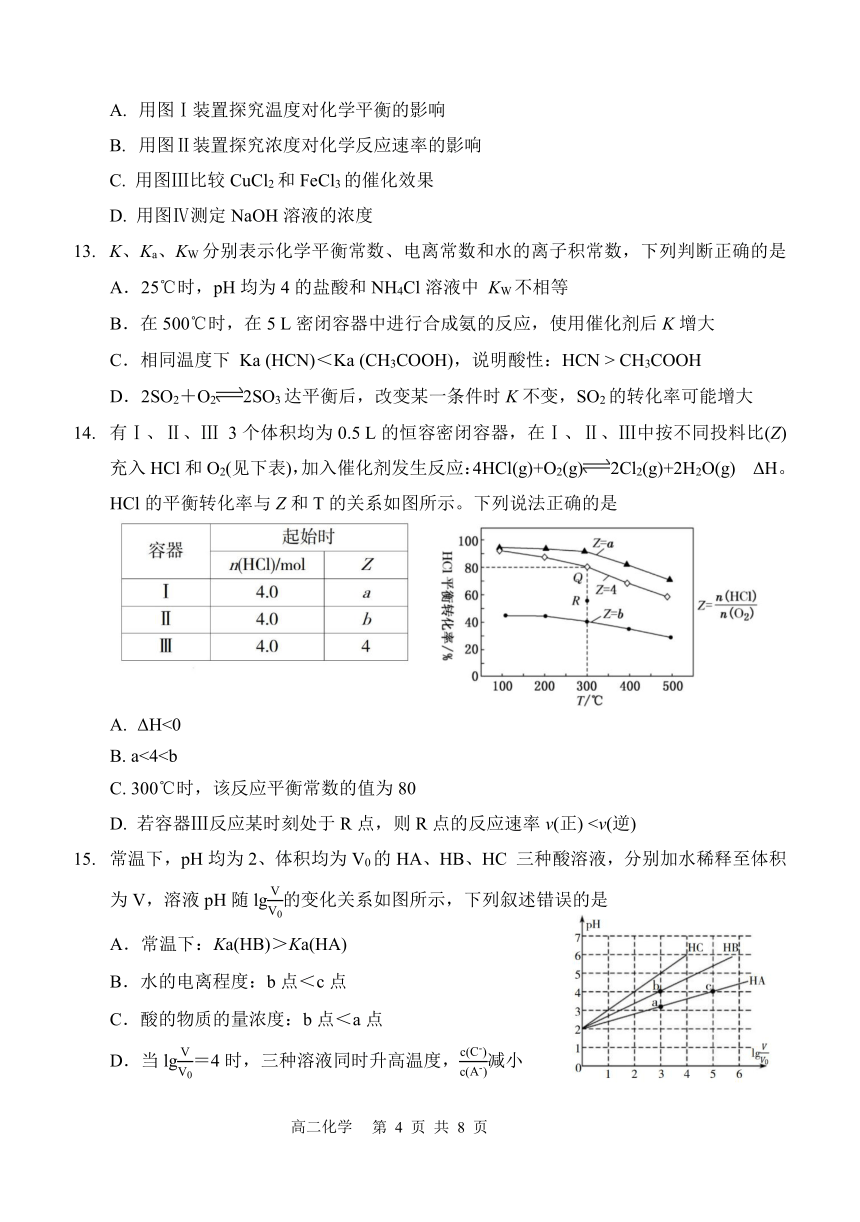
化学试题
注意事项:
1.本试卷总分 100分,考试时间 75分钟。
2.答题前将答题卡上的项目填涂清楚。
3.答题时,请用 0.5毫米黑色签字笔直接把答案写在答题卡上对应的答题区域,超.出.答.题.区.
域.书.写.的.答.案.无.效.,.在.试.卷.、.草.稿.纸.上.作.答.无.效.。
可能用到的相对原子质量: H-1、C-12、O-16
第Ⅰ卷(共 50 分)
一、 单项选择题(本题包括 10 小题。每小题 3 分,共 30 分。每小题只有一个正确选项。)
1. 化学与生活、生产密切相关,下列说法中错误的是
A. 汽车尾气净化器通常使用贵金属为催化剂,提高有害气体的平衡转化率
B. CO中毒应将中毒者移至空气流通处,必要时放入高压氧仓
C. 液氧甲烷火箭朱雀二号成功发射时,能量的转化形式为化学能→热能→机械能
D. 利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济”
2. 下列说法正确的是
A. 软脂酸(CH3(CH2)14COOH)燃烧热的热化学方程式为:
CH3(CH2)14COOH(s)+23O2(g)=16CO2(g)+16H2O(g) ΔH=-9273 kJ·mol-1
B. 2CO(g)+O2(g)=2CO2(g)和 CO(g)+1/2O2(g)=CO2(g) 两个反应的ΔH相同
C. I2(g)+H2(g)=2HI(g) ΔH=-9.48 kJ·mol-1;则 1mol I2(g)和 1mol H2(g)的总能量低于 2mol
HI(g)的能量
D. 化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因
3. 为了维持正常的生理活动,人体各种体液的 pH 都要保持在一定的范围。血浆中
H CO /HCO —“ 2 3 3 ”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系可用如下平衡
表示:H+(aq)+HCO3-(aq) H2CO3(aq) CO2(g)+H2O(l),下列说法不正确的是
A. NaHCO3属于强电解质,H2CO3属于弱电解质
B. NaHCO3属于酸式盐,NaHCO3溶液呈酸性
C. 当体系中增加少量强酸时,平衡向正反应方向移动而消耗 H+
D. —当体系中增加少量强碱时,平衡向逆反应方向移动而消耗 OH
高二化学 第 1 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
4. 大气中的臭氧层能有效阻挡紫外线。臭氧层中 O3分解过程如图所示,下列说法正确的
是
A.催化反应①、②和总反应均是放热反应 ①
B.决定 O3分解反应速率的是催化反应② ②
C.E1是催化反应①正反应的活化能
D.Cl是反应的催化剂,改变了反应历程,降低了ΔH
5. 关于工业合成氨反应:N2(g)+3H2(g) 2NH3(g)。下列叙述错误的是
A. 在合成氨中,v 正(NH3):v 正(H2)=2:3
B. 在恒温恒容下 1mol N2和 1mol H2制 NH3,当 N2体积分数不变时达到平衡
C. 在恒温恒压下合成氨,平衡后通入少量氩气,N2的平衡转化率不变
D. 在恒温恒容下合成氨,平衡后通入少量氨气,逆反应速率增大且大于正反应速率
6. 下列措施或现象不能用勒夏特列原理解释的是
A.2SO2(g)+O2(g) 2SO3(g),高压比常压有利于合成 SO3
B.向氯水中加入 AgNO3溶液后,溶液颜色变浅
C.锌与稀硫酸反应,加入少量硫酸铜反应速率加快
D.将混合气体中的氨液化有利于合成氨反应
7. 设 NA为阿伏加德罗常数的值。下列说法正确的是
A.2 L 0.5mol/L氨水中含有的 NH4+的数目为 NA
B.常温下,1 L纯水中含有的离子数目约为 2×10-7 NA
C.1 L 0.1mol/LAl2(SO4)3溶液中含有的阴离子总数为 0.3 NA
D.1 L pH=2的稀硫酸中含有 H+的数目为 0.02 NA
8. 某学生通过测定反应过程中所放出的热量来计算中和反应的反应热。下列说法正确的
是
A. 所用实验装置如右图所示
B. 为减小实验误差,将 NaOH溶液分多次缓慢加入酸溶液中
C. 本实验中,读取混合溶液不再变化的温度为终止温度
第 9题 A项图
D. 测量盐酸的温度后,温度计没有冲洗干净,去测 NaOH溶液的温度,会使测定反应
热偏高
高二化学 第 2 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
9. “水是生命之源”,科学家连续在木星、卫星和月球上都找到了水的痕迹。下列与水
相关的说法正确的是
A. 100℃时,纯水的 pH=7
B. 温度升高,纯水中 c(H+)增大, c(OH-)减小
C. 在任何温度下,纯水都呈中性
D. 向纯水中加酸或碱均能抑制水的电离,使水的离子积减小
10. N2O是一种强温室气体,且易形成颗粒性污染物,研究 N2O的分解对环境保护有重要
意义。碘蒸气的存在能大幅度提高 N2O的分解速率,反应历程如下:
第一步 I2(g)→2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时 N2O的分解速率方程 v=k·c(N2O)·c0.5(I2)(k 为速率常数)。下列表述正
确的是
A.IO为反应的中间产物 B.第一步对总反应速率起决定作用
C.I2浓度与 N2O分解速率无关 D.第二步活化能比第三步小
二、不定项选择题(本题包括 5小题。每小题 4分,共 20分。每小题有一个或两个选项符
合题目 要求,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。)
11. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(OH—)/c(H+)=1×10-13 — —的溶液中:NO3 、SO42 、Na+、Fe2+
B.由水电离出的 c(H+)=1×10-13mol/L — — —的溶液中:NH4+、NO3 、Cl 、HCO3
C pH=1 Mg2+ NO — —. 的溶液中: 、 3 、Cl 、Fe3+
D — —.某无色溶液中:Na+、Cr2O72 、SO42 、K+
12. 下列实验装置或操作不能达到实验目的的是
标准盐酸溶液
待测 NaOH溶液
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
高二化学 第 3 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
A. 用图Ⅰ装置探究温度对化学平衡的影响
B. 用图Ⅱ装置探究浓度对化学反应速率的影响
C. 用图Ⅲ比较 CuCl2和 FeCl3的催化效果
D. 用图Ⅳ测定 NaOH溶液的浓度
13. K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是
A.25℃时,pH均为 4的盐酸和 NH4Cl溶液中 KW不相等
B.在 500℃时,在 5 L密闭容器中进行合成氨的反应,使用催化剂后 K 增大
C.相同温度下 Ka (HCN)<Ka (CH3COOH),说明酸性:HCN > CH3COOH
D.2SO2+O2 2SO3达平衡后,改变某一条件时 K 不变,SO2的转化率可能增大
14. 有Ⅰ、Ⅱ、Ⅲ 3 个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)
充入 HCl和 O2(见下表),加入催化剂发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH。
HCl的平衡转化率与 Z 和 T的关系如图所示。下列说法正确的是
A. ΔH<0
B. a<4C. 300℃时,该反应平衡常数的值为 80
D. 若容器Ⅲ反应某时刻处于 R点,则 R点的反应速率 v(正)15. 常温下,pH均为 2、体积均为 V0的 HA、HB、HC 三种酸溶液,分别加水稀释至体积
V V为 ,溶液 pH随 lg 的变化关系如图所示,下列叙述错误的是
V0
A.常温下:Ka(HB)>Ka(HA)
B.水的电离程度:b点<c点
C.酸的物质的量浓度:b点<a点
-
D V c(C ).当 lg =4时,三种溶液同时升高温度, - 减小V0 c(A )
高二化学 第 4 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
第Ⅱ卷(共 50 分)
三、非选择题(本题包括 4小题,共 50分。)
16. (6分) 磷及其化合物应用广泛,磷元素有白磷、红磷、黑磷等单质。
(1)一定条件下,红磷在氯气中燃烧的产物有两种(PCl3和 PCl5),反应过程中的能量
变化关系如图所示。回答下列问题:
写出固态红磷在一定量的 Cl2中完全燃烧生成气态物质(PCl3)的热化学方程式:
________________________________________________。(ΔH用图中字母表示)
(2)白磷(P4)在 O2中燃烧有如下转化关系。
其中ΔH 2= (用含ΔH 1和ΔH 3的代数式表示)。
(3)已知:P4 (s,白磷)=P (s,黑磷) ΔH=-39.3 kJ·mol-1;
P4 (s,白磷)=P (s,红磷) ΔH=-17.6 kJ·mol-1 ;
由此推知,其中最稳定的磷单质是 (填“白磷”、“黑磷”或“红磷”)。
17. (18分)汽车尾气处理系统的催化转化器中发生的主要反应为:
2NO(g)+2CO(g) 2CO2(g)+N2(g) △H。回答下列与该反应有关的问题。
(1)在恒温恒容的密闭容器内充入一定量的 NO 和 CO,发生上述反应。下列能说
明反应达到平衡状态的是____________(填字母序号)。
A.容器内气体的密度不再改变
B.容器内气体的平均摩尔质量不再改变
C.容器内气体的压强不再改变
D.ν(NO)∶ν(CO)∶ν(CO2)=1∶1∶1
高二化学 第 5 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
(2)向甲、乙两个恒温、恒容(体积均为 2 L)的密闭容器内分别加入相同物质的量
的NO和CO,在不同时刻测得两容器内NO的物质的量随时间的变化情况如下表:
时间/min 0 40 80 120 160
甲容器恒温为 T1℃ n(NO)/mol 4.00 3.00 2.20 1.60 1.60
乙容器恒温为 T2℃ n(NO)/mol 4.00 2.90 2.00 2.00 2.00
1 甲容器中 0~120 min内,用 N -2表示的平均反应速率ν(N2)=___mol·L 1·min-1。
②T1 ____T2,该反应的△H______ 0。(填“>”、“<”或“=”)。
③该反应能够自发进行的条件是______(填“低温”“高温”或“任何温度”)。
④T2℃时,该反应的平衡常数 K=_______L/mol。
(3)T℃时,在密闭容器内充入一定量的 NO和 CO,发生上述反应,测得ν(正)=k1·c
2 (NO)·c 2 (CO)、ν(逆)=k2·c(N2)·c 2 (CO2)(k1、k2为速率常数)。NO的平衡转化
率与温度、压强的关系如下图所示。
1 压强 P1、P2、P3由小到大的顺序是_______,理由是_______________________。
2 该反应的平衡常数 K=_____________(用 k1、k2表示)。
3 达到平衡后,压缩容器体积,在达到新的平衡之前,ν(正)______ ν(逆)(填“>”、
“<”或“=”)。
18. (16 分)某化学兴趣小组用 0.1000 mol/L NaOH 标准溶液滴定食用白醋,测定白醋中醋
酸(CH3COOH)的含量(g/100 mL),并判断白醋的等级。已知:
级别 优质醋 一级醋 二级醋
醋酸含量(g/100 mL) >6.0 >4.5 >3.5
高二化学 第 6 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
(1)取 100 mL 白醋样品溶于水,加水稀释配成 1000 mL 溶液。准确量取 25.00 mL
所配白醋溶液放入锥形瓶中,滴加 2~3 滴酚酞作指示剂。下列仪器可用于准确
量取白醋溶液的是________。
A. 酸式滴定管 B. 碱式滴定管 C. 量筒 D. 容量瓶
(2)滴定管在使用之前应进行的操作是___________,洗涤,润洗。滴定管盛装好
NaOH溶液后排气泡,下列排气泡操作正确的是___________。
(3)若用 50 mL的滴定管进行实验,当滴定管中的凹液面最低处在刻度“15”处时,
则管内液体的体积____________(填标号)。
A.=15 mL B. =35 mL C. <15 mL D. >35 mL
(4)判断达到滴定终点的方法是_____________________________________。
(5)某同学一共进行了三次实验,实验数据如下:
实验次数 量取稀释后白醋体积(mL)消耗标准 NaOH溶液体积(mL)
1 25.00 17.95
2 25.00 18.95
3 25.00 18.05
数据处理:消耗标准 NaOH 溶液的体积= mL。通过计算可知该白醋中
醋酸的含量为_______ g/100mL (保留两位有效数字),该白醋的级别为_______。
(6)下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是 。
A. 碱式滴定管未用标准 NaOH 溶液润洗就直接注入标准 NaOH溶液
B. 滴定过程中振荡时有液滴溅出
C. 滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
D. 读取 NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
高二化学 第 7 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
19. (10分)查阅资料获得 25℃时部分弱电解质的电离平衡常数数据:
化学式 HF HClO CH3COOH HNO2 NH3·H2O
- - -
电离常数 Ka=6.8×10 4 Ka=4.7×10 8 Ka=2.0×10 5 Ka=5.6×10-4 Kb=2.0×10-5
回答下列问题:
(1)HNO2的电离方程式为________________________________________。
(2)物质的量浓度相同的 HF、HClO、CH3COOH、HNO2中,c(H+)由大到小的顺序
是_______________________________________。
(3)常温下,0.1 mol·L-1的氨水的 pH 约为________________(lg2=0.3)。
(4)常温下,NH4F 的水溶液的 pH ____________7(填“>”、“<”或“=”)。
(5)常温下,在 pH=3的 CH3COOH溶液中,水电离出来的 c(H+)为_______mol/L。
高二化学 第 8 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
濮阳市一高 2022 级高二上学期第二次质量检测
化学试题答案
2023.10
一、 选择题(本小题共 10小题,每题 3分,共 30分。每小题只有一个正确选项。)
题号 1 2 3 4 5 6 7 8 9 10
答案 A D B C C C B D C A
二、选择题(本题包括 5小题。每小题 4分,共 20分。每小题有一个或两个选项符合题目
要求,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。)
题号 11 12 13 14 15
答案 C B D AB B
三、非选择题(本小题共 4小题,共 50分。)
16. (每空 2分,共 6分)
⑴ 2P(s)+3Cl2(g)=2PCl3(g) ΔH= -(c-b) kJ·mol-1
(或 P(s)+3/2Cl2(g)=PCl3(g) ΔH= -(c-b) /2kJ·mol-1 等其他合理答案)
⑵ ΔH3-ΔH1 ⑶黑磷
17. (除标注外,每空 2分,共 18分)
⑴ BC(少选得 1 分,多选错选得 0 分)
⑵ ①5×10-3(或 0.005) ②<(1 分) < ③低温 ④0.5
⑶ ①P3<P2<P1 (1 分) 该反应为气体分子数减小的反应,增大压强,平衡正向移动,
NO的平衡转化率增大 ②k1 /k2 ③>
18. (除标注外,每空 2分,共 16分)
⑴ A
⑵ 检查滴定管是否漏水(或检漏) c
⑶ D(1 分)
⑷ 滴入最后半滴 NaOH标准溶液后,溶液由无色变为粉红色,且半分钟内不褪色
⑸ 18.00(1 分) 4.3 二级醋
⑹ BD
19. (除标注外,每空 2分,共 10分)
(1) HNO2 H++NO2- (2) HF >HNO2 >CH3COOH>HClO
(3) 11.15 (或 11.2) (4) < (5)10-11
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
1. A. 催化剂能够同等程度地改变正反应速率与逆反应速率,因此,它对化学平衡移动没影响。
2. A. 燃烧热指可燃物中的氢元素变为 H2O(l)。
B. ΔH 必须与化学方程式一一对应。
C. 总能量高于。
D. 教材第 7 页。
3. 教材第 65 页,资料卡片。B. NaHCO3溶液显碱性。
4. A. ①为吸热反应。
B. 活化能大的为决速步,应为反应①。
C.教材第 26 页,图 2-3。
D.教材第 27 页,催化剂之所以改变化学反应速率,是因为它能能改变化学反应历程,改变
反应活化能。
5. C. 通入氩气,体积变大,反应物质浓度均减小,相当于减小压强,平衡逆向移动,N2的转
化率降低。
6. 教材第 38 页,勒夏特列原理内容。C.是形成了原电池,加快反应速率。
7. A. 一水合氨不能完全电离,数目小于 NA。
B. 教材第 62 页。
C. 考虑水电离的氢氧根。
D. pH=2,c(H+)=0.01mol/L,H+数目 0.01 NA。
8. 教材第 5 页。D. 接触立即反应,造成起始温度偏高。
9. A. C 升温促进水电离,c(H+)、c(OH—)均增大,pH 减小。
B. 水电离的 c(H+)和 c(OH—)相等,所以纯水在任何温度下一定是中性。
D. 水的离子积,只受温度影响。
10. B. 慢反应为决速步。
C. 由信息 N2O 的分解速率方程 v=k·c(N
0.5
2O)·c (I2)可知,I2的浓度与 N2O 分解速率有关。
D. 快反应的活化能小。
11. A. 此溶液为酸性溶液,酸性条件下,NO -3 氧化 Fe
2+。
B. 该溶液可能为酸溶液,也可能为碱溶液。酸性条件下,HCO -3 不能大量共存,碱性条件下,
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
HCO -3 和 NH
+
4 均不能大量共存。
D. Cr2O
2-
7 橙色。
12. C. 不是单一变量,还存在接触面积的不同。
13. A. 水的离子积,只受温度影响。
B . K 只受温度影响。
C. 教材第 58 页。电离常数越大,弱电解质越易电离,酸性越强。
D. 增加 O2浓度,SO2转化率增大,但是 K 不变。
14. A. 观察温度-转化率图像,温度升高,HCl 转化率减小,说明平衡逆向移动,逆反应吸热。
B. Z 越小,说明 O2浓度大,HCl 的转化率大,因此 a<4C. 根据温度-转化率图像信息,可知 HCl 的转化率为 80%,列三段式,求得 K=40
D. 容器Ⅲ处于 R 点时,HCl 的转化率小于平衡时,所以反应正向进行,v(正) >v(逆)。
15. A. 观察图像变化趋势可知酸性:HC>HB>HA
B. b 点和 c 点氢离子浓度相同,对水的抑制程度相同。
C. HA 酸性比 HB 的弱,所以相同 pH 时,c(HA)远大于 c(HB),所以 b 点<a 点
D. HC 是强酸,电离不受温度影响,c(C—)不变;HA 是弱酸,升温促进电离,c(A—)增大;所
以比值减小。
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
化学试题
注意事项:
1.本试卷总分 100分,考试时间 75分钟。
2.答题前将答题卡上的项目填涂清楚。
3.答题时,请用 0.5毫米黑色签字笔直接把答案写在答题卡上对应的答题区域,超.出.答.题.区.
域.书.写.的.答.案.无.效.,.在.试.卷.、.草.稿.纸.上.作.答.无.效.。
可能用到的相对原子质量: H-1、C-12、O-16
第Ⅰ卷(共 50 分)
一、 单项选择题(本题包括 10 小题。每小题 3 分,共 30 分。每小题只有一个正确选项。)
1. 化学与生活、生产密切相关,下列说法中错误的是
A. 汽车尾气净化器通常使用贵金属为催化剂,提高有害气体的平衡转化率
B. CO中毒应将中毒者移至空气流通处,必要时放入高压氧仓
C. 液氧甲烷火箭朱雀二号成功发射时,能量的转化形式为化学能→热能→机械能
D. 利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济”
2. 下列说法正确的是
A. 软脂酸(CH3(CH2)14COOH)燃烧热的热化学方程式为:
CH3(CH2)14COOH(s)+23O2(g)=16CO2(g)+16H2O(g) ΔH=-9273 kJ·mol-1
B. 2CO(g)+O2(g)=2CO2(g)和 CO(g)+1/2O2(g)=CO2(g) 两个反应的ΔH相同
C. I2(g)+H2(g)=2HI(g) ΔH=-9.48 kJ·mol-1;则 1mol I2(g)和 1mol H2(g)的总能量低于 2mol
HI(g)的能量
D. 化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因
3. 为了维持正常的生理活动,人体各种体液的 pH 都要保持在一定的范围。血浆中
H CO /HCO —“ 2 3 3 ”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系可用如下平衡
表示:H+(aq)+HCO3-(aq) H2CO3(aq) CO2(g)+H2O(l),下列说法不正确的是
A. NaHCO3属于强电解质,H2CO3属于弱电解质
B. NaHCO3属于酸式盐,NaHCO3溶液呈酸性
C. 当体系中增加少量强酸时,平衡向正反应方向移动而消耗 H+
D. —当体系中增加少量强碱时,平衡向逆反应方向移动而消耗 OH
高二化学 第 1 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
4. 大气中的臭氧层能有效阻挡紫外线。臭氧层中 O3分解过程如图所示,下列说法正确的
是
A.催化反应①、②和总反应均是放热反应 ①
B.决定 O3分解反应速率的是催化反应② ②
C.E1是催化反应①正反应的活化能
D.Cl是反应的催化剂,改变了反应历程,降低了ΔH
5. 关于工业合成氨反应:N2(g)+3H2(g) 2NH3(g)。下列叙述错误的是
A. 在合成氨中,v 正(NH3):v 正(H2)=2:3
B. 在恒温恒容下 1mol N2和 1mol H2制 NH3,当 N2体积分数不变时达到平衡
C. 在恒温恒压下合成氨,平衡后通入少量氩气,N2的平衡转化率不变
D. 在恒温恒容下合成氨,平衡后通入少量氨气,逆反应速率增大且大于正反应速率
6. 下列措施或现象不能用勒夏特列原理解释的是
A.2SO2(g)+O2(g) 2SO3(g),高压比常压有利于合成 SO3
B.向氯水中加入 AgNO3溶液后,溶液颜色变浅
C.锌与稀硫酸反应,加入少量硫酸铜反应速率加快
D.将混合气体中的氨液化有利于合成氨反应
7. 设 NA为阿伏加德罗常数的值。下列说法正确的是
A.2 L 0.5mol/L氨水中含有的 NH4+的数目为 NA
B.常温下,1 L纯水中含有的离子数目约为 2×10-7 NA
C.1 L 0.1mol/LAl2(SO4)3溶液中含有的阴离子总数为 0.3 NA
D.1 L pH=2的稀硫酸中含有 H+的数目为 0.02 NA
8. 某学生通过测定反应过程中所放出的热量来计算中和反应的反应热。下列说法正确的
是
A. 所用实验装置如右图所示
B. 为减小实验误差,将 NaOH溶液分多次缓慢加入酸溶液中
C. 本实验中,读取混合溶液不再变化的温度为终止温度
第 9题 A项图
D. 测量盐酸的温度后,温度计没有冲洗干净,去测 NaOH溶液的温度,会使测定反应
热偏高
高二化学 第 2 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
9. “水是生命之源”,科学家连续在木星、卫星和月球上都找到了水的痕迹。下列与水
相关的说法正确的是
A. 100℃时,纯水的 pH=7
B. 温度升高,纯水中 c(H+)增大, c(OH-)减小
C. 在任何温度下,纯水都呈中性
D. 向纯水中加酸或碱均能抑制水的电离,使水的离子积减小
10. N2O是一种强温室气体,且易形成颗粒性污染物,研究 N2O的分解对环境保护有重要
意义。碘蒸气的存在能大幅度提高 N2O的分解速率,反应历程如下:
第一步 I2(g)→2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时 N2O的分解速率方程 v=k·c(N2O)·c0.5(I2)(k 为速率常数)。下列表述正
确的是
A.IO为反应的中间产物 B.第一步对总反应速率起决定作用
C.I2浓度与 N2O分解速率无关 D.第二步活化能比第三步小
二、不定项选择题(本题包括 5小题。每小题 4分,共 20分。每小题有一个或两个选项符
合题目 要求,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。)
11. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(OH—)/c(H+)=1×10-13 — —的溶液中:NO3 、SO42 、Na+、Fe2+
B.由水电离出的 c(H+)=1×10-13mol/L — — —的溶液中:NH4+、NO3 、Cl 、HCO3
C pH=1 Mg2+ NO — —. 的溶液中: 、 3 、Cl 、Fe3+
D — —.某无色溶液中:Na+、Cr2O72 、SO42 、K+
12. 下列实验装置或操作不能达到实验目的的是
标准盐酸溶液
待测 NaOH溶液
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
高二化学 第 3 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
A. 用图Ⅰ装置探究温度对化学平衡的影响
B. 用图Ⅱ装置探究浓度对化学反应速率的影响
C. 用图Ⅲ比较 CuCl2和 FeCl3的催化效果
D. 用图Ⅳ测定 NaOH溶液的浓度
13. K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是
A.25℃时,pH均为 4的盐酸和 NH4Cl溶液中 KW不相等
B.在 500℃时,在 5 L密闭容器中进行合成氨的反应,使用催化剂后 K 增大
C.相同温度下 Ka (HCN)<Ka (CH3COOH),说明酸性:HCN > CH3COOH
D.2SO2+O2 2SO3达平衡后,改变某一条件时 K 不变,SO2的转化率可能增大
14. 有Ⅰ、Ⅱ、Ⅲ 3 个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)
充入 HCl和 O2(见下表),加入催化剂发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH。
HCl的平衡转化率与 Z 和 T的关系如图所示。下列说法正确的是
A. ΔH<0
B. a<4
D. 若容器Ⅲ反应某时刻处于 R点,则 R点的反应速率 v(正)
V V为 ,溶液 pH随 lg 的变化关系如图所示,下列叙述错误的是
V0
A.常温下:Ka(HB)>Ka(HA)
B.水的电离程度:b点<c点
C.酸的物质的量浓度:b点<a点
-
D V c(C ).当 lg =4时,三种溶液同时升高温度, - 减小V0 c(A )
高二化学 第 4 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
第Ⅱ卷(共 50 分)
三、非选择题(本题包括 4小题,共 50分。)
16. (6分) 磷及其化合物应用广泛,磷元素有白磷、红磷、黑磷等单质。
(1)一定条件下,红磷在氯气中燃烧的产物有两种(PCl3和 PCl5),反应过程中的能量
变化关系如图所示。回答下列问题:
写出固态红磷在一定量的 Cl2中完全燃烧生成气态物质(PCl3)的热化学方程式:
________________________________________________。(ΔH用图中字母表示)
(2)白磷(P4)在 O2中燃烧有如下转化关系。
其中ΔH 2= (用含ΔH 1和ΔH 3的代数式表示)。
(3)已知:P4 (s,白磷)=P (s,黑磷) ΔH=-39.3 kJ·mol-1;
P4 (s,白磷)=P (s,红磷) ΔH=-17.6 kJ·mol-1 ;
由此推知,其中最稳定的磷单质是 (填“白磷”、“黑磷”或“红磷”)。
17. (18分)汽车尾气处理系统的催化转化器中发生的主要反应为:
2NO(g)+2CO(g) 2CO2(g)+N2(g) △H。回答下列与该反应有关的问题。
(1)在恒温恒容的密闭容器内充入一定量的 NO 和 CO,发生上述反应。下列能说
明反应达到平衡状态的是____________(填字母序号)。
A.容器内气体的密度不再改变
B.容器内气体的平均摩尔质量不再改变
C.容器内气体的压强不再改变
D.ν(NO)∶ν(CO)∶ν(CO2)=1∶1∶1
高二化学 第 5 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
(2)向甲、乙两个恒温、恒容(体积均为 2 L)的密闭容器内分别加入相同物质的量
的NO和CO,在不同时刻测得两容器内NO的物质的量随时间的变化情况如下表:
时间/min 0 40 80 120 160
甲容器恒温为 T1℃ n(NO)/mol 4.00 3.00 2.20 1.60 1.60
乙容器恒温为 T2℃ n(NO)/mol 4.00 2.90 2.00 2.00 2.00
1 甲容器中 0~120 min内,用 N -2表示的平均反应速率ν(N2)=___mol·L 1·min-1。
②T1 ____T2,该反应的△H______ 0。(填“>”、“<”或“=”)。
③该反应能够自发进行的条件是______(填“低温”“高温”或“任何温度”)。
④T2℃时,该反应的平衡常数 K=_______L/mol。
(3)T℃时,在密闭容器内充入一定量的 NO和 CO,发生上述反应,测得ν(正)=k1·c
2 (NO)·c 2 (CO)、ν(逆)=k2·c(N2)·c 2 (CO2)(k1、k2为速率常数)。NO的平衡转化
率与温度、压强的关系如下图所示。
1 压强 P1、P2、P3由小到大的顺序是_______,理由是_______________________。
2 该反应的平衡常数 K=_____________(用 k1、k2表示)。
3 达到平衡后,压缩容器体积,在达到新的平衡之前,ν(正)______ ν(逆)(填“>”、
“<”或“=”)。
18. (16 分)某化学兴趣小组用 0.1000 mol/L NaOH 标准溶液滴定食用白醋,测定白醋中醋
酸(CH3COOH)的含量(g/100 mL),并判断白醋的等级。已知:
级别 优质醋 一级醋 二级醋
醋酸含量(g/100 mL) >6.0 >4.5 >3.5
高二化学 第 6 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
(1)取 100 mL 白醋样品溶于水,加水稀释配成 1000 mL 溶液。准确量取 25.00 mL
所配白醋溶液放入锥形瓶中,滴加 2~3 滴酚酞作指示剂。下列仪器可用于准确
量取白醋溶液的是________。
A. 酸式滴定管 B. 碱式滴定管 C. 量筒 D. 容量瓶
(2)滴定管在使用之前应进行的操作是___________,洗涤,润洗。滴定管盛装好
NaOH溶液后排气泡,下列排气泡操作正确的是___________。
(3)若用 50 mL的滴定管进行实验,当滴定管中的凹液面最低处在刻度“15”处时,
则管内液体的体积____________(填标号)。
A.=15 mL B. =35 mL C. <15 mL D. >35 mL
(4)判断达到滴定终点的方法是_____________________________________。
(5)某同学一共进行了三次实验,实验数据如下:
实验次数 量取稀释后白醋体积(mL)消耗标准 NaOH溶液体积(mL)
1 25.00 17.95
2 25.00 18.95
3 25.00 18.05
数据处理:消耗标准 NaOH 溶液的体积= mL。通过计算可知该白醋中
醋酸的含量为_______ g/100mL (保留两位有效数字),该白醋的级别为_______。
(6)下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是 。
A. 碱式滴定管未用标准 NaOH 溶液润洗就直接注入标准 NaOH溶液
B. 滴定过程中振荡时有液滴溅出
C. 滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
D. 读取 NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
高二化学 第 7 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
19. (10分)查阅资料获得 25℃时部分弱电解质的电离平衡常数数据:
化学式 HF HClO CH3COOH HNO2 NH3·H2O
- - -
电离常数 Ka=6.8×10 4 Ka=4.7×10 8 Ka=2.0×10 5 Ka=5.6×10-4 Kb=2.0×10-5
回答下列问题:
(1)HNO2的电离方程式为________________________________________。
(2)物质的量浓度相同的 HF、HClO、CH3COOH、HNO2中,c(H+)由大到小的顺序
是_______________________________________。
(3)常温下,0.1 mol·L-1的氨水的 pH 约为________________(lg2=0.3)。
(4)常温下,NH4F 的水溶液的 pH ____________7(填“>”、“<”或“=”)。
(5)常温下,在 pH=3的 CH3COOH溶液中,水电离出来的 c(H+)为_______mol/L。
高二化学 第 8 页 共 8 页
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
濮阳市一高 2022 级高二上学期第二次质量检测
化学试题答案
2023.10
一、 选择题(本小题共 10小题,每题 3分,共 30分。每小题只有一个正确选项。)
题号 1 2 3 4 5 6 7 8 9 10
答案 A D B C C C B D C A
二、选择题(本题包括 5小题。每小题 4分,共 20分。每小题有一个或两个选项符合题目
要求,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。)
题号 11 12 13 14 15
答案 C B D AB B
三、非选择题(本小题共 4小题,共 50分。)
16. (每空 2分,共 6分)
⑴ 2P(s)+3Cl2(g)=2PCl3(g) ΔH= -(c-b) kJ·mol-1
(或 P(s)+3/2Cl2(g)=PCl3(g) ΔH= -(c-b) /2kJ·mol-1 等其他合理答案)
⑵ ΔH3-ΔH1 ⑶黑磷
17. (除标注外,每空 2分,共 18分)
⑴ BC(少选得 1 分,多选错选得 0 分)
⑵ ①5×10-3(或 0.005) ②<(1 分) < ③低温 ④0.5
⑶ ①P3<P2<P1 (1 分) 该反应为气体分子数减小的反应,增大压强,平衡正向移动,
NO的平衡转化率增大 ②k1 /k2 ③>
18. (除标注外,每空 2分,共 16分)
⑴ A
⑵ 检查滴定管是否漏水(或检漏) c
⑶ D(1 分)
⑷ 滴入最后半滴 NaOH标准溶液后,溶液由无色变为粉红色,且半分钟内不褪色
⑸ 18.00(1 分) 4.3 二级醋
⑹ BD
19. (除标注外,每空 2分,共 10分)
(1) HNO2 H++NO2- (2) HF >HNO2 >CH3COOH>HClO
(3) 11.15 (或 11.2) (4) < (5)10-11
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
1. A. 催化剂能够同等程度地改变正反应速率与逆反应速率,因此,它对化学平衡移动没影响。
2. A. 燃烧热指可燃物中的氢元素变为 H2O(l)。
B. ΔH 必须与化学方程式一一对应。
C. 总能量高于。
D. 教材第 7 页。
3. 教材第 65 页,资料卡片。B. NaHCO3溶液显碱性。
4. A. ①为吸热反应。
B. 活化能大的为决速步,应为反应①。
C.教材第 26 页,图 2-3。
D.教材第 27 页,催化剂之所以改变化学反应速率,是因为它能能改变化学反应历程,改变
反应活化能。
5. C. 通入氩气,体积变大,反应物质浓度均减小,相当于减小压强,平衡逆向移动,N2的转
化率降低。
6. 教材第 38 页,勒夏特列原理内容。C.是形成了原电池,加快反应速率。
7. A. 一水合氨不能完全电离,数目小于 NA。
B. 教材第 62 页。
C. 考虑水电离的氢氧根。
D. pH=2,c(H+)=0.01mol/L,H+数目 0.01 NA。
8. 教材第 5 页。D. 接触立即反应,造成起始温度偏高。
9. A. C 升温促进水电离,c(H+)、c(OH—)均增大,pH 减小。
B. 水电离的 c(H+)和 c(OH—)相等,所以纯水在任何温度下一定是中性。
D. 水的离子积,只受温度影响。
10. B. 慢反应为决速步。
C. 由信息 N2O 的分解速率方程 v=k·c(N
0.5
2O)·c (I2)可知,I2的浓度与 N2O 分解速率有关。
D. 快反应的活化能小。
11. A. 此溶液为酸性溶液,酸性条件下,NO -3 氧化 Fe
2+。
B. 该溶液可能为酸溶液,也可能为碱溶液。酸性条件下,HCO -3 不能大量共存,碱性条件下,
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
HCO -3 和 NH
+
4 均不能大量共存。
D. Cr2O
2-
7 橙色。
12. C. 不是单一变量,还存在接触面积的不同。
13. A. 水的离子积,只受温度影响。
B . K 只受温度影响。
C. 教材第 58 页。电离常数越大,弱电解质越易电离,酸性越强。
D. 增加 O2浓度,SO2转化率增大,但是 K 不变。
14. A. 观察温度-转化率图像,温度升高,HCl 转化率减小,说明平衡逆向移动,逆反应吸热。
B. Z 越小,说明 O2浓度大,HCl 的转化率大,因此 a<4
D. 容器Ⅲ处于 R 点时,HCl 的转化率小于平衡时,所以反应正向进行,v(正) >v(逆)。
15. A. 观察图像变化趋势可知酸性:HC>HB>HA
B. b 点和 c 点氢离子浓度相同,对水的抑制程度相同。
C. HA 酸性比 HB 的弱,所以相同 pH 时,c(HA)远大于 c(HB),所以 b 点<a 点
D. HC 是强酸,电离不受温度影响,c(C—)不变;HA 是弱酸,升温促进电离,c(A—)增大;所
以比值减小。
{#{QQABBYIQogigQBIAARhCQQVYCgMQkBECAIoOQBAAIAIBQANABAA=}#}
同课章节目录
