化学人教版(2019)必修第一册1.3.1氧化还原反应的概念 电子转移的表示(共37张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.1氧化还原反应的概念 电子转移的表示(共37张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 08:58:41 | ||
图片预览











文档简介
(共37张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应的概念 电子转移的表示
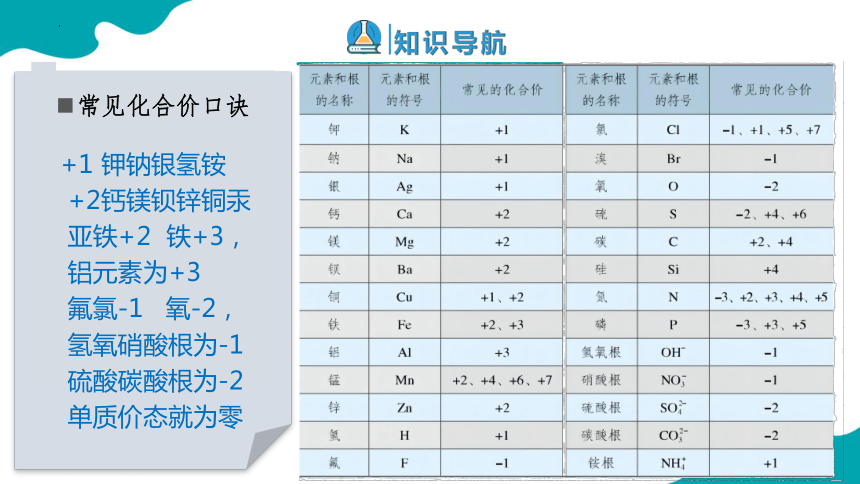
常见化合价口诀
+1 钾钠银氢铵
+2钙镁钡锌铜汞
亚铁+2 铁+3,
铝元素为+3
氟氯-1 氧-2,
氢氧硝酸根为-1
硫酸碳酸根为-2
单质价态就为零
化合反应
分解反应
置换反应
复分解反应
一见钟情型
各奔东西型
挖墙角型
互挖墙角型
化学反应类型
基本反应
类型
是否有
离子参与
离子反应
非离子反应
我们在初中还学过哪些反应类型?
2
1
本节重点
本节难点
从不同的角度认识氧化还原反应
氧化还原反应中电子转移的表示方法
日常生活中我们经常会见到,穿久了的鞋子,鞋底会发黄,切开的苹果放置段时间变黄。
都因为发生了氧化还原反应
在初中,我们把物质得氧的反应叫做氧化反应;物质失氧的反应叫做还原反应。
从得氧、失氧的角度,完成课本P22表格
氧化还原反应
①从得失氧的角度认识氧化还原反应
氧化铜
氧化铁
高温
2CuO
+
C
2Cu
+
CO2↑
铜
铁
失去
_____氧
高温
Fe2O3
+
3CO
2Fe
+
3CO2↑
还原
_____反应
碳
一氧化碳
二氧化碳
二氧化碳
得到
_____氧
氧化
_____反应
注意:得氧、失氧是同时发生,对立统一,缺一不可!
一、氧化还原反应
1、从得失氧的角度认识氧化还原反应
结论:
也就是说:氧化反应和还原反应是在一个反应中同时发生的,这样的反应称之为氧化还原反应。
在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。
即:凡是有得氧、失氧的化学反应称之为氧化还原反应。
以上反应物质在得氧发生氧化反应、失氧发生还原反应的同时,元素的化合价是否发生了变化?
【思考与讨论】
(教材P22)
碳元素化合价_____,发生_____反应。
碳元素化合价_____,发生_____反应。
一、氧化还原反应
2、从元素化合价升降的角度认识氧化还原反应
高温
Fe2O3
+
3CO
2Fe
+
3CO2↑
-2
+4
-2
+2
-2
0
+3
高温
2CuO
+
C
2Cu
+
CO2↑
+2
-2
0
0
+4
-2
化合价降低
化合价升高
铜元素化合价_____,发生_____反应。
降低
还原
升高
氧化
铁元素化合价_____,发生_____反应。
降低
还原
升高
氧化
化合价降低
化合价升高
(失氧)
(得氧)
(失氧)
(得氧)
【思考与讨论】
(教材P22)
发生还原反应
发生氧化反应
发生氧化反应
发生还原反应
氧化还原反应是否一定要有氧的参与?
并非只有得氧、失氧的反应才是氧化还原反应。
反应前后元素化合价发生变化是氧化还原反应的重要特征
Fe+CuCl2 Cu+FeCl2
Fe+CuCl2===FeCl2 + Cu
Fe → FeCl2
CuCl2 → Cu
化合价:0 → +2
化合价:+2 → 0
氧化反应
还原反应
—— 判断依据
即:凡是有元素化合价变化的化学反应称之为氧化还原反应。
2NO+O2===2NO2
CaO + H2O === Ca(OH)2
2H2O === 2H2↑ + O2↑
通电
CaCO3 === CaO + CO2↑
高温
Fe + CuSO4 === FeSO4 + Cu
Fe+2HCl===FeCl2+H2↑
NaOH + HCl === NaCl +H2O
NaCl + AgNO3 === AgCl↓+NaNO3
凡是有元素化合价升降的化学反应称之为氧化还原反应。
氧化还原反应:
化合反应
分解反应
复分解反应
置换反应
1.判断下列反应是否为氧化还原反应
1)关键:正确判断反应物、生成物中所有元素的化合价及其变化;
2)方法:看反应前后是否有化合价升降
1. 化合反应_____________是氧化还原反应;
2. 分解反应_____________是氧化还原反应;
3. 置换反应_____________是氧化还原反应;
4. 复分解反应___________是氧化还原反应。
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
不一定
不一定
一定
一定不
四大基本反应类型与氧化还原反应的关系
有单质生成的分解反应
有单质参加的化合反应
化合反应:有单质参加的是氧化还原反应;
分解反应:有单质生成的是氧化还原反应;
置换反应:全部是氧化还原反应;
复分解反应:都是非氧化还原反应。
有单质参加或生成的化学反应一定是氧化还原反应吗?
放电
3O2 2O3
1.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是( )
A.2HClO 2HCl+O2↑
B.NH4HCO3 NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O === 4Fe(OH)3
D.Fe2O3+3CO 2Fe+3CO2
高温
D
那么,是什么原因导致元素的化合价发生变化的呢?
氧化还原反应
Cl
Na
失去
钠原子_____电子,钠元素化合价升高,Na发生氧化反应,被氧化。
2Na+Cl2 2NaCl
氯原子_____电子,氯元素化合价降低,Cl2发生还原反应,被还原。
得到
③从电子转移的角度认识氧化还原反应
+
-
Na+
Cl-
0
0
+1
-1
①对于金属与非金属的反应:
电子的得失
元素化合价升高,物质发生氧化反应
元素化合价降低,物质发生还原反应
失去
钠原子_____电子,钠元素化合价升高,Na发生氧化反应,被氧化。
氯原子_____电子,氯元素化合价降低,Cl2发生还原反应,被还原。
得到
原子失去电子,
原子得到电子,
物质
氧化还原反应
H2+Cl2 2HCl
点燃
共用电子对
共用电子对______氢原子,氢元素化合价升高,H2发生氧化反应。
共用电子对______氯原子,氯元素化合价降低,Cl2发生还原反应。
偏向
偏离
Cl
H
③从电子转移的角度认识氧化还原反应
0
0
+1
-1
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
H
Cl
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
②对于非金属与非金属的反应:
共用电子对的偏移
氧化还原反应
易错提醒
氧化还原反应的 本质:电子的转移(得失或偏移)
氧化还原反应的 特征:元素的化合价发生了变化。
注意区分清楚氧化还原反应的本质与特征
定滑轮
化合价
失去电子
得到电子
e-
化合价
升高
降低
电子的转移
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
失去电子e-,化合价升高,被氧化
得到电子e-,化合价降低,被还原
元素失去电子e-,化合价升高,被氧化
元素得到电子e-,化合价降低,被还原
氧化还原反应概念间的关系
反应物
化合价升高
失去电子
被
氧化
氧化反应
化合价降低
得到电子
被
还原
还原反应
重要
特征
本质
升失氧
降得还
完成下列填空
(1)C+H2O(g) CO+H2中发生氧化反应的物质是____,被还原的元素是_____。
(2)2KClO3 2KCl+3O2↑中被氧化的元素是___,被还原的元素是____。
(3)2H2S+SO2===3S↓+2H2O中被还原的物质是_____,被氧化的物质是_____,被氧化的元素是____,被还原的元素是___。
(4)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑中发生氧化反应的物质是______,发生还原反应的物质_______,被氧化的元素是_____,被还原的元素是_____。
C
H
O
Cl
SO2
H2S
S
S
HCl
MnO2
Cl
Mn
高温
MnO2
氧化还原反应中一定有氧元素的得失( )
氧化还原反应中得电子的物质发生还原反应( )
氧化还原反应中所有元素的化合价都一定发生变化( )
一个反应中可以只有元素化合价升高,而无元素化合价降低( )
×
√
×
×
【例】请同学们认真思考并判断正误:
氧化还原反应
双线桥法
——表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
2Na + Cl2 2NaCl
失去2×e-
得到2 × e-
0
0
+1
-1
基本步骤
标价态
连双线
注得失
氧化还原反应中电子转移的表示方法
升失氧,降得还
同种元素,
反应物→生成物
得/失a×be-
氧化还原反应
氧化还原反应中电子转移的表示方法
双线桥法的注意事项
画桥必须对应化合价变化的同种元素的原子;
必须注明“得到”或“失去”;
电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略;
被还原的物质和被氧化的物质得失电子数守恒。
【例1】请同学们用双线桥法标出以下反应的电子转移:
标价态
连双线
注得失
Zn+H2SO4 ZnSO4+H2↑
Fe2O3+3CO 2Fe+3CO2
高温
标价态
连单线
注数目
标出反应前后有化合价变化的元素的化合价
用线桥将反应物连接起来,箭头由失电子的元素指向得电子的元素
在线桥上注明电子转移的总数目,不需要写“得到”或“失去”
4e-
C + 2CuO
CO2↑ + 2Cu
高温
我举个例子
2. 单线桥法:表示反应过程中不同元素原子间的电子转移情况。
0
+2
0
+4
氧化还原反应中电子转移的表示方法
be-
反应物:失电子→得电子
氧化还原反应
单线桥法的注意事项
不需要标明“得到”或“失去”,只标明电子转移总数目;
要用箭头标明电子转移的方向;
箭头由反应物中失电子元素原子指向得电子元素原子。
氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用单线桥法标出电子转移情况
高温
②WO3+3H2 W+3H2O
①MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
氧化还原反应的发展历程
1774年,法国化学家拉瓦锡提出燃烧的氧化学说后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应
1
1852年,英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念,并逐步得到完善以后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应
2
1897年,英国物理学家汤姆孙发现了电子,打破了原子不可再分的传统观念,使人们对原子的结构有了深入的认识
3
1.下列有关氧化还原反应说法正确的是( )
A.氧化还原反应一定有氧元素参加
B.氧化还原反应中不能只有一种元素化合价变化
C.有单质参加的反应一定是氧化还原反应
D.氧化还原反应中一定有元素化合价变化
D
2.下列化学反应中,不属于氧化还原反应的是( )
A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4
C.Fe2O3+3CO 2Fe+3CO2
D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
高温
A
3.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3(稀)
===3Cu(NO3)2+2NO↑+4H2O。
(1)被氧化的元素是_____,被还原的元素是____。
(2)发生氧化反应的物质是______,发生还原反应的物质是______。
(3)用单线桥法表示反应电子得失的方向和数目:
____________________________________________。
Cu
N
Cu
HNO3
①
②Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
4.标出变价元素的化合价,用双线桥法标出电子转移情况
Cl2+2NaOH NaCl+NaClO+H2O
③MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
④2H2S+SO2 3S↓+2H2O
5.标出变价元素的化合价,用单线桥法和双线桥法两种方法标出电子转移情况
===3S↓+2H2O
多角度认识氧化还原反应
氧化还原反应中电子转移的表示方法
从得失氧的角度认识氧化还原反应
从电子转移的角度认识氧化还原反应
双线桥法
单线桥法
从元素化合价升降的角度认识氧化还原反应
注意事项
第三节
氧化还原反应
第1课时
第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应的概念 电子转移的表示
常见化合价口诀
+1 钾钠银氢铵
+2钙镁钡锌铜汞
亚铁+2 铁+3,
铝元素为+3
氟氯-1 氧-2,
氢氧硝酸根为-1
硫酸碳酸根为-2
单质价态就为零
化合反应
分解反应
置换反应
复分解反应
一见钟情型
各奔东西型
挖墙角型
互挖墙角型
化学反应类型
基本反应
类型
是否有
离子参与
离子反应
非离子反应
我们在初中还学过哪些反应类型?
2
1
本节重点
本节难点
从不同的角度认识氧化还原反应
氧化还原反应中电子转移的表示方法
日常生活中我们经常会见到,穿久了的鞋子,鞋底会发黄,切开的苹果放置段时间变黄。
都因为发生了氧化还原反应
在初中,我们把物质得氧的反应叫做氧化反应;物质失氧的反应叫做还原反应。
从得氧、失氧的角度,完成课本P22表格
氧化还原反应
①从得失氧的角度认识氧化还原反应
氧化铜
氧化铁
高温
2CuO
+
C
2Cu
+
CO2↑
铜
铁
失去
_____氧
高温
Fe2O3
+
3CO
2Fe
+
3CO2↑
还原
_____反应
碳
一氧化碳
二氧化碳
二氧化碳
得到
_____氧
氧化
_____反应
注意:得氧、失氧是同时发生,对立统一,缺一不可!
一、氧化还原反应
1、从得失氧的角度认识氧化还原反应
结论:
也就是说:氧化反应和还原反应是在一个反应中同时发生的,这样的反应称之为氧化还原反应。
在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。
即:凡是有得氧、失氧的化学反应称之为氧化还原反应。
以上反应物质在得氧发生氧化反应、失氧发生还原反应的同时,元素的化合价是否发生了变化?
【思考与讨论】
(教材P22)
碳元素化合价_____,发生_____反应。
碳元素化合价_____,发生_____反应。
一、氧化还原反应
2、从元素化合价升降的角度认识氧化还原反应
高温
Fe2O3
+
3CO
2Fe
+
3CO2↑
-2
+4
-2
+2
-2
0
+3
高温
2CuO
+
C
2Cu
+
CO2↑
+2
-2
0
0
+4
-2
化合价降低
化合价升高
铜元素化合价_____,发生_____反应。
降低
还原
升高
氧化
铁元素化合价_____,发生_____反应。
降低
还原
升高
氧化
化合价降低
化合价升高
(失氧)
(得氧)
(失氧)
(得氧)
【思考与讨论】
(教材P22)
发生还原反应
发生氧化反应
发生氧化反应
发生还原反应
氧化还原反应是否一定要有氧的参与?
并非只有得氧、失氧的反应才是氧化还原反应。
反应前后元素化合价发生变化是氧化还原反应的重要特征
Fe+CuCl2 Cu+FeCl2
Fe+CuCl2===FeCl2 + Cu
Fe → FeCl2
CuCl2 → Cu
化合价:0 → +2
化合价:+2 → 0
氧化反应
还原反应
—— 判断依据
即:凡是有元素化合价变化的化学反应称之为氧化还原反应。
2NO+O2===2NO2
CaO + H2O === Ca(OH)2
2H2O === 2H2↑ + O2↑
通电
CaCO3 === CaO + CO2↑
高温
Fe + CuSO4 === FeSO4 + Cu
Fe+2HCl===FeCl2+H2↑
NaOH + HCl === NaCl +H2O
NaCl + AgNO3 === AgCl↓+NaNO3
凡是有元素化合价升降的化学反应称之为氧化还原反应。
氧化还原反应:
化合反应
分解反应
复分解反应
置换反应
1.判断下列反应是否为氧化还原反应
1)关键:正确判断反应物、生成物中所有元素的化合价及其变化;
2)方法:看反应前后是否有化合价升降
1. 化合反应_____________是氧化还原反应;
2. 分解反应_____________是氧化还原反应;
3. 置换反应_____________是氧化还原反应;
4. 复分解反应___________是氧化还原反应。
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
不一定
不一定
一定
一定不
四大基本反应类型与氧化还原反应的关系
有单质生成的分解反应
有单质参加的化合反应
化合反应:有单质参加的是氧化还原反应;
分解反应:有单质生成的是氧化还原反应;
置换反应:全部是氧化还原反应;
复分解反应:都是非氧化还原反应。
有单质参加或生成的化学反应一定是氧化还原反应吗?
放电
3O2 2O3
1.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是( )
A.2HClO 2HCl+O2↑
B.NH4HCO3 NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O === 4Fe(OH)3
D.Fe2O3+3CO 2Fe+3CO2
高温
D
那么,是什么原因导致元素的化合价发生变化的呢?
氧化还原反应
Cl
Na
失去
钠原子_____电子,钠元素化合价升高,Na发生氧化反应,被氧化。
2Na+Cl2 2NaCl
氯原子_____电子,氯元素化合价降低,Cl2发生还原反应,被还原。
得到
③从电子转移的角度认识氧化还原反应
+
-
Na+
Cl-
0
0
+1
-1
①对于金属与非金属的反应:
电子的得失
元素化合价升高,物质发生氧化反应
元素化合价降低,物质发生还原反应
失去
钠原子_____电子,钠元素化合价升高,Na发生氧化反应,被氧化。
氯原子_____电子,氯元素化合价降低,Cl2发生还原反应,被还原。
得到
原子失去电子,
原子得到电子,
物质
氧化还原反应
H2+Cl2 2HCl
点燃
共用电子对
共用电子对______氢原子,氢元素化合价升高,H2发生氧化反应。
共用电子对______氯原子,氯元素化合价降低,Cl2发生还原反应。
偏向
偏离
Cl
H
③从电子转移的角度认识氧化还原反应
0
0
+1
-1
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
H
Cl
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
②对于非金属与非金属的反应:
共用电子对的偏移
氧化还原反应
易错提醒
氧化还原反应的 本质:电子的转移(得失或偏移)
氧化还原反应的 特征:元素的化合价发生了变化。
注意区分清楚氧化还原反应的本质与特征
定滑轮
化合价
失去电子
得到电子
e-
化合价
升高
降低
电子的转移
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
失去电子e-,化合价升高,被氧化
得到电子e-,化合价降低,被还原
元素失去电子e-,化合价升高,被氧化
元素得到电子e-,化合价降低,被还原
氧化还原反应概念间的关系
反应物
化合价升高
失去电子
被
氧化
氧化反应
化合价降低
得到电子
被
还原
还原反应
重要
特征
本质
升失氧
降得还
完成下列填空
(1)C+H2O(g) CO+H2中发生氧化反应的物质是____,被还原的元素是_____。
(2)2KClO3 2KCl+3O2↑中被氧化的元素是___,被还原的元素是____。
(3)2H2S+SO2===3S↓+2H2O中被还原的物质是_____,被氧化的物质是_____,被氧化的元素是____,被还原的元素是___。
(4)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑中发生氧化反应的物质是______,发生还原反应的物质_______,被氧化的元素是_____,被还原的元素是_____。
C
H
O
Cl
SO2
H2S
S
S
HCl
MnO2
Cl
Mn
高温
MnO2
氧化还原反应中一定有氧元素的得失( )
氧化还原反应中得电子的物质发生还原反应( )
氧化还原反应中所有元素的化合价都一定发生变化( )
一个反应中可以只有元素化合价升高,而无元素化合价降低( )
×
√
×
×
【例】请同学们认真思考并判断正误:
氧化还原反应
双线桥法
——表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
2Na + Cl2 2NaCl
失去2×e-
得到2 × e-
0
0
+1
-1
基本步骤
标价态
连双线
注得失
氧化还原反应中电子转移的表示方法
升失氧,降得还
同种元素,
反应物→生成物
得/失a×be-
氧化还原反应
氧化还原反应中电子转移的表示方法
双线桥法的注意事项
画桥必须对应化合价变化的同种元素的原子;
必须注明“得到”或“失去”;
电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略;
被还原的物质和被氧化的物质得失电子数守恒。
【例1】请同学们用双线桥法标出以下反应的电子转移:
标价态
连双线
注得失
Zn+H2SO4 ZnSO4+H2↑
Fe2O3+3CO 2Fe+3CO2
高温
标价态
连单线
注数目
标出反应前后有化合价变化的元素的化合价
用线桥将反应物连接起来,箭头由失电子的元素指向得电子的元素
在线桥上注明电子转移的总数目,不需要写“得到”或“失去”
4e-
C + 2CuO
CO2↑ + 2Cu
高温
我举个例子
2. 单线桥法:表示反应过程中不同元素原子间的电子转移情况。
0
+2
0
+4
氧化还原反应中电子转移的表示方法
be-
反应物:失电子→得电子
氧化还原反应
单线桥法的注意事项
不需要标明“得到”或“失去”,只标明电子转移总数目;
要用箭头标明电子转移的方向;
箭头由反应物中失电子元素原子指向得电子元素原子。
氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用单线桥法标出电子转移情况
高温
②WO3+3H2 W+3H2O
①MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
氧化还原反应的发展历程
1774年,法国化学家拉瓦锡提出燃烧的氧化学说后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应
1
1852年,英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念,并逐步得到完善以后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应
2
1897年,英国物理学家汤姆孙发现了电子,打破了原子不可再分的传统观念,使人们对原子的结构有了深入的认识
3
1.下列有关氧化还原反应说法正确的是( )
A.氧化还原反应一定有氧元素参加
B.氧化还原反应中不能只有一种元素化合价变化
C.有单质参加的反应一定是氧化还原反应
D.氧化还原反应中一定有元素化合价变化
D
2.下列化学反应中,不属于氧化还原反应的是( )
A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4
C.Fe2O3+3CO 2Fe+3CO2
D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
高温
A
3.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3(稀)
===3Cu(NO3)2+2NO↑+4H2O。
(1)被氧化的元素是_____,被还原的元素是____。
(2)发生氧化反应的物质是______,发生还原反应的物质是______。
(3)用单线桥法表示反应电子得失的方向和数目:
____________________________________________。
Cu
N
Cu
HNO3
①
②Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
4.标出变价元素的化合价,用双线桥法标出电子转移情况
Cl2+2NaOH NaCl+NaClO+H2O
③MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
④2H2S+SO2 3S↓+2H2O
5.标出变价元素的化合价,用单线桥法和双线桥法两种方法标出电子转移情况
===3S↓+2H2O
多角度认识氧化还原反应
氧化还原反应中电子转移的表示方法
从得失氧的角度认识氧化还原反应
从电子转移的角度认识氧化还原反应
双线桥法
单线桥法
从元素化合价升降的角度认识氧化还原反应
注意事项
第三节
氧化还原反应
第1课时
