化学人教版(2019)选择性必修1 4.2.1电解原理化学(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.2.1电解原理化学(共23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 09:07:55 | ||
图片预览





文档简介
(共23张PPT)
电解原理
电解池
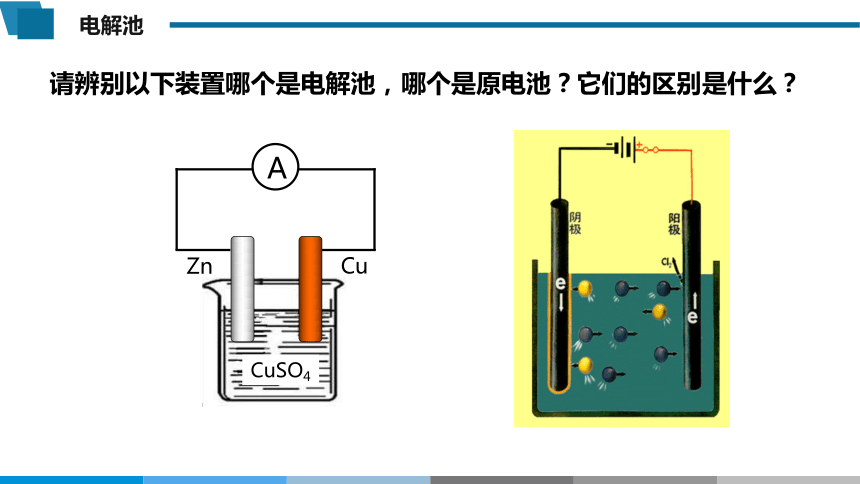
请辨别以下装置哪个是电解池,哪个是原电池?它们的区别是什么?
CuSO4
Cu
Zn
A
电解池
1807年,英国化学家戴维把电池连上电极,放入熔融的钾的化合物中,在阴极附近产生了银白色金属,它们遇到空气就瞬间燃烧,产生紫色的火焰。
英国化学家
汉弗莱·戴维
电解水实验
电解水实验
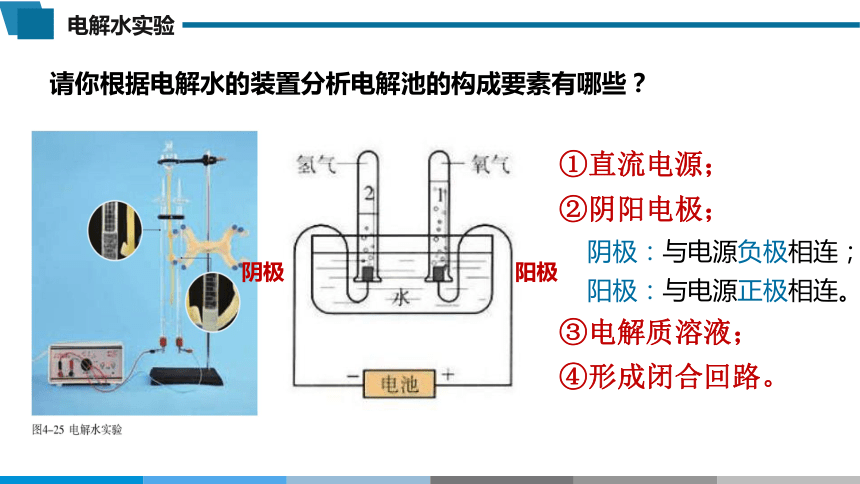
请你根据电解水的装置分析电解池的构成要素有哪些?
①直流电源;
②阴阳电极;
阴极:与电源负极相连;
阳极:与电源正极相连。
③电解质溶液;
④形成闭合回路。
阴极
阳极
电解水实验
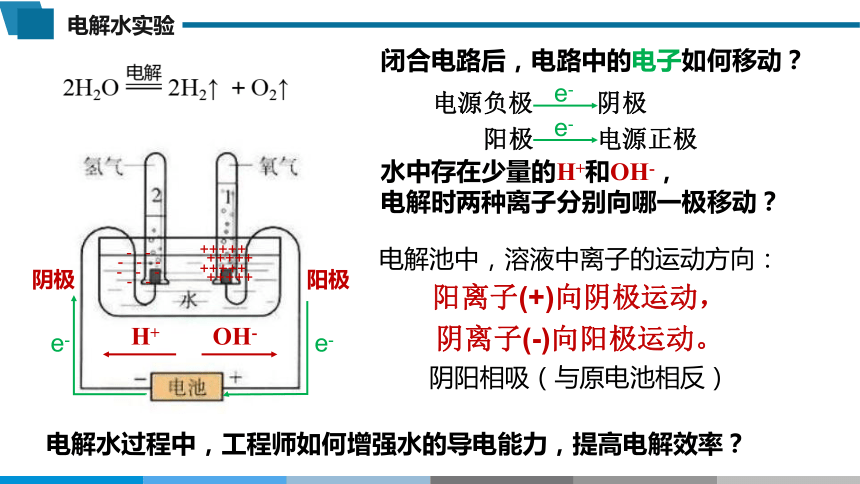
2H2O 2H2↑ +O2↑
水中存在少量的H+和OH-,
电解时两种离子分别向哪一极移动?
阴极
阳极
H+
OH-
电解池中,溶液中离子的运动方向:
阳离子(+)向阴极运动,
阴离子(-)向阳极运动。
阴阳相吸(与原电池相反)
电解水过程中,工程师如何增强水的导电能力,提高电解效率?
闭合电路后,电路中的电子如何移动?
e-
e-
电源负极 阴极
阳极 电源正极
e-
e-
+++++
+++++
+++++
+++++
- - -
- -
- - -
- -
氯化铜溶液的电解
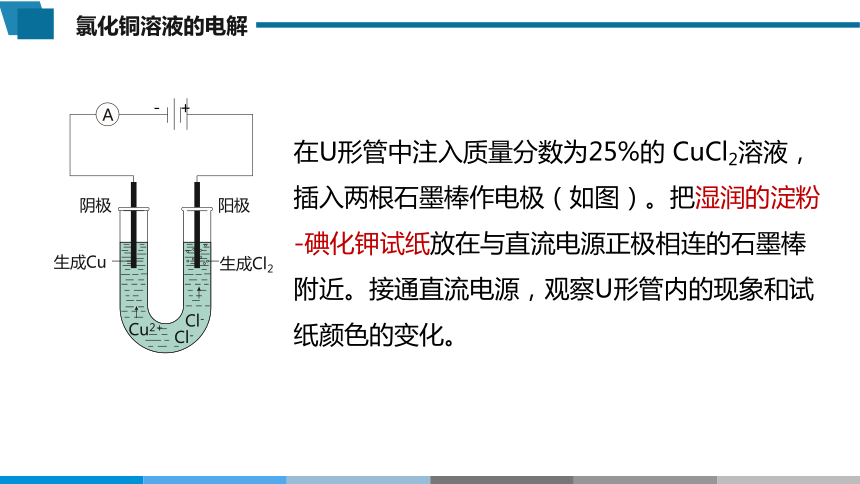
在U形管中注入质量分数为25%的 CuCl2溶液,插入两根石墨棒作电极(如图)。把湿润的淀粉-碘化钾试纸放在与直流电源正极相连的石墨棒附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
阴极
生成Cu
A
Cu2+
Cl-
Cl-
生成Cl2
- +
阳极
氯化铜溶液的电解
与直流电源负极
相连的石墨棒(阴极)上逐渐覆盖一层
红色的固体
与直流电源正极相连的石墨棒(阴极)
上有使湿润的淀粉-碘化钾试纸变蓝的刺激性气味的气体产生
阳极:2Cl- - 2e- = Cl2↑(氧化反应)
总反应:Cu2+ + 2Cl- Cu + Cl2↑
阴极:Cu2++ 2e- = Cu(还原反应)
“放电”
氯化铜溶液的电解
通电前,CuCl2溶液中存在哪些离子?如何移动?
Cu2+、Cl-、H+、OH-
石墨
Cl-
Cu2+
Cu2+
Cu2+
OH-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
H+
自由移动
CuCl2 = Cu2+ + 2Cl-
H2O H+ + OH-
氯化铜溶液的电解
通电后,CuCl2溶液中的离子如何移动?
定向移动,阴阳相吸
阳极
石墨
阴极
Cl-
Cu2+
Cu2+
H+
Cl-
Cl-
Cl-
Cl-
Cl-
OH-
Cl-
Cu2+
e-
e-
e-
e-
氯化铜溶液的电解
该实验条件下,水电离出的H+和OH-为什么没有参与电极反应呢?
阳极:2Cl- - 2e- = Cl2↑(氧化反应)
阴极:Cu2++ 2e- = Cu(还原反应)
是否参与反应与其得失电子的能力有关
阴极——得电子——还原反应
阳极——失电子——氧化反应
氯化铜溶液的电解
溶液中只考虑部分
活性电极(除Pt、Au以外的金属电极):
活性电极失去电子,电极溶解,溶液中阴离子不能失去电子
阴极(得电子能力):溶液中的离子放电
(无需考虑电极材料)
Ag+ > Hg+ > Fe3+ > Cu2+ > H+(酸) > Pb2+ > Sn2+ >Fe2+ >Zn2+> H+(水) > Al3+ > Mg2+ > Na+ > Ca2+ > K+
各种离子的放电顺序总结:
阳极(失电子能力):
(需要考虑电极材料)
S2- > I- > Fe2+ > Br- > Cl- > OH- >含氧酸根> F-
惰性电极(Pt、Au、石墨等):溶液中的离子放电
溶液中只考虑部分
应用模型
回忆初中学过的电解水实验
水中可加入少量Na2SO4或NaOH以增强导电性。
画出以石墨电极电解水(含有少量Na2SO4)的装置示意图,并写出阴极、阳极的电极反应式。
应用模型
+ -
直流电源
Na+
H+
OH-
C
C
含有少量Na2SO4的水
阴极:
阳极:
2H2O+2e-=H2↑+2OH-
2H2O-4e-=O2↑+4H+
e-
e-
阴极
阳极
得电子能力: H+>Na+
失电子能力:OH->
总反应:
2H2O2H2↑+O2↑
能否换成NaCl溶液呢?
(H2OH++OH-)
(H2OH++OH-)
应用模型
+ -
直流电源
Na+
H+
Cl-
OH-
C
C
NaCl溶液
阴极:
阳极:
2H2O+2e-=H2↑+2OH-
2Cl--2e-=Cl2↑
e-
e-
阴极
阳极
得电子能力: H+>Na+
失电子能力:Cl->OH-
总反应:
2H2O+2Cl-H2↑+Cl2↑+2OH-
电极方程式的书写
阴极(+e-):
各种离子的放电顺序总结:
阳极(- e-):
H+
OH-
Na+
SO42-
Cu2+
Cl-
(Al3+ > Mg2+ > Na+ > Ca2+ > K+)
(含氧酸根> F-)
(Ag+ > Hg+ > Fe3+ > Cu2+)
(S2- > I- > Fe2+ > Br- > Cl-)
>
>
>
>
Cu
>
(活性电极)
(1)
电解水型:Na2SO4
NaOH
H2SO4
(2)
电解电解质型:
CuCl2
Cu(OH)2
HCl
(3)
电解水和电解质型:
NaCl
CuSO4
如果有活性电极,
活性电极先放电。
看电极→找离子→分阴阳→排顺序→写反应
小结
(电解槽)
直流电源
(电解质溶液/熔融电解质)
得电子
失电子
(导线)
原电池与电解池
电解池(电能转化为化学能)
原电池(化学能转化为电能 )
课后练习
1.下列有关电解的叙述中不正确的是
A.与电源正极相连的是阳极
B.与电源负极相连的是阴极
C.在阴极上发生氧化反应
D.阴离子向阳极方向迁移
2.下列说法中正确的是
A.在原电池中,电子由正极通过导线流向负极
B.在原电池中,还原剂在负极发生氧化反应
C.在电解池中,与电源正极相连的电极是阴极
D.在电解池中,还原剂在阴极发生氧化反应
课后练习
3.实验室电解饱和食盐水的装置如图所示。下列判断正确的是
A.电极a为阴极
B.电极b上发生了还原反应
C.阳极附近溶液变红
D.阴极产生黄绿色气体
课后练习
4.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:
Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
课后练习
电解原理
电解池
请辨别以下装置哪个是电解池,哪个是原电池?它们的区别是什么?
CuSO4
Cu
Zn
A
电解池
1807年,英国化学家戴维把电池连上电极,放入熔融的钾的化合物中,在阴极附近产生了银白色金属,它们遇到空气就瞬间燃烧,产生紫色的火焰。
英国化学家
汉弗莱·戴维
电解水实验
电解水实验
请你根据电解水的装置分析电解池的构成要素有哪些?
①直流电源;
②阴阳电极;
阴极:与电源负极相连;
阳极:与电源正极相连。
③电解质溶液;
④形成闭合回路。
阴极
阳极
电解水实验
2H2O 2H2↑ +O2↑
水中存在少量的H+和OH-,
电解时两种离子分别向哪一极移动?
阴极
阳极
H+
OH-
电解池中,溶液中离子的运动方向:
阳离子(+)向阴极运动,
阴离子(-)向阳极运动。
阴阳相吸(与原电池相反)
电解水过程中,工程师如何增强水的导电能力,提高电解效率?
闭合电路后,电路中的电子如何移动?
e-
e-
电源负极 阴极
阳极 电源正极
e-
e-
+++++
+++++
+++++
+++++
- - -
- -
- - -
- -
氯化铜溶液的电解
在U形管中注入质量分数为25%的 CuCl2溶液,插入两根石墨棒作电极(如图)。把湿润的淀粉-碘化钾试纸放在与直流电源正极相连的石墨棒附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
阴极
生成Cu
A
Cu2+
Cl-
Cl-
生成Cl2
- +
阳极
氯化铜溶液的电解
与直流电源负极
相连的石墨棒(阴极)上逐渐覆盖一层
红色的固体
与直流电源正极相连的石墨棒(阴极)
上有使湿润的淀粉-碘化钾试纸变蓝的刺激性气味的气体产生
阳极:2Cl- - 2e- = Cl2↑(氧化反应)
总反应:Cu2+ + 2Cl- Cu + Cl2↑
阴极:Cu2++ 2e- = Cu(还原反应)
“放电”
氯化铜溶液的电解
通电前,CuCl2溶液中存在哪些离子?如何移动?
Cu2+、Cl-、H+、OH-
石墨
Cl-
Cu2+
Cu2+
Cu2+
OH-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
H+
自由移动
CuCl2 = Cu2+ + 2Cl-
H2O H+ + OH-
氯化铜溶液的电解
通电后,CuCl2溶液中的离子如何移动?
定向移动,阴阳相吸
阳极
石墨
阴极
Cl-
Cu2+
Cu2+
H+
Cl-
Cl-
Cl-
Cl-
Cl-
OH-
Cl-
Cu2+
e-
e-
e-
e-
氯化铜溶液的电解
该实验条件下,水电离出的H+和OH-为什么没有参与电极反应呢?
阳极:2Cl- - 2e- = Cl2↑(氧化反应)
阴极:Cu2++ 2e- = Cu(还原反应)
是否参与反应与其得失电子的能力有关
阴极——得电子——还原反应
阳极——失电子——氧化反应
氯化铜溶液的电解
溶液中只考虑部分
活性电极(除Pt、Au以外的金属电极):
活性电极失去电子,电极溶解,溶液中阴离子不能失去电子
阴极(得电子能力):溶液中的离子放电
(无需考虑电极材料)
Ag+ > Hg+ > Fe3+ > Cu2+ > H+(酸) > Pb2+ > Sn2+ >Fe2+ >Zn2+> H+(水) > Al3+ > Mg2+ > Na+ > Ca2+ > K+
各种离子的放电顺序总结:
阳极(失电子能力):
(需要考虑电极材料)
S2- > I- > Fe2+ > Br- > Cl- > OH- >含氧酸根> F-
惰性电极(Pt、Au、石墨等):溶液中的离子放电
溶液中只考虑部分
应用模型
回忆初中学过的电解水实验
水中可加入少量Na2SO4或NaOH以增强导电性。
画出以石墨电极电解水(含有少量Na2SO4)的装置示意图,并写出阴极、阳极的电极反应式。
应用模型
+ -
直流电源
Na+
H+
OH-
C
C
含有少量Na2SO4的水
阴极:
阳极:
2H2O+2e-=H2↑+2OH-
2H2O-4e-=O2↑+4H+
e-
e-
阴极
阳极
得电子能力: H+>Na+
失电子能力:OH->
总反应:
2H2O2H2↑+O2↑
能否换成NaCl溶液呢?
(H2OH++OH-)
(H2OH++OH-)
应用模型
+ -
直流电源
Na+
H+
Cl-
OH-
C
C
NaCl溶液
阴极:
阳极:
2H2O+2e-=H2↑+2OH-
2Cl--2e-=Cl2↑
e-
e-
阴极
阳极
得电子能力: H+>Na+
失电子能力:Cl->OH-
总反应:
2H2O+2Cl-H2↑+Cl2↑+2OH-
电极方程式的书写
阴极(+e-):
各种离子的放电顺序总结:
阳极(- e-):
H+
OH-
Na+
SO42-
Cu2+
Cl-
(Al3+ > Mg2+ > Na+ > Ca2+ > K+)
(含氧酸根> F-)
(Ag+ > Hg+ > Fe3+ > Cu2+)
(S2- > I- > Fe2+ > Br- > Cl-)
>
>
>
>
Cu
>
(活性电极)
(1)
电解水型:Na2SO4
NaOH
H2SO4
(2)
电解电解质型:
CuCl2
Cu(OH)2
HCl
(3)
电解水和电解质型:
NaCl
CuSO4
如果有活性电极,
活性电极先放电。
看电极→找离子→分阴阳→排顺序→写反应
小结
(电解槽)
直流电源
(电解质溶液/熔融电解质)
得电子
失电子
(导线)
原电池与电解池
电解池(电能转化为化学能)
原电池(化学能转化为电能 )
课后练习
1.下列有关电解的叙述中不正确的是
A.与电源正极相连的是阳极
B.与电源负极相连的是阴极
C.在阴极上发生氧化反应
D.阴离子向阳极方向迁移
2.下列说法中正确的是
A.在原电池中,电子由正极通过导线流向负极
B.在原电池中,还原剂在负极发生氧化反应
C.在电解池中,与电源正极相连的电极是阴极
D.在电解池中,还原剂在阴极发生氧化反应
课后练习
3.实验室电解饱和食盐水的装置如图所示。下列判断正确的是
A.电极a为阴极
B.电极b上发生了还原反应
C.阳极附近溶液变红
D.阴极产生黄绿色气体
课后练习
4.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:
Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
课后练习
