4.1 原子结构与元素周期表 元素周期表 研究课 课件(共36张PPT) 2023-2024学年人教版(2019)高一化学必修第一册
文档属性
| 名称 | 4.1 原子结构与元素周期表 元素周期表 研究课 课件(共36张PPT) 2023-2024学年人教版(2019)高一化学必修第一册 |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 09:24:34 | ||
图片预览









文档简介
(共36张PPT)
元素周期表
日本政府宣布,2023年8月24日启动福岛核污染水排海。日本核污染水排海至少要持续30年,将会影响整个太平洋乃至全球海域。核污水主要含有:碘I-129、铯Cs-135、锶Sr-90、钴Co-60,还有铀U-235、钚Pu-239等放射性元素,半衰期有的长达亿年。
如何处理碘I-129、铯Cs-135、锶Sr-90、钴Co-60等元素?
问题:
1.有没有和它们性质相似的、已学习过的元素?
2.元素之间有何内在联系?现已发现的一百多种元素之间能否有序排列或分类?
活动一:黑暗中的摸索、论证:
(一)1789年,发现了33种元素,法国化学家拉瓦锡,按照化学性质分为金属元素,非金属元素等四组。
简单中性物质:光、热、氧、氮、氢
简单的非金属物质:硫、磷、碳、盐酸基、氢氟酸基、硼酸基
简单的金属物质:锑、银、铋、铜、钴、锰、汞、金、铂、铅、锌、锡、铁、钼、镍、钨
简单的碱性物质:石灰、镁土、铝土、钡土、硅土
评价:
1.优点:开始分类
2.缺点:没有真正弄清元素的含义,受“水、火、土、气”四元素说的影响把光、热、石灰等当成了元素
活动一:黑暗中的摸索、论证:
(二)1829年(44年后),发现了44种元素:
德国化学家德贝莱纳,按照原子量把化学性质相似的元素为一组。
评价:
1.背景:道尔顿原子论、原子量建立
2.继承和发展:元素的内在联系
3.缺点:主观性、无系统性
F=19 Cl=35.5、Br=80
4.当时的影响:
不认可
(1)锂Li,钠 Na,钾 K;
(2)钙Ca,锶Sr,钡Ba;
(3)氯Cl,溴 Br,碘I;
(4)硫S,硒Se,碲Te;
(5)锰Mn,铬Cr,铁Fe。
活动一:黑暗中的摸索、论证:
活动: 以上面的分析为例,对学案上的(三)、(四)进行分析,以小组为单位,确定该观点继承和发展了什么?缺点是什么?
活动一:黑暗中的摸索、论证:
(三)1862年(73年后),发现了60种元素:
法国教授尚古多,按照原子量由小到大把元素标记在分成16格的圆柱体上,发现化学性质相似的元素在同一条垂线上。
评价:
1.背景:1860年初步统一了原子量
2.继承和发展:元素性质周期性变化
3.缺点:主观性
为什么是16,有例外!
4.当时的影响:
无人支持
(1)锂Li,钠 Na,钾 K;
(2)氟F 氯Cl,溴 Br,碘I;
(3)硫S,硒Se,碲Te;
活动一:黑暗中的摸索、论证:
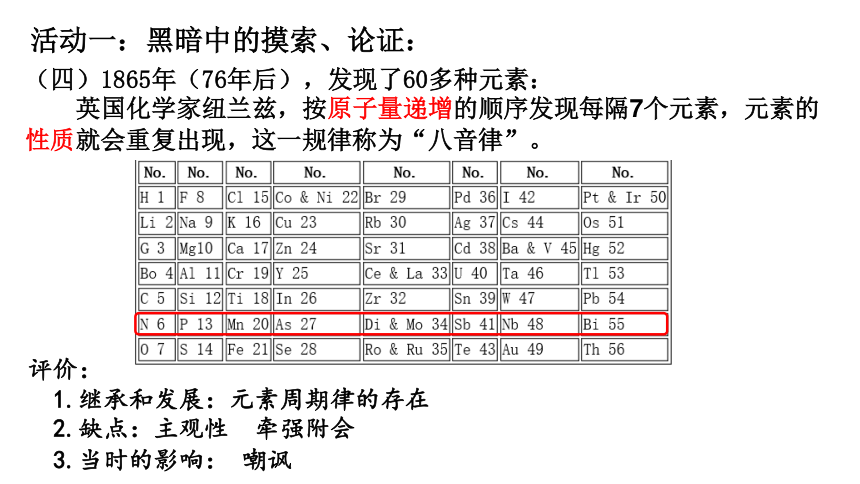
(四)1865年(76年后),发现了60多种元素:
英国化学家纽兰兹,按原子量递增的顺序发现每隔7个元素,元素的性质就会重复出现,这一规律称为“八音律”。
评价:
1.继承和发展:元素周期律的存在
2.缺点:主观性 牵强附会
3.当时的影响: 嘲讽
活动一:黑暗中的摸索、论证:
(五)1861年(72年后),发现了63种元素:
俄国化学家门捷列夫,寻找元素间的规律。
苦苦的思索,使他十分疲惫。有一次,他伏在办公桌上睡着了。梦见自己在打牌,但手里拿着的不是一般的扑克牌,而是一张张写有元素名称的纸牌。玩了一会儿,竟把元素纸牌分成了若干类,而且又排列了一张元素分类表。
醒后,赶紧找来63张厚纸,做成卡片,在每一张常片上都写上了元素名称、原子量、化合物的化学式和主要性质。有了纸牌,研究起元素分类、寻求元素间的联系,就方便得多了,有时为了把全部60多张纸牌看清楚,他不得不把纸牌摆放到一个很大的实验台上,而自己高高地站在一个凳子上。
活动一:黑暗中的摸索、论证:
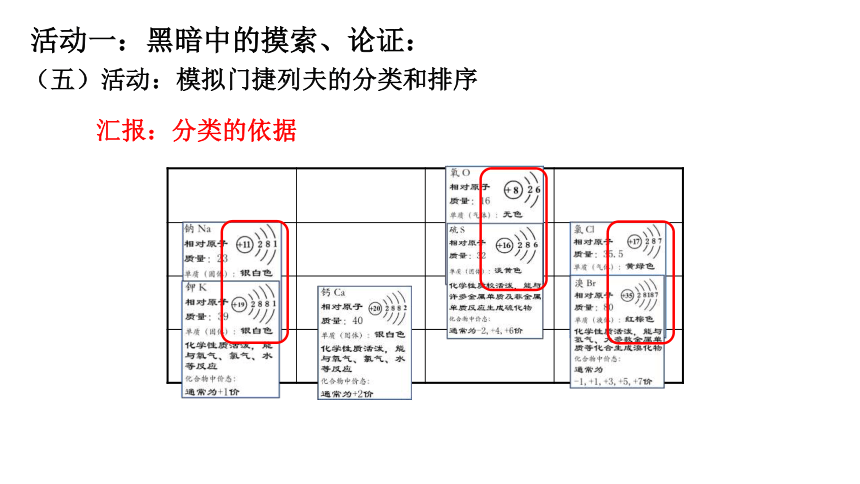
(五)活动:模拟门捷列夫的分类和排序,注意分类的依据!
活动一:黑暗中的摸索、论证:
(五)活动:模拟门捷列夫的分类和排序
汇报:分类的依据
活动一:黑暗中的摸索、论证:
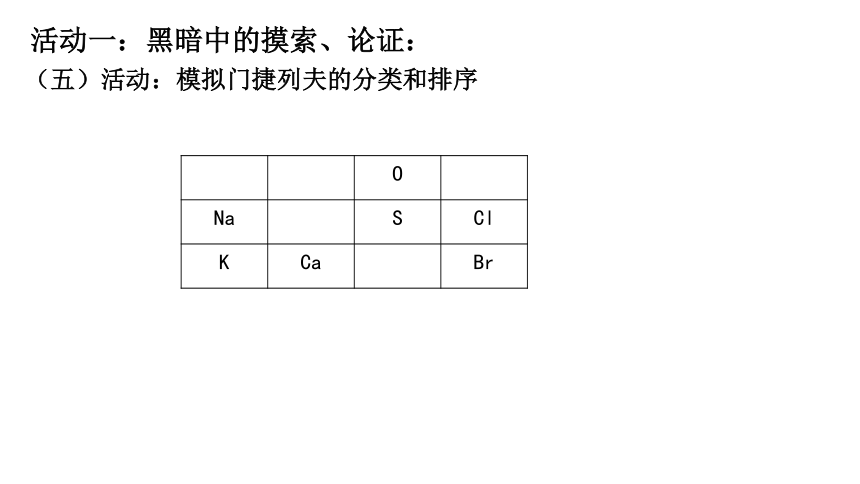
(五)活动:模拟门捷列夫的分类和排序
O
Na S Cl
K Ca Br
活动一:黑暗中的摸索、论证:
(五)1869年2月17日
(80年后,开始玩牌的8年后)
当时的影响:
没有引起重视,反而受到许多化学家的嘲讽
活动一:黑暗中的摸索、论证:
(五)门捷列夫对此并不在意,坚信自己研究的价值
1.铟,原子量是75.4,铟应排在砷和硒之间,就把元素性质的规律破坏了。门捷列夫查阅了铟的发现者的论文,铟的原子量是113.1,按这个原子量,铟排在镉和锡之间,这样排使得元素性质的变化又符合规律了。
2.“应该重新测定锇、铱、铂的原子量”门捷列夫向科学界提出建议。
再次测定的结果是:锇为190.1,铱为193.1,铂为195.2,这样,按锇、铱、铂、金的顺序排列,完全符合原子量递增的顺序。门捷列夫还修正了铍、钛、铈、铀等元素的原子量,所排出的元素队伍有明显的周期性了。
活动一:黑暗中的摸索、论证:
(五)经过2年含辛茹苦的奋斗,1871年12月,他发表了第二张元素周期表,每一横行为一个周期,每一竖行为一个族
按原子量的大小,砷应排在锌的后面。这样排的话,砷的性质应与铅相似,但它的性质与磷相似。他根据演绎推理,做了一个大胆的假设:“既然元素是一个个被发现的,那么,元素周期表上就应当给尚未被发现的元素留下一席之地”,门捷列夫预言,在锌和砷之间,应该还有别的元素,“就把它叫做‘类铝’吧!”。
活动一:黑暗中的摸索、论证:
(五)门捷列夫的“类铝”、“类硅”等的证实
活动一:黑暗中的摸索、论证:
(六)德国化学家迈尔的遗憾 人教版教材92页 科学史话
活动一:黑暗中的摸索、论证:
(七) 历史的高速发展
4.1919年发现质子
5.1932年发现中子、核式模型修正
活动一:黑暗中的摸索、论证:
(七) 历史的高速发展
6. 20 世纪 30 年代,科学家弄清了各元素原子的核外电子排布之后,才实现了对元素周期律实质的认识。
1936年构造原理的发现
1789年
1829年
1865年
1869年
1913年
1936年
1897年
发现电子
1911年
原子的核式模型
1860年
统一原子量
活动一:黑暗中的摸索、论证:
1803年
道尔顿原子论
依据:原子量、性质、周期性
依据?
活动二:认识元素周期表:
观察元素周期表,分析构成要素及依据
活动二:认识元素周期表:
元素周期表排布特点
元素周期表
横行:周期
纵列:族
周期序数=电子层数
主族序数=最外层电子数
按照核电荷数(质子数)由小到大排列
活动二:认识元素周期表:
活动二:认识元素周期表:
元素周期表排布特点
元素周期表
横行:周期,7个
纵列:族,18列,16个族
周期序数=电子层数
主族序数=最外层电子数
主族:IA-VIIA
副族:IB-VIIB,VIII
0族:稀有气体
按照核电荷数(质子数)由小到大排列
短周期:1-3
长周期:4-7
活动二:认识元素周期表:
对元素周期表,还有哪些疑问吗?
活动三:认识元素周期表的实质:
活动:从核外电子排布的角度,认识元素周期表的形成过程。
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
1.前3周期
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
1.前3周期
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四周期
+20
2
8
8
2
4s2
+19
2
8
8
1
+21
2
8
9
2
4s1
3d14s2
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四周期
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四周期
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四周期
第四周期
4s1
4s2
3d14s2
3d104s2
4s24p6
多了10种元素
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四、五周期
第四周期
4s1
4s2
3d14s2
3d104s2
4s24p6
第五周期
5s1
5s2
4d15s2
4d105s2
5s25p6
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第六、七周期
第六周期:6s 4f 5p 6p 多了14种元素镧系
第七周期:锕系
总结:
原子结构
反映
决定
元素周期表
(元素位置)
核电荷数
核外电子排布
结构
规律
1.如何处理碘I-129、铯Cs-135、锶Sr-90、钴Co-60等元素?
有没有和它们性质相似的、已学习过的元素?
活动四:元素周期表的应用
元素周期表
日本政府宣布,2023年8月24日启动福岛核污染水排海。日本核污染水排海至少要持续30年,将会影响整个太平洋乃至全球海域。核污水主要含有:碘I-129、铯Cs-135、锶Sr-90、钴Co-60,还有铀U-235、钚Pu-239等放射性元素,半衰期有的长达亿年。
如何处理碘I-129、铯Cs-135、锶Sr-90、钴Co-60等元素?
问题:
1.有没有和它们性质相似的、已学习过的元素?
2.元素之间有何内在联系?现已发现的一百多种元素之间能否有序排列或分类?
活动一:黑暗中的摸索、论证:
(一)1789年,发现了33种元素,法国化学家拉瓦锡,按照化学性质分为金属元素,非金属元素等四组。
简单中性物质:光、热、氧、氮、氢
简单的非金属物质:硫、磷、碳、盐酸基、氢氟酸基、硼酸基
简单的金属物质:锑、银、铋、铜、钴、锰、汞、金、铂、铅、锌、锡、铁、钼、镍、钨
简单的碱性物质:石灰、镁土、铝土、钡土、硅土
评价:
1.优点:开始分类
2.缺点:没有真正弄清元素的含义,受“水、火、土、气”四元素说的影响把光、热、石灰等当成了元素
活动一:黑暗中的摸索、论证:
(二)1829年(44年后),发现了44种元素:
德国化学家德贝莱纳,按照原子量把化学性质相似的元素为一组。
评价:
1.背景:道尔顿原子论、原子量建立
2.继承和发展:元素的内在联系
3.缺点:主观性、无系统性
F=19 Cl=35.5、Br=80
4.当时的影响:
不认可
(1)锂Li,钠 Na,钾 K;
(2)钙Ca,锶Sr,钡Ba;
(3)氯Cl,溴 Br,碘I;
(4)硫S,硒Se,碲Te;
(5)锰Mn,铬Cr,铁Fe。
活动一:黑暗中的摸索、论证:
活动: 以上面的分析为例,对学案上的(三)、(四)进行分析,以小组为单位,确定该观点继承和发展了什么?缺点是什么?
活动一:黑暗中的摸索、论证:
(三)1862年(73年后),发现了60种元素:
法国教授尚古多,按照原子量由小到大把元素标记在分成16格的圆柱体上,发现化学性质相似的元素在同一条垂线上。
评价:
1.背景:1860年初步统一了原子量
2.继承和发展:元素性质周期性变化
3.缺点:主观性
为什么是16,有例外!
4.当时的影响:
无人支持
(1)锂Li,钠 Na,钾 K;
(2)氟F 氯Cl,溴 Br,碘I;
(3)硫S,硒Se,碲Te;
活动一:黑暗中的摸索、论证:
(四)1865年(76年后),发现了60多种元素:
英国化学家纽兰兹,按原子量递增的顺序发现每隔7个元素,元素的性质就会重复出现,这一规律称为“八音律”。
评价:
1.继承和发展:元素周期律的存在
2.缺点:主观性 牵强附会
3.当时的影响: 嘲讽
活动一:黑暗中的摸索、论证:
(五)1861年(72年后),发现了63种元素:
俄国化学家门捷列夫,寻找元素间的规律。
苦苦的思索,使他十分疲惫。有一次,他伏在办公桌上睡着了。梦见自己在打牌,但手里拿着的不是一般的扑克牌,而是一张张写有元素名称的纸牌。玩了一会儿,竟把元素纸牌分成了若干类,而且又排列了一张元素分类表。
醒后,赶紧找来63张厚纸,做成卡片,在每一张常片上都写上了元素名称、原子量、化合物的化学式和主要性质。有了纸牌,研究起元素分类、寻求元素间的联系,就方便得多了,有时为了把全部60多张纸牌看清楚,他不得不把纸牌摆放到一个很大的实验台上,而自己高高地站在一个凳子上。
活动一:黑暗中的摸索、论证:
(五)活动:模拟门捷列夫的分类和排序,注意分类的依据!
活动一:黑暗中的摸索、论证:
(五)活动:模拟门捷列夫的分类和排序
汇报:分类的依据
活动一:黑暗中的摸索、论证:
(五)活动:模拟门捷列夫的分类和排序
O
Na S Cl
K Ca Br
活动一:黑暗中的摸索、论证:
(五)1869年2月17日
(80年后,开始玩牌的8年后)
当时的影响:
没有引起重视,反而受到许多化学家的嘲讽
活动一:黑暗中的摸索、论证:
(五)门捷列夫对此并不在意,坚信自己研究的价值
1.铟,原子量是75.4,铟应排在砷和硒之间,就把元素性质的规律破坏了。门捷列夫查阅了铟的发现者的论文,铟的原子量是113.1,按这个原子量,铟排在镉和锡之间,这样排使得元素性质的变化又符合规律了。
2.“应该重新测定锇、铱、铂的原子量”门捷列夫向科学界提出建议。
再次测定的结果是:锇为190.1,铱为193.1,铂为195.2,这样,按锇、铱、铂、金的顺序排列,完全符合原子量递增的顺序。门捷列夫还修正了铍、钛、铈、铀等元素的原子量,所排出的元素队伍有明显的周期性了。
活动一:黑暗中的摸索、论证:
(五)经过2年含辛茹苦的奋斗,1871年12月,他发表了第二张元素周期表,每一横行为一个周期,每一竖行为一个族
按原子量的大小,砷应排在锌的后面。这样排的话,砷的性质应与铅相似,但它的性质与磷相似。他根据演绎推理,做了一个大胆的假设:“既然元素是一个个被发现的,那么,元素周期表上就应当给尚未被发现的元素留下一席之地”,门捷列夫预言,在锌和砷之间,应该还有别的元素,“就把它叫做‘类铝’吧!”。
活动一:黑暗中的摸索、论证:
(五)门捷列夫的“类铝”、“类硅”等的证实
活动一:黑暗中的摸索、论证:
(六)德国化学家迈尔的遗憾 人教版教材92页 科学史话
活动一:黑暗中的摸索、论证:
(七) 历史的高速发展
4.1919年发现质子
5.1932年发现中子、核式模型修正
活动一:黑暗中的摸索、论证:
(七) 历史的高速发展
6. 20 世纪 30 年代,科学家弄清了各元素原子的核外电子排布之后,才实现了对元素周期律实质的认识。
1936年构造原理的发现
1789年
1829年
1865年
1869年
1913年
1936年
1897年
发现电子
1911年
原子的核式模型
1860年
统一原子量
活动一:黑暗中的摸索、论证:
1803年
道尔顿原子论
依据:原子量、性质、周期性
依据?
活动二:认识元素周期表:
观察元素周期表,分析构成要素及依据
活动二:认识元素周期表:
元素周期表排布特点
元素周期表
横行:周期
纵列:族
周期序数=电子层数
主族序数=最外层电子数
按照核电荷数(质子数)由小到大排列
活动二:认识元素周期表:
活动二:认识元素周期表:
元素周期表排布特点
元素周期表
横行:周期,7个
纵列:族,18列,16个族
周期序数=电子层数
主族序数=最外层电子数
主族:IA-VIIA
副族:IB-VIIB,VIII
0族:稀有气体
按照核电荷数(质子数)由小到大排列
短周期:1-3
长周期:4-7
活动二:认识元素周期表:
对元素周期表,还有哪些疑问吗?
活动三:认识元素周期表的实质:
活动:从核外电子排布的角度,认识元素周期表的形成过程。
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
1.前3周期
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
1.前3周期
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四周期
+20
2
8
8
2
4s2
+19
2
8
8
1
+21
2
8
9
2
4s1
3d14s2
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四周期
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四周期
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四周期
第四周期
4s1
4s2
3d14s2
3d104s2
4s24p6
多了10种元素
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第四、五周期
第四周期
4s1
4s2
3d14s2
3d104s2
4s24p6
第五周期
5s1
5s2
4d15s2
4d105s2
5s25p6
活动三:认识元素周期表的实质:
从核外电子排布的角度,认识元素周期表的形成过程。
2.第六、七周期
第六周期:6s 4f 5p 6p 多了14种元素镧系
第七周期:锕系
总结:
原子结构
反映
决定
元素周期表
(元素位置)
核电荷数
核外电子排布
结构
规律
1.如何处理碘I-129、铯Cs-135、锶Sr-90、钴Co-60等元素?
有没有和它们性质相似的、已学习过的元素?
活动四:元素周期表的应用
