鲁教版八年级化学第五单元 第三节 化学反应中的有关计算课件(共33张PPT)
文档属性
| 名称 | 鲁教版八年级化学第五单元 第三节 化学反应中的有关计算课件(共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 11:44:05 | ||
图片预览






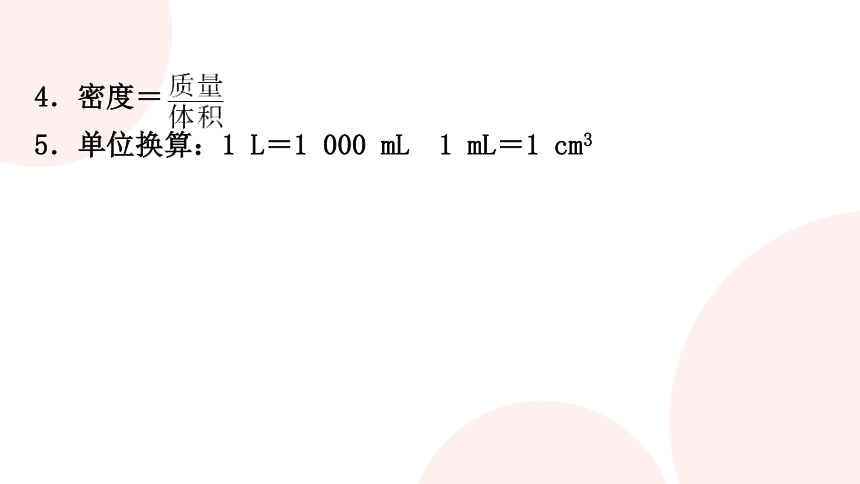





文档简介
(共33张PPT)
第三节 化学反应中的有关计算
化学方程式计算的依据
1.理论证据:_________定律。
2.计算依据:
化学方程式中各物质的质量比在数值上等于_________________
___________的乘积之比。
3.化学方程式表示的意义:从量的方面看,它表示反应物、生
成物之间分子或原子个数比,也表示它们之间的质量比。因此根
据化学方程式中各物质间的质量比,通过列比例式的方式进行计
算。
质量守恒
相对分子质量与其
化学计量数
知识讲解
化学方程式计算的步骤及常见题型
1.计算步骤:
(1)设未知量。
(2)写出反应的___________。
(3)找出反应物与生成物之间的_________,并将与之成比例的
已知量与未知量写在相应位置上。
(4)列出_______,求解。
(5)检查无误后简明地写出答案。
化学方程式
质量关系
比例式
计算的5个关键点
①设未知数时不带单位;②正确书写化学方程式是关键,特别要注意配平;③计算过程中要带单位;④把不纯物质的量换算成纯净物的量代入计算;⑤同一题目中不同未知量不能用同一字母表示。
2.根据化学方程式计算的常见题型:
(1)已知某反应物的质量,求另一反应物或生成物的质量。
(2)已知某生成物的质量,求另一生成物或反应物的质量。
(3)含杂质物质的有关计算。
化学方程式计算常用的几个关系式
1.分解百分率= ×100%
2.某物质的质量分数= ×100%
3.纯净物的质量=混合物的质量×该纯净物在混合物中的质量分数
4.密度=
5.单位换算:1 L=1 000 mL 1 mL=1 cm3
已知反应物的质量,求生成物的质量
典例1 [2022·安徽]某同学在学习质量守恒定律时,称取0.6 g镁条进行燃烧实验(如图)。
(1)计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。
(2)该同学称得反应后固体的质量小于0.6 g,
原因可能是________。
典例分析
思路导析⊙ (1)根据镁的性质和质量守恒定律分析解答。
解题过程⊙ 解:(1)设生成氧化镁的质量为x。
2Mg+O2 2MgO
48 80
0.6 g x
x=1 g
答:生成氧化镁的质量为1 g。
(2)镁条完全燃烧后固体质量小于0.6 g,可能是生成的部分氧化镁以白烟形式逸散。
变式1 完全电解18 g水产生氧气的质量是( )
A.2 g B.4 g C.16 g D.32 g
已知生成物的质量,求反应物的质量
典例2 [2022·北京]钙在冶炼工业中具有重要的作用,可采用电解熔融氯化钙的方法生产钙,反应的化学方程式为CaCl2
Ca+Cl2↑,若制得40 kg Ca。请计算:参加反应的CaCl2的质量(写出计算过程及结果)。
解题过程⊙ 解:设参加反应的氯化钙的质量为x。
CaCl2 Ca+Cl2↑
111 40
x 40 kg
x=111 kg
答:参加反应的氯化钙的质量为111 kg。
变式2 二氧化碳是一种宝贵的碳氧资源。一定条件下,二氧化碳转变成燃料甲醇(CH3OH)的化学方程式为 CO2+3H2===CH3OH+H2O。若生产64 t甲醇,则可回收二氧化碳的质量是多少?
解:设可回收二氧化碳的质量为x。
CO2+3H2===CH3OH+H2O
44 32
x 64t
x=88 t
答:可回收二氧化碳的质量是88 t。
有关反应物中含杂质的计算
典例3 小明同学用不纯的氯酸钾样品(杂质受热不分解)与2 g二氧化锰混合放在大试管中加热制取氧气,测得试管中剩余固体的质量与反应时间的关系如图。求:
(1)氯酸钾在________时刻开始分解。
(2)小明同学共制得氧气________g。
(3)小明所用样品中氯酸钾的质量分数是多少(写出计算过程)
解题过程⊙ (1)由图像知固体质量在t1时刻开始减少,即氯酸钾此时开始分解。(2)反应过程中,固体质量减少16 g-11.2 g=4.8 g,即共制得氧气4.8 g。
(3)解:设样品中氯酸钾的质量为x。
2KClO3 2KCl+3O2↑
245 96
x 4.8 g
x=12.25 g
则样品中氯酸钾的质量分数是 ×100%=87.5%
答:样品中氯酸钾的质量分数是87.5%。
变式3 为了测定某石灰石中碳酸钙的质量分数,某同学进行了如下实验:称取10.0 g石灰石样品高温煅烧,石灰石在高温条件下可生成生石灰和二氧化碳,实验数据记录如表(杂质不参与反应):
求石灰石样品中碳酸钙的质量分数(写出计算过程)。
解:设样品中CaCO3的质量为x。
CaCO3 CaO+CO2↑
100 44
x 3.3 g
x=7.5 g
样品中CaCO3的质量分数= ×100%=75%
答:样品中CaCO3的质量分数是75%。
1.现将20 g A和足量B在一定条件下充分反应,生成16 g C和11 g D,则参加反应的A和B的质量比是( )
A.20∶11 B.20∶7
C.5∶4 D.16∶11
随堂练习
2.在化学反应3A+2B=2C+4D中,已知B、C、D的相对分子质量比为16∶22∶9,若24 g A恰好完全反应,同时生成D的质量为( )
A.4.5 g B.9 g C.18 g D.36 g
3.质量相同的下列四种物质,完全分解后制得氧气质量最多的是( )
A.H2O2 B.KMnO4
C.KClO3 D.H2O
4.[2022·衡阳]以下是某同学解答一道计算题的过程,请你一起参与完成相关问题。
题目:将氯酸钾和二氧化锰的混合物共27.5 g放入试管中加热,反应中剩余固体质量与反应时间的关系如图。完全反应后,生成氯化钾的质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
2KClO3 2KCl+3O2↑
122.5 74.5
27.5 g x
答:生成KCl的质量为16.7 g。
请回答下列问题:
(1)从图中可知完全反应后生成的O2质量是____g。
(2)上述计算过程是否正确?_____(填“正确”或“错误”)。如果错误,请你重新利用化学方程式计算生成KCl的质量。
9.6
错误
解析:(1)根据质量守恒定律可知,完全反应后生成的O2质量是27.5 g-17.9 g=9.6 g;
(2)27.5 g是氯酸钾和二氧化锰的混合物的质量,不是氯酸钾质量,故上述计算过程错误。
设生成KCl的质量为x。
2KClO3 2KCl+3O2↑
149 96
x 9.6 g
x=14.9 g
答:生成KCl的质量为14.9 g。
5.实验室为了测定过氧化氢溶液的质量分数,称取85.00 g H2O2溶液和2.0 g MnO2混合放入质量为50.00 g的烧杯中,用电子天平称得烧杯的总质量随时间变化如表所示:
(1)产生O2的质量为____g。
(2)过氧化氢溶液中过氧化氢的质量是多少(写出解题过程)
1.6
解:设过氧化氢质量为x。
2H2O2 2H2O+O2↑
68 32
x 1.6 g
x=3.4 g
答:过氧化氢质量为3.4 g。
6.实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如图:
请回答下列问题:
(1)a=____。
(2)受热分解的氯酸钾的质量为_______(精确到0.1 g)。
4.5
12.3 g
解:设受热分解的氯酸钾的质量为x,生成KCl的质量为y。
2KClO3 2KCl + 3O2↑
2×122.5 2×74.5 96
x y 4.8 g
x=12.3 g
y=7.5 g
a=18.2 g-(18.5 g-12.3 g)-7.5 g=4.5 g
谢谢观看
第三节 化学反应中的有关计算
化学方程式计算的依据
1.理论证据:_________定律。
2.计算依据:
化学方程式中各物质的质量比在数值上等于_________________
___________的乘积之比。
3.化学方程式表示的意义:从量的方面看,它表示反应物、生
成物之间分子或原子个数比,也表示它们之间的质量比。因此根
据化学方程式中各物质间的质量比,通过列比例式的方式进行计
算。
质量守恒
相对分子质量与其
化学计量数
知识讲解
化学方程式计算的步骤及常见题型
1.计算步骤:
(1)设未知量。
(2)写出反应的___________。
(3)找出反应物与生成物之间的_________,并将与之成比例的
已知量与未知量写在相应位置上。
(4)列出_______,求解。
(5)检查无误后简明地写出答案。
化学方程式
质量关系
比例式
计算的5个关键点
①设未知数时不带单位;②正确书写化学方程式是关键,特别要注意配平;③计算过程中要带单位;④把不纯物质的量换算成纯净物的量代入计算;⑤同一题目中不同未知量不能用同一字母表示。
2.根据化学方程式计算的常见题型:
(1)已知某反应物的质量,求另一反应物或生成物的质量。
(2)已知某生成物的质量,求另一生成物或反应物的质量。
(3)含杂质物质的有关计算。
化学方程式计算常用的几个关系式
1.分解百分率= ×100%
2.某物质的质量分数= ×100%
3.纯净物的质量=混合物的质量×该纯净物在混合物中的质量分数
4.密度=
5.单位换算:1 L=1 000 mL 1 mL=1 cm3
已知反应物的质量,求生成物的质量
典例1 [2022·安徽]某同学在学习质量守恒定律时,称取0.6 g镁条进行燃烧实验(如图)。
(1)计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。
(2)该同学称得反应后固体的质量小于0.6 g,
原因可能是________。
典例分析
思路导析⊙ (1)根据镁的性质和质量守恒定律分析解答。
解题过程⊙ 解:(1)设生成氧化镁的质量为x。
2Mg+O2 2MgO
48 80
0.6 g x
x=1 g
答:生成氧化镁的质量为1 g。
(2)镁条完全燃烧后固体质量小于0.6 g,可能是生成的部分氧化镁以白烟形式逸散。
变式1 完全电解18 g水产生氧气的质量是( )
A.2 g B.4 g C.16 g D.32 g
已知生成物的质量,求反应物的质量
典例2 [2022·北京]钙在冶炼工业中具有重要的作用,可采用电解熔融氯化钙的方法生产钙,反应的化学方程式为CaCl2
Ca+Cl2↑,若制得40 kg Ca。请计算:参加反应的CaCl2的质量(写出计算过程及结果)。
解题过程⊙ 解:设参加反应的氯化钙的质量为x。
CaCl2 Ca+Cl2↑
111 40
x 40 kg
x=111 kg
答:参加反应的氯化钙的质量为111 kg。
变式2 二氧化碳是一种宝贵的碳氧资源。一定条件下,二氧化碳转变成燃料甲醇(CH3OH)的化学方程式为 CO2+3H2===CH3OH+H2O。若生产64 t甲醇,则可回收二氧化碳的质量是多少?
解:设可回收二氧化碳的质量为x。
CO2+3H2===CH3OH+H2O
44 32
x 64t
x=88 t
答:可回收二氧化碳的质量是88 t。
有关反应物中含杂质的计算
典例3 小明同学用不纯的氯酸钾样品(杂质受热不分解)与2 g二氧化锰混合放在大试管中加热制取氧气,测得试管中剩余固体的质量与反应时间的关系如图。求:
(1)氯酸钾在________时刻开始分解。
(2)小明同学共制得氧气________g。
(3)小明所用样品中氯酸钾的质量分数是多少(写出计算过程)
解题过程⊙ (1)由图像知固体质量在t1时刻开始减少,即氯酸钾此时开始分解。(2)反应过程中,固体质量减少16 g-11.2 g=4.8 g,即共制得氧气4.8 g。
(3)解:设样品中氯酸钾的质量为x。
2KClO3 2KCl+3O2↑
245 96
x 4.8 g
x=12.25 g
则样品中氯酸钾的质量分数是 ×100%=87.5%
答:样品中氯酸钾的质量分数是87.5%。
变式3 为了测定某石灰石中碳酸钙的质量分数,某同学进行了如下实验:称取10.0 g石灰石样品高温煅烧,石灰石在高温条件下可生成生石灰和二氧化碳,实验数据记录如表(杂质不参与反应):
求石灰石样品中碳酸钙的质量分数(写出计算过程)。
解:设样品中CaCO3的质量为x。
CaCO3 CaO+CO2↑
100 44
x 3.3 g
x=7.5 g
样品中CaCO3的质量分数= ×100%=75%
答:样品中CaCO3的质量分数是75%。
1.现将20 g A和足量B在一定条件下充分反应,生成16 g C和11 g D,则参加反应的A和B的质量比是( )
A.20∶11 B.20∶7
C.5∶4 D.16∶11
随堂练习
2.在化学反应3A+2B=2C+4D中,已知B、C、D的相对分子质量比为16∶22∶9,若24 g A恰好完全反应,同时生成D的质量为( )
A.4.5 g B.9 g C.18 g D.36 g
3.质量相同的下列四种物质,完全分解后制得氧气质量最多的是( )
A.H2O2 B.KMnO4
C.KClO3 D.H2O
4.[2022·衡阳]以下是某同学解答一道计算题的过程,请你一起参与完成相关问题。
题目:将氯酸钾和二氧化锰的混合物共27.5 g放入试管中加热,反应中剩余固体质量与反应时间的关系如图。完全反应后,生成氯化钾的质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
2KClO3 2KCl+3O2↑
122.5 74.5
27.5 g x
答:生成KCl的质量为16.7 g。
请回答下列问题:
(1)从图中可知完全反应后生成的O2质量是____g。
(2)上述计算过程是否正确?_____(填“正确”或“错误”)。如果错误,请你重新利用化学方程式计算生成KCl的质量。
9.6
错误
解析:(1)根据质量守恒定律可知,完全反应后生成的O2质量是27.5 g-17.9 g=9.6 g;
(2)27.5 g是氯酸钾和二氧化锰的混合物的质量,不是氯酸钾质量,故上述计算过程错误。
设生成KCl的质量为x。
2KClO3 2KCl+3O2↑
149 96
x 9.6 g
x=14.9 g
答:生成KCl的质量为14.9 g。
5.实验室为了测定过氧化氢溶液的质量分数,称取85.00 g H2O2溶液和2.0 g MnO2混合放入质量为50.00 g的烧杯中,用电子天平称得烧杯的总质量随时间变化如表所示:
(1)产生O2的质量为____g。
(2)过氧化氢溶液中过氧化氢的质量是多少(写出解题过程)
1.6
解:设过氧化氢质量为x。
2H2O2 2H2O+O2↑
68 32
x 1.6 g
x=3.4 g
答:过氧化氢质量为3.4 g。
6.实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如图:
请回答下列问题:
(1)a=____。
(2)受热分解的氯酸钾的质量为_______(精确到0.1 g)。
4.5
12.3 g
解:设受热分解的氯酸钾的质量为x,生成KCl的质量为y。
2KClO3 2KCl + 3O2↑
2×122.5 2×74.5 96
x y 4.8 g
x=12.3 g
y=7.5 g
a=18.2 g-(18.5 g-12.3 g)-7.5 g=4.5 g
谢谢观看
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
