专题1《化学反应与能量变化》(含解析)单元检测题2023---2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题1《化学反应与能量变化》(含解析)单元检测题2023---2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 984.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 11:54:05 | ||
图片预览




文档简介
专题1《化学反应与能量变化》
一、单选题(共14题)
1.下列说法不正确的是
A.热化学方程式中的与该方程式中的计量数有关
B.旧化学键的断裂和新化学键的形成都需要吸收能量
C.燃烧热和中和热都属于反应热
D.一个化学反应不属于放热反应,一定属于吸热反应
2.纯净物状态下的标准电极电势,可用来比较对应氧化剂的氧化性强弱,现有5组标准电极电势数据如表所示:
氧化还原电对(氧化型/还原型) 电极反应式 标准电极电势
0.77
0.54
1.36
1.07
0.151
下列分析不正确的是
A.氧化性:
B.往淀粉溶液中滴加溶液,溶液不变蓝
C.往含有的溶液中滴加少量溴水,溶液变红色
D.溶液与溶液反应的离子方程式为:
3.如图装置是酒精检测仪,工作原理与酸性燃料电池相似。下列说法不正确的是
A.该电池的总反应式为:
B.当右侧Pt电极表面有0.2mol发生还原反应时,会有0.8mol向左移动
C.电流由所在的铂电极经外电路流向另一电极
D.该装置实现了化学能转化为电能
4.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)= 4CO2(g)+ 2H2O(l); H=-2b kJ/mol
B.C2H2(g)+ 5/2O2(g)= 2CO2(g)+H2O(l); H=2b kJ/mol
C.2C2H2(g)+5O2(g)= 4CO2(g)+2H2O(l); H=-4b kJ/mol
D.2C2H2(g)+5O2(g)= 4CO2(g)+ 2H2O(l); H=b kJ/mol
5.化学与生产、生活、科技等密切相关。下列说法错误的是
A.制作电饭锅内胆的304不锈钢属于合金
B.制作亚克力浴缸的聚甲基丙烯酸甲酯属于有机高分子材料
C.大力实施矿物燃料的脱硫脱硝,可以减少、的排放
D.喷油漆、涂油脂、电镀或金属表面钝化,都是金属防护的物理方法
6.全钒液流电池的放电原理为VO+V2++2H+=VO2++V3++H2O,该电池续航能力强,充电时间短。用太阳能电池给全钒液流电池充电的装置示意图如图所示。下列说法错误的是
A.太阳能电池放电时,化学能转化为电能
B.电极M上的电势低于电极N上的电势
C.交换膜可选用质子交换膜
D.全钒液流电池放电时,正极的电极反应式为VO+2H++e-=VO2++H2O
7.某燃料电池以乙醇为燃料,空气为氧化剂,强碱溶液为电解质组成,有关该电池的说法正确的是
A.放电时正极发生氧化反应
B.放电一段时间后,正极附近溶液的pH减小
C.放电时负极电极反应为:
D.消耗0.2mol乙醇,有1.2mol转移
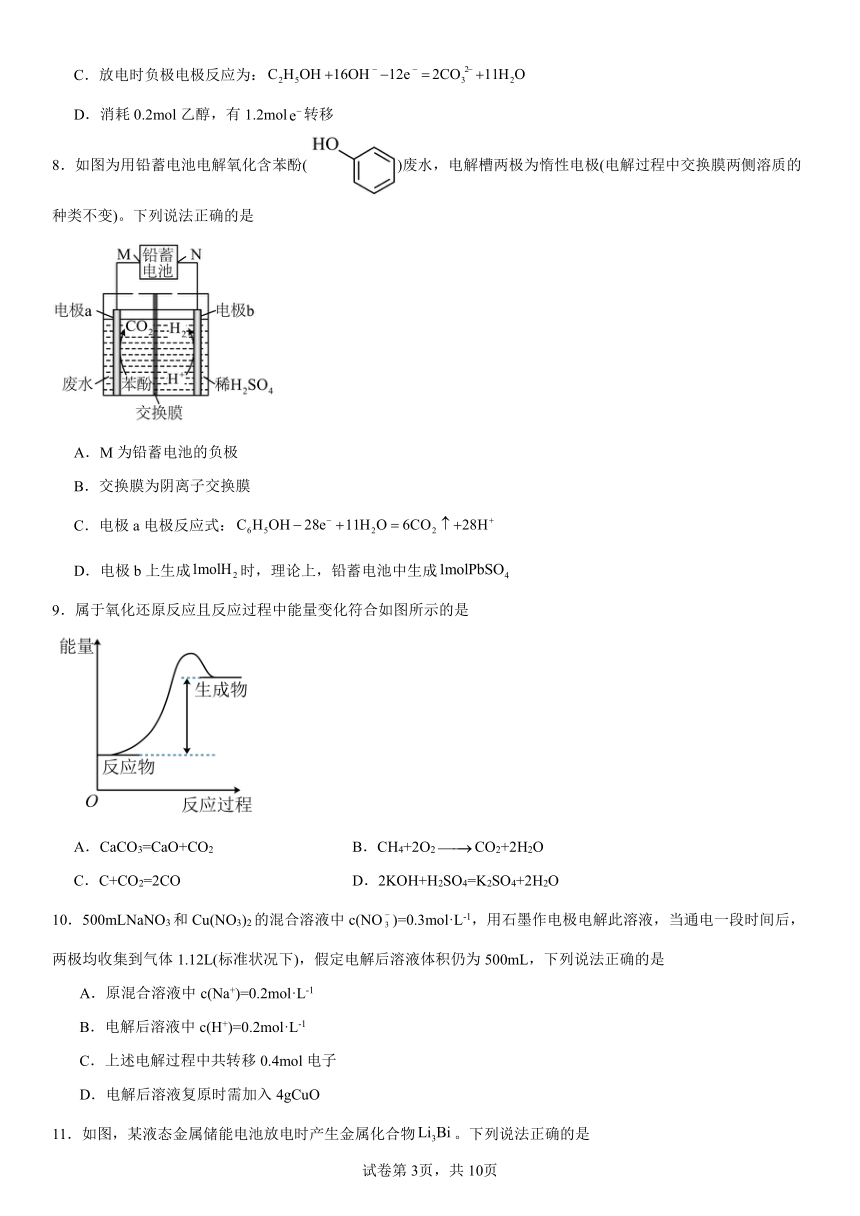
8.如图为用铅蓄电池电解氧化含苯酚()废水,电解槽两极为惰性电极(电解过程中交换膜两侧溶质的种类不变)。下列说法正确的是
A.M为铅蓄电池的负极
B.交换膜为阴离子交换膜
C.电极a电极反应式:
D.电极b上生成时,理论上,铅蓄电池中生成
9.属于氧化还原反应且反应过程中能量变化符合如图所示的是
A.CaCO3=CaO+CO2 B.CH4+2O2CO2+2H2O
C.C+CO2=2CO D.2KOH+H2SO4=K2SO4+2H2O
10.500mLNaNO3和Cu(NO3)2的混合溶液中c(NO)=0.3mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12L(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是
A.原混合溶液中c(Na+)=0.2mol·L-1
B.电解后溶液中c(H+)=0.2mol·L-1
C.上述电解过程中共转移0.4mol电子
D.电解后溶液复原时需加入4gCuO
11.如图,某液态金属储能电池放电时产生金属化合物。下列说法正确的是
A.放电时,M电极反应为
B.放电时,由M电极向N电极移动
C.充电时,M电极的质量减小
D.充电时,N电极反应为
12.如图所示的装置中进行硫酸和氢氧化钠的中和反应。通过测定反应过程中放出的热量可计算中和热。下列关于该实验的说法正确的是
A.烧杯间的碎泡沫塑料的作用只是固定小烧杯的位置
B.如果没有玻璃搅拌器,酸碱混合后可用温度计轻轻搅拌
C.实验时应慢慢把氢氧化钠溶液倒入盛有硫酸溶液的内筒中
D.若将氢氧化钠溶液换成氢氧化钠固体,则所测得的中和热的数值偏大
13.下列变化过程,属于放热反应的是
①金属钠与水
②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
③H2在Cl2中燃烧
④水蒸气变成液态水
⑤中和反应
⑥碳酸钙热分解
A.①②⑤ B.①③⑤ C.③④⑤ D.②④⑥
14.下列实验操作、现象及所得结论或解释均正确的是
选项 实验操作 现象 结论或解释
A 在两支试管中分别加入等物质的量浓度的和溶液,然后各滴加2滴酚酞溶液 溶液均变成红色,且溶液颜色更深一些 同浓度的溶液碱性更强
B 向腐蚀覆铜板的废液X中加入少量的铁粉,振荡 未出现红色固体 X中一定不含
C 用坩埚钳夹住一块铝箔在酒精灯上加热 铝箔熔化,失去光泽并滴落下来 金属铝的熔点较低
D 用3mL稀硫酸与纯锌粒反应,再加入几滴浓溶液 迅速产生无色气体 形成Zn—Cu原电池加快了制取的速率
A.A B.B C.C D.D
二、填空题(共8题)
15.回答下列问题
(1)用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化循环实现。
其中,反应①为2HCl(g)+CuO(s) = H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为 (反应热用ΔH1和ΔH2表示)。
(2)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(3)已知:温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1
贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为 。
(4)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 。
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) = CH3OH(g) ΔH1
②CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) = CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 H—H C—O C≡O H—O C—H
E/(kJ·mol-1) 436 343 1076 465 413
由此计算ΔH1= kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3= kJ·mol-1。
(6)已知:① H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
② 断开1mol H2分子中的化学键需要吸收436kJ的能量
③ 断开1mol Cl2分子中的化学键需要吸收243kJ的能量
则:断开1mol HCl分子中的化学键需要吸收 kJ的能量。
16.根据信息回答问题
(1)实验测得28gC2H4(g)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出1411.0kJ的热量,试写出C2H4燃烧热的热化学方程式:
(2)已知反应:。有关键能数据如下:,,,根据键能数据计算a=
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的反应热为: 。C2H2的燃烧热为 。
(4)473K,101KPa时,把1molH2和1molI2放在某密闭容器中进行反应,热化学方程式如下:
,测得反应放出的热量少于14.9kJ,其原因是 。
17.汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化如图甲所示。1molN2和1molO2完全反应生成NO会 (填“吸收"或“放出") kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图乙所示:
①NiO电极上发生的是 反应(填“氧化”或“还原”)。
②外电路中,电子是从 电极流出(填“NiO”或“Pt”)。
③Pt电极上的电极反应式为 。
18.I.回答下列问题:
(1)有下列反应:Fe+Cu2+=Fe2++Cu;2Fe3++Cu=2Fe2++Cu2+;在Cu2+、Fe2+、Fe3+中,其氧化性由强到弱顺序为 。
(2)根据反应MnO2+4HClMnCl2+Cl2↑+2H2O,回答下列问题:
①反应中n(还原剂):n(氧化剂)= 。
②该反应中盐酸的作用是 (填字母)。
A.只氧化性 B.只有酸性 C.只有还原性 D.有氧化性也有酸性 E.有还原性也有酸性
③在方程式上用单线桥表示上述反应电子转移的方向和数目 。
MnO2+4HCl=MnCl2+Cl2↑+2H2O
④配平方程式: 。
______MnO+______C2O+______H+=______Mn2++______CO2↑+______H2O
II.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(3)在101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题。
①氢气燃烧热的热化学方程式为 。
②若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ mol-1,O=O键能为498kJ mol-1,计算H-H键能为 kJ mol-1。
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) △H1=-74.5kJ mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3= kJ mol-1。
19.写出下列二次电池的电极反应式。
类型 放电时负极反应式 充电时阳极反应式
(1)铅蓄电池:
(2)镍镉电池:
(3)钴酸锂电池:
20.绿色能源是未来能源发展的重要方向,氢能是重要的绿色能源,利用生物乙醇来制取氢气的部分反应过程如图所示。
已知:总反应 ;反应Ⅱ 。
(1)则反应Ⅰ的热化学方程式为 。
(2)研究氮和碳的化合物对工业生产和防治污染有重要意义,相关化学键的键能数据如表所示:
化学键
436 946 391
合成氨反应的活化能,由此计算氨分解反应的活化能 。
21.Ⅰ.(化学与生活)保证食品安全、保持营养均衡,是保障人体健康的基础。
(1)维生素C能促进人体生长发育,下列富含维生素C的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
(2)缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是 。
A.碘 B.铁 C.钙
(3)在蛋清溶液中加入饱和硫酸铵溶液有沉淀析出的过程称为 。
Ⅱ.(化学反应原理)
(4)由氢气和氧气反应生成1 mol水蒸气放热241.8 J,写出该反应的热化学方程式: 。已知18 g液态水转化成水蒸气需吸热44 kJ,则反应2H2(g)+O2(g)=2H2O(l)的△H= kJ · mol-1。
(5)已知:2SO2(g)+O2(g)2SO3(g) △H=﹣196.6 kJ · mol-1
2NO(g)+O2(g)2NO2(g) △H=﹣113.0 kJ · mol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的△H= kJ · mol-1。
22.根据所学电化学知识,回答下列问题:
(1)①甲池中通入CH3OH的电极名称是 极,写出其电极反应式 ;乙池中石墨电极反应式为 ;丙池中反应的离子方程式为 ;
②反应一段时间后,甲池中消耗560mL (标准状况下) O2,此时乙池溶液的pH= ;若向乙池中加入 ,其质量为 g,能使CuSO4溶液恢复到原浓度(假设电解前后溶液的体积不变,均为100mL)。丙池中理论上最多产生 g 固体。
(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,写出此过程中阴极上的电极反应式 。
23.微生物电池可用来处理废水中的对氯苯酚,原理如图所示。
(1)该电池放电时,电子从 (填“b→a”或“a→b”)。
(2)a极上生成H2CO3的电极反应为 。
(3)已知b极的电极反应为+2H++2e-=+Cl-,经处理后的水样中要求对氯苯酚的含量小于mmol/L。若废水中对氯苯酚的含量是nmol/L,则处理1m3废水,至少添加CH3COO-的物质的量为 mol(溶液体积变化忽略不计)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.焓变的值与化学方程式的化学计量数有关,化学计量数扩大,则焓变的值相应地就扩大,A项正确;
B.化学反应中旧的化学键断裂需要吸收能量,新的化学键的形成需要放出能量,B项错误;
C.燃烧热和中和热都属于放热反应,是反应热的种类之一,C项正确;
D.化学反应必然伴随能量的变化,则化学反应不属于放热反应,一定属于吸热反应,D项正确;
答案选B。
2.C
【详解】A.标准电极电势越高,其中氧化剂的氧化性越强,氧化性,A项正确;
B.的氧化性弱于,不能氧化得到,因此溶液不变蓝,B项正确;
C.的还原性大于,当加入少量溴水时,溴水先氧化,溴水量不足不能被氧化为,则滴加KSCN溶液不一定变红,C项错误;
D.溶液与溶液反应,具有氧化性,具有还原性,则离子方程式为,D项正确;
答案选C。
3.B
【详解】A.该电池的负极上乙醇失电子发生氧化反应,分析装置图可知酒精在负极被氧气氧化生成醋酸,CH3CH2OH-4e-+H2O=4H++CH3COOH;正极上是氧气得电子的还原反应,O2所在的铂电极处发生还原反应为O2+4e-+4H+=2H2O,总反应式为,故A正确;
B.右侧Pt电极表面O2化合价降低,发生还原反应O2+4e-+4H+=2H2O,当右侧Pt电极表面有0.2mol O2发生还原反应时,会有0.8mol H+向右移动,故B错误;
C.电流由O2所在的铂电极正极经外电路流向另一电极负极上,故C正确;
D.该装置属于原电池,实现了化学能转化为电能,故D正确;
故答案:B。
4.C
【详解】充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,所以生成4 mol二氧化碳气体和液态水,放出热量为4b kJ,则乙炔燃烧的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) H=-4b kJ/mol。
答案选C。
5.D
【详解】A.合金是金属与金属或非金属熔合而成的具有金属特性的物质;304不锈钢属于合金,A正确;
B.聚甲基丙烯酸甲酯属于有机合成高分子材料,B正确;
C.矿物燃料的脱硫脱硝,可以减少、的排放,减少污染物的污染,C正确;
D.金属表面钝化的过程生成新物质,属于化学方法,D错误;
故选D。
6.A
【详解】A. 太阳能电池放电时存在光能转化为电能,故A错误;
B. 由图知,M为阴极,N为阳极,则电极M上的电势低于电极N上的电势,故B正确;
C.由放电总反应知,阳极反应式为VO2++ H2O - e- =+2H+,阴极反应式为V3++e- =V2+,则交换膜适合选择质子交换膜,故C正确;
D.全钒液流电池放电时,正极得电子,反应式为+2H++e-=VO2++ H2O, 故D正确;
故选A。
7.C
【分析】由题意可知,乙醇燃料电池中通入乙醇的一极为负极,碱性条件下,乙醇在负极失去电子发生还原反应生成碳酸根离子和水,电极反应式为C2H5OH+16OH--12e-=2CO+11H2O,通入氧气的一极为正极,氧气在正极上得到电子发生还原反应生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-。
【详解】
A.由分析可知,放电时,通入氧气的一极为正极,氧气在正极上得到电子发生还原反应生成氢氧根离子,A错误;
B.由分析可知,通入氧气的一极为正极,氧气在正极上得到电子发生还原反应生成氢氧根离子,正极附近溶液的氢氧根离子浓度增大,溶液碱性增强,B错误;
C.由分析可知,放电时,通入乙醇的一极为负极,碱性条件下,乙醇在负极失去电子发生还原反应生成碳酸根离子和水,电极反应式为C2H5OH+16OH--12e-=2CO+11H2O,C正确;
D.由分析可知,放电时,通入乙醇的一极为负极,碱性条件下,乙醇在负极失去电子发生还原反应生成碳酸根离子和水,电极反应式为C2H5OH+16OH--12e-=2CO+11H2O,由电极反应式可知,消耗0.2 mol乙醇,转移电子的物质的量为2.4mol,D错误;
故选C。
8.C
【详解】A.苯酚在电极a失电子转化为,电极a为阳极,所以M为铅蓄电池的正极,故A错误;
B.电极a反应式为,生成的在电极b得电子生成,交换膜为阳离子交换膜,故B错误;
C.苯酚在电极a失电子转化为,电极反应式为,故C正确;
D.电极b上生成时转移电子,根据铅蓄电池反应为知,每生成时,铅蓄电池中生成,故D错误;
故选C。
9.C
【详解】该图示为反应物的总能量低于生成物的总能量,为吸热反应,
A.CaCO3分解反应,没有元素的化合价变化,为非氧化还原反应,故A错误;
B.甲烷和氧气的反应为燃烧反应,燃烧为放热反应,故B错误;
C.碳与二氧化碳的反应为吸热反应,符合图像,且该反应元素化合价发生改变属于氧化还原反应,故C正确;
D.酸碱中和反应为放热反应,故D错误;
故选:C。
10.B
【分析】石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况),则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,n(O2)==0.05mol,结合电子守恒及物质的量浓度的计算来解答。
【详解】石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=n(H2)==0.05mol,
阳极发生反应:,即阳极失去0.2mol电子,阴极得到0.2mol电子,阴极发生反应:Cu2++2e-═Cu、2H++2e-═H2↑,H2的物质的量为0.05mol,即氢离子的物质的量为0.1mol,铜离子的物质的量为0.05mol;
A.c(Cu2+)= =0.1mol/L,由电荷守恒可知,原混合溶液中c(Na+)为0.3mol/L-0.1mol/L×2=0.1mol/L,故A错误;
B.电解后溶液中c(H+)依据阳极氢离子增大和阴极氢离子减小共同决定得到溶液中氢离子浓度==0.2mol/L,故B正确;
C.由上述分析可知,电解过程中转移电子总数为0.2mol,故C错误;
D.复原时需加CuO:0.05×80g=4g和H2O:0.05×18g=0.9g 或加Cu(OH)24.9g,故D错误。
答案选B。
11.B
【分析】由题干信息可知,放电时,M极由于Li比Ni更活泼,也比N极上的Sb、Bi、Sn更活泼,故M极作负极,电极反应为:Li-e-=Li+,N极为正极,电极反应为:3Li++3e-+Bi=Li3Bi,据此分析解题。
【详解】A.由分析可知,放电时,M电极反应为Li-e-=Li+,A错误;
B.由分析可知,放电时,M极为负极,N极为正极,故由M电极向N电极移动,B正确;
C.由二次电池的原理可知,充电时和放电时同一电极上发生的反应互为逆过程,M电极的电极反应为:Li++e-= Li,故电极质量增大,C错误;
D.由二次电池的原理可知,充电时和放电时同一电极上发生的反应互为逆过程,充电时,N电极反应为,D错误;
故答案为:B。
12.D
【详解】A.烧杯间的碎泡沫塑料的作用是保温、隔热,防止热量散失,A错误;
B.温度计不能用作搅拌器,应该用环形玻璃搅拌棒,B错误;
C.为防止热量散失,实验时需把氢氧化钠溶液一次性倒入盛有硫酸溶液的内筒中,减小热量损失,C错误;
D.氢氧化钠固体溶于水属于放热过程,所以最终所测得的中和热的数值偏大,D正确;
故选D。
13.B
【分析】常见的放热反应有:酸碱中和反应、燃烧反应、大多数的化合反应、活泼金属和水或酸的置换反应、铝热反应;常见的吸热反应有:大多数的分解反应、NH4Cl与Ba(OH)2·8H2O的复分解反应、碳和水蒸气生成水煤气的反应、碳和二氧化碳生成一氧化碳的反应。
【详解】①金属钠与水反应生成NaOH和氢气,是放热反应;
②NH4Cl晶体与Ba(OH)2·8H2O的反应是吸热反应;
③燃烧都是放热反应;
④水蒸气变成液态水不是化学反应,但是放热的过程;
⑤酸碱中和都是放热反应;
⑥碳酸钙热分解是吸热反应;
综上所述放热反应有①③⑤,故答案为B。
14.A
【详解】A.等物质的量浓度的和溶液中滴加酚酞,碳酸钠溶液的颜色深说明其溶液中氢氧根浓度大,碱性更强,故A正确;
B.腐蚀覆铜板的废液中含有氯化铁,且其氧化性比氯化铜强,加入的铁粉先于氯化铁反应,因铁粉少量,可能只与氯化铁反应,所以没出现红色固体不能说明不含有铜离子,故B错误;
C.铝箔加热过程中熔化,但同时迅速与氧气反应生成熔点较高的氧化铝将铝包裹,所以不会滴落,故C错误;
D.稀硫酸与纯锌粒反应,再加入几滴浓溶液后,硝酸根在酸性条件下具有强氧化性,优先与锌粒发生反应,不能生成氢气,故D错误;
故选:A。
15.(1)4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2)
(2)4FeCO3(s)+O2(g)= 2Fe2O3(s)+4CO2(g) △H=-260kJ/mol
(3)CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ·mol-1
(4)Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=+174.9kJ/mol
(5) -99 +41
(6)431
【分析】(1)
由图示可知,反应①为2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) △H1,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为CuCl2(g)+O2(g)=CuO(s)+Cl2(g) △H2,总反应方程式为4HCl+O2=2Cl2+2H2O,根据盖斯定律(①+②)×2可得总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2);答案为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2)。
(2)
FeCO3在空气中加热反应生成Fe2O3的化学方程式为4FeCO3+O2=2Fe2O3+4CO2,已知①4Fe(s)+3O2(g)═2Fe2O3(s) △H=-1648kJ/mol,②C(s)+O2(g)═CO2(g) △H=-393kJ/mol,③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s) △H=-1480kJ/mol,根据盖斯定律,①+②×4-③×2可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),△H=(-1648kJ/mol)+(-393kJ/mol)×4-2×(-1480kJ/mol)=-260kJ/mol,答案为4FeCO3(s)+O2(g)= 2Fe2O3(s)+4CO2(g) △H=-260kJ/mol。
(3)
CO、H2在催化剂条件下合成CH4的化学方程式为CO+3H2=CH4+H2O,已知①CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH1=+165 kJ·mol-1,②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41 kJ·mol-1,根据盖斯定律,②-①可得CO(g)+3H2(g)=CH4(g)+H2O(g)△H=(-41 kJ·mol-1)-(+165 kJ·mol-1)=-206kJ·mol-1;答案为CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ·mol-1。
(4)
Al2O3、C和Cl2反应生成AlCl3的化学方程式为Al2O3+3C+3Cl2=2AlCl3+3CO,已知①Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=+1344.1kJ·mol-1,②2AlCl3(g)=2Al(s)+3Cl2(g)△H2=+1169.2kJ·mol-1,根据盖斯定律,将①-②可得Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=(+1344.1kJ·mol-1)-(+1169.2kJ·mol-1)=+174.9kJ/mol;答案为Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=+174.9kJ/mol。
(5)
△H=反应物总键能-生成物总键能,由①CO(g)+2H2(g) = CH3OH(g) ΔH1可知,ΔH1=1076kJ·mol-1+2×436kJ·mol-1-(3×413+343+465)kJ·mol-1=-99kJ·mol-1;根据盖斯定律,反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ·mol-1-(-99kJ·mol-1)=+41kJ·mol-1;答案为-99;+41。
(6)
由H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol可知,断开1mol HCl分子中的化学键需要吸收xkJ热量,△H=反应物的总键能-生成物的总键能,则-183kJ/mol =436kJ/mol+243 kJ/mol-xkJ/mol×2,解得x=431;答案为431。
16.(1)
(2)
(3) c/2
(4)该反应为可逆反应,不能进行到底
【详解】(1)C2H4的摩尔质量为28g/mol,燃烧热为25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,故C2H4燃烧热的热化学方程式为。
(2)△H=反应物的总键能-生成物的总键能,故根据已知条件a=945+3×436-6×391 =-93。
(3)298K时,由C(s,石墨)和H2(g)生成1molC2H2(g)反应为2C(s,石墨)+H2(g)= C2H2(g),根据盖斯定律,△H1×2+△H2÷2-△H3÷2=()。燃烧热为25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,故C2H2的燃烧热为。
(4)该反应为可逆反应,不能进行到底,故测得反应放出的热量少于14.9kJ。
17. 吸收 180 氧化 NiO O2+4e-=2O2-
【分析】N2(g)+O2(g)=2NO(g),根据能量变化图计算反应热,反应热=反应物断键吸收的能量-生成物成键释放出的能量;根据图知这是一个原电池装置,由O2-移动的方向判断出NiO电极是负极,负极上NO失电子和氧离子反应生成二氧化氮,发生氧化反应,铂电极是正极,氧气得到电子,发生还原反应,据此解答。
【详解】(1)N2(g)+O2(g)=2NO(g),反应热=反应物断键吸收的能量-生成物成键释放出的能量,该反应的反应热=(946+498)kJ/mol-2×632kJ/mol=+180kJ/mol,所以这是一个吸热反应,1molN2和1molO2完全反应生成2 mol NO会吸收180kJ的能量;故答案为:吸收;180;
(2)①NiO电极上NO失电子和氧离子反应生成二氧化氮,发生的是氧化反应(填“氧化”或“还原”)。故答案为:氧化;
②外电路中,电子从负极(NiO)流出,经外电路到正极(Pt),即导线中电子流动方向是从上→下,所以电子是从NiO电极流出(填“NiO”或“Pt”)。故答案为:NiO;
③Pt电极上是氧气得到电子被还原成氧离子,电极反应式为O2+4e-=2O2-。故答案为:O2+4e-=2O2-。
18.(1)Fe3+>Cu2+>Fe2+
(2) 2:1 E 2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O
(3) H2(g)+O2(g)= H2O(l) △H=-285.8kJ mol-1 436
(4)+84.6
【详解】(1)氧化性:氧化剂>氧化产物,Cu2+>Fe2+,Fe3+>Cu2+;
故答案为:Fe3+>Cu2+>Fe2+。
(2)①Mn化合价由+4降低到+2作氧化剂,Cl化合价由-1升高到0作还原剂,则n(还原剂):n(氧化剂)=2:1;
故答案为:2:1。
②该反应中有4个HCl参与反应,其中2个HCl化合价升高作还原剂,2个HCl化合价不变体现酸的同性;
故答案为:E。
③根据单线桥原则,表示电子转移方向及数目
故答案为:。
④根据得失电子守恒,Mn由+7降低+2,C由+3升高到+4,需要有10个C原子反应,1个Mn原子反应,则有方程式:2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O。
(3)①根据热化学方程式书写原则,H2(g)+O2(g)= H2O(l) △H=-285.8kJ mol-1
故答案为:H2(g)+O2(g)= H2O(l) △H=-285.8kJ mol-1。
②设H-H键能为x,则有关系式x ,x=436kJ/mol;
故答案为:436
(4)③=②-2①,△H3=-64.4kJ mol-1-2(-74.5kJ mol-1)=+84.6kJ mol-1
故答案为:+84.6
19.
【详解】(1)铅蓄电池:中正反应为放电过程,Pb化合价由0价升高到+2价,失电子,发生氧化反应,作负极,故负极反应式为;逆反应为充电过程,阳极发生失电子的氧化反应,故为PbSO4生成PbO2的反应,阳极反应式为;
(2) 镍镉电池:中正反应为放电过程,Cd化合价由0价升高到+2价,失电子,发生氧化反应,作负极,故负极反应式为;逆反应为充电过程,阳极发生失电子的氧化反应,故为Ni(OH)2生成NiOOH的反应,阳极反应式为;
(3) 钴酸锂电池:中正反应为放电过程,LixC6化合价由0价升高到+1价,失电子,发生氧化反应,作负极,故负极反应式为;逆反应为充电过程,阳极发生失电子的氧化反应,故为LiCoO2生成的反应,阳极反应式为。
20.(1)
(2)300
【详解】(1)由题图可知,反应Ⅰ为 ,根据盖斯定律,总反应反应Ⅱ可得反应Ⅰ的热化学方程式为 。
(2)正反应的活化能-逆反应的活化能、反应物的键能总和-生成物的键能总和。,又,则。
21.(1)B
(2)A
(3)盐析
(4) H2(g)+O2(g)=H2O(g) △H=-241.8 kJ · mol-1 -571.6
(5)-41.8
【解析】(1)
维生素C能促进人体生长发育,维生素C主要存在于水果和蔬菜中,则下列富含维生素C的是辣椒,故合理选项是B;
(2)
缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是碘,互合理选项是A;
(3)
在蛋清溶液中加入饱和硫酸铵溶液有沉淀析出,该过程为可逆过程,将析出的沉淀加入水中,固体还可以再溶解,这个过程称为盐析;
(4)
由氢气和氧气反应生成1 mol水蒸气放热241.8 J,由于反应过程的热量变化与物质的存在状态及物质的多少相对应,则该反应的热化学方程式:H2(g)+O2(g)=H2O(g) △H=-241.8 kJ · mol-1;
已知18 g液态水转化成水蒸气需吸热44 kJ,18 g水的物质的量是1 mol,则反应2H2(g)+O2(g)=2H2O(l)的△H=(-241.8 kJ · mol-1-44 kJ · mol-1)×2=-571.6 kJ · mol-1;
(5)
已知:①2SO2(g)+O2(g)2SO3(g) △H=﹣196.6 kJ · mol-1
②2NO(g)+O2(g)2NO2(g) △H=﹣113.0 kJ · mol-1
则根据盖斯定律,将反应×(①-②),整理可得NO2(g)+SO2(g)SO3(g)+NO(g)的△H=-41.8 kJ · mol-1。
22. 负极 CH3OH-6e-+8OH-=CO32-+6H2O 4OH--4e-=O2↑+2H2O Mg2++2Cl-+2H2OMg(OH)2↓+H2↑+Cl2↑ pH=0 CuO 4g 2.9g Cu2+ +e-+Cl=CuCl
【详解】(1)①燃料电池中可燃物作为负极材料失去电子,CH3OH发生氧化反应,所以该电极是负极,反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;乙池为以甲池为外加电源的电解池,石墨电极连接正极,为阳极氢氧根离子放电,电极反应式为:4OH--4e-=O2↑+2H2O;丙池为惰性电极电解氯化镁溶液,反应的离子方程式为:Mg2++2Cl-+2H2OMg(OH)2↓+H2↑+Cl2↑;②反应一段时间后,甲池中消耗560mL (标准状况下) O2,为=0.025mol,根据反应O2+4e-+2H2O =4OH-,则转移电子的物质的量为0.025mol×4=0.1mol,根据乙池是电极反应4OH--4e-=O2↑+2H2O,则溶液中产生氢离子的物质的量为0.1mol,浓度为=1mol/L,则pH=0;乙池中总反应式为2CuSO4+2H2O 2Cu+2H2SO4+O2↑,若向乙池中加入CuO,物质的量为氧气的2倍,其质量为2×0.025mol×80g/mol=4g,能使CuSO4溶液恢复到原浓度;根据丙装置中,在阳极上是氢离子放电,所以镁离子和氢氧根离子之间反应生成氢氧化镁,理论上最多产生氢氧化镁0.1mol×58g/mol=2.9g固体;(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,过程中铜离子得电子产生CuCl,阴极上的电极反应式为:Cu2+ +e-+Cl-=CuCl。
23.(1)a→b
(2)CH3COO--8e- + 4H2O = 2H2CO3 + 7H+
(3)250(n - m)
【详解】(1)a极碳元素价态升高失电子,故a极为负极,电子由负极到正极,该电池放电时,电子从a→b,故答案为: a→b;
(2)a极上CH3COO-发生氧化反应生成碳酸,电极反应为: CH3COO--8e- + 4H2O = 2H2CO3 + 7H+,故答案为: CH3COO--8e- + 4H2O = 2H2CO3 + 7H+;
(3)1m3 = 1000L,若废水中对氯苯酚的含量是nmol/L,经处理后的水样中要求对氯苯酚的含量小于mmol/L,则处理掉的n(氯苯)= 1000(n- m) mol,根据转移电子守恒可知,醋酸根离子和氯苯的关系为:n(CH3COO- ) ~ 4n(氯苯),则至少添加CH3COO-的物质的量为250(n- m),故答案为: 250(n - m)。
答案第1页,共2页
答案第1页,共2页
一、单选题(共14题)
1.下列说法不正确的是
A.热化学方程式中的与该方程式中的计量数有关
B.旧化学键的断裂和新化学键的形成都需要吸收能量
C.燃烧热和中和热都属于反应热
D.一个化学反应不属于放热反应,一定属于吸热反应
2.纯净物状态下的标准电极电势,可用来比较对应氧化剂的氧化性强弱,现有5组标准电极电势数据如表所示:
氧化还原电对(氧化型/还原型) 电极反应式 标准电极电势
0.77
0.54
1.36
1.07
0.151
下列分析不正确的是
A.氧化性:
B.往淀粉溶液中滴加溶液,溶液不变蓝
C.往含有的溶液中滴加少量溴水,溶液变红色
D.溶液与溶液反应的离子方程式为:
3.如图装置是酒精检测仪,工作原理与酸性燃料电池相似。下列说法不正确的是
A.该电池的总反应式为:
B.当右侧Pt电极表面有0.2mol发生还原反应时,会有0.8mol向左移动
C.电流由所在的铂电极经外电路流向另一电极
D.该装置实现了化学能转化为电能
4.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)= 4CO2(g)+ 2H2O(l); H=-2b kJ/mol
B.C2H2(g)+ 5/2O2(g)= 2CO2(g)+H2O(l); H=2b kJ/mol
C.2C2H2(g)+5O2(g)= 4CO2(g)+2H2O(l); H=-4b kJ/mol
D.2C2H2(g)+5O2(g)= 4CO2(g)+ 2H2O(l); H=b kJ/mol
5.化学与生产、生活、科技等密切相关。下列说法错误的是
A.制作电饭锅内胆的304不锈钢属于合金
B.制作亚克力浴缸的聚甲基丙烯酸甲酯属于有机高分子材料
C.大力实施矿物燃料的脱硫脱硝,可以减少、的排放
D.喷油漆、涂油脂、电镀或金属表面钝化,都是金属防护的物理方法
6.全钒液流电池的放电原理为VO+V2++2H+=VO2++V3++H2O,该电池续航能力强,充电时间短。用太阳能电池给全钒液流电池充电的装置示意图如图所示。下列说法错误的是
A.太阳能电池放电时,化学能转化为电能
B.电极M上的电势低于电极N上的电势
C.交换膜可选用质子交换膜
D.全钒液流电池放电时,正极的电极反应式为VO+2H++e-=VO2++H2O
7.某燃料电池以乙醇为燃料,空气为氧化剂,强碱溶液为电解质组成,有关该电池的说法正确的是
A.放电时正极发生氧化反应
B.放电一段时间后,正极附近溶液的pH减小
C.放电时负极电极反应为:
D.消耗0.2mol乙醇,有1.2mol转移
8.如图为用铅蓄电池电解氧化含苯酚()废水,电解槽两极为惰性电极(电解过程中交换膜两侧溶质的种类不变)。下列说法正确的是
A.M为铅蓄电池的负极
B.交换膜为阴离子交换膜
C.电极a电极反应式:
D.电极b上生成时,理论上,铅蓄电池中生成
9.属于氧化还原反应且反应过程中能量变化符合如图所示的是
A.CaCO3=CaO+CO2 B.CH4+2O2CO2+2H2O
C.C+CO2=2CO D.2KOH+H2SO4=K2SO4+2H2O
10.500mLNaNO3和Cu(NO3)2的混合溶液中c(NO)=0.3mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12L(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是
A.原混合溶液中c(Na+)=0.2mol·L-1
B.电解后溶液中c(H+)=0.2mol·L-1
C.上述电解过程中共转移0.4mol电子
D.电解后溶液复原时需加入4gCuO
11.如图,某液态金属储能电池放电时产生金属化合物。下列说法正确的是
A.放电时,M电极反应为
B.放电时,由M电极向N电极移动
C.充电时,M电极的质量减小
D.充电时,N电极反应为
12.如图所示的装置中进行硫酸和氢氧化钠的中和反应。通过测定反应过程中放出的热量可计算中和热。下列关于该实验的说法正确的是
A.烧杯间的碎泡沫塑料的作用只是固定小烧杯的位置
B.如果没有玻璃搅拌器,酸碱混合后可用温度计轻轻搅拌
C.实验时应慢慢把氢氧化钠溶液倒入盛有硫酸溶液的内筒中
D.若将氢氧化钠溶液换成氢氧化钠固体,则所测得的中和热的数值偏大
13.下列变化过程,属于放热反应的是
①金属钠与水
②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
③H2在Cl2中燃烧
④水蒸气变成液态水
⑤中和反应
⑥碳酸钙热分解
A.①②⑤ B.①③⑤ C.③④⑤ D.②④⑥
14.下列实验操作、现象及所得结论或解释均正确的是
选项 实验操作 现象 结论或解释
A 在两支试管中分别加入等物质的量浓度的和溶液,然后各滴加2滴酚酞溶液 溶液均变成红色,且溶液颜色更深一些 同浓度的溶液碱性更强
B 向腐蚀覆铜板的废液X中加入少量的铁粉,振荡 未出现红色固体 X中一定不含
C 用坩埚钳夹住一块铝箔在酒精灯上加热 铝箔熔化,失去光泽并滴落下来 金属铝的熔点较低
D 用3mL稀硫酸与纯锌粒反应,再加入几滴浓溶液 迅速产生无色气体 形成Zn—Cu原电池加快了制取的速率
A.A B.B C.C D.D
二、填空题(共8题)
15.回答下列问题
(1)用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化循环实现。
其中,反应①为2HCl(g)+CuO(s) = H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为 (反应热用ΔH1和ΔH2表示)。
(2)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(3)已知:温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1
贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为 。
(4)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 。
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) = CH3OH(g) ΔH1
②CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) = CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 H—H C—O C≡O H—O C—H
E/(kJ·mol-1) 436 343 1076 465 413
由此计算ΔH1= kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3= kJ·mol-1。
(6)已知:① H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
② 断开1mol H2分子中的化学键需要吸收436kJ的能量
③ 断开1mol Cl2分子中的化学键需要吸收243kJ的能量
则:断开1mol HCl分子中的化学键需要吸收 kJ的能量。
16.根据信息回答问题
(1)实验测得28gC2H4(g)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出1411.0kJ的热量,试写出C2H4燃烧热的热化学方程式:
(2)已知反应:。有关键能数据如下:,,,根据键能数据计算a=
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的反应热为: 。C2H2的燃烧热为 。
(4)473K,101KPa时,把1molH2和1molI2放在某密闭容器中进行反应,热化学方程式如下:
,测得反应放出的热量少于14.9kJ,其原因是 。
17.汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化如图甲所示。1molN2和1molO2完全反应生成NO会 (填“吸收"或“放出") kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图乙所示:
①NiO电极上发生的是 反应(填“氧化”或“还原”)。
②外电路中,电子是从 电极流出(填“NiO”或“Pt”)。
③Pt电极上的电极反应式为 。
18.I.回答下列问题:
(1)有下列反应:Fe+Cu2+=Fe2++Cu;2Fe3++Cu=2Fe2++Cu2+;在Cu2+、Fe2+、Fe3+中,其氧化性由强到弱顺序为 。
(2)根据反应MnO2+4HClMnCl2+Cl2↑+2H2O,回答下列问题:
①反应中n(还原剂):n(氧化剂)= 。
②该反应中盐酸的作用是 (填字母)。
A.只氧化性 B.只有酸性 C.只有还原性 D.有氧化性也有酸性 E.有还原性也有酸性
③在方程式上用单线桥表示上述反应电子转移的方向和数目 。
MnO2+4HCl=MnCl2+Cl2↑+2H2O
④配平方程式: 。
______MnO+______C2O+______H+=______Mn2++______CO2↑+______H2O
II.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(3)在101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题。
①氢气燃烧热的热化学方程式为 。
②若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ mol-1,O=O键能为498kJ mol-1,计算H-H键能为 kJ mol-1。
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) △H1=-74.5kJ mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3= kJ mol-1。
19.写出下列二次电池的电极反应式。
类型 放电时负极反应式 充电时阳极反应式
(1)铅蓄电池:
(2)镍镉电池:
(3)钴酸锂电池:
20.绿色能源是未来能源发展的重要方向,氢能是重要的绿色能源,利用生物乙醇来制取氢气的部分反应过程如图所示。
已知:总反应 ;反应Ⅱ 。
(1)则反应Ⅰ的热化学方程式为 。
(2)研究氮和碳的化合物对工业生产和防治污染有重要意义,相关化学键的键能数据如表所示:
化学键
436 946 391
合成氨反应的活化能,由此计算氨分解反应的活化能 。
21.Ⅰ.(化学与生活)保证食品安全、保持营养均衡,是保障人体健康的基础。
(1)维生素C能促进人体生长发育,下列富含维生素C的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
(2)缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是 。
A.碘 B.铁 C.钙
(3)在蛋清溶液中加入饱和硫酸铵溶液有沉淀析出的过程称为 。
Ⅱ.(化学反应原理)
(4)由氢气和氧气反应生成1 mol水蒸气放热241.8 J,写出该反应的热化学方程式: 。已知18 g液态水转化成水蒸气需吸热44 kJ,则反应2H2(g)+O2(g)=2H2O(l)的△H= kJ · mol-1。
(5)已知:2SO2(g)+O2(g)2SO3(g) △H=﹣196.6 kJ · mol-1
2NO(g)+O2(g)2NO2(g) △H=﹣113.0 kJ · mol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的△H= kJ · mol-1。
22.根据所学电化学知识,回答下列问题:
(1)①甲池中通入CH3OH的电极名称是 极,写出其电极反应式 ;乙池中石墨电极反应式为 ;丙池中反应的离子方程式为 ;
②反应一段时间后,甲池中消耗560mL (标准状况下) O2,此时乙池溶液的pH= ;若向乙池中加入 ,其质量为 g,能使CuSO4溶液恢复到原浓度(假设电解前后溶液的体积不变,均为100mL)。丙池中理论上最多产生 g 固体。
(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,写出此过程中阴极上的电极反应式 。
23.微生物电池可用来处理废水中的对氯苯酚,原理如图所示。
(1)该电池放电时,电子从 (填“b→a”或“a→b”)。
(2)a极上生成H2CO3的电极反应为 。
(3)已知b极的电极反应为+2H++2e-=+Cl-,经处理后的水样中要求对氯苯酚的含量小于mmol/L。若废水中对氯苯酚的含量是nmol/L,则处理1m3废水,至少添加CH3COO-的物质的量为 mol(溶液体积变化忽略不计)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.焓变的值与化学方程式的化学计量数有关,化学计量数扩大,则焓变的值相应地就扩大,A项正确;
B.化学反应中旧的化学键断裂需要吸收能量,新的化学键的形成需要放出能量,B项错误;
C.燃烧热和中和热都属于放热反应,是反应热的种类之一,C项正确;
D.化学反应必然伴随能量的变化,则化学反应不属于放热反应,一定属于吸热反应,D项正确;
答案选B。
2.C
【详解】A.标准电极电势越高,其中氧化剂的氧化性越强,氧化性,A项正确;
B.的氧化性弱于,不能氧化得到,因此溶液不变蓝,B项正确;
C.的还原性大于,当加入少量溴水时,溴水先氧化,溴水量不足不能被氧化为,则滴加KSCN溶液不一定变红,C项错误;
D.溶液与溶液反应,具有氧化性,具有还原性,则离子方程式为,D项正确;
答案选C。
3.B
【详解】A.该电池的负极上乙醇失电子发生氧化反应,分析装置图可知酒精在负极被氧气氧化生成醋酸,CH3CH2OH-4e-+H2O=4H++CH3COOH;正极上是氧气得电子的还原反应,O2所在的铂电极处发生还原反应为O2+4e-+4H+=2H2O,总反应式为,故A正确;
B.右侧Pt电极表面O2化合价降低,发生还原反应O2+4e-+4H+=2H2O,当右侧Pt电极表面有0.2mol O2发生还原反应时,会有0.8mol H+向右移动,故B错误;
C.电流由O2所在的铂电极正极经外电路流向另一电极负极上,故C正确;
D.该装置属于原电池,实现了化学能转化为电能,故D正确;
故答案:B。
4.C
【详解】充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,所以生成4 mol二氧化碳气体和液态水,放出热量为4b kJ,则乙炔燃烧的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) H=-4b kJ/mol。
答案选C。
5.D
【详解】A.合金是金属与金属或非金属熔合而成的具有金属特性的物质;304不锈钢属于合金,A正确;
B.聚甲基丙烯酸甲酯属于有机合成高分子材料,B正确;
C.矿物燃料的脱硫脱硝,可以减少、的排放,减少污染物的污染,C正确;
D.金属表面钝化的过程生成新物质,属于化学方法,D错误;
故选D。
6.A
【详解】A. 太阳能电池放电时存在光能转化为电能,故A错误;
B. 由图知,M为阴极,N为阳极,则电极M上的电势低于电极N上的电势,故B正确;
C.由放电总反应知,阳极反应式为VO2++ H2O - e- =+2H+,阴极反应式为V3++e- =V2+,则交换膜适合选择质子交换膜,故C正确;
D.全钒液流电池放电时,正极得电子,反应式为+2H++e-=VO2++ H2O, 故D正确;
故选A。
7.C
【分析】由题意可知,乙醇燃料电池中通入乙醇的一极为负极,碱性条件下,乙醇在负极失去电子发生还原反应生成碳酸根离子和水,电极反应式为C2H5OH+16OH--12e-=2CO+11H2O,通入氧气的一极为正极,氧气在正极上得到电子发生还原反应生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-。
【详解】
A.由分析可知,放电时,通入氧气的一极为正极,氧气在正极上得到电子发生还原反应生成氢氧根离子,A错误;
B.由分析可知,通入氧气的一极为正极,氧气在正极上得到电子发生还原反应生成氢氧根离子,正极附近溶液的氢氧根离子浓度增大,溶液碱性增强,B错误;
C.由分析可知,放电时,通入乙醇的一极为负极,碱性条件下,乙醇在负极失去电子发生还原反应生成碳酸根离子和水,电极反应式为C2H5OH+16OH--12e-=2CO+11H2O,C正确;
D.由分析可知,放电时,通入乙醇的一极为负极,碱性条件下,乙醇在负极失去电子发生还原反应生成碳酸根离子和水,电极反应式为C2H5OH+16OH--12e-=2CO+11H2O,由电极反应式可知,消耗0.2 mol乙醇,转移电子的物质的量为2.4mol,D错误;
故选C。
8.C
【详解】A.苯酚在电极a失电子转化为,电极a为阳极,所以M为铅蓄电池的正极,故A错误;
B.电极a反应式为,生成的在电极b得电子生成,交换膜为阳离子交换膜,故B错误;
C.苯酚在电极a失电子转化为,电极反应式为,故C正确;
D.电极b上生成时转移电子,根据铅蓄电池反应为知,每生成时,铅蓄电池中生成,故D错误;
故选C。
9.C
【详解】该图示为反应物的总能量低于生成物的总能量,为吸热反应,
A.CaCO3分解反应,没有元素的化合价变化,为非氧化还原反应,故A错误;
B.甲烷和氧气的反应为燃烧反应,燃烧为放热反应,故B错误;
C.碳与二氧化碳的反应为吸热反应,符合图像,且该反应元素化合价发生改变属于氧化还原反应,故C正确;
D.酸碱中和反应为放热反应,故D错误;
故选:C。
10.B
【分析】石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况),则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,n(O2)==0.05mol,结合电子守恒及物质的量浓度的计算来解答。
【详解】石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=n(H2)==0.05mol,
阳极发生反应:,即阳极失去0.2mol电子,阴极得到0.2mol电子,阴极发生反应:Cu2++2e-═Cu、2H++2e-═H2↑,H2的物质的量为0.05mol,即氢离子的物质的量为0.1mol,铜离子的物质的量为0.05mol;
A.c(Cu2+)= =0.1mol/L,由电荷守恒可知,原混合溶液中c(Na+)为0.3mol/L-0.1mol/L×2=0.1mol/L,故A错误;
B.电解后溶液中c(H+)依据阳极氢离子增大和阴极氢离子减小共同决定得到溶液中氢离子浓度==0.2mol/L,故B正确;
C.由上述分析可知,电解过程中转移电子总数为0.2mol,故C错误;
D.复原时需加CuO:0.05×80g=4g和H2O:0.05×18g=0.9g 或加Cu(OH)24.9g,故D错误。
答案选B。
11.B
【分析】由题干信息可知,放电时,M极由于Li比Ni更活泼,也比N极上的Sb、Bi、Sn更活泼,故M极作负极,电极反应为:Li-e-=Li+,N极为正极,电极反应为:3Li++3e-+Bi=Li3Bi,据此分析解题。
【详解】A.由分析可知,放电时,M电极反应为Li-e-=Li+,A错误;
B.由分析可知,放电时,M极为负极,N极为正极,故由M电极向N电极移动,B正确;
C.由二次电池的原理可知,充电时和放电时同一电极上发生的反应互为逆过程,M电极的电极反应为:Li++e-= Li,故电极质量增大,C错误;
D.由二次电池的原理可知,充电时和放电时同一电极上发生的反应互为逆过程,充电时,N电极反应为,D错误;
故答案为:B。
12.D
【详解】A.烧杯间的碎泡沫塑料的作用是保温、隔热,防止热量散失,A错误;
B.温度计不能用作搅拌器,应该用环形玻璃搅拌棒,B错误;
C.为防止热量散失,实验时需把氢氧化钠溶液一次性倒入盛有硫酸溶液的内筒中,减小热量损失,C错误;
D.氢氧化钠固体溶于水属于放热过程,所以最终所测得的中和热的数值偏大,D正确;
故选D。
13.B
【分析】常见的放热反应有:酸碱中和反应、燃烧反应、大多数的化合反应、活泼金属和水或酸的置换反应、铝热反应;常见的吸热反应有:大多数的分解反应、NH4Cl与Ba(OH)2·8H2O的复分解反应、碳和水蒸气生成水煤气的反应、碳和二氧化碳生成一氧化碳的反应。
【详解】①金属钠与水反应生成NaOH和氢气,是放热反应;
②NH4Cl晶体与Ba(OH)2·8H2O的反应是吸热反应;
③燃烧都是放热反应;
④水蒸气变成液态水不是化学反应,但是放热的过程;
⑤酸碱中和都是放热反应;
⑥碳酸钙热分解是吸热反应;
综上所述放热反应有①③⑤,故答案为B。
14.A
【详解】A.等物质的量浓度的和溶液中滴加酚酞,碳酸钠溶液的颜色深说明其溶液中氢氧根浓度大,碱性更强,故A正确;
B.腐蚀覆铜板的废液中含有氯化铁,且其氧化性比氯化铜强,加入的铁粉先于氯化铁反应,因铁粉少量,可能只与氯化铁反应,所以没出现红色固体不能说明不含有铜离子,故B错误;
C.铝箔加热过程中熔化,但同时迅速与氧气反应生成熔点较高的氧化铝将铝包裹,所以不会滴落,故C错误;
D.稀硫酸与纯锌粒反应,再加入几滴浓溶液后,硝酸根在酸性条件下具有强氧化性,优先与锌粒发生反应,不能生成氢气,故D错误;
故选:A。
15.(1)4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2)
(2)4FeCO3(s)+O2(g)= 2Fe2O3(s)+4CO2(g) △H=-260kJ/mol
(3)CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ·mol-1
(4)Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=+174.9kJ/mol
(5) -99 +41
(6)431
【分析】(1)
由图示可知,反应①为2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) △H1,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为CuCl2(g)+O2(g)=CuO(s)+Cl2(g) △H2,总反应方程式为4HCl+O2=2Cl2+2H2O,根据盖斯定律(①+②)×2可得总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2);答案为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2)。
(2)
FeCO3在空气中加热反应生成Fe2O3的化学方程式为4FeCO3+O2=2Fe2O3+4CO2,已知①4Fe(s)+3O2(g)═2Fe2O3(s) △H=-1648kJ/mol,②C(s)+O2(g)═CO2(g) △H=-393kJ/mol,③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s) △H=-1480kJ/mol,根据盖斯定律,①+②×4-③×2可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),△H=(-1648kJ/mol)+(-393kJ/mol)×4-2×(-1480kJ/mol)=-260kJ/mol,答案为4FeCO3(s)+O2(g)= 2Fe2O3(s)+4CO2(g) △H=-260kJ/mol。
(3)
CO、H2在催化剂条件下合成CH4的化学方程式为CO+3H2=CH4+H2O,已知①CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH1=+165 kJ·mol-1,②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41 kJ·mol-1,根据盖斯定律,②-①可得CO(g)+3H2(g)=CH4(g)+H2O(g)△H=(-41 kJ·mol-1)-(+165 kJ·mol-1)=-206kJ·mol-1;答案为CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ·mol-1。
(4)
Al2O3、C和Cl2反应生成AlCl3的化学方程式为Al2O3+3C+3Cl2=2AlCl3+3CO,已知①Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=+1344.1kJ·mol-1,②2AlCl3(g)=2Al(s)+3Cl2(g)△H2=+1169.2kJ·mol-1,根据盖斯定律,将①-②可得Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=(+1344.1kJ·mol-1)-(+1169.2kJ·mol-1)=+174.9kJ/mol;答案为Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=+174.9kJ/mol。
(5)
△H=反应物总键能-生成物总键能,由①CO(g)+2H2(g) = CH3OH(g) ΔH1可知,ΔH1=1076kJ·mol-1+2×436kJ·mol-1-(3×413+343+465)kJ·mol-1=-99kJ·mol-1;根据盖斯定律,反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ·mol-1-(-99kJ·mol-1)=+41kJ·mol-1;答案为-99;+41。
(6)
由H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol可知,断开1mol HCl分子中的化学键需要吸收xkJ热量,△H=反应物的总键能-生成物的总键能,则-183kJ/mol =436kJ/mol+243 kJ/mol-xkJ/mol×2,解得x=431;答案为431。
16.(1)
(2)
(3) c/2
(4)该反应为可逆反应,不能进行到底
【详解】(1)C2H4的摩尔质量为28g/mol,燃烧热为25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,故C2H4燃烧热的热化学方程式为。
(2)△H=反应物的总键能-生成物的总键能,故根据已知条件a=945+3×436-6×391 =-93。
(3)298K时,由C(s,石墨)和H2(g)生成1molC2H2(g)反应为2C(s,石墨)+H2(g)= C2H2(g),根据盖斯定律,△H1×2+△H2÷2-△H3÷2=()。燃烧热为25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,故C2H2的燃烧热为。
(4)该反应为可逆反应,不能进行到底,故测得反应放出的热量少于14.9kJ。
17. 吸收 180 氧化 NiO O2+4e-=2O2-
【分析】N2(g)+O2(g)=2NO(g),根据能量变化图计算反应热,反应热=反应物断键吸收的能量-生成物成键释放出的能量;根据图知这是一个原电池装置,由O2-移动的方向判断出NiO电极是负极,负极上NO失电子和氧离子反应生成二氧化氮,发生氧化反应,铂电极是正极,氧气得到电子,发生还原反应,据此解答。
【详解】(1)N2(g)+O2(g)=2NO(g),反应热=反应物断键吸收的能量-生成物成键释放出的能量,该反应的反应热=(946+498)kJ/mol-2×632kJ/mol=+180kJ/mol,所以这是一个吸热反应,1molN2和1molO2完全反应生成2 mol NO会吸收180kJ的能量;故答案为:吸收;180;
(2)①NiO电极上NO失电子和氧离子反应生成二氧化氮,发生的是氧化反应(填“氧化”或“还原”)。故答案为:氧化;
②外电路中,电子从负极(NiO)流出,经外电路到正极(Pt),即导线中电子流动方向是从上→下,所以电子是从NiO电极流出(填“NiO”或“Pt”)。故答案为:NiO;
③Pt电极上是氧气得到电子被还原成氧离子,电极反应式为O2+4e-=2O2-。故答案为:O2+4e-=2O2-。
18.(1)Fe3+>Cu2+>Fe2+
(2) 2:1 E 2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O
(3) H2(g)+O2(g)= H2O(l) △H=-285.8kJ mol-1 436
(4)+84.6
【详解】(1)氧化性:氧化剂>氧化产物,Cu2+>Fe2+,Fe3+>Cu2+;
故答案为:Fe3+>Cu2+>Fe2+。
(2)①Mn化合价由+4降低到+2作氧化剂,Cl化合价由-1升高到0作还原剂,则n(还原剂):n(氧化剂)=2:1;
故答案为:2:1。
②该反应中有4个HCl参与反应,其中2个HCl化合价升高作还原剂,2个HCl化合价不变体现酸的同性;
故答案为:E。
③根据单线桥原则,表示电子转移方向及数目
故答案为:。
④根据得失电子守恒,Mn由+7降低+2,C由+3升高到+4,需要有10个C原子反应,1个Mn原子反应,则有方程式:2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O。
(3)①根据热化学方程式书写原则,H2(g)+O2(g)= H2O(l) △H=-285.8kJ mol-1
故答案为:H2(g)+O2(g)= H2O(l) △H=-285.8kJ mol-1。
②设H-H键能为x,则有关系式x ,x=436kJ/mol;
故答案为:436
(4)③=②-2①,△H3=-64.4kJ mol-1-2(-74.5kJ mol-1)=+84.6kJ mol-1
故答案为:+84.6
19.
【详解】(1)铅蓄电池:中正反应为放电过程,Pb化合价由0价升高到+2价,失电子,发生氧化反应,作负极,故负极反应式为;逆反应为充电过程,阳极发生失电子的氧化反应,故为PbSO4生成PbO2的反应,阳极反应式为;
(2) 镍镉电池:中正反应为放电过程,Cd化合价由0价升高到+2价,失电子,发生氧化反应,作负极,故负极反应式为;逆反应为充电过程,阳极发生失电子的氧化反应,故为Ni(OH)2生成NiOOH的反应,阳极反应式为;
(3) 钴酸锂电池:中正反应为放电过程,LixC6化合价由0价升高到+1价,失电子,发生氧化反应,作负极,故负极反应式为;逆反应为充电过程,阳极发生失电子的氧化反应,故为LiCoO2生成的反应,阳极反应式为。
20.(1)
(2)300
【详解】(1)由题图可知,反应Ⅰ为 ,根据盖斯定律,总反应反应Ⅱ可得反应Ⅰ的热化学方程式为 。
(2)正反应的活化能-逆反应的活化能、反应物的键能总和-生成物的键能总和。,又,则。
21.(1)B
(2)A
(3)盐析
(4) H2(g)+O2(g)=H2O(g) △H=-241.8 kJ · mol-1 -571.6
(5)-41.8
【解析】(1)
维生素C能促进人体生长发育,维生素C主要存在于水果和蔬菜中,则下列富含维生素C的是辣椒,故合理选项是B;
(2)
缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是碘,互合理选项是A;
(3)
在蛋清溶液中加入饱和硫酸铵溶液有沉淀析出,该过程为可逆过程,将析出的沉淀加入水中,固体还可以再溶解,这个过程称为盐析;
(4)
由氢气和氧气反应生成1 mol水蒸气放热241.8 J,由于反应过程的热量变化与物质的存在状态及物质的多少相对应,则该反应的热化学方程式:H2(g)+O2(g)=H2O(g) △H=-241.8 kJ · mol-1;
已知18 g液态水转化成水蒸气需吸热44 kJ,18 g水的物质的量是1 mol,则反应2H2(g)+O2(g)=2H2O(l)的△H=(-241.8 kJ · mol-1-44 kJ · mol-1)×2=-571.6 kJ · mol-1;
(5)
已知:①2SO2(g)+O2(g)2SO3(g) △H=﹣196.6 kJ · mol-1
②2NO(g)+O2(g)2NO2(g) △H=﹣113.0 kJ · mol-1
则根据盖斯定律,将反应×(①-②),整理可得NO2(g)+SO2(g)SO3(g)+NO(g)的△H=-41.8 kJ · mol-1。
22. 负极 CH3OH-6e-+8OH-=CO32-+6H2O 4OH--4e-=O2↑+2H2O Mg2++2Cl-+2H2OMg(OH)2↓+H2↑+Cl2↑ pH=0 CuO 4g 2.9g Cu2+ +e-+Cl=CuCl
【详解】(1)①燃料电池中可燃物作为负极材料失去电子,CH3OH发生氧化反应,所以该电极是负极,反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;乙池为以甲池为外加电源的电解池,石墨电极连接正极,为阳极氢氧根离子放电,电极反应式为:4OH--4e-=O2↑+2H2O;丙池为惰性电极电解氯化镁溶液,反应的离子方程式为:Mg2++2Cl-+2H2OMg(OH)2↓+H2↑+Cl2↑;②反应一段时间后,甲池中消耗560mL (标准状况下) O2,为=0.025mol,根据反应O2+4e-+2H2O =4OH-,则转移电子的物质的量为0.025mol×4=0.1mol,根据乙池是电极反应4OH--4e-=O2↑+2H2O,则溶液中产生氢离子的物质的量为0.1mol,浓度为=1mol/L,则pH=0;乙池中总反应式为2CuSO4+2H2O 2Cu+2H2SO4+O2↑,若向乙池中加入CuO,物质的量为氧气的2倍,其质量为2×0.025mol×80g/mol=4g,能使CuSO4溶液恢复到原浓度;根据丙装置中,在阳极上是氢离子放电,所以镁离子和氢氧根离子之间反应生成氢氧化镁,理论上最多产生氢氧化镁0.1mol×58g/mol=2.9g固体;(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,过程中铜离子得电子产生CuCl,阴极上的电极反应式为:Cu2+ +e-+Cl-=CuCl。
23.(1)a→b
(2)CH3COO--8e- + 4H2O = 2H2CO3 + 7H+
(3)250(n - m)
【详解】(1)a极碳元素价态升高失电子,故a极为负极,电子由负极到正极,该电池放电时,电子从a→b,故答案为: a→b;
(2)a极上CH3COO-发生氧化反应生成碳酸,电极反应为: CH3COO--8e- + 4H2O = 2H2CO3 + 7H+,故答案为: CH3COO--8e- + 4H2O = 2H2CO3 + 7H+;
(3)1m3 = 1000L,若废水中对氯苯酚的含量是nmol/L,经处理后的水样中要求对氯苯酚的含量小于mmol/L,则处理掉的n(氯苯)= 1000(n- m) mol,根据转移电子守恒可知,醋酸根离子和氯苯的关系为:n(CH3COO- ) ~ 4n(氯苯),则至少添加CH3COO-的物质的量为250(n- m),故答案为: 250(n - m)。
答案第1页,共2页
答案第1页,共2页
