江苏省启东市东南中学2023-2024学年高二上学期第二次质量检测化学试卷(PDF版含答案)
文档属性
| 名称 | 江苏省启东市东南中学2023-2024学年高二上学期第二次质量检测化学试卷(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 14:40:35 | ||
图片预览


文档简介
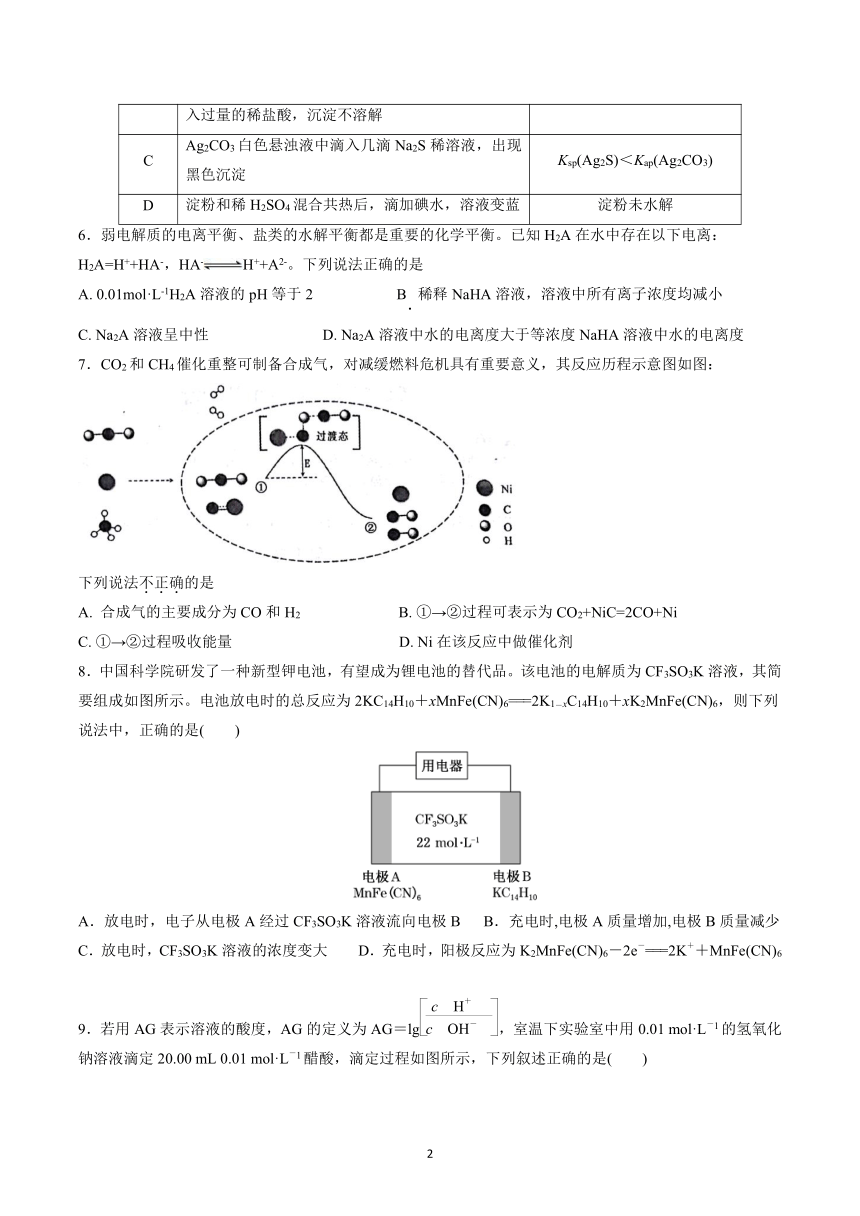
东南中学 2023-2024 学年度第一学期第二次质量检测
高二年级化学试卷
(考试时间:75 分钟 试卷满分:100 分)
可能用到的相对原子质量:H:1 C:12 O:16 Ca:40 Fe:56 Cu:64 Zn:65 Co:59
一、选择题(本题共 14小题,每小题 3分,共 42分,每小题只有一个选项符合题意)
1.下列措施能促进水的电离,并使 c(OH-)>c(H+)的是
A.向水中加入少量 NaCl B.将水加热煮沸
C.向水中加入少量 CH3COONa D.向水中加入少量 NH4NO3
2.某反应使用催化剂后,其反应过程中能量变化如图,下列说法错误的是( )
A.总反应为放热反应 B.使用催化剂后,活化能不变
C.反应①是吸热反应,反应②是放热反应 D.ΔH=ΔH1+ΔH2
3.已知 NA为阿伏加德罗常数。常温下,下列说法正确的是
A. 0.1LpH=8的氨水中 NH4+的个数为 9.9×10-8NA
B. 1LpH=9的 CH3COONa 溶液中,发生电离的水分子数为 1×10-9NA
C. 1L0.5mol·L-1NH4Cl溶液所含 NH4+的数目为 0.5NA
D. 0.2L0.5mol·L-1NH4NO3溶液中含有的氮原子数小于 0.2NA
4.下表所列是 2个反应在不同温度时的化学平衡常数(K)。
反应 ①N2(g)+O2(g) 2NO(g) ΔH1 ②N2(g)+3H2(g) 2NH3(g) ΔH2
温度/℃ 27 2 000 25 400 450
K 3.8×10-31 0.1 5×108 0.507 0.152
关于反应①、②的下列说法正确的是( )
A.反应①、②均为吸热反应
B.反应①不适合用于大规模人工固氮
C.可求算反应 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)的ΔH
D.一定温度下,①、②分别达到平衡,压缩容器体积均可使 N2的转化率增大
5.下列实验操作、现象及结论均正确的是( )
选项 实验操作和现象 结论
A Al2(SO4)3溶液蒸发结晶后得到白色固体 该固体成分为 Al2O3
B 向某溶液中加入 BaCl -2溶液,产生白色沉淀,再加 该溶液中含有 SO24
1
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
入过量的稀盐酸,沉淀不溶解
Ag2CO3白色悬浊液中滴入几滴 Na2S 稀溶液,出现
C Ksp(Ag2S)<Kap(Ag2CO3)
黑色沉淀
D 淀粉和稀 H2SO4混合共热后,滴加碘水,溶液变蓝 淀粉未水解
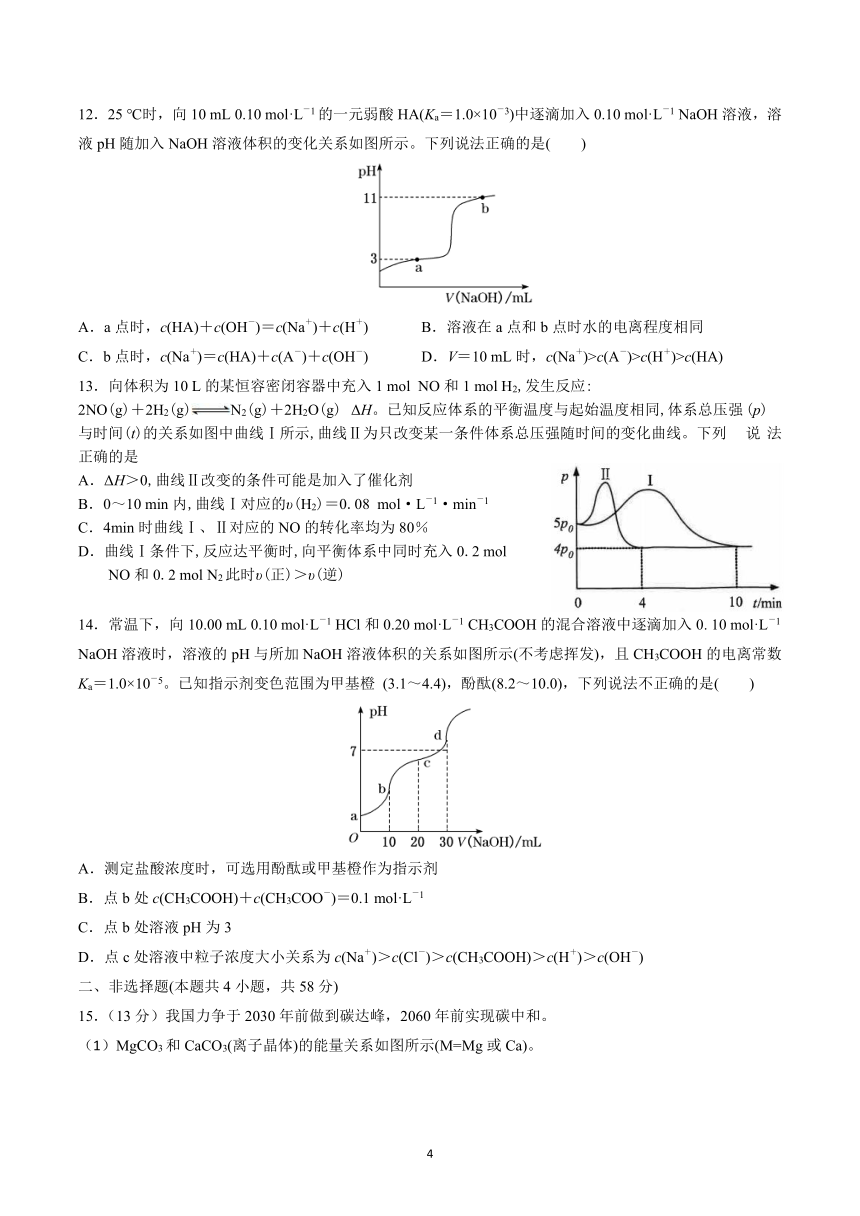
6.弱电解质的电离平衡、盐类的水解平衡都是重要的化学平衡。已知 H2A在水中存在以下电离:
H2A=H++HA-,HA- H++A2-。下列说法正确的是
A. 0.01mol·L-1H2A溶液的 pH等于 2 B. 稀释 NaHA溶液,溶液中所有离子浓度均减小
C. Na2A溶液呈中性 D. Na2A溶液中水的电离度大于等浓度 NaHA溶液中水的电离度
7.CO2和 CH4催化重整可制备合成气,对减缓燃料危机具有重要意义,其反应历程示意图如图:
下列说法不.正.确.的是
A. 合成气的主要成分为 CO和 H2 B.①→②过程可表示为 CO2+NiC=2CO+Ni
C.①→②过程吸收能量 D. Ni在该反应中做催化剂
8.中国科学院研发了一种新型钾电池,有望成为锂电池的替代品。该电池的电解质为 CF3SO3K溶液,其简
要组成如图所示。电池放电时的总反应为 2KC14H10+xMnFe(CN)6===2K1-xC14H10+xK2MnFe(CN)6,则下列
说法中,正确的是( )
A.放电时,电子从电极 A经过 CF3SO3K溶液流向电极 B B.充电时,电极 A质量增加,电极 B质量减少
C - +.放电时,CF3SO3K溶液的浓度变大 D.充电时,阳极反应为 K2MnFe(CN)6-2e ===2K +MnFe(CN)6
c H+
9.若用 AG - -表示溶液的酸度,AG的定义为 AG=lg c OH ,室温下实验室中用 0.01 mol·L 1的氢氧化
钠溶液滴定 20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是( )
2
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
A.室温下,A点的溶液显酸性 B.A点时加入氢氧化钠溶液的体积等于 20.00 mL
C.室温下,AG=7时溶液的 pH=3.5 D.从 O到 B,水的电离程度逐渐减小
10.中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯
放电
电池,电池反应式为 LixC6+Li1-xCoO2 充电 C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确
的是( )
A.该电池若用隔膜可选用阴离子交换膜
B.充电时,电路中每转移 1 mol e-,石墨烯电极质量增加 7 g
C.放电时,LiCoO2极发生的电极反应为 LiCoO2-xe-===Li1-xCoO2+xLi+
D.对废旧的该电池进行“放电处理”,让 Li+嵌入石墨烯中而有利于回收
11.丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为
,为了提高过氧化氢异丙苯的转化率,反应进行时需及时
从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的
-
初始浓度为 x mol·L 1,反应过程中的液体体积变化忽略不计。下列说法不正确的是( )
A.a、c 两点丙酮的物质的量浓度相等
B.b、c两点的逆反应速率:v(b)>v(c)
C.100 ℃时,0~5 h 之间丙酮的平均反应速率为 0.14x mol·L-1·h-1
D 0.98x×0.98x.若 b点处于化学平衡,则 120 ℃时反应的平衡常数 K=
0.02x
3
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
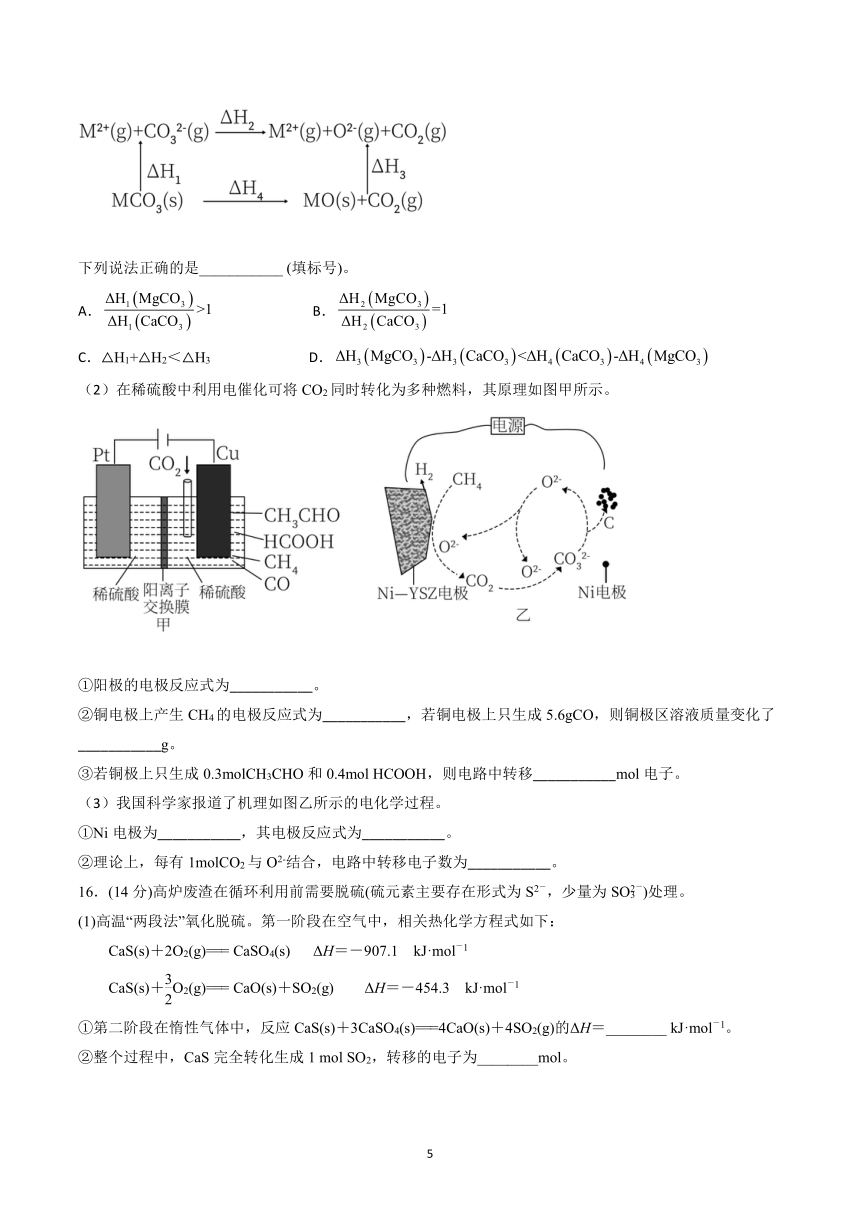
12.25 ℃时,向 10 mL 0.10 mol·L-1的一元弱酸 HA(K =1.0×10-3)中逐滴加入 0.10 mol·L-a 1 NaOH溶液,溶
液 pH随加入 NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
A.a点时,c(HA)+c(OH-) c(Na+= )+c(H+) B.溶液在 a点和 b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A-)+c(OH-) D.V=10 mL时,c(Na+)>c(A-)>c(H+)>c(HA)
13.向体积为 10 L的某恒容密闭容器中充入 1 mol NO和 1 mol H2,发生反应:
2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH。已知反应体系的平衡温度与起始温度相同,体系总压强(p)
与时间(t)的关系如图中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件体系总压强随时间的变化曲线。下列 说 法
正确的是
A.ΔH>0,曲线Ⅱ改变的条件可能是加入了催化剂
B.0~10 min内,曲线Ⅰ对应的υ -(H2)=0.08 mol·L 1·min-1
C.4min时曲线Ⅰ、Ⅱ对应的 NO的转化率均为 80%
D.曲线Ⅰ条件下,反应达平衡时,向平衡体系中同时充入 0.2 mol
NO和 0.2 mol N2此时υ(正)>υ(逆)
14 -.常温下,向 10.00 mL 0.10 mol·L 1 HCl和 0.20 mol·L-1 CH3COOH的混合溶液中逐滴加入 0. 10 mol·L-1
NaOH溶液时,溶液的 pH与所加 NaOH溶液体积的关系如图所示(不考虑挥发),且 CH3COOH的电离常数
Ka=1.0×10-5。已知指示剂变色范围为甲基橙 (3.1~4.4),酚酞(8.2~10.0),下列说法不正确的是( )
A.测定盐酸浓度时,可选用酚酞或甲基橙作为指示剂
B.点 b处 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
C.点 b处溶液 pH为 3
D +.点 c处溶液中粒子浓度大小关系为 c(Na )>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-)
二、非选择题(本题共 4小题,共 58分)
15.(13分)我国力争于 2030年前做到碳达峰,2060年前实现碳中和。
(1)MgCO3和 CaCO3(离子晶体)的能量关系如图所示(M=Mg或 Ca)。
4
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
下列说法正确的是___________ (填标号)。
ΔH1 MgCO3 ΔH2 MgCOA 3 . >1 =1ΔH1
B
CaCO .3 ΔH2 CaCO3
C.△H1+△H2<△H3 D.ΔH3 MgCO3 -ΔH3 CaCO3 <ΔH4 CaCO3 -ΔH4 MgCO3
(2)在稀硫酸中利用电催化可将 CO2同时转化为多种燃料,其原理如图甲所示。
①阳极的电极反应式为___________。
②铜电极上产生 CH4的电极反应式为___________,若铜电极上只生成 5.6gCO,则铜极区溶液质量变化了
___________g。
③若铜极上只生成 0.3molCH3CHO和 0.4mol HCOOH,则电路中转移___________mol电子。
(3)我国科学家报道了机理如图乙所示的电化学过程。
①Ni电极为___________,其电极反应式为___________。
②理论上,每有 1molCO2与 O2-结合,电路中转移电子数为___________。
16.(14分) -高炉废渣在循环利用前需要脱硫(硫元素主要存在形式为 S2-,少量为 SO23 )处理。
(1)高温“两段法”氧化脱硫。第一阶段在空气中,相关热化学方程式如下:
CaS(s)+2O2(g)=== CaSO4(s) ΔH=-907.1 kJ·mol-1
CaS(s) 3+ O2(g)=== CaO(s)+SO -2(g) ΔH=-454.3 kJ·mol 1
2
①第二阶段在惰性气体中,反应 CaS(s)+3CaSO -4(s)===4CaO(s)+4SO2(g)的ΔH=________ kJ·mol 1。
②整个过程中,CaS完全转化生成 1 mol SO2,转移的电子为________mol。
5
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
电解
③生成的 SO2用硫酸铜溶液吸收电解氧化,总反应为 CuSO4+SO2+2H2O=====Cu+2H2SO4。写出电解时阳
极的电极反应式__________________________。
(2)喷吹 CO2脱硫。用水浸取炉渣,通入适量的 CO2,将硫元素以含硫气体形式脱去。当 CO2的流量、温度
- -
一定时,渣—水混合液的 pH、含碳元素各种微粒(H2CO3、HCO3、 CO23 )的分布随喷吹时间变化如图 1和
图 2所示。
-
①已知 Ksp(CdS)=8.0×10 27,Ksp(CdCO3)=4.0×10-12。取渣-水混合液过滤,可用如下试剂和一定浓度
-
盐酸验证滤液中存在 SO23 。试剂的添加顺序依次为________(填字母)。
a.H2O2 B.BaCl2 c.CdCO3
②H2CO3第二步电离的电离常数为 Ka2,则 pKa2=________(填数值,已知 pKa2=-lg Ka2)。
③通入 CO2 15~30 min时,混合液中发生的主要脱硫反应的离子方程式为______________。
(3)硫酸工业生产中 SO3吸收率与进入吸收塔的硫酸浓度和温度关系如图 3,由图可知吸收 SO3所用硫
酸的适宜浓度为 98.3%,温度为____________,而工业生产中一般采用 60℃的可能原因是
__________________________________________________________________。
17.(15 分)高氯酸(化学式 HClO4,一种无色液体,沸点 130℃)及其盐是重要的强氧化剂。其制备、降解和
监测是研究的热点课题之一。
(1)工业制备。一种生产高氯酸的工业流程如下:
6
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
①“反应器”中发生反应的化学方程式为 。
②使用过量浓 H2SO4的原因是 。
③“操作 a”的名称: 。
(2)降解过程。高氯酸盐还原菌降解 ClO 4 是一种高效降解的生物手段,过程如题 16图-1所示:
根据图示过程,高氯酸根离子降解的总反应离子方程式可表示为 。
(3)Cl- -监测。高氯酸盐降解后排放的废水中 Cl 的含量不得超过国家规定值。实验室可用 AgNO3标准
-
溶液测定某废水中 Cl 的含量。请完成相应的实验步骤:准确量取 25.00 mL待测废水于锥形瓶中,
2Ag+ CrO 2 ,进行数据处理。(终点反应为 + 4 =Ag2CrO4↓砖红色)。实验中须使用的
试剂有:K2CrO4溶液、AgNO3标准溶液;除常用仪器外须使用的仪器有:棕色酸式滴定管)
18.(16分)CO2的资源化利用技术是世界各国研究的热点。
Ⅰ.CO2与 H2合成二甲醚(CH3OCH3)。该工艺主要涉及三个反应:
反应 A:CO2(g)+3H2(g)=CH3OH -(g)+H2O(g) ΔH=-49.01 kJ·mol 1
反应 B:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1
反应 C:2CH3OH(g)=CH3OCH g H O g ΔH 24 52kJ mol-3( )+ 2 ( ) =- . · 1
(1)一定温度下,向 1 L恒容密闭容器中加入 0.25 mol CO2和 1.0 mol H2发生上述 3个反应,达到平衡
时测得部分物质的浓度如下表所示:
成分 CO CO2 CH3OCH3
浓度/mol·L-1 8×10-3 0.17 3×10-2
则 CO2的平衡转化率α= ,平衡时 CO2转化为 CH3OCH3的选择性= ,(选择
性是指生成指定物质消耗的 CO2占 CO2消耗总量的百分比)。
n H2
(2)在压强 3.0 MPa, =4 时,不同温度下 CO2的平衡转化率
n CO2
和产物的选择性如题 17图-1所示。
①当温度超过 290℃,CO2的平衡转化率随温度升高而增大的原
因是 。
②不改变反应时间和温度,一定能提高 CH3OCH3 选择性的措
7
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
施有 。
Ⅱ.CO2与 CH4重整制合成气(反应中催化剂活性因积碳而降低。)主要反应为:
反应 A:CH4(g)+CO2(g)=2CO(g)+2H2(g)
反应 B:CO2(g)+H2(g)=CO(g)+H2O(g)
反应 C:CH4(g)+H2O(g)=CO(g)+3H2(g)
不同温度下,分别向若干体积相等的密闭容器中充入等量 CH4
和 CO2。反应相同时间,实验测得原料气的转化率和水的物质
的量随温度变化的曲线如题 17图-2所示。
(3) 图 中 表 示 CO2 的 转 化 率 随 温 度 变 化 的 曲 线
是 。(填 X或 Y)
n CH4
(4)其他条件不变,起始 较小或较大时,CO2的转化率都较低的原因是 。
n CO2
8
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
答案
一、选择题(本题共 14 小题,每小题 3 分,共 42 分,每小题只有一个选项符合题意)
1.【答案】C
2.【答案】B
【解析】 A.总反应热ΔH=生成物总能量-反应物总能量,根据图像可知,反应物 A+B的总能量高于
生成物 E+F的总能量,故ΔH<0,反应放热,正确;B.催化剂可降低反应活化能,错误;C.反应①A+B→C
+D,ΔH1>0,是吸热反应;反应②C+D→E+F,ΔH2<0,是放热反应,正确;D.根据盖斯定律,总反应
为 A+B→E+F,故ΔH=ΔH1+ΔH2,正确。
3.【答案】A
【解析】A. 25℃时,100mLpH=8 的氨水中存在电荷守恒:[NH4+]+[H+]=[OH-],则:[NH4+]=[OH-]-[H+]=
(10-6-10-8)mol/L,氨根离子个数为:9.9×10-8NA, A正确;
B.1LpH=9的 CH3COONa 溶液中,水的电离是促进的,发生电离的水分子数为 1×10-5NA,B错误;
C.1L0.5mol·L-1NH4Cl溶液中 NH4+有部分发生水解,所含 NH4+的数目小于 0.5NA,C错误;
D. 0.2L0.5mol·L-1NH4NO3溶液中含有的氮原子守恒,所以氮原子数等于 0.2NA,D错误;
答案选 A。
【点睛】易错点 D,考虑 NH4+水解变少,所以误以为 0.2L0.5mol·L-1NH4NO3溶液中含有的氮原子数小于
0.2NA。
4.【答案】B
【解析】反应①随温度升高,K变大,平衡正向移动,是吸热反应;反应②随温度升高,K变小,平衡逆向
移动,是放热反应,故 A错误;反应①为吸热反应,平衡常数太小,不适合用于大规模人工固氮,故 B正
确;由盖斯定律,①×2-②×2得:4NH3(g)+2O2(g) 4NO(g)+6H2(g),得不到 4NH3(g)+5O2(g) 4NO(g)
+6H2O(g),故 C错误;一定温度下,反应①N2(g)+O2(g) 2NO(g)是气体体积不变的反应,压缩容器体
积(加压),平衡不移动,不能使 N2的转化率增大,故 D错误。
5.【答案】C
【解析】在 Al2(SO4)3溶液中存在水解平衡:Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4,蒸发结晶时温度升高
水解平衡正向移动,但由于 H2SO4是不挥发性酸,故最后水解生成的 Al(OH)3与 H2SO4仍会反应,得到的
白色固体为 Al2(SO4)3,A错误;向某溶液中加入 BaCl2溶液产生白色沉淀,再加入过量的稀盐酸,沉淀不
-
溶解,该溶液中可能含有 SO 24 或 Ag+等,B错误;Ag2CO3白色悬浊液中存在溶解平衡:Ag2CO3(s) 2Ag
+(aq) -+CO23 (aq),滴入几滴 Na2S稀溶液出现黑色沉淀,说明 Ag2CO3转化为了更难溶于水的 Ag2S沉淀,由
于 Ag2CO3、Ag2S的类型相同,故 Ksp(Ag2S)<Ksp(Ag2CO3),C正确;淀粉和稀 H2SO4混合共热后,滴加碘
水,溶液变蓝,说明溶液中仍有淀粉存在,淀粉可能未水解、也可能部分水解,D错误。
6.【答案】D
【解析】A.0.01mol·L-1H2A溶液缺少第二步电离平衡常数 Ka,pH无法计算,A错误;
9
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
B. NaHA溶液呈酸性稀释时,其 c(H+)减小,因温度不变,KW不变,故 c(OH-)增大,B错误;
C. Na2A溶液中 A2-水解,溶液呈碱性,C错误;
D.Na - -2A溶液中 A2 水解,水的电离受促进,NaHA溶液中 HA 电离,水的电离度收到抑制。Na2A溶液中水
的电离度大于等浓度 NaHA溶液中水的电离度,D正确;
答案选 D。
7.【答案】C
【解析】由图可知,发生 CH4(g)+CO2(g)=2CO(g)+2H2(g),Ni为催化剂,且化学反应中有化学键
的断裂和生成,①→②放出热量,以此来解答。
A. CO2和 CH4催化重整可制备合成气,则合成气的主要成分为 CO和 H2,A正确;
B. 由反应物、生成物可知,①→②既有碳氧键的断裂,又有碳氧键的形成,CO2+NiC=2CO+Ni,B正确;
C.①→②中能量降低,放出热量,C错误;
D. Ni在该反应中做催化剂,改变反应的途径,不改变反应物、生成物,D正确;
答案选 C。
8.【答案】D
【解析】放电时,该装置为原电池装置,即放电时电子不可能经过电解质溶液,故 A错误;放电时,负极(电
极 B)反应式为 KC14H10-xe-===K +1-xC14H10+xK ,正极(电极 A)反应式为MnFe(CN) +2e-6 +2K+
===K2MnFe(CN)6,充电时应将放电反应倒过来看,显然电极 A的质量是减少的,电极 B的质量是增加的,
故 B错误;根据 B项分析,放电时, CF3SO3K溶液的浓度是不发生变化,故 C错误;充电时,阳极连接
- +
电源的正极,充电时的电极反应应是放电时电极反应的逆过程,即阳极反应式为 K2MnFe(CN)6-2e ===2K
+MnFe(CN)6,故 D正确。
9.【答案】C
c H+
+
【解析】A点的 AG lg c OH- c H= =0,即 =1,则 c(H+)=c(OH-),此时溶液显中性,故 A错误;
c OH-
根据 A项分析,A点时溶液显中性,当加入氢氧化钠溶液 20.00 mL时,氢氧化钠和醋酸恰好完全中和,得
-
到醋酸钠溶液,醋酸钠是强碱弱酸盐,CH3COO 水解使溶液显碱性,说明 A点时加入氢氧化钠溶液的体积
c H+
+
小于 20.00 mL,故B - c H错误;根据图像可知,在室温下,O点时,醋酸溶液的AG=lg c OH =7,即
c OH-
107 + - - + - -= ,而水的离子积 Kw=c(H )·c(OH )=10 14,两式联立可知,c(H )=10 3.5 mol·L 1,即溶液的 pH=3.5,
故 C正确;酸或碱都会抑制水的电离,可水解的盐会促进水的电离,O点为醋酸溶液,水的电离被抑制,
从 O到 A点,醋酸的量逐渐减少,醋酸钠的量逐渐增多,溶液由酸性变为中性,水的电离程度逐渐增大,
当 V(NaOH)=20 mL时,溶液变为醋酸钠溶液,此时水的电离程度最大,继续加入氢氧化钠溶液,水的电
离程度又逐渐减小,即从 O到 B,水的电离程度先逐渐增大后逐渐减小,故 D错误。
10.【答案】B
10
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
【解析】根据电池反应,则需要锂离子由负极移向正极,所以该电池不可选用阴离子交换膜,故 A项不符
合题意;根据 Li~e-知每转移 1 mol电子,石墨烯电极上就会增加 1 mol Li,质量为 7 g,B项符合题意;
+
放电时,LiCoO2电极是正极,发生得电子的还原反应,电极反应式为 Li1-xCoO2+xLi +xe-===LiCoO2,故
C项不符合题意;根据电池反应式知,充电时锂离子嵌入石墨烯中,才会有利于回收,故 D项不符合题意。
11.【答案】D
【解析】由于起始反应物浓度相同且 a、c点转化率相同,故生成的丙酮浓度相等,A正确;由于反应物转
化率:b点>c点,故生成物浓度:b点>c点,且 b点温度大于 c点,故逆反应速率:b点>c点,B正确;
由图示知,100 ℃时,5 h时反应物的转化率为 70%,故生成丙酮的浓度=0.7x mol·L-1,则 0~5 h丙酮的平
0.7x mol·L-1
均反应速率= =0.14x mol·L-1·h-1,C正确;b点对应反应物转化率为 98%,故两种生成物的浓
5 h
度均为 0.98x mol·L-1,但在反应过程中有部分苯酚被移出反应体系,故平衡时体系中苯酚的浓度未知,故
无法求算平衡常数,D错误。
12.【答案】A
+
【解析】 A项,a点时,pH=3,c(H )=10-3mol·L-1 - -,因为 Ka=1.0×10 3,所以 c(HA)=c(A ),根据电荷
- - + +
守恒:c(A )+c(OH )=c(Na )+c(H )和 c(HA)=c(A-),得 c(HA)+c(OH-) +=c(Na )+c(H+),正确;B项,
a - - -点溶质为 HA和 NaA,pH=3,由水电离出的 c(OH )=10 11 mol·L 1;b点溶质为 NaOH和 NaA,pH=11,
c(OH-)=10-3 mol·L-1,OH-是由 NaOH电离和水电离两部分组成的,推断出由水电离出的 c(OH-)<10-3
mol·L-1,则由水电离的 c(H+)>10-11 mol·L-1,错误;C项,根据电荷守恒 c(Na+)+c(H+)=c(A-)+c(OH-)
c(Na+可得: )=c(A-)+c(OH-)-c(H+),假设 C -选项成立,则 c(A )+c(OH-)-c(H+) -=c(HA)+c(A )+c(OH
-),推出 c(HA)+c(H+)=0,故假设不成立,错误;D项,V=10 mL时,HA与 NaOH恰好完全反应生成
NaA,A-+H O HA+OH-2 ,水解后溶液显碱性,c(OH-)>c(H+),即 c(HA)>c(H+),错误。
13.【答案】D
14.【答案】A
【解析】由 HCl和 CH3COOH组成的混合溶液中,滴加 NaOH溶液,NaOH首先与 HCl反应,再与 CH3COOH
反应,而指示剂的选择则是由滴定终点时溶液的酸碱性决定的,因此加入 NaOH溶液的体积为 10 mL时,
HCl完全反应,醋酸未反应,且 CH3COOH的浓度为 0.1 mol·L-1,因此 Ka=
c H+ ·c CH3COO- 2 +≈c H =1.0×10-5,由于醋酸电离时,产生的氢离子和醋酸根离子相等,所以
c CH3COOH 0.1
c(H+) 10-此时溶液中 = 3 mol·L-1,pH=3,因此应该选择甲基橙作为指示剂,当醋酸完全反应时,溶质为
NaCl和 CH3COONa,溶液呈碱性,因此应该选择酚酞作为指示剂。根据以上分析知,测定盐酸浓度时,可
选用甲基橙作为指示剂,故 A错误;加入 NaOH溶液的体积为 10 mL时,HCl完全反应,醋酸未反应,且
CH3COOH的浓度为 0.1 mol·L-1,醋酸部分电离,所以 c(CH3COOH)+c(CH -3COO )=0.1 mol·L-1,故 B正
确;由分析可知,点 b处溶液 pH为 3,故 C正确;点 c处加入 NaOH溶液的体积为 20 mL,溶质为等物质
的量的 NaCl、CH3COONa 和 CH3COOH,溶液呈酸性,所以醋酸的电离程度大于醋酸根离子的水解程度,
11
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
c(CH3COO-)>c(Cl-)>c(CH3COOH),点 c处溶液中粒子浓度大小关系为 c(Na+)>c(Cl-)>c(CH3COOH)>c(H
+)>c(OH-),故 D正确。
二、非选择题(本题共 4 小题,共 58 分)
15.(1)AB
(2) 2H2O-4e-=4H++O2 CO2+8e-+8H+=CH4+2H2O 3.6(1分) 3.8(1分)
2-
(3) 阴极(1 分) CO 3 +4e-=C+3O2- 4NA或(4mol)
【解析】
(1)
ΔH1 MgCO3
碳酸盐分解为吸热反应,且镁离子半径小,离子键强,则 >1ΔH CaCO ,图中
ΔH2 均为碳和氧之间化学
1 3
ΔH2 MgCO3
键的断裂,故 =1ΔH CaCO 。根据盖斯定律分析,碳酸盐分解为吸热反应,即△H4=△H1+△H2-△H3>0,2 3
ΔH CaCO
即△H +△H <△H 。, 3 3
+ΔH4 CaCO3 =ΔH1 CaCO3 +ΔH2 CaCO3
1 2 3 ,
ΔH3 MgCO3 +ΔH4 MgCO3 =ΔH1 MgCO3 +ΔH2 MgCO3
因为ΔH1 MgCO3 >ΔH1 CaCO3 ,ΔH2 CaCO3 ΔH2 MgCO3 ,
故 ΔH3 MgCO3 +ΔH4 MgCO3 >ΔH3 CaCO3 +ΔH4 CaCO3 ,
即ΔH3 MgCO3 -ΔH3 CaCO3 >ΔH4 CaCO3 -ΔH4 MgCO3 ,故选 AB。
(2)
①阳极为铂电极,电极反应式为 2H2O-4e-=4H++O2。
②铜电极为阴极,实现的是二氧化碳变甲烷或一氧化碳、甲酸、乙醛等,其中生成甲烷的,电极反应式为
CO2+8e-+8H+=CH4+2H2O,若铜电极上只生成 5.6gCO,电极反应为 CO2+2e-+2H+=CO+H2O,当有
1mol一氧化碳生成,则铜极去溶液的质量变化为 44+2-28=18克,则当生成 5.6克一氧化碳,即 0.2mol一氧
化碳时,铜极区溶液质量变化了 3.6g。
③若铜极上每生成 1molCH3CHO,转移 10mol 电子,每生成 1mol HCOOH,转移 2mol 电子,则只生成
0.3molCH3CHO和 0.4mol HCOOH,则电路中转移 3+0.8=3.8mol电子。
(3)
2-
①Ni电极碳酸根离子生成碳和氧气,为阴极,其电极反应式为 CO 3 +4e-C+3O2-。
②理论上,每有 1molCO2与 O2-结合生成 1mol 碳酸根离子,则意味着电路中有 4mol 电子转移,故电路中转
移电子数为 4NA。
16 -.【答案】(1)①904.1 ②6 ③SO2+2H2O-2e-===SO2 +4 +4H (2)①cba ②10.25(1 分) ③2CO2
-
+S2 +2H2O===2HCO-3+H2S↑ (3)40 ℃(1分) 适当升高反应的温度可加快吸收 SO3的速率
12
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
【解析】(1)①将题给已知热化学方程式依次编号为①②,利用盖斯定律将②×4-①×3可得反应 CaS(s)
+3CaSO4(s)===4CaO(s)+4SO2(g),则ΔH=(-454.3 kJ·mol-1)×4-(-907.1 kJ·mol-1)×3=904.1 kJ·mol-
1;②CaS完全转化生成 SO2时,S元素的化合价从-2价升高到+4价,则生成 1 mol SO2转移电子的物质
的量为[(+4)-(-2)]mol=6 mol;③由电解总反应式可知,SO2在阳极上失电子发生氧化反应生成 H2SO4,
电极反应式为 SO -2+2H2O-2e ===SO2-4 +4H+。(2)①由题意可知渣-水混合液的滤液中含有 S2-,为排除 S2
- -对 SO 23 检验的干扰,应先加入 CdCO -3将 S2 转化为 CdS沉淀,过滤,向滤液中加入 BaCl2溶液,得到碳
酸钡和亚硫酸钡沉淀,过滤,向滤渣中加入双氧水充分反应,将亚硫酸钡氧化成硫酸钡,最后加入盐酸,
- -
若溶液中存在 SO32 ,沉淀不能完全溶解,若不存在 SO32 ,沉淀会完全溶解;②由图 1、2可知,当溶液中
2- +
c(CO2- - c CO3 ·c H + -3 )和 c(HCO3 )相等时,溶液的 pH为 10.25,则 Ka2= =c(H )=10 10.25,则 pKa2=
c HCO-3
10.25 -;③由图 1、2可知,通入 CO2 15~30 min时,溶液中碳元素主要以 HCO 3形式存在,说明二氧化碳
- - - -
与溶液中的 S2 反应生成 HCO 3和 H2S,反应的离子方程式为 2CO2+S2 +2H2O===2HCO3+H2S↑;(3)由图
3可知,当吸收 SO3所用硫酸的浓度为 98.3%,温度为 40 ℃时 SO3的吸收率最高,但是适当升高温度可以
加快吸收速率,所以工业生产中一般采用 60 ℃。
18.
13
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
19.
14
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
高二年级化学试卷
(考试时间:75 分钟 试卷满分:100 分)
可能用到的相对原子质量:H:1 C:12 O:16 Ca:40 Fe:56 Cu:64 Zn:65 Co:59
一、选择题(本题共 14小题,每小题 3分,共 42分,每小题只有一个选项符合题意)
1.下列措施能促进水的电离,并使 c(OH-)>c(H+)的是
A.向水中加入少量 NaCl B.将水加热煮沸
C.向水中加入少量 CH3COONa D.向水中加入少量 NH4NO3
2.某反应使用催化剂后,其反应过程中能量变化如图,下列说法错误的是( )
A.总反应为放热反应 B.使用催化剂后,活化能不变
C.反应①是吸热反应,反应②是放热反应 D.ΔH=ΔH1+ΔH2
3.已知 NA为阿伏加德罗常数。常温下,下列说法正确的是
A. 0.1LpH=8的氨水中 NH4+的个数为 9.9×10-8NA
B. 1LpH=9的 CH3COONa 溶液中,发生电离的水分子数为 1×10-9NA
C. 1L0.5mol·L-1NH4Cl溶液所含 NH4+的数目为 0.5NA
D. 0.2L0.5mol·L-1NH4NO3溶液中含有的氮原子数小于 0.2NA
4.下表所列是 2个反应在不同温度时的化学平衡常数(K)。
反应 ①N2(g)+O2(g) 2NO(g) ΔH1 ②N2(g)+3H2(g) 2NH3(g) ΔH2
温度/℃ 27 2 000 25 400 450
K 3.8×10-31 0.1 5×108 0.507 0.152
关于反应①、②的下列说法正确的是( )
A.反应①、②均为吸热反应
B.反应①不适合用于大规模人工固氮
C.可求算反应 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)的ΔH
D.一定温度下,①、②分别达到平衡,压缩容器体积均可使 N2的转化率增大
5.下列实验操作、现象及结论均正确的是( )
选项 实验操作和现象 结论
A Al2(SO4)3溶液蒸发结晶后得到白色固体 该固体成分为 Al2O3
B 向某溶液中加入 BaCl -2溶液,产生白色沉淀,再加 该溶液中含有 SO24
1
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
入过量的稀盐酸,沉淀不溶解
Ag2CO3白色悬浊液中滴入几滴 Na2S 稀溶液,出现
C Ksp(Ag2S)<Kap(Ag2CO3)
黑色沉淀
D 淀粉和稀 H2SO4混合共热后,滴加碘水,溶液变蓝 淀粉未水解
6.弱电解质的电离平衡、盐类的水解平衡都是重要的化学平衡。已知 H2A在水中存在以下电离:
H2A=H++HA-,HA- H++A2-。下列说法正确的是
A. 0.01mol·L-1H2A溶液的 pH等于 2 B. 稀释 NaHA溶液,溶液中所有离子浓度均减小
C. Na2A溶液呈中性 D. Na2A溶液中水的电离度大于等浓度 NaHA溶液中水的电离度
7.CO2和 CH4催化重整可制备合成气,对减缓燃料危机具有重要意义,其反应历程示意图如图:
下列说法不.正.确.的是
A. 合成气的主要成分为 CO和 H2 B.①→②过程可表示为 CO2+NiC=2CO+Ni
C.①→②过程吸收能量 D. Ni在该反应中做催化剂
8.中国科学院研发了一种新型钾电池,有望成为锂电池的替代品。该电池的电解质为 CF3SO3K溶液,其简
要组成如图所示。电池放电时的总反应为 2KC14H10+xMnFe(CN)6===2K1-xC14H10+xK2MnFe(CN)6,则下列
说法中,正确的是( )
A.放电时,电子从电极 A经过 CF3SO3K溶液流向电极 B B.充电时,电极 A质量增加,电极 B质量减少
C - +.放电时,CF3SO3K溶液的浓度变大 D.充电时,阳极反应为 K2MnFe(CN)6-2e ===2K +MnFe(CN)6
c H+
9.若用 AG - -表示溶液的酸度,AG的定义为 AG=lg c OH ,室温下实验室中用 0.01 mol·L 1的氢氧化
钠溶液滴定 20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是( )
2
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
A.室温下,A点的溶液显酸性 B.A点时加入氢氧化钠溶液的体积等于 20.00 mL
C.室温下,AG=7时溶液的 pH=3.5 D.从 O到 B,水的电离程度逐渐减小
10.中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯
放电
电池,电池反应式为 LixC6+Li1-xCoO2 充电 C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确
的是( )
A.该电池若用隔膜可选用阴离子交换膜
B.充电时,电路中每转移 1 mol e-,石墨烯电极质量增加 7 g
C.放电时,LiCoO2极发生的电极反应为 LiCoO2-xe-===Li1-xCoO2+xLi+
D.对废旧的该电池进行“放电处理”,让 Li+嵌入石墨烯中而有利于回收
11.丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为
,为了提高过氧化氢异丙苯的转化率,反应进行时需及时
从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的
-
初始浓度为 x mol·L 1,反应过程中的液体体积变化忽略不计。下列说法不正确的是( )
A.a、c 两点丙酮的物质的量浓度相等
B.b、c两点的逆反应速率:v(b)>v(c)
C.100 ℃时,0~5 h 之间丙酮的平均反应速率为 0.14x mol·L-1·h-1
D 0.98x×0.98x.若 b点处于化学平衡,则 120 ℃时反应的平衡常数 K=
0.02x
3
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
12.25 ℃时,向 10 mL 0.10 mol·L-1的一元弱酸 HA(K =1.0×10-3)中逐滴加入 0.10 mol·L-a 1 NaOH溶液,溶
液 pH随加入 NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
A.a点时,c(HA)+c(OH-) c(Na+= )+c(H+) B.溶液在 a点和 b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A-)+c(OH-) D.V=10 mL时,c(Na+)>c(A-)>c(H+)>c(HA)
13.向体积为 10 L的某恒容密闭容器中充入 1 mol NO和 1 mol H2,发生反应:
2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH。已知反应体系的平衡温度与起始温度相同,体系总压强(p)
与时间(t)的关系如图中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件体系总压强随时间的变化曲线。下列 说 法
正确的是
A.ΔH>0,曲线Ⅱ改变的条件可能是加入了催化剂
B.0~10 min内,曲线Ⅰ对应的υ -(H2)=0.08 mol·L 1·min-1
C.4min时曲线Ⅰ、Ⅱ对应的 NO的转化率均为 80%
D.曲线Ⅰ条件下,反应达平衡时,向平衡体系中同时充入 0.2 mol
NO和 0.2 mol N2此时υ(正)>υ(逆)
14 -.常温下,向 10.00 mL 0.10 mol·L 1 HCl和 0.20 mol·L-1 CH3COOH的混合溶液中逐滴加入 0. 10 mol·L-1
NaOH溶液时,溶液的 pH与所加 NaOH溶液体积的关系如图所示(不考虑挥发),且 CH3COOH的电离常数
Ka=1.0×10-5。已知指示剂变色范围为甲基橙 (3.1~4.4),酚酞(8.2~10.0),下列说法不正确的是( )
A.测定盐酸浓度时,可选用酚酞或甲基橙作为指示剂
B.点 b处 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
C.点 b处溶液 pH为 3
D +.点 c处溶液中粒子浓度大小关系为 c(Na )>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-)
二、非选择题(本题共 4小题,共 58分)
15.(13分)我国力争于 2030年前做到碳达峰,2060年前实现碳中和。
(1)MgCO3和 CaCO3(离子晶体)的能量关系如图所示(M=Mg或 Ca)。
4
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
下列说法正确的是___________ (填标号)。
ΔH1 MgCO3 ΔH2 MgCOA 3 . >1 =1ΔH1
B
CaCO .3 ΔH2 CaCO3
C.△H1+△H2<△H3 D.ΔH3 MgCO3 -ΔH3 CaCO3 <ΔH4 CaCO3 -ΔH4 MgCO3
(2)在稀硫酸中利用电催化可将 CO2同时转化为多种燃料,其原理如图甲所示。
①阳极的电极反应式为___________。
②铜电极上产生 CH4的电极反应式为___________,若铜电极上只生成 5.6gCO,则铜极区溶液质量变化了
___________g。
③若铜极上只生成 0.3molCH3CHO和 0.4mol HCOOH,则电路中转移___________mol电子。
(3)我国科学家报道了机理如图乙所示的电化学过程。
①Ni电极为___________,其电极反应式为___________。
②理论上,每有 1molCO2与 O2-结合,电路中转移电子数为___________。
16.(14分) -高炉废渣在循环利用前需要脱硫(硫元素主要存在形式为 S2-,少量为 SO23 )处理。
(1)高温“两段法”氧化脱硫。第一阶段在空气中,相关热化学方程式如下:
CaS(s)+2O2(g)=== CaSO4(s) ΔH=-907.1 kJ·mol-1
CaS(s) 3+ O2(g)=== CaO(s)+SO -2(g) ΔH=-454.3 kJ·mol 1
2
①第二阶段在惰性气体中,反应 CaS(s)+3CaSO -4(s)===4CaO(s)+4SO2(g)的ΔH=________ kJ·mol 1。
②整个过程中,CaS完全转化生成 1 mol SO2,转移的电子为________mol。
5
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
电解
③生成的 SO2用硫酸铜溶液吸收电解氧化,总反应为 CuSO4+SO2+2H2O=====Cu+2H2SO4。写出电解时阳
极的电极反应式__________________________。
(2)喷吹 CO2脱硫。用水浸取炉渣,通入适量的 CO2,将硫元素以含硫气体形式脱去。当 CO2的流量、温度
- -
一定时,渣—水混合液的 pH、含碳元素各种微粒(H2CO3、HCO3、 CO23 )的分布随喷吹时间变化如图 1和
图 2所示。
-
①已知 Ksp(CdS)=8.0×10 27,Ksp(CdCO3)=4.0×10-12。取渣-水混合液过滤,可用如下试剂和一定浓度
-
盐酸验证滤液中存在 SO23 。试剂的添加顺序依次为________(填字母)。
a.H2O2 B.BaCl2 c.CdCO3
②H2CO3第二步电离的电离常数为 Ka2,则 pKa2=________(填数值,已知 pKa2=-lg Ka2)。
③通入 CO2 15~30 min时,混合液中发生的主要脱硫反应的离子方程式为______________。
(3)硫酸工业生产中 SO3吸收率与进入吸收塔的硫酸浓度和温度关系如图 3,由图可知吸收 SO3所用硫
酸的适宜浓度为 98.3%,温度为____________,而工业生产中一般采用 60℃的可能原因是
__________________________________________________________________。
17.(15 分)高氯酸(化学式 HClO4,一种无色液体,沸点 130℃)及其盐是重要的强氧化剂。其制备、降解和
监测是研究的热点课题之一。
(1)工业制备。一种生产高氯酸的工业流程如下:
6
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
①“反应器”中发生反应的化学方程式为 。
②使用过量浓 H2SO4的原因是 。
③“操作 a”的名称: 。
(2)降解过程。高氯酸盐还原菌降解 ClO 4 是一种高效降解的生物手段,过程如题 16图-1所示:
根据图示过程,高氯酸根离子降解的总反应离子方程式可表示为 。
(3)Cl- -监测。高氯酸盐降解后排放的废水中 Cl 的含量不得超过国家规定值。实验室可用 AgNO3标准
-
溶液测定某废水中 Cl 的含量。请完成相应的实验步骤:准确量取 25.00 mL待测废水于锥形瓶中,
2Ag+ CrO 2 ,进行数据处理。(终点反应为 + 4 =Ag2CrO4↓砖红色)。实验中须使用的
试剂有:K2CrO4溶液、AgNO3标准溶液;除常用仪器外须使用的仪器有:棕色酸式滴定管)
18.(16分)CO2的资源化利用技术是世界各国研究的热点。
Ⅰ.CO2与 H2合成二甲醚(CH3OCH3)。该工艺主要涉及三个反应:
反应 A:CO2(g)+3H2(g)=CH3OH -(g)+H2O(g) ΔH=-49.01 kJ·mol 1
反应 B:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1
反应 C:2CH3OH(g)=CH3OCH g H O g ΔH 24 52kJ mol-3( )+ 2 ( ) =- . · 1
(1)一定温度下,向 1 L恒容密闭容器中加入 0.25 mol CO2和 1.0 mol H2发生上述 3个反应,达到平衡
时测得部分物质的浓度如下表所示:
成分 CO CO2 CH3OCH3
浓度/mol·L-1 8×10-3 0.17 3×10-2
则 CO2的平衡转化率α= ,平衡时 CO2转化为 CH3OCH3的选择性= ,(选择
性是指生成指定物质消耗的 CO2占 CO2消耗总量的百分比)。
n H2
(2)在压强 3.0 MPa, =4 时,不同温度下 CO2的平衡转化率
n CO2
和产物的选择性如题 17图-1所示。
①当温度超过 290℃,CO2的平衡转化率随温度升高而增大的原
因是 。
②不改变反应时间和温度,一定能提高 CH3OCH3 选择性的措
7
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
施有 。
Ⅱ.CO2与 CH4重整制合成气(反应中催化剂活性因积碳而降低。)主要反应为:
反应 A:CH4(g)+CO2(g)=2CO(g)+2H2(g)
反应 B:CO2(g)+H2(g)=CO(g)+H2O(g)
反应 C:CH4(g)+H2O(g)=CO(g)+3H2(g)
不同温度下,分别向若干体积相等的密闭容器中充入等量 CH4
和 CO2。反应相同时间,实验测得原料气的转化率和水的物质
的量随温度变化的曲线如题 17图-2所示。
(3) 图 中 表 示 CO2 的 转 化 率 随 温 度 变 化 的 曲 线
是 。(填 X或 Y)
n CH4
(4)其他条件不变,起始 较小或较大时,CO2的转化率都较低的原因是 。
n CO2
8
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
答案
一、选择题(本题共 14 小题,每小题 3 分,共 42 分,每小题只有一个选项符合题意)
1.【答案】C
2.【答案】B
【解析】 A.总反应热ΔH=生成物总能量-反应物总能量,根据图像可知,反应物 A+B的总能量高于
生成物 E+F的总能量,故ΔH<0,反应放热,正确;B.催化剂可降低反应活化能,错误;C.反应①A+B→C
+D,ΔH1>0,是吸热反应;反应②C+D→E+F,ΔH2<0,是放热反应,正确;D.根据盖斯定律,总反应
为 A+B→E+F,故ΔH=ΔH1+ΔH2,正确。
3.【答案】A
【解析】A. 25℃时,100mLpH=8 的氨水中存在电荷守恒:[NH4+]+[H+]=[OH-],则:[NH4+]=[OH-]-[H+]=
(10-6-10-8)mol/L,氨根离子个数为:9.9×10-8NA, A正确;
B.1LpH=9的 CH3COONa 溶液中,水的电离是促进的,发生电离的水分子数为 1×10-5NA,B错误;
C.1L0.5mol·L-1NH4Cl溶液中 NH4+有部分发生水解,所含 NH4+的数目小于 0.5NA,C错误;
D. 0.2L0.5mol·L-1NH4NO3溶液中含有的氮原子守恒,所以氮原子数等于 0.2NA,D错误;
答案选 A。
【点睛】易错点 D,考虑 NH4+水解变少,所以误以为 0.2L0.5mol·L-1NH4NO3溶液中含有的氮原子数小于
0.2NA。
4.【答案】B
【解析】反应①随温度升高,K变大,平衡正向移动,是吸热反应;反应②随温度升高,K变小,平衡逆向
移动,是放热反应,故 A错误;反应①为吸热反应,平衡常数太小,不适合用于大规模人工固氮,故 B正
确;由盖斯定律,①×2-②×2得:4NH3(g)+2O2(g) 4NO(g)+6H2(g),得不到 4NH3(g)+5O2(g) 4NO(g)
+6H2O(g),故 C错误;一定温度下,反应①N2(g)+O2(g) 2NO(g)是气体体积不变的反应,压缩容器体
积(加压),平衡不移动,不能使 N2的转化率增大,故 D错误。
5.【答案】C
【解析】在 Al2(SO4)3溶液中存在水解平衡:Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4,蒸发结晶时温度升高
水解平衡正向移动,但由于 H2SO4是不挥发性酸,故最后水解生成的 Al(OH)3与 H2SO4仍会反应,得到的
白色固体为 Al2(SO4)3,A错误;向某溶液中加入 BaCl2溶液产生白色沉淀,再加入过量的稀盐酸,沉淀不
-
溶解,该溶液中可能含有 SO 24 或 Ag+等,B错误;Ag2CO3白色悬浊液中存在溶解平衡:Ag2CO3(s) 2Ag
+(aq) -+CO23 (aq),滴入几滴 Na2S稀溶液出现黑色沉淀,说明 Ag2CO3转化为了更难溶于水的 Ag2S沉淀,由
于 Ag2CO3、Ag2S的类型相同,故 Ksp(Ag2S)<Ksp(Ag2CO3),C正确;淀粉和稀 H2SO4混合共热后,滴加碘
水,溶液变蓝,说明溶液中仍有淀粉存在,淀粉可能未水解、也可能部分水解,D错误。
6.【答案】D
【解析】A.0.01mol·L-1H2A溶液缺少第二步电离平衡常数 Ka,pH无法计算,A错误;
9
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
B. NaHA溶液呈酸性稀释时,其 c(H+)减小,因温度不变,KW不变,故 c(OH-)增大,B错误;
C. Na2A溶液中 A2-水解,溶液呈碱性,C错误;
D.Na - -2A溶液中 A2 水解,水的电离受促进,NaHA溶液中 HA 电离,水的电离度收到抑制。Na2A溶液中水
的电离度大于等浓度 NaHA溶液中水的电离度,D正确;
答案选 D。
7.【答案】C
【解析】由图可知,发生 CH4(g)+CO2(g)=2CO(g)+2H2(g),Ni为催化剂,且化学反应中有化学键
的断裂和生成,①→②放出热量,以此来解答。
A. CO2和 CH4催化重整可制备合成气,则合成气的主要成分为 CO和 H2,A正确;
B. 由反应物、生成物可知,①→②既有碳氧键的断裂,又有碳氧键的形成,CO2+NiC=2CO+Ni,B正确;
C.①→②中能量降低,放出热量,C错误;
D. Ni在该反应中做催化剂,改变反应的途径,不改变反应物、生成物,D正确;
答案选 C。
8.【答案】D
【解析】放电时,该装置为原电池装置,即放电时电子不可能经过电解质溶液,故 A错误;放电时,负极(电
极 B)反应式为 KC14H10-xe-===K +1-xC14H10+xK ,正极(电极 A)反应式为MnFe(CN) +2e-6 +2K+
===K2MnFe(CN)6,充电时应将放电反应倒过来看,显然电极 A的质量是减少的,电极 B的质量是增加的,
故 B错误;根据 B项分析,放电时, CF3SO3K溶液的浓度是不发生变化,故 C错误;充电时,阳极连接
- +
电源的正极,充电时的电极反应应是放电时电极反应的逆过程,即阳极反应式为 K2MnFe(CN)6-2e ===2K
+MnFe(CN)6,故 D正确。
9.【答案】C
c H+
+
【解析】A点的 AG lg c OH- c H= =0,即 =1,则 c(H+)=c(OH-),此时溶液显中性,故 A错误;
c OH-
根据 A项分析,A点时溶液显中性,当加入氢氧化钠溶液 20.00 mL时,氢氧化钠和醋酸恰好完全中和,得
-
到醋酸钠溶液,醋酸钠是强碱弱酸盐,CH3COO 水解使溶液显碱性,说明 A点时加入氢氧化钠溶液的体积
c H+
+
小于 20.00 mL,故B - c H错误;根据图像可知,在室温下,O点时,醋酸溶液的AG=lg c OH =7,即
c OH-
107 + - - + - -= ,而水的离子积 Kw=c(H )·c(OH )=10 14,两式联立可知,c(H )=10 3.5 mol·L 1,即溶液的 pH=3.5,
故 C正确;酸或碱都会抑制水的电离,可水解的盐会促进水的电离,O点为醋酸溶液,水的电离被抑制,
从 O到 A点,醋酸的量逐渐减少,醋酸钠的量逐渐增多,溶液由酸性变为中性,水的电离程度逐渐增大,
当 V(NaOH)=20 mL时,溶液变为醋酸钠溶液,此时水的电离程度最大,继续加入氢氧化钠溶液,水的电
离程度又逐渐减小,即从 O到 B,水的电离程度先逐渐增大后逐渐减小,故 D错误。
10.【答案】B
10
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
【解析】根据电池反应,则需要锂离子由负极移向正极,所以该电池不可选用阴离子交换膜,故 A项不符
合题意;根据 Li~e-知每转移 1 mol电子,石墨烯电极上就会增加 1 mol Li,质量为 7 g,B项符合题意;
+
放电时,LiCoO2电极是正极,发生得电子的还原反应,电极反应式为 Li1-xCoO2+xLi +xe-===LiCoO2,故
C项不符合题意;根据电池反应式知,充电时锂离子嵌入石墨烯中,才会有利于回收,故 D项不符合题意。
11.【答案】D
【解析】由于起始反应物浓度相同且 a、c点转化率相同,故生成的丙酮浓度相等,A正确;由于反应物转
化率:b点>c点,故生成物浓度:b点>c点,且 b点温度大于 c点,故逆反应速率:b点>c点,B正确;
由图示知,100 ℃时,5 h时反应物的转化率为 70%,故生成丙酮的浓度=0.7x mol·L-1,则 0~5 h丙酮的平
0.7x mol·L-1
均反应速率= =0.14x mol·L-1·h-1,C正确;b点对应反应物转化率为 98%,故两种生成物的浓
5 h
度均为 0.98x mol·L-1,但在反应过程中有部分苯酚被移出反应体系,故平衡时体系中苯酚的浓度未知,故
无法求算平衡常数,D错误。
12.【答案】A
+
【解析】 A项,a点时,pH=3,c(H )=10-3mol·L-1 - -,因为 Ka=1.0×10 3,所以 c(HA)=c(A ),根据电荷
- - + +
守恒:c(A )+c(OH )=c(Na )+c(H )和 c(HA)=c(A-),得 c(HA)+c(OH-) +=c(Na )+c(H+),正确;B项,
a - - -点溶质为 HA和 NaA,pH=3,由水电离出的 c(OH )=10 11 mol·L 1;b点溶质为 NaOH和 NaA,pH=11,
c(OH-)=10-3 mol·L-1,OH-是由 NaOH电离和水电离两部分组成的,推断出由水电离出的 c(OH-)<10-3
mol·L-1,则由水电离的 c(H+)>10-11 mol·L-1,错误;C项,根据电荷守恒 c(Na+)+c(H+)=c(A-)+c(OH-)
c(Na+可得: )=c(A-)+c(OH-)-c(H+),假设 C -选项成立,则 c(A )+c(OH-)-c(H+) -=c(HA)+c(A )+c(OH
-),推出 c(HA)+c(H+)=0,故假设不成立,错误;D项,V=10 mL时,HA与 NaOH恰好完全反应生成
NaA,A-+H O HA+OH-2 ,水解后溶液显碱性,c(OH-)>c(H+),即 c(HA)>c(H+),错误。
13.【答案】D
14.【答案】A
【解析】由 HCl和 CH3COOH组成的混合溶液中,滴加 NaOH溶液,NaOH首先与 HCl反应,再与 CH3COOH
反应,而指示剂的选择则是由滴定终点时溶液的酸碱性决定的,因此加入 NaOH溶液的体积为 10 mL时,
HCl完全反应,醋酸未反应,且 CH3COOH的浓度为 0.1 mol·L-1,因此 Ka=
c H+ ·c CH3COO- 2 +≈c H =1.0×10-5,由于醋酸电离时,产生的氢离子和醋酸根离子相等,所以
c CH3COOH 0.1
c(H+) 10-此时溶液中 = 3 mol·L-1,pH=3,因此应该选择甲基橙作为指示剂,当醋酸完全反应时,溶质为
NaCl和 CH3COONa,溶液呈碱性,因此应该选择酚酞作为指示剂。根据以上分析知,测定盐酸浓度时,可
选用甲基橙作为指示剂,故 A错误;加入 NaOH溶液的体积为 10 mL时,HCl完全反应,醋酸未反应,且
CH3COOH的浓度为 0.1 mol·L-1,醋酸部分电离,所以 c(CH3COOH)+c(CH -3COO )=0.1 mol·L-1,故 B正
确;由分析可知,点 b处溶液 pH为 3,故 C正确;点 c处加入 NaOH溶液的体积为 20 mL,溶质为等物质
的量的 NaCl、CH3COONa 和 CH3COOH,溶液呈酸性,所以醋酸的电离程度大于醋酸根离子的水解程度,
11
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
c(CH3COO-)>c(Cl-)>c(CH3COOH),点 c处溶液中粒子浓度大小关系为 c(Na+)>c(Cl-)>c(CH3COOH)>c(H
+)>c(OH-),故 D正确。
二、非选择题(本题共 4 小题,共 58 分)
15.(1)AB
(2) 2H2O-4e-=4H++O2 CO2+8e-+8H+=CH4+2H2O 3.6(1分) 3.8(1分)
2-
(3) 阴极(1 分) CO 3 +4e-=C+3O2- 4NA或(4mol)
【解析】
(1)
ΔH1 MgCO3
碳酸盐分解为吸热反应,且镁离子半径小,离子键强,则 >1ΔH CaCO ,图中
ΔH2 均为碳和氧之间化学
1 3
ΔH2 MgCO3
键的断裂,故 =1ΔH CaCO 。根据盖斯定律分析,碳酸盐分解为吸热反应,即△H4=△H1+△H2-△H3>0,2 3
ΔH CaCO
即△H +△H <△H 。, 3 3
+ΔH4 CaCO3 =ΔH1 CaCO3 +ΔH2 CaCO3
1 2 3 ,
ΔH3 MgCO3 +ΔH4 MgCO3 =ΔH1 MgCO3 +ΔH2 MgCO3
因为ΔH1 MgCO3 >ΔH1 CaCO3 ,ΔH2 CaCO3 ΔH2 MgCO3 ,
故 ΔH3 MgCO3 +ΔH4 MgCO3 >ΔH3 CaCO3 +ΔH4 CaCO3 ,
即ΔH3 MgCO3 -ΔH3 CaCO3 >ΔH4 CaCO3 -ΔH4 MgCO3 ,故选 AB。
(2)
①阳极为铂电极,电极反应式为 2H2O-4e-=4H++O2。
②铜电极为阴极,实现的是二氧化碳变甲烷或一氧化碳、甲酸、乙醛等,其中生成甲烷的,电极反应式为
CO2+8e-+8H+=CH4+2H2O,若铜电极上只生成 5.6gCO,电极反应为 CO2+2e-+2H+=CO+H2O,当有
1mol一氧化碳生成,则铜极去溶液的质量变化为 44+2-28=18克,则当生成 5.6克一氧化碳,即 0.2mol一氧
化碳时,铜极区溶液质量变化了 3.6g。
③若铜极上每生成 1molCH3CHO,转移 10mol 电子,每生成 1mol HCOOH,转移 2mol 电子,则只生成
0.3molCH3CHO和 0.4mol HCOOH,则电路中转移 3+0.8=3.8mol电子。
(3)
2-
①Ni电极碳酸根离子生成碳和氧气,为阴极,其电极反应式为 CO 3 +4e-C+3O2-。
②理论上,每有 1molCO2与 O2-结合生成 1mol 碳酸根离子,则意味着电路中有 4mol 电子转移,故电路中转
移电子数为 4NA。
16 -.【答案】(1)①904.1 ②6 ③SO2+2H2O-2e-===SO2 +4 +4H (2)①cba ②10.25(1 分) ③2CO2
-
+S2 +2H2O===2HCO-3+H2S↑ (3)40 ℃(1分) 适当升高反应的温度可加快吸收 SO3的速率
12
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
【解析】(1)①将题给已知热化学方程式依次编号为①②,利用盖斯定律将②×4-①×3可得反应 CaS(s)
+3CaSO4(s)===4CaO(s)+4SO2(g),则ΔH=(-454.3 kJ·mol-1)×4-(-907.1 kJ·mol-1)×3=904.1 kJ·mol-
1;②CaS完全转化生成 SO2时,S元素的化合价从-2价升高到+4价,则生成 1 mol SO2转移电子的物质
的量为[(+4)-(-2)]mol=6 mol;③由电解总反应式可知,SO2在阳极上失电子发生氧化反应生成 H2SO4,
电极反应式为 SO -2+2H2O-2e ===SO2-4 +4H+。(2)①由题意可知渣-水混合液的滤液中含有 S2-,为排除 S2
- -对 SO 23 检验的干扰,应先加入 CdCO -3将 S2 转化为 CdS沉淀,过滤,向滤液中加入 BaCl2溶液,得到碳
酸钡和亚硫酸钡沉淀,过滤,向滤渣中加入双氧水充分反应,将亚硫酸钡氧化成硫酸钡,最后加入盐酸,
- -
若溶液中存在 SO32 ,沉淀不能完全溶解,若不存在 SO32 ,沉淀会完全溶解;②由图 1、2可知,当溶液中
2- +
c(CO2- - c CO3 ·c H + -3 )和 c(HCO3 )相等时,溶液的 pH为 10.25,则 Ka2= =c(H )=10 10.25,则 pKa2=
c HCO-3
10.25 -;③由图 1、2可知,通入 CO2 15~30 min时,溶液中碳元素主要以 HCO 3形式存在,说明二氧化碳
- - - -
与溶液中的 S2 反应生成 HCO 3和 H2S,反应的离子方程式为 2CO2+S2 +2H2O===2HCO3+H2S↑;(3)由图
3可知,当吸收 SO3所用硫酸的浓度为 98.3%,温度为 40 ℃时 SO3的吸收率最高,但是适当升高温度可以
加快吸收速率,所以工业生产中一般采用 60 ℃。
18.
13
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
19.
14
{#{QQABaYKQoggAQAAAARgCQQH4CACQkACCCIoORBAIsAABwQFABAA=}#}
同课章节目录
