辽宁省抚顺市六校协作体2023-2024学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 辽宁省抚顺市六校协作体2023-2024学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 652.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 19:39:28 | ||
图片预览

文档简介
抚顺市六校协作体2023-2024学年高二上学期期末考试
化学试卷
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1、选择性必修2第一章。
5.可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 P-31 S-32
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2,4,6-三硝基甲苯(结构如图所示)是一种淡黄色晶体,不溶于水。它是一种烈性炸药,广泛用于国防、采矿、筑路、水利建设等。下列说法正确的是( )
A.原子半径:O>N>C>H B.酸性:HNO3>H2CO3
C.稳定性:CH4>NH3>H2O D.常温下,0.1mol/LHNO2溶液的pH为1
2.常温下,下列离子在酸性条件下能大量存在的是( )
A. B. C. D.CH3COO-
3.工业上利用乙烯与水的加成反应来制取乙醇,发生的反应为C2H2+H2OC2H5OH,下列说法错误的是( )
A.C2H4的空间填充模型: B.H2O的电子式:
C.H2O和H2O2互为同素异形体 D.C2H4的结构简式:CH2=CH2
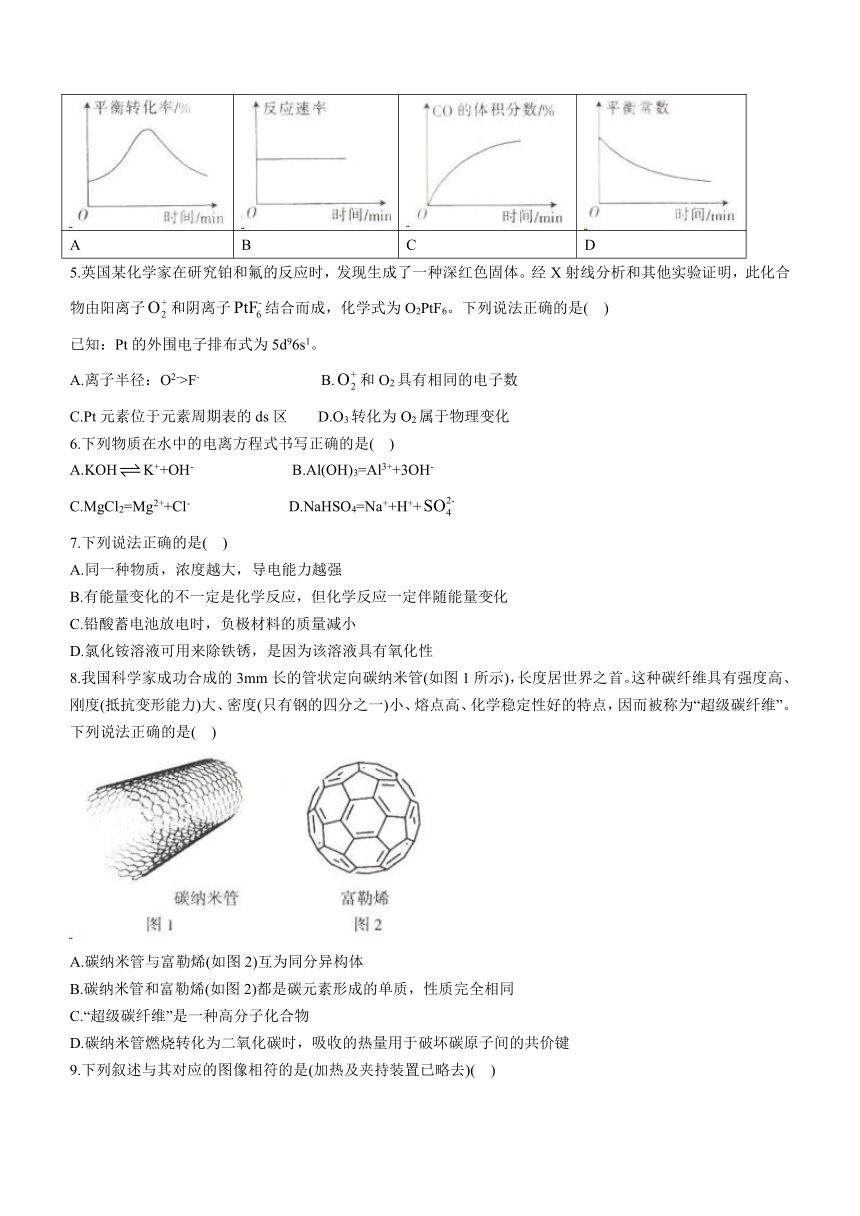
4.某密闭容器中.发生反应COCl2(g)CO(g)+Cl2(g) △H>0。当该反应达到平衡时,保持温度和容积不变,向该容器中充入少量的稀有气体,下列图像正确的是( )
A B C D
5.英国某化学家在研究铂和氟的反应时,发现生成了一种深红色固体。经X射线分析和其他实验证明,此化合物由阳离子和阴离子结合而成,化学式为O2PtF6。下列说法正确的是( )
已知:Pt的外围电子排布式为5d96s1。
A.离子半径:O2->F- B.和O2具有相同的电子数
C.Pt元素位于元素周期表的ds区 D.O3转化为O2属于物理变化
6.下列物质在水中的电离方程式书写正确的是( )
A.KOHK++OH- B.Al(OH)3=Al3++3OH-
C.MgCl2=Mg2++Cl- D.NaHSO4=Na++H++
7.下列说法正确的是( )
A.同一种物质,浓度越大,导电能力越强
B.有能量变化的不一定是化学反应,但化学反应一定伴随能量变化
C.铅酸蓄电池放电时,负极材料的质量减小
D.氯化铵溶液可用来除铁锈,是因为该溶液具有氧化性
8.我国科学家成功合成的3mm长的管状定向碳纳米管(如图1所示),长度居世界之首。这种碳纤维具有强度高、刚度(抵抗变形能力)大、密度(只有钢的四分之一)小、熔点高、化学稳定性好的特点,因而被称为“超级碳纤维”。下列说法正确的是( )
A.碳纳米管与富勒烯(如图2)互为同分异构体
B.碳纳米管和富勒烯(如图2)都是碳元素形成的单质,性质完全相同
C.“超级碳纤维”是一种高分子化合物
D.碳纳米管燃烧转化为二氧化碳时,吸收的热量用于破坏碳原子间的共价键
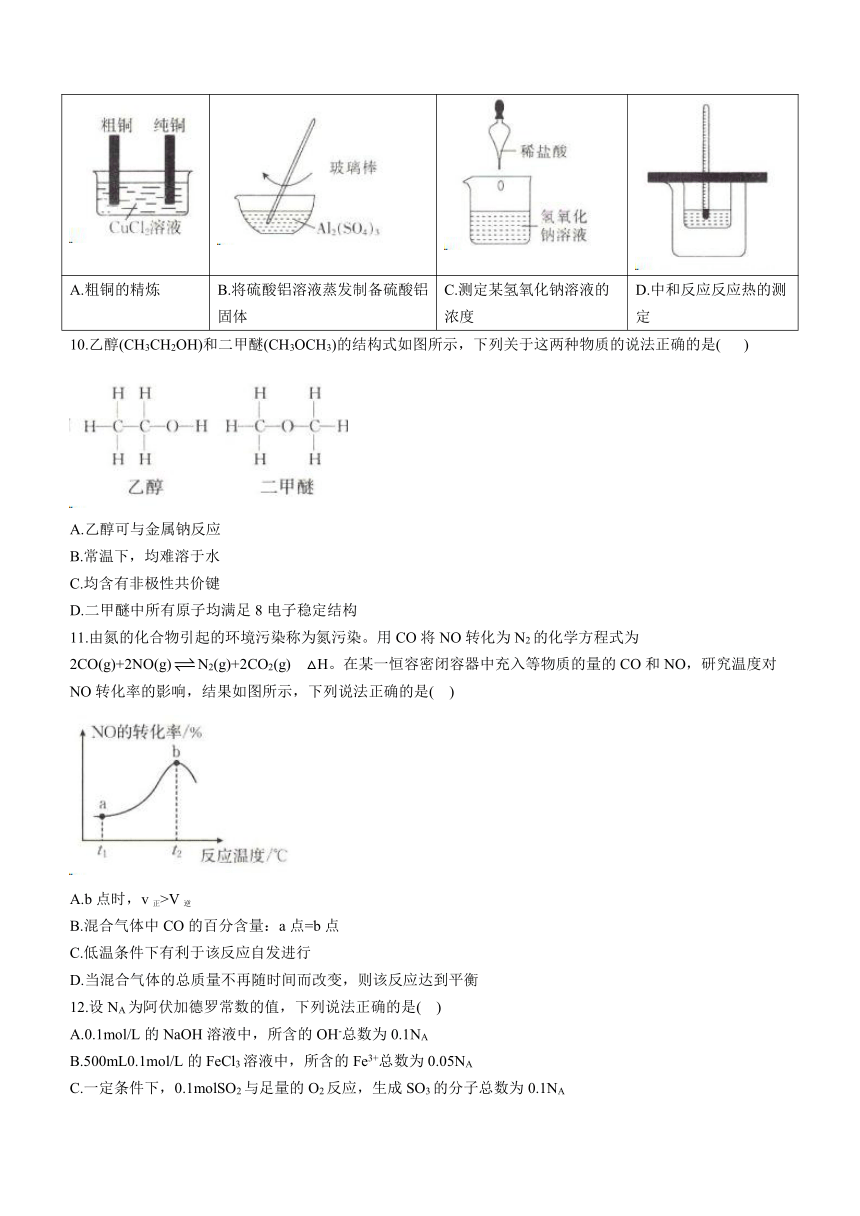
9.下列叙述与其对应的图像相符的是(加热及夹持装置已略去)( )
A.粗铜的精炼 B.将硫酸铝溶液蒸发制备硫酸铝固体 C.测定某氢氧化钠溶液的浓度 D.中和反应反应热的测定
10.乙醇(CH3CH2OH)和二甲醚(CH3OCH3)的结构式如图所示,下列关于这两种物质的说法正确的是( )
A.乙醇可与金属钠反应
B.常温下,均难溶于水
C.均含有非极性共价键
D.二甲醚中所有原子均满足8电子稳定结构
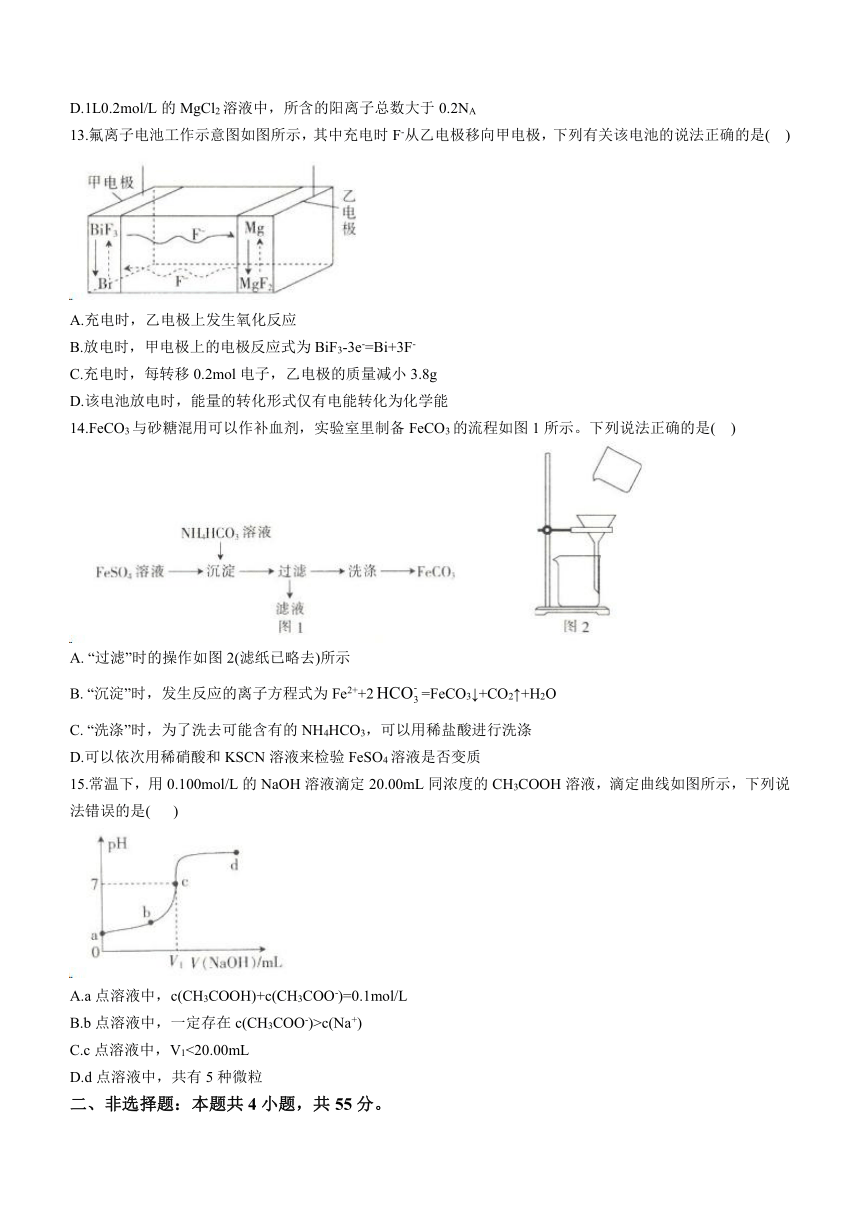
11.由氮的化合物引起的环境污染称为氮污染。用CO将NO转化为N2的化学方程式为2CO(g)+2NO(g)N2(g)+2CO2(g) △H。在某一恒容密闭容器中充入等物质的量的CO和NO,研究温度对NO转化率的影响,结果如图所示,下列说法正确的是( )
A.b点时,v正>V逆
B.混合气体中CO的百分含量:a点=b点
C.低温条件下有利于该反应自发进行
D.当混合气体的总质量不再随时间而改变,则该反应达到平衡
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1mol/L的NaOH溶液中,所含的OH-总数为0.1NA
B.500mL0.1mol/L的FeCl3溶液中,所含的Fe3+总数为0.05NA
C.一定条件下,0.1molSO2与足量的O2反应,生成SO3的分子总数为0.1NA
D.1L0.2mol/L的MgCl2溶液中,所含的阳离子总数大于0.2NA
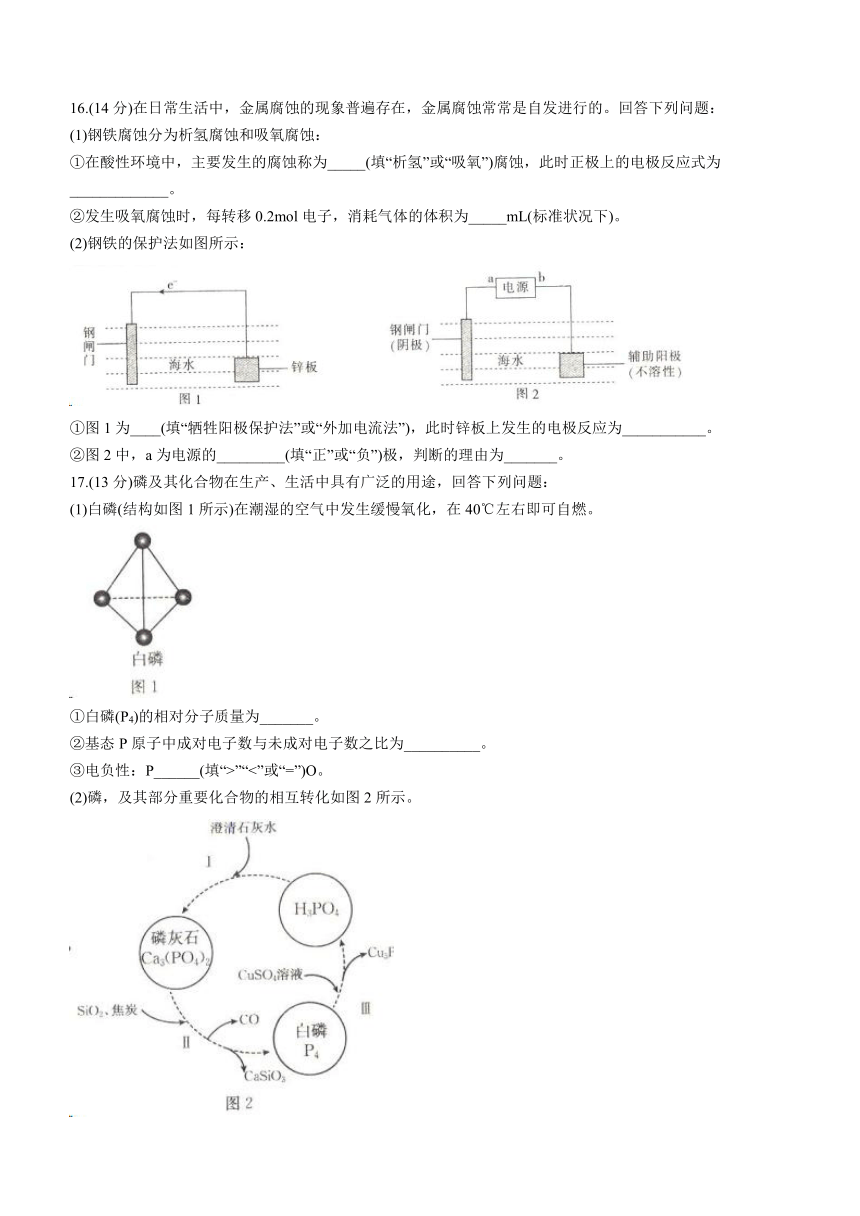
13.氟离子电池工作示意图如图所示,其中充电时F-从乙电极移向甲电极,下列有关该电池的说法正确的是( )
A.充电时,乙电极上发生氧化反应
B.放电时,甲电极上的电极反应式为BiF3-3e-=Bi+3F-
C.充电时,每转移0.2mol电子,乙电极的质量减小3.8g
D.该电池放电时,能量的转化形式仅有电能转化为化学能
14.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图1所示。下列说法正确的是( )
A. “过滤”时的操作如图2(滤纸已略去)所示
B. “沉淀”时,发生反应的离子方程式为Fe2++2=FeCO3↓+CO2↑+H2O
C. “洗涤”时,为了洗去可能含有的NH4HCO3,可以用稀盐酸进行洗涤
D.可以依次用稀硝酸和KSCN溶液来检验FeSO4溶液是否变质
15.常温下,用0.100mol/L的NaOH溶液滴定20.00mL同浓度的CH3COOH溶液,滴定曲线如图所示,下列说法错误的是( )
A.a点溶液中,c(CH3COOH)+c(CH3COO-)=0.1mol/L
B.b点溶液中,一定存在c(CH3COO-)>c(Na+)
C.c点溶液中,V1<20.00mL
D.d点溶液中,共有5种微粒
二、非选择题:本题共4小题,共55分。
16.(14分)在日常生活中,金属腐蚀的现象普遍存在,金属腐蚀常常是自发进行的。回答下列问题:
(1)钢铁腐蚀分为析氢腐蚀和吸氧腐蚀:
①在酸性环境中,主要发生的腐蚀称为_____(填“析氢”或“吸氧”)腐蚀,此时正极上的电极反应式为_____________。
②发生吸氧腐蚀时,每转移0.2mol电子,消耗气体的体积为_____mL(标准状况下)。
(2)钢铁的保护法如图所示:
①图1为____(填“牺牲阳极保护法”或“外加电流法”),此时锌板上发生的电极反应为___________。
②图2中,a为电源的_________(填“正”或“负”)极,判断的理由为_______。
17.(13分)磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。
①白磷(P4)的相对分子质量为_______。
②基态P原子中成对电子数与未成对电子数之比为__________。
③电负性:P______(填“>”“<”或“=”)O。
(2)磷,及其部分重要化合物的相互转化如图2所示。
①基态钙原子的简化电子排布式为_________。
②第一电离能:Si______(填“>”“<”或“=”)C。
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为_________。
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为________.
(3)反应Ⅲ的离子方程式为__________(已知:Cu3P不溶于水)。
18.(13分)K2Cr2O7溶液中存在平衡: (橙色)+H2O2(黄色)+2H+。用K2Cr2O7溶液进行如图所示的实验。
已知:Cr3+为绿色。
回答下列问题:
(1) K2Cr2O7中Cr元素的化合价为______价。
(2)试管Ⅰ中溶液橙色_______(填“加深”或“变浅”),判断的理由为________。
(3) Ⅰ→Ⅱ发生反应的离子方程式为___________。
(4)试管Ⅲ中存在的阳离子有K+、______(填离子符号)。
(5)试管Ⅳ中溶液为_________色。
(6)若向试管Ⅳ中加70%H2SO4溶液至过量,此时溶液呈_________,由此得出的结论为___________________。
19.(15分)我国力争于2030年前实现碳达峰,2060年前实现碳中和。研发二氧化碳的碳捕集和碳利用技术是科学研究的热点问题。实现碳达峰、碳中和目标的有效方式之一是CO2加氢生产甲醇(CH3OH),反应体系中发生如下反应:
ⅰ.CO(g)+2H2(g)CH3OH(g) △H1=-90.77kJ/mol
ⅱ.CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.21kJ/mol
ⅲ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
(1) △H3=_________kJ/mol;反应ⅰ、ⅱ、ⅲ在不同温度下对应的平衡常数如图1所示,220℃时,反应ⅰ的平衡常数K=8.1×10-3,则220℃时,反应ⅲ的平衡常数K=________。
(2)在催化剂作用下,往容积为2L的刚性容器中通入1molCO2(g)和3molH2(g),发生反应ⅰ、ⅱ、ⅲ,不同温度下CO2的平衡转化率和甲醇的选择性【甲醇的选择性=】如图2所示。
①在T℃时,若仅发生反应ⅲ,下列说法能证明反应ⅲ达到平衡状态的是______(填标号)。
A.容器内混合气体的密度不再改变
B.容器内二氧化碳与水的物质的量之比不再改变
C.容器内总压强不再改变
D.碳原子数目不再改变
②甲醇的选择性随温度的升高而降低的原因可能是___________;T℃下反应ⅱ的平衡常数K=______(保留小数点后3位)。
(3)在In2O3表面可以实现CO2加氢合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3,反应历程如图3,下列说法正确的是______(填标号)。
A.In2O3能提高CO2的平衡转化率 B.反应过程中,CO2发生了还原反应
C.In2O3会使|△H3|的数值减小 D.In2O3提高了活化分子百分数
(4)利用光电催化原理,由CO2和H2O也可制备CH3OH,装置如图4所示,不同催化剂下生成CH3OH的法拉第效率与电极电势的关系如图5所示(已知法拉第效率是指实际生成物和理论生成物的百分比)。
①为了保证生成甲醇的法拉第效率在较高水平,最合适的电势及最佳催化剂是_________。
②写出光电催化装置图中右侧的电极反应式:___________。
化学试卷参考答案
1.B
【解析】原子半径:C>N>O>H,A项错误;稳定性:H2O>NH3>CH4,C项错误;0.1mol/LHNO2溶液的pH大于1,D项错误。
2.C
【解析】、、CH3COO-均能与H+结合,形成弱电解质,A、B、D项均不符合题意。
3.C
【解析】H2O和H2O2不互为同素异形体,C项错误。
4.B
【解析】恒温恒容条件下,充入少量稀有气体对反应速率无影响,B项正确。
5.A
【解析】O3和O2的电子数不相同,B项错误;Pt元素位于元素周期表的d区,C项错误;
O3转化为O2属于化学变化,D项错误。
6.D
【解析】KOH→K++OH-,A项错误;Al(OH)3=Al3++3OH-,B项错误;MgCl2=Mg2++2Cl-,C项错误。
7.B
【解析】石灰乳比澄清石灰水的导电性弱,A项错误;铅酸蓄电池放电时,负极材料的质量增大,C项错误;氯化铵溶液可用来除铁锈,是因为该溶液显酸性,D项错误。
8.D
【解析】碳纳米管与富勒烯互为同素异形体,A项错误;碳纳米管和富勒烯都是由碳元素形成的单质,性质不完全相同,B项错误;“超级碳纤维”不是化合物,C项错误。
9.B
【解析】未形成闭合回路,A项不符合题意;无法确定稀盐酸具体的量,C项不符合题意;缺少玻璃搅拌器,D项不符合题意。
10.A
【解析】乙醇溶于水,B项错误;二甲醚不含非极性共价键,C项错误;H原子不满足8电子稳定结构,D项错误。
11.C
12.D
【解析】未给出具体体积,A项错误;Fe3+会水解,Fe3+总数小于0.05NA,B项错误;该反应为可逆反应,C项错误。
13.C
【解析】充电时,乙电极上发生还原反应,A项错误;放电时,甲电极上的电极反应式为BiF3+3e-=Bi+3F-,B项错误;电池放电时还伴随热量的变化,D项错误。
14.B
【解析】缺少玻璃棒,A项错误;稀盐酸会与FeCO3发生反应,C项错误;稀硝酸会将Fe2+氧化,D项错误。
15.D
【解析】d点溶液中,共有6种微粒,D项错误。
16.(1)①析氢(2分);2H++2e-=H2↑(2分)
②1120(2分)
(2)①牺牲阳极保护法(2分);Zn-2e-=Zn2+(2分)
②负(2分);与电源负极相连的电极为阴极(或其他合理答案,2分)
【解析】(1)②由电极反应式O2+2H2O+4e-=4OH-可得,n(O2)=0.05mol,故V(O2)=1.12L。
17.(1)①124(1分)
②4:1(2分)
③<(1分)
(2)①[Ar]4s2(2分)
②<(1分)
③CO2和CO的分子构成不同(2分)
④H3PO4+NaOH=NaH2PO4+H2O(2分)
(3)11P4+60Cu2++96H2O=24H3PO4+20Cu3P+120H+(2分)
18.(1)+6(2分)
(2)加深(1分);增大H+浓度,该反应逆向进行(2分)
(3)2+16H++3C2H5OH=4Cr3++3CH3COOH+11H2O(2分).
(4)Na+、H+(2分)
(5)黄(1分)
(6)绿色(1分);在酸性条件下的氧化性强于在碱性条件下(或其他合理答案,2分)
19.(1)-49.56(1分);6.561×10-5(2分)
(2)①BC(2分)
②反应ⅲ为放热反应,温度升高,不利于甲醇的生成(或其他合理答案,2分);0.018(2分)
(3)BD(2分)
(4)①-1.0V、Cu6(S)(2分)
②CO2+6e-+6H+=CH3OH+H2O(2分)
化学试卷
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1、选择性必修2第一章。
5.可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 P-31 S-32
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2,4,6-三硝基甲苯(结构如图所示)是一种淡黄色晶体,不溶于水。它是一种烈性炸药,广泛用于国防、采矿、筑路、水利建设等。下列说法正确的是( )
A.原子半径:O>N>C>H B.酸性:HNO3>H2CO3
C.稳定性:CH4>NH3>H2O D.常温下,0.1mol/LHNO2溶液的pH为1
2.常温下,下列离子在酸性条件下能大量存在的是( )
A. B. C. D.CH3COO-
3.工业上利用乙烯与水的加成反应来制取乙醇,发生的反应为C2H2+H2OC2H5OH,下列说法错误的是( )
A.C2H4的空间填充模型: B.H2O的电子式:
C.H2O和H2O2互为同素异形体 D.C2H4的结构简式:CH2=CH2
4.某密闭容器中.发生反应COCl2(g)CO(g)+Cl2(g) △H>0。当该反应达到平衡时,保持温度和容积不变,向该容器中充入少量的稀有气体,下列图像正确的是( )
A B C D
5.英国某化学家在研究铂和氟的反应时,发现生成了一种深红色固体。经X射线分析和其他实验证明,此化合物由阳离子和阴离子结合而成,化学式为O2PtF6。下列说法正确的是( )
已知:Pt的外围电子排布式为5d96s1。
A.离子半径:O2->F- B.和O2具有相同的电子数
C.Pt元素位于元素周期表的ds区 D.O3转化为O2属于物理变化
6.下列物质在水中的电离方程式书写正确的是( )
A.KOHK++OH- B.Al(OH)3=Al3++3OH-
C.MgCl2=Mg2++Cl- D.NaHSO4=Na++H++
7.下列说法正确的是( )
A.同一种物质,浓度越大,导电能力越强
B.有能量变化的不一定是化学反应,但化学反应一定伴随能量变化
C.铅酸蓄电池放电时,负极材料的质量减小
D.氯化铵溶液可用来除铁锈,是因为该溶液具有氧化性
8.我国科学家成功合成的3mm长的管状定向碳纳米管(如图1所示),长度居世界之首。这种碳纤维具有强度高、刚度(抵抗变形能力)大、密度(只有钢的四分之一)小、熔点高、化学稳定性好的特点,因而被称为“超级碳纤维”。下列说法正确的是( )
A.碳纳米管与富勒烯(如图2)互为同分异构体
B.碳纳米管和富勒烯(如图2)都是碳元素形成的单质,性质完全相同
C.“超级碳纤维”是一种高分子化合物
D.碳纳米管燃烧转化为二氧化碳时,吸收的热量用于破坏碳原子间的共价键
9.下列叙述与其对应的图像相符的是(加热及夹持装置已略去)( )
A.粗铜的精炼 B.将硫酸铝溶液蒸发制备硫酸铝固体 C.测定某氢氧化钠溶液的浓度 D.中和反应反应热的测定
10.乙醇(CH3CH2OH)和二甲醚(CH3OCH3)的结构式如图所示,下列关于这两种物质的说法正确的是( )
A.乙醇可与金属钠反应
B.常温下,均难溶于水
C.均含有非极性共价键
D.二甲醚中所有原子均满足8电子稳定结构
11.由氮的化合物引起的环境污染称为氮污染。用CO将NO转化为N2的化学方程式为2CO(g)+2NO(g)N2(g)+2CO2(g) △H。在某一恒容密闭容器中充入等物质的量的CO和NO,研究温度对NO转化率的影响,结果如图所示,下列说法正确的是( )
A.b点时,v正>V逆
B.混合气体中CO的百分含量:a点=b点
C.低温条件下有利于该反应自发进行
D.当混合气体的总质量不再随时间而改变,则该反应达到平衡
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1mol/L的NaOH溶液中,所含的OH-总数为0.1NA
B.500mL0.1mol/L的FeCl3溶液中,所含的Fe3+总数为0.05NA
C.一定条件下,0.1molSO2与足量的O2反应,生成SO3的分子总数为0.1NA
D.1L0.2mol/L的MgCl2溶液中,所含的阳离子总数大于0.2NA
13.氟离子电池工作示意图如图所示,其中充电时F-从乙电极移向甲电极,下列有关该电池的说法正确的是( )
A.充电时,乙电极上发生氧化反应
B.放电时,甲电极上的电极反应式为BiF3-3e-=Bi+3F-
C.充电时,每转移0.2mol电子,乙电极的质量减小3.8g
D.该电池放电时,能量的转化形式仅有电能转化为化学能
14.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图1所示。下列说法正确的是( )
A. “过滤”时的操作如图2(滤纸已略去)所示
B. “沉淀”时,发生反应的离子方程式为Fe2++2=FeCO3↓+CO2↑+H2O
C. “洗涤”时,为了洗去可能含有的NH4HCO3,可以用稀盐酸进行洗涤
D.可以依次用稀硝酸和KSCN溶液来检验FeSO4溶液是否变质
15.常温下,用0.100mol/L的NaOH溶液滴定20.00mL同浓度的CH3COOH溶液,滴定曲线如图所示,下列说法错误的是( )
A.a点溶液中,c(CH3COOH)+c(CH3COO-)=0.1mol/L
B.b点溶液中,一定存在c(CH3COO-)>c(Na+)
C.c点溶液中,V1<20.00mL
D.d点溶液中,共有5种微粒
二、非选择题:本题共4小题,共55分。
16.(14分)在日常生活中,金属腐蚀的现象普遍存在,金属腐蚀常常是自发进行的。回答下列问题:
(1)钢铁腐蚀分为析氢腐蚀和吸氧腐蚀:
①在酸性环境中,主要发生的腐蚀称为_____(填“析氢”或“吸氧”)腐蚀,此时正极上的电极反应式为_____________。
②发生吸氧腐蚀时,每转移0.2mol电子,消耗气体的体积为_____mL(标准状况下)。
(2)钢铁的保护法如图所示:
①图1为____(填“牺牲阳极保护法”或“外加电流法”),此时锌板上发生的电极反应为___________。
②图2中,a为电源的_________(填“正”或“负”)极,判断的理由为_______。
17.(13分)磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。
①白磷(P4)的相对分子质量为_______。
②基态P原子中成对电子数与未成对电子数之比为__________。
③电负性:P______(填“>”“<”或“=”)O。
(2)磷,及其部分重要化合物的相互转化如图2所示。
①基态钙原子的简化电子排布式为_________。
②第一电离能:Si______(填“>”“<”或“=”)C。
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为_________。
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为________.
(3)反应Ⅲ的离子方程式为__________(已知:Cu3P不溶于水)。
18.(13分)K2Cr2O7溶液中存在平衡: (橙色)+H2O2(黄色)+2H+。用K2Cr2O7溶液进行如图所示的实验。
已知:Cr3+为绿色。
回答下列问题:
(1) K2Cr2O7中Cr元素的化合价为______价。
(2)试管Ⅰ中溶液橙色_______(填“加深”或“变浅”),判断的理由为________。
(3) Ⅰ→Ⅱ发生反应的离子方程式为___________。
(4)试管Ⅲ中存在的阳离子有K+、______(填离子符号)。
(5)试管Ⅳ中溶液为_________色。
(6)若向试管Ⅳ中加70%H2SO4溶液至过量,此时溶液呈_________,由此得出的结论为___________________。
19.(15分)我国力争于2030年前实现碳达峰,2060年前实现碳中和。研发二氧化碳的碳捕集和碳利用技术是科学研究的热点问题。实现碳达峰、碳中和目标的有效方式之一是CO2加氢生产甲醇(CH3OH),反应体系中发生如下反应:
ⅰ.CO(g)+2H2(g)CH3OH(g) △H1=-90.77kJ/mol
ⅱ.CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.21kJ/mol
ⅲ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
(1) △H3=_________kJ/mol;反应ⅰ、ⅱ、ⅲ在不同温度下对应的平衡常数如图1所示,220℃时,反应ⅰ的平衡常数K=8.1×10-3,则220℃时,反应ⅲ的平衡常数K=________。
(2)在催化剂作用下,往容积为2L的刚性容器中通入1molCO2(g)和3molH2(g),发生反应ⅰ、ⅱ、ⅲ,不同温度下CO2的平衡转化率和甲醇的选择性【甲醇的选择性=】如图2所示。
①在T℃时,若仅发生反应ⅲ,下列说法能证明反应ⅲ达到平衡状态的是______(填标号)。
A.容器内混合气体的密度不再改变
B.容器内二氧化碳与水的物质的量之比不再改变
C.容器内总压强不再改变
D.碳原子数目不再改变
②甲醇的选择性随温度的升高而降低的原因可能是___________;T℃下反应ⅱ的平衡常数K=______(保留小数点后3位)。
(3)在In2O3表面可以实现CO2加氢合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3,反应历程如图3,下列说法正确的是______(填标号)。
A.In2O3能提高CO2的平衡转化率 B.反应过程中,CO2发生了还原反应
C.In2O3会使|△H3|的数值减小 D.In2O3提高了活化分子百分数
(4)利用光电催化原理,由CO2和H2O也可制备CH3OH,装置如图4所示,不同催化剂下生成CH3OH的法拉第效率与电极电势的关系如图5所示(已知法拉第效率是指实际生成物和理论生成物的百分比)。
①为了保证生成甲醇的法拉第效率在较高水平,最合适的电势及最佳催化剂是_________。
②写出光电催化装置图中右侧的电极反应式:___________。
化学试卷参考答案
1.B
【解析】原子半径:C>N>O>H,A项错误;稳定性:H2O>NH3>CH4,C项错误;0.1mol/LHNO2溶液的pH大于1,D项错误。
2.C
【解析】、、CH3COO-均能与H+结合,形成弱电解质,A、B、D项均不符合题意。
3.C
【解析】H2O和H2O2不互为同素异形体,C项错误。
4.B
【解析】恒温恒容条件下,充入少量稀有气体对反应速率无影响,B项正确。
5.A
【解析】O3和O2的电子数不相同,B项错误;Pt元素位于元素周期表的d区,C项错误;
O3转化为O2属于化学变化,D项错误。
6.D
【解析】KOH→K++OH-,A项错误;Al(OH)3=Al3++3OH-,B项错误;MgCl2=Mg2++2Cl-,C项错误。
7.B
【解析】石灰乳比澄清石灰水的导电性弱,A项错误;铅酸蓄电池放电时,负极材料的质量增大,C项错误;氯化铵溶液可用来除铁锈,是因为该溶液显酸性,D项错误。
8.D
【解析】碳纳米管与富勒烯互为同素异形体,A项错误;碳纳米管和富勒烯都是由碳元素形成的单质,性质不完全相同,B项错误;“超级碳纤维”不是化合物,C项错误。
9.B
【解析】未形成闭合回路,A项不符合题意;无法确定稀盐酸具体的量,C项不符合题意;缺少玻璃搅拌器,D项不符合题意。
10.A
【解析】乙醇溶于水,B项错误;二甲醚不含非极性共价键,C项错误;H原子不满足8电子稳定结构,D项错误。
11.C
12.D
【解析】未给出具体体积,A项错误;Fe3+会水解,Fe3+总数小于0.05NA,B项错误;该反应为可逆反应,C项错误。
13.C
【解析】充电时,乙电极上发生还原反应,A项错误;放电时,甲电极上的电极反应式为BiF3+3e-=Bi+3F-,B项错误;电池放电时还伴随热量的变化,D项错误。
14.B
【解析】缺少玻璃棒,A项错误;稀盐酸会与FeCO3发生反应,C项错误;稀硝酸会将Fe2+氧化,D项错误。
15.D
【解析】d点溶液中,共有6种微粒,D项错误。
16.(1)①析氢(2分);2H++2e-=H2↑(2分)
②1120(2分)
(2)①牺牲阳极保护法(2分);Zn-2e-=Zn2+(2分)
②负(2分);与电源负极相连的电极为阴极(或其他合理答案,2分)
【解析】(1)②由电极反应式O2+2H2O+4e-=4OH-可得,n(O2)=0.05mol,故V(O2)=1.12L。
17.(1)①124(1分)
②4:1(2分)
③<(1分)
(2)①[Ar]4s2(2分)
②<(1分)
③CO2和CO的分子构成不同(2分)
④H3PO4+NaOH=NaH2PO4+H2O(2分)
(3)11P4+60Cu2++96H2O=24H3PO4+20Cu3P+120H+(2分)
18.(1)+6(2分)
(2)加深(1分);增大H+浓度,该反应逆向进行(2分)
(3)2+16H++3C2H5OH=4Cr3++3CH3COOH+11H2O(2分).
(4)Na+、H+(2分)
(5)黄(1分)
(6)绿色(1分);在酸性条件下的氧化性强于在碱性条件下(或其他合理答案,2分)
19.(1)-49.56(1分);6.561×10-5(2分)
(2)①BC(2分)
②反应ⅲ为放热反应,温度升高,不利于甲醇的生成(或其他合理答案,2分);0.018(2分)
(3)BD(2分)
(4)①-1.0V、Cu6(S)(2分)
②CO2+6e-+6H+=CH3OH+H2O(2分)
同课章节目录
