江苏省连云港市2023-2024学年高二上学期普通高中学业水平合格性考试模拟化学试题(含答案)
文档属性
| 名称 | 江苏省连云港市2023-2024学年高二上学期普通高中学业水平合格性考试模拟化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 226.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 19:22:57 | ||
图片预览


文档简介
连云港市2023~2024学年普通高中学业水平合格性考试模拟试卷
化 学
(满分100分 考试时间75分钟)
可能用到的相对原子质量:H—1 C—12 O—16 S—32 Fe—56
一、 选择题:本大题共28小题,每小题3分,共计84分。在每小题的四个选项中,只有一个选项符合题目要求。
1. 2023年杭州亚运会火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内二氧化碳的零排放。甲醇(CH3OH)属于( )
A. 酸 B. 碱 C. 氧化物 D. 有机物
2. 大米主要营养成分是淀粉,淀粉属于( )
A. 糖类 B. 油脂 C. 蛋白质 D. 维生素
3. 配制100 mL 0.1 mol·L-1NaCl溶液必须用到的仪器是( )
4. 下列离子不会对水体造成污染的是( )
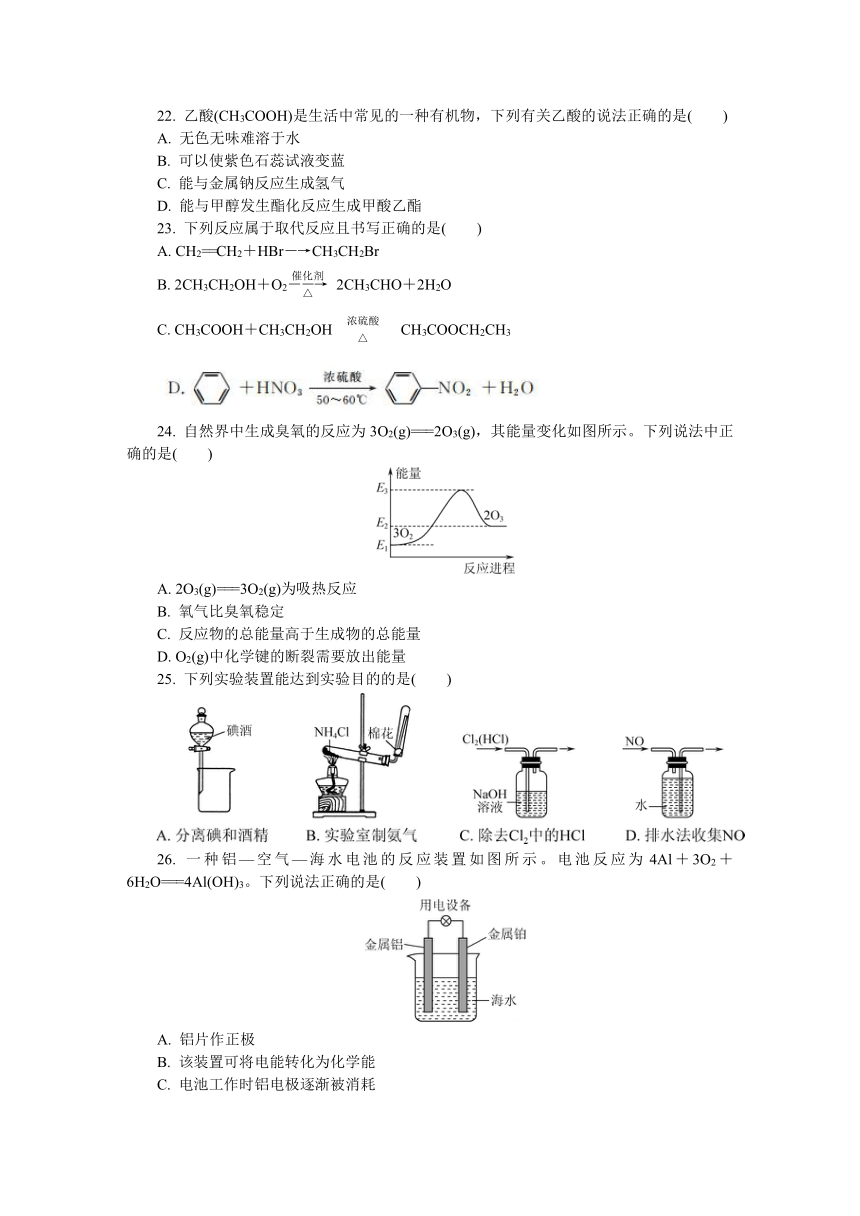
A. Cl- B. MnO C. Hg2+ D. Pb2+
5. 当光束通过下列分散系时,一定能产生明显的丁达尔效应的是( )
A. Fe(OH)3胶体 B. 石灰乳 C. 碘酒 D. 硫酸铜溶液
6. 下列属于电解质的是( )
A. 氯化钠溶液 B. 硫酸钾
C. 金属铝 D. 二氧化硫
7. 下列互为同位素的是( )
A. 乙醇和乙酸 B. 和CH3CH2CH2CH3
C. 12C与14C D. 金刚石和石墨
8. 下列物质中含有共价键的是( )
A. BaCl2 B. KOH C. CaO D. Na2S
9. 某溶液中存在大量的NH、CO、Cl-,该溶液中还可能大量存在的离子是( )
A. OH- B. Ba2+ C. Na+ D. Ag+
10. 下列物质通入(或加入)水中,溶液呈酸性的是( )
A. 氯气 B. 氨气 C. 氯化钠 D. 碳酸钠
11. 下列物质属于高分子化合物的是( )
A. 乙酸乙酯 B. 聚乙烯 C. 十六烷 D. 甘油
阅读下列材料,回答12~15题。
海水中蕴含着丰富的氯元素,主要以NaCl、MgCl2形式存在。电解熔融MgCl2可以获取Mg和Cl2,Cl2可以制盐酸、漂白粉[主要成分为Ca(ClO)2和CaCl2]等,可用NH3来处理工业生产中的氯气尾气,反应的化学方程式为3Cl2+8NH3===6NH4Cl+N2。
12. Na+和Mg2+的结构中不相同的是( )
A. 核电荷数 B. 电子数
C. 最外层电子数 D. 电子层数
13. 下列有关Cl2的说法错误的是( )
A. Cl2是有毒气体 B. 氯水中存在的分子为HClO和H2O
C. H2在Cl2中燃烧生成HCl D. Cl2通入石灰乳中制漂白粉
14. 下列化学用语表示正确的是( )
A. N2的结构式:N—N
B. 中子数为8的氮原子:N
C. NH3的电子式:
D. NH4Cl的电离方程式:NH4Cl NH+Cl-
15. 对于反应3Cl2+8NH3===6NH4Cl+N2,下列说法正确的是( )
A. Cl2是氧化剂 B. N元素化合价降低
C. 该反应中N元素全部被氧化 D. Cl2在反应过程中失去电子
16. 氨是工业制取硝酸的原料,制备硝酸时利用了氨的性质是( )
A. 无色无味气体 B. 极易溶于水
C. 具有还原性 D. 氨气易液化
17. 下列物质的性质与用途具有对应关系的是( )
A. 浓硫酸具有脱水性,可用来干燥Cl2
B. FeCl3溶液显酸性,可用于印刷电路板
C. Na2O2呈淡黄色,可用作呼吸面具中的供氧剂
D. 活性铁粉具有还原性,可用作食品抗氧化剂
18. 下列实验方案不能达到实验目的的是( )
A. 用过滤法除去NaCl溶液中的泥沙
B. 用蒸馏法分离乙酸(沸点118℃)与乙醚(沸点34℃)
C. 用石灰水鉴别NaHCO3与Na2CO3
D. 用盐酸酸化的BaCl2溶液检验Na2SO3是否变质
阅读下列材料,回答19~21题。
第三周期金属元素的单质及其化合物具有重要用途。熔融状态下金属钠可用于制备人造金刚石,方程式为4Na+CCl4C+4NaCl。氯化钠可用于氯碱工业,小苏打可治疗胃酸过多症等。氧化铝属于两性氧化物,可用作耐火材料。
19. 用金属钠制备人造金刚石的反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
20. 下列说法正确的是( )
A. 原子半径:r(Al)>r(Mg) B. 金属性:Mg>Na
C. 熔点:Na2O>Al2O3 D. 碱性:NaOH>Mg(OH)2
21. 下列反应的离子方程式表示错误的是( )
A. 钠与水的反应:2Na+2H2O===2Na++2OH-+H2↑
B. 用小苏打治疗胃酸过多:CO+2H+===CO2↑+H2O
C. 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-===2AlO +H2O
D. 电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑
22. 乙酸(CH3COOH)是生活中常见的一种有机物,下列有关乙酸的说法正确的是( )
A. 无色无味难溶于水
B. 可以使紫色石蕊试液变蓝
C. 能与金属钠反应生成氢气
D. 能与甲醇发生酯化反应生成甲酸乙酯
23. 下列反应属于取代反应且书写正确的是( )
A. CH2==CH2+HBr―→CH3CH2Br
B. 2CH3CH2OH+O22CH3CHO+2H2O
C. CH3COOH+CH3CH2OHCH3COOCH2CH3
24. 自然界中生成臭氧的反应为3O2(g)===2O3(g),其能量变化如图所示。下列说法中正确的是( )
A. 2O3(g)===3O2(g)为吸热反应
B. 氧气比臭氧稳定
C. 反应物的总能量高于生成物的总能量
D. O2(g)中化学键的断裂需要放出能量
25. 下列实验装置能达到实验目的的是( )
26. 一种铝—空气—海水电池的反应装置如图所示。电池反应为4Al+3O2+6H2O===4Al(OH)3。下列说法正确的是( )
A. 铝片作正极
B. 该装置可将电能转化为化学能
C. 电池工作时铝电极逐渐被消耗
D. 电子从铂电极经导线流向铝电极
27. 已知FeCl3溶液和KI溶液能发生反应:2Fe3++2I- 2Fe2++I2。下列关于该反应的说法错误的是( )
A. 升高温度会加快反应速率
B. 增大Fe3+和I-的浓度能加快反应速率
C. 当上述可逆反应达到平衡时,溶液中c(Fe3+)与c(Fe2+)相等
D. 向反应后的溶液中加入CCl4,充分振荡后静置,取上层溶液滴加KSCN溶液,溶液变成血红色
28. 实验室制备CuCl:将按一定物质的量之比混合的CuSO4溶液和NaCl溶液加入到三颈烧瓶中(装置如图1所示,其中夹持仪器已省略),通入SO2,充分反应后过滤,得CuCl。CuCl的产率随NaCl和CuSO4的物质的量之比变化如图2所示。已知:CuCl是难溶于水的白色固体,能溶于浓盐酸产生[CuCl2]-。下列说法错误的是( )
A. 装置a中每生成1 mol CuCl,理论上至少需要通入标准状况下22.4 L SO2
B. 装置b的作用是安全瓶,防止倒吸
C. 装置c中的液体可以是NaOH浓溶液,吸收尾气
D. 当n(NaCl)/n(CuSO4)大于1.6时,CuCl产率减小的原因是部分CuCl转化为[CuCl2]-
二、 非选择题:本题共2小题,共计16分。
29. (6分)我国科学家首次在实验室实现从CO2到淀粉的全合成。其部分合成路线如图所示:
CO2CH3OHHCHO…―→(C6H10O5)n
(1) CH3OH分子中与氧原子形成共价键的原子为________。
(2) CH3CHO与HCHO互为同系物,具有相同的官能团是________(写名称)。
(3) CO2催化加H2制CH3OH,该反应一般由以下两步反应实现:
Ⅰ. CO2+H2 CO+H2O Ⅱ. ……
写出一定条件下反应Ⅱ的化学方程式:________________________________________________________________________。
30. (10分)我国在明代就有了利用绿矾(FeSO4·7H2O)和硝酸钾制备硝酸的工艺,其主要流程如下:
(1) 已知“煅烧”时得到一种红棕色固体和三种气态氧化物,写出“煅烧”时发生反应的化学方程式:_________________________________________________。
(2) “吸收”过程通入足量空气的目的是________________________________________。
(3) “蒸馏”获得的硝酸液体显黄色是因为溶有______________(用化学式表示)。
(4) 通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.200 0 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.020 00 mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液41.00 mL。
已知:8H++MnO+5Fe2+===Mn2++5Fe3++4H2O。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
2023~2024学年普通高中学业水平合格性考试模拟试卷
化学参考答案及评分标准
1. D 2. A 3. D 4. A 5. A 6. B 7. C 8. B 9. C 10. A 11. B 12. A 13. B 14. C 15. A
16. C 17. D 18. C 19. C 20. D 21. B 22. C 23. D 24. B 25. D 26. C 27. C 28. A
29. (6分)
(1) C、H(2分)
(2) 醛基(1分)
(3) CO+2H2CH3OH(3分)
30. (10分)
(1) 2FeSO4·7H2OFe2O3+SO2↑+SO3↑+14H2O↑(3分)
(2) 将亚硫酸转化为硫酸(2分)
(3) NO2(1分)
(4) 根据离子方程式可得:MnO~5Fe2+(1分)
n(FeSO4·7H2O)=n(Fe2+)=5n(MnO)
=5×0.020 00 mol·L-1×41.00×10-3 L
=4.100×10-3 mol(1分)
m(FeSO4·7H2O)=4.100×10-3mol×278 g·mol-1=1.139 8 g(1分)
w(FeSO4·7H2O)=×100%≈94.98%(1分)
化 学
(满分100分 考试时间75分钟)
可能用到的相对原子质量:H—1 C—12 O—16 S—32 Fe—56
一、 选择题:本大题共28小题,每小题3分,共计84分。在每小题的四个选项中,只有一个选项符合题目要求。
1. 2023年杭州亚运会火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内二氧化碳的零排放。甲醇(CH3OH)属于( )
A. 酸 B. 碱 C. 氧化物 D. 有机物
2. 大米主要营养成分是淀粉,淀粉属于( )
A. 糖类 B. 油脂 C. 蛋白质 D. 维生素
3. 配制100 mL 0.1 mol·L-1NaCl溶液必须用到的仪器是( )
4. 下列离子不会对水体造成污染的是( )
A. Cl- B. MnO C. Hg2+ D. Pb2+
5. 当光束通过下列分散系时,一定能产生明显的丁达尔效应的是( )
A. Fe(OH)3胶体 B. 石灰乳 C. 碘酒 D. 硫酸铜溶液
6. 下列属于电解质的是( )
A. 氯化钠溶液 B. 硫酸钾
C. 金属铝 D. 二氧化硫
7. 下列互为同位素的是( )
A. 乙醇和乙酸 B. 和CH3CH2CH2CH3
C. 12C与14C D. 金刚石和石墨
8. 下列物质中含有共价键的是( )
A. BaCl2 B. KOH C. CaO D. Na2S
9. 某溶液中存在大量的NH、CO、Cl-,该溶液中还可能大量存在的离子是( )
A. OH- B. Ba2+ C. Na+ D. Ag+
10. 下列物质通入(或加入)水中,溶液呈酸性的是( )
A. 氯气 B. 氨气 C. 氯化钠 D. 碳酸钠
11. 下列物质属于高分子化合物的是( )
A. 乙酸乙酯 B. 聚乙烯 C. 十六烷 D. 甘油
阅读下列材料,回答12~15题。
海水中蕴含着丰富的氯元素,主要以NaCl、MgCl2形式存在。电解熔融MgCl2可以获取Mg和Cl2,Cl2可以制盐酸、漂白粉[主要成分为Ca(ClO)2和CaCl2]等,可用NH3来处理工业生产中的氯气尾气,反应的化学方程式为3Cl2+8NH3===6NH4Cl+N2。
12. Na+和Mg2+的结构中不相同的是( )
A. 核电荷数 B. 电子数
C. 最外层电子数 D. 电子层数
13. 下列有关Cl2的说法错误的是( )
A. Cl2是有毒气体 B. 氯水中存在的分子为HClO和H2O
C. H2在Cl2中燃烧生成HCl D. Cl2通入石灰乳中制漂白粉
14. 下列化学用语表示正确的是( )
A. N2的结构式:N—N
B. 中子数为8的氮原子:N
C. NH3的电子式:
D. NH4Cl的电离方程式:NH4Cl NH+Cl-
15. 对于反应3Cl2+8NH3===6NH4Cl+N2,下列说法正确的是( )
A. Cl2是氧化剂 B. N元素化合价降低
C. 该反应中N元素全部被氧化 D. Cl2在反应过程中失去电子
16. 氨是工业制取硝酸的原料,制备硝酸时利用了氨的性质是( )
A. 无色无味气体 B. 极易溶于水
C. 具有还原性 D. 氨气易液化
17. 下列物质的性质与用途具有对应关系的是( )
A. 浓硫酸具有脱水性,可用来干燥Cl2
B. FeCl3溶液显酸性,可用于印刷电路板
C. Na2O2呈淡黄色,可用作呼吸面具中的供氧剂
D. 活性铁粉具有还原性,可用作食品抗氧化剂
18. 下列实验方案不能达到实验目的的是( )
A. 用过滤法除去NaCl溶液中的泥沙
B. 用蒸馏法分离乙酸(沸点118℃)与乙醚(沸点34℃)
C. 用石灰水鉴别NaHCO3与Na2CO3
D. 用盐酸酸化的BaCl2溶液检验Na2SO3是否变质
阅读下列材料,回答19~21题。
第三周期金属元素的单质及其化合物具有重要用途。熔融状态下金属钠可用于制备人造金刚石,方程式为4Na+CCl4C+4NaCl。氯化钠可用于氯碱工业,小苏打可治疗胃酸过多症等。氧化铝属于两性氧化物,可用作耐火材料。
19. 用金属钠制备人造金刚石的反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
20. 下列说法正确的是( )
A. 原子半径:r(Al)>r(Mg) B. 金属性:Mg>Na
C. 熔点:Na2O>Al2O3 D. 碱性:NaOH>Mg(OH)2
21. 下列反应的离子方程式表示错误的是( )
A. 钠与水的反应:2Na+2H2O===2Na++2OH-+H2↑
B. 用小苏打治疗胃酸过多:CO+2H+===CO2↑+H2O
C. 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-===2AlO +H2O
D. 电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑
22. 乙酸(CH3COOH)是生活中常见的一种有机物,下列有关乙酸的说法正确的是( )
A. 无色无味难溶于水
B. 可以使紫色石蕊试液变蓝
C. 能与金属钠反应生成氢气
D. 能与甲醇发生酯化反应生成甲酸乙酯
23. 下列反应属于取代反应且书写正确的是( )
A. CH2==CH2+HBr―→CH3CH2Br
B. 2CH3CH2OH+O22CH3CHO+2H2O
C. CH3COOH+CH3CH2OHCH3COOCH2CH3
24. 自然界中生成臭氧的反应为3O2(g)===2O3(g),其能量变化如图所示。下列说法中正确的是( )
A. 2O3(g)===3O2(g)为吸热反应
B. 氧气比臭氧稳定
C. 反应物的总能量高于生成物的总能量
D. O2(g)中化学键的断裂需要放出能量
25. 下列实验装置能达到实验目的的是( )
26. 一种铝—空气—海水电池的反应装置如图所示。电池反应为4Al+3O2+6H2O===4Al(OH)3。下列说法正确的是( )
A. 铝片作正极
B. 该装置可将电能转化为化学能
C. 电池工作时铝电极逐渐被消耗
D. 电子从铂电极经导线流向铝电极
27. 已知FeCl3溶液和KI溶液能发生反应:2Fe3++2I- 2Fe2++I2。下列关于该反应的说法错误的是( )
A. 升高温度会加快反应速率
B. 增大Fe3+和I-的浓度能加快反应速率
C. 当上述可逆反应达到平衡时,溶液中c(Fe3+)与c(Fe2+)相等
D. 向反应后的溶液中加入CCl4,充分振荡后静置,取上层溶液滴加KSCN溶液,溶液变成血红色
28. 实验室制备CuCl:将按一定物质的量之比混合的CuSO4溶液和NaCl溶液加入到三颈烧瓶中(装置如图1所示,其中夹持仪器已省略),通入SO2,充分反应后过滤,得CuCl。CuCl的产率随NaCl和CuSO4的物质的量之比变化如图2所示。已知:CuCl是难溶于水的白色固体,能溶于浓盐酸产生[CuCl2]-。下列说法错误的是( )
A. 装置a中每生成1 mol CuCl,理论上至少需要通入标准状况下22.4 L SO2
B. 装置b的作用是安全瓶,防止倒吸
C. 装置c中的液体可以是NaOH浓溶液,吸收尾气
D. 当n(NaCl)/n(CuSO4)大于1.6时,CuCl产率减小的原因是部分CuCl转化为[CuCl2]-
二、 非选择题:本题共2小题,共计16分。
29. (6分)我国科学家首次在实验室实现从CO2到淀粉的全合成。其部分合成路线如图所示:
CO2CH3OHHCHO…―→(C6H10O5)n
(1) CH3OH分子中与氧原子形成共价键的原子为________。
(2) CH3CHO与HCHO互为同系物,具有相同的官能团是________(写名称)。
(3) CO2催化加H2制CH3OH,该反应一般由以下两步反应实现:
Ⅰ. CO2+H2 CO+H2O Ⅱ. ……
写出一定条件下反应Ⅱ的化学方程式:________________________________________________________________________。
30. (10分)我国在明代就有了利用绿矾(FeSO4·7H2O)和硝酸钾制备硝酸的工艺,其主要流程如下:
(1) 已知“煅烧”时得到一种红棕色固体和三种气态氧化物,写出“煅烧”时发生反应的化学方程式:_________________________________________________。
(2) “吸收”过程通入足量空气的目的是________________________________________。
(3) “蒸馏”获得的硝酸液体显黄色是因为溶有______________(用化学式表示)。
(4) 通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.200 0 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.020 00 mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液41.00 mL。
已知:8H++MnO+5Fe2+===Mn2++5Fe3++4H2O。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
2023~2024学年普通高中学业水平合格性考试模拟试卷
化学参考答案及评分标准
1. D 2. A 3. D 4. A 5. A 6. B 7. C 8. B 9. C 10. A 11. B 12. A 13. B 14. C 15. A
16. C 17. D 18. C 19. C 20. D 21. B 22. C 23. D 24. B 25. D 26. C 27. C 28. A
29. (6分)
(1) C、H(2分)
(2) 醛基(1分)
(3) CO+2H2CH3OH(3分)
30. (10分)
(1) 2FeSO4·7H2OFe2O3+SO2↑+SO3↑+14H2O↑(3分)
(2) 将亚硫酸转化为硫酸(2分)
(3) NO2(1分)
(4) 根据离子方程式可得:MnO~5Fe2+(1分)
n(FeSO4·7H2O)=n(Fe2+)=5n(MnO)
=5×0.020 00 mol·L-1×41.00×10-3 L
=4.100×10-3 mol(1分)
m(FeSO4·7H2O)=4.100×10-3mol×278 g·mol-1=1.139 8 g(1分)
w(FeSO4·7H2O)=×100%≈94.98%(1分)
同课章节目录
