题型五 化学实验综合(1) ——2024届高考化学高频题型专项训练(含解析)
文档属性
| 名称 | 题型五 化学实验综合(1) ——2024届高考化学高频题型专项训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 413.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-10 21:58:25 | ||
图片预览


文档简介
题型五 化学实验综合(1)
——2024届高考化学高频题型专项训练
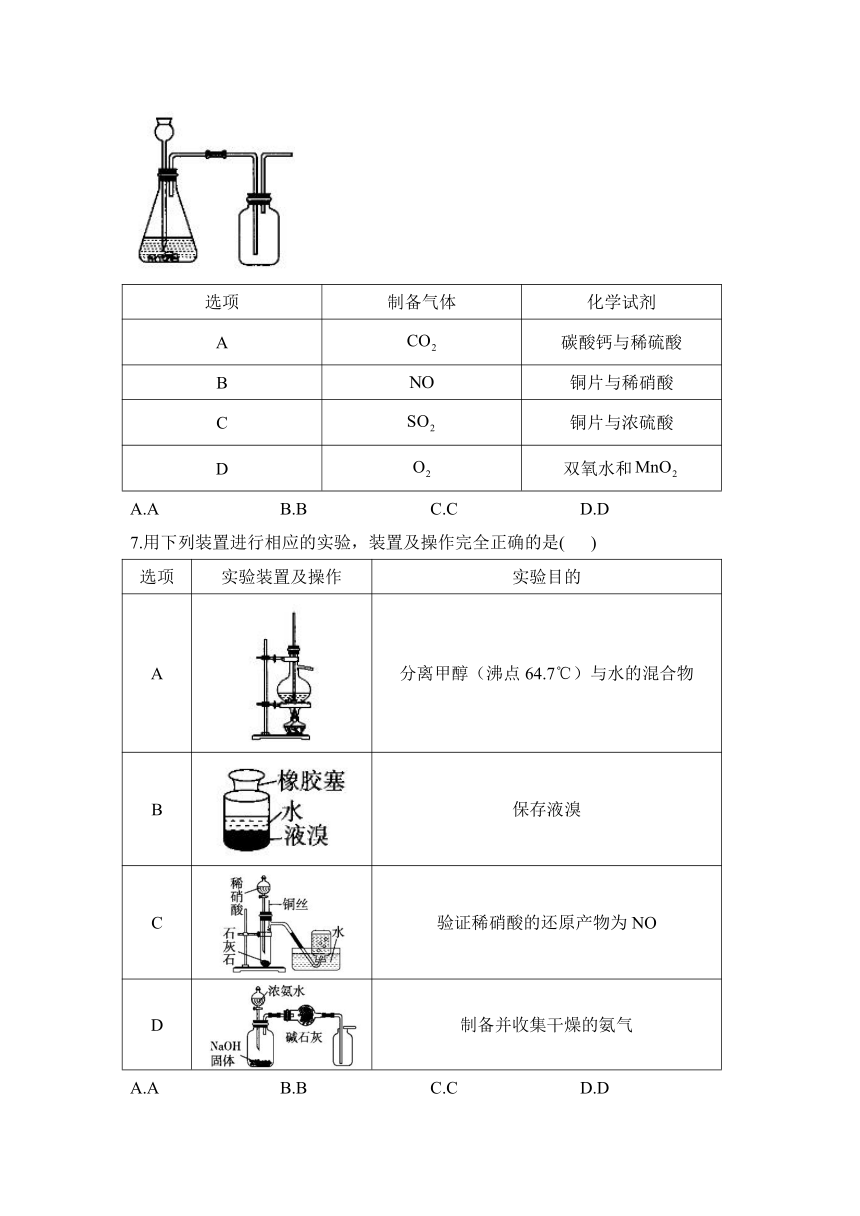
1.关于下列仪器名称或使用方法的说法错误的是( )
A.①在使用过程中酒精的量过多或过少都能造成危险
B.②③均可用于干燥气体或尾气处理
C.④的名称为坩埚,可用于灼烧固体
D.⑤在蒸发液体过程中需垫石棉网加热
2.下列说法正确的是( )
A.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
B.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
C.在未知液中滴加溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中存在或
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
3.在如图所示各个实验中,所选择的装置或实验设计合理的是( )
A.用图甲所示装置除去乙醇中混有的碘单质
B.用图乙所示装置分离乙酸乙酯和饱和的混合溶液
C.用图丙所示装置分离苯和溴苯的混合溶液
D.用图丁所示装置除去二氧化碳中混有的少量氯化氢
4.固体粉末X中可能含有Fe、FeO、CuO、、NaCl和中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物
③用玻璃棒蘸取溶液Z滴于广泛pH试纸上,试纸呈蓝色
④向Z溶液中滴加溶液,生成白色沉淀
分析以上实验现象,下列结论正确的是( )
A.X中一定不存在FeO
B.不溶物Y中一定含有和CuO,Fe和FeO至少含其中一种
C.溶液Z中一定含有
D.向④中所生成的白色沉淀中滴加盐酸,若沉淀不完全溶解,则粉末X中含有NaCl
5.实验室利用反应制取并得到纯净干燥的CO气体,合适的组合装置是( )
A.①④⑦ B.②③⑤ C.②④③⑥ D.①④③⑤
6.化学是以实验为基础的科学。在实验室采用如图装置制备气体(不考虑尾气处理),合理的是( )
选项 制备气体 化学试剂
A 碳酸钙与稀硫酸
B 铜片与稀硝酸
C 铜片与浓硫酸
D 双氧水和
A.A B.B C.C D.D
7.用下列装置进行相应的实验,装置及操作完全正确的是( )
选项 实验装置及操作 实验目的
A 分离甲醇(沸点64.7℃)与水的混合物
B 保存液溴
C 验证稀硝酸的还原产物为NO
D 制备并收集干燥的氨气
A.A B.B C.C D.D
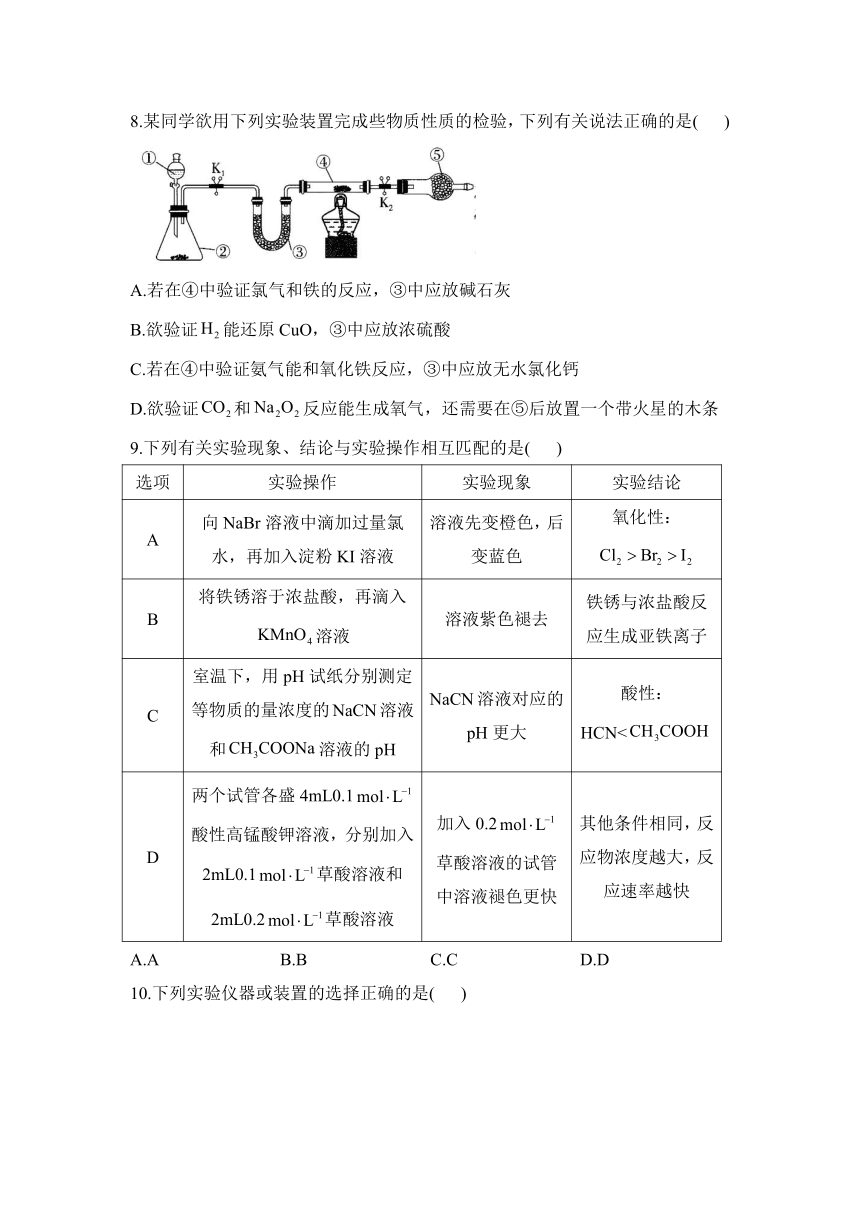
8.某同学欲用下列实验装置完成些物质性质的检验,下列有关说法正确的是( )
A.若在④中验证氯气和铁的反应,③中应放碱石灰
B.欲验证能还原CuO,③中应放浓硫酸
C.若在④中验证氨气能和氧化铁反应,③中应放无水氯化钙
D.欲验证和反应能生成氧气,还需要在⑤后放置一个带火星的木条
9.下列有关实验现象、结论与实验操作相互匹配的是( )
选项 实验操作 实验现象 实验结论
A 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液 溶液先变橙色,后变蓝色 氧化性:
B 将铁锈溶于浓盐酸,再滴入溶液 溶液紫色褪去 铁锈与浓盐酸反应生成亚铁离子
C 室温下,用pH试纸分别测定等物质的量浓度的NaCN溶液和溶液的pH NaCN溶液对应的pH更大 酸性:HCN<
D 两个试管各盛4mL0.1酸性高锰酸钾溶液,分别加入2mL0.1草酸溶液和2mL0.2草酸溶液 加入0.2草酸溶液的试管中溶液褪色更快 其他条件相同,反应物浓度越大,反应速率越快
A.A B.B C.C D.D
10.下列实验仪器或装置的选择正确的是( )
配制50.00mL0.1000溶液 除去中的HCl 制备少量 证明乙炔可使溴水褪色
A B C D
A.A B.B C.C D.D
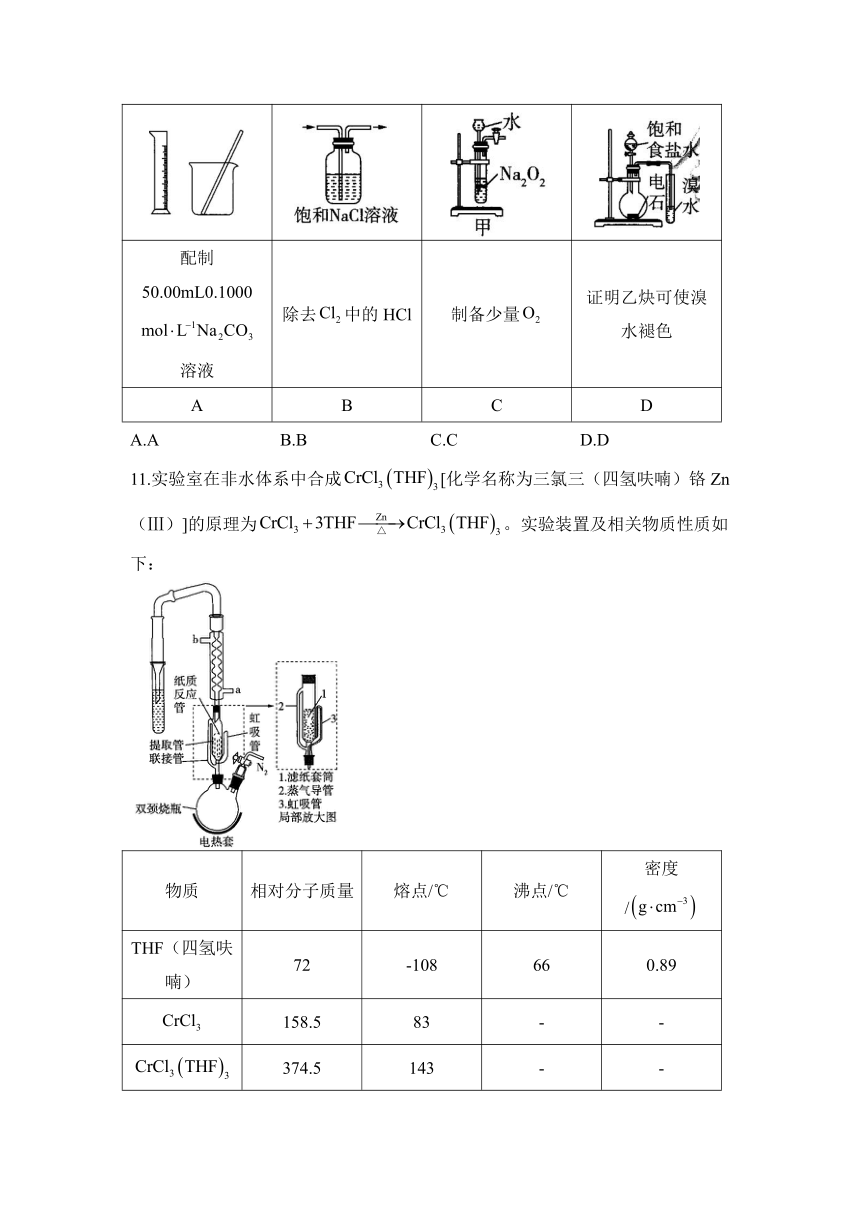
11.实验室在非水体系中合成[化学名称为三氯三(四氢呋喃)铬Zn(Ⅲ)]的原理为。实验装置及相关物质性质如下:
物质 相对分子质量 熔点/℃ 沸点/℃ 密度/
THF(四氢呋喃) 72 -108 66 0.89
158.5 83 - -
374.5 143 - -
实验步骤如下:
①按图所示组装仪器。
②填装反应物:称取6.340g(0.04 mol)无水和0.20g锌粉放入纸质反应管(用滤纸制作)内,双颈烧瓶中加入100mL无水THF(四氢呋喃,过量)。
③合成:先通入一段时间,然后在球形冷凝管中通入冷却水,加热THF至沸腾,THF蒸气通过联接管进入提取管中,在冷凝管中冷凝回流到纸质反应管中进行反应,当纸质反应管中的液面高于虹吸管最高处时,发生虹吸现象,纸质反应管中的液体流入双颈烧瓶,从而实现THF与的连续反应及产物的连续萃取。
④分离:回流2.5h,再通入冷却至室温。取下双颈烧瓶,在通风橱中蒸发THF至有较多固体析出,冷却、抽滤、干燥称量,得产品6.290g。
(1)步骤①后需进行的实验操作是_______,步骤③中冷却水进水口是_______(填“a”或“b”)。
(2)和在THF中的溶解性分别为_______、为_______(填“溶”或“不溶”)。
(3)步骤③通入的目的可能是_______。
(4)该实验中THF的作用是_______。
(5)该实验过程用电热套加热,不可用明火直接加热的原因是_______。
(6)本实验制得产品的产率为_______(保留3位有效数字)。
12.实验仪器的改进和创新,便于我们更好地进行科学探究和物质制备。
(1)微量实验。如图所示,将浓硫酸滴入装有固体的培养皿一段时间后,a、b、c三个棉球变化如表(气体和试剂均充分反应)。
序号 棉球 棉球上滴加试剂的名称 实验现象 解释或结论
① a _____ 棉球变白,微热后又恢复红色 该气体具有漂白性
② b 含酚酞的NaOH溶液 棉球变为白色 该气体属于_____氧化物(填“酸性”或“碱性”)
③ c 碘与淀粉的混合溶液 棉球变为白色 该气体具有还原性,化学方程式为____
(2)燃烧模拟。用如图装置模拟工业合成盐酸,挤压软塑瓶,向锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。下列试剂选择正确的是______(填序号)。
溶液A 固体B 固体C
① 浓盐酸
② 稀硝酸
③ 浓盐酸
(3)晶体制备。实验室用粗锌(含ZnS杂质)和稀硫酸反应制备后的溶液制备皓矾()。
①制备过程中生成的杂质气体具有臭鸡蛋气味,该气体的化学品标签是_______(填标号)。
②选择合适仪器并组装抽滤装置从溶液中得到皓矾,安装顺序为_______(填标号)。
③抽滤也称减压过滤,下列说法不正确的是______(填标号)。
A.抽滤的原理是利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.抽滤的优点是过滤速度快,可得到较干燥的沉淀
C.抽滤完之后,先关抽气泵,后拔掉抽滤瓶接管
答案以及解析
1.答案:D
解析:A.①酒精灯内酒精过少,则灯壶中酒精蒸气过多,易引起爆燃;酒精过多则受热膨胀,易使酒精溢出,发生事故,故A正确;
B.②③中盛放碱石灰,可用于干燥气体或尾气处理,故B正确;
C.④的名称为坩埚,可用于灼烧固体,故C正确;
D.⑤是蒸发皿,蒸发皿在蒸发液体过程中直接加热,故D错误;
选D。
2.答案:A
解析:氯水中的次氯酸能漂白pH试纸,不能用pH试纸测定新制氯水的pH,B错误;硫酸钡和AgCl均为不溶于酸的白色沉淀,故溶液中还可能含,C错误;氯化钠的溶解度随温度变化不大,硝酸钾的溶解度随温度变化较大,故提纯混有少量硝酸钾的氯化钠,应采用蒸发结晶、趁热过滤的方法,D错误。
3.答案:B
解析:碘易溶于乙醇,不能用过滤法分离,A错误;乙酸乙酯和饱和碳酸钠溶液不互溶,溶液会分层,可用分液法分离,B正确;苯和溴苯的沸点相差较大,可用蒸馏法分离,但图中蒸馏装置缺少温度计,C错误;和HCl都能与碳酸钠溶液反应,应选用饱和碳酸氢钠溶液,D错误。
4.答案:C
解析:实验②中黄绿色气体为氯气,红色不溶物为铜,说明Y中含有CuO、,CuO与酸反应生成,最终又被置换出来生成Cu,则Y中还应含有Fe,可能含有FeO,A错误,B错误;用玻璃棒蘸取溶液Z滴于广泛pH试纸上,试纸呈蓝色,溶液呈碱性,说明溶液中含有,C正确;实验④生成的白色沉淀为,可能含有AgCl,向其中加入盐酸,引入了氯离子,不能确定是否存在NaCl,D错误。
5.答案:C
解析:该反应中有浓硫酸作催化剂,因此气体发生装置只能用②;用浓烧碱液除去混合气体中的,石灰水用于检验是否除尽,⑤⑥⑦均可用于干燥CO气体,其中⑥还可进一步除去,因此合适的组合装置为②④③⑥,C正确。
6.答案:D
解析:碳酸钙与稀硫酸反应生成的硫酸钙是微溶物,会附着在碳酸钙表面,阻止反应继续进行,故一般不用碳酸钙与稀硫酸反应制,而是用碳酸钙与盐酸反应制备,A错误;NO会与发生反应生成,因此不可以用排空气法收集,B错误;铜片与浓硫酸反应需要加热,该装置没有加热装置,C错误;在的催化作用下分解生成水与,的密度比空气大,可用向上排空气法收集,D正确。
7.答案:C
解析:蒸馏时温度计的水银球应处于蒸馏烧瓶的支管口处,A错误;液溴能够腐蚀橡胶塞,故B错误;稀硝酸与碳酸钙反应生成硝酸钙、二氧化碳和水,二氧化碳能够排除装置中的空气,待空气排净后,再将铜丝伸入,若装置内气体颜色无变化,则说明稀硝酸的还原产物为一氧化氮,C正确;氨气的密度比空气小,应采用向下排空气法收集,D错误。
8.答案:D
解析:若在④中验证氯气和铁的反应,则③的作用是净化并干燥氯气,但是氯气能与碱石灰发生反应,故A错误;③中应为固体干燥剂,不能是浓硫酸,B错误;氨气与无水氯化钙可以发生反应,不能用无水氯化钙干燥,C错误;验证和反应能生成氧气,在⑤后放置一个带火星的木条,如果木条复燃,则说明有氧气生成,D正确。
9.答案:C
解析:实验氯水过量,不能证明氧化性:,A错误;浓盐酸中含有氯离子,也能使溶液褪色,B错误;两个试管中均过量,褪色不明显,D错误。
10.答案:B
解析:配制50.00mL0.1000溶液需要50mL容量瓶,A错误;为粉末状固体,不能选用简易启普发生器制取,C错误;电石中除了碳化钙之外,还含有硫化钙和磷化钙等,与水反应还生成硫化氢等杂质,硫化氢也能使溴水褪色,D错误。
11.答案:(1)检查装置的气密性;a
(2)不溶;溶
(3)排尽装置内的空气,防止空气中水蒸气对产物造成影响
(4)反应物和萃取剂
(5)THF易挥发、易燃,遇明火可能发生爆炸
(6)42.0%
解析:(1)实验仪器连接好后,首先需要检查装置气密性;冷却水是下面进上面出,故应该从a口进。
(2)由步骤③中实验原理可知,四氢呋喃在双颈烧瓶和纸质反应管中循环,只有不溶于四氢呋喃、溶于四氢呋喃方能实现四氢呋喃与的连续反应及产物的连续萃取,故和在THF中的溶解性分别为不溶、溶。
(3)根据题意,该实验要在非水体系中合成,因此实验开始之前需先通入一段时间,排除装置内的空气,防止空气中的水蒸气对产物造成影响。
(4)由题目信息可知,THF是反应物之一,另外通过(2)的分析可知,THF是萃取剂。
(5)由题中表格信息可知,THF沸点较低,且可以燃烧,故不可以用明火直接加热。
(6)由题可知四氢呋喃过量,设理论上生成的质量为xg,则根据反应原理有:
则,所以本实验制得产品的产率为。
12.答案:(1)①品红溶液;②酸性;③
(2)③
(3)①AD;②ACEF;③C
解析:(1)①二氧化硫具有漂白性,能使品红溶液褪色,加热后又恢复红色,故棉球a上滴加的为品红溶液。②棉球b变为白色,说明二氧化硫和氢氧化钠反应,该气体属于酸性氧化物。③棉球c变为白色,说明碘单质和二氧化硫反应生成碘化氢、硫酸,反应的化学方程式为。
(2)看到明显的燃烧现象,说明两种气体能够燃烧发生反应;浓盐酸和二氧化锰需要加热才能反应生成氯气;稀硝酸和铁反应生成的一氧化氮气体和氯气不反应;浓盐酸和高锰酸钾反应生成氯气,氯气和氢气点燃燃烧生成氯化氢,故选③。
(3)①制备过程中生成的具有臭鸡蛋气味的气体为硫化氢,硫化氢有毒、易燃,故选AD。②抽滤装置需要布氏漏斗、吸滤瓶、安全瓶、抽气装置,故安装顺序为ACEF。③抽滤完之后,应先拔掉抽滤瓶接管,后关抽气泵,以防止水倒流,C错误
——2024届高考化学高频题型专项训练
1.关于下列仪器名称或使用方法的说法错误的是( )
A.①在使用过程中酒精的量过多或过少都能造成危险
B.②③均可用于干燥气体或尾气处理
C.④的名称为坩埚,可用于灼烧固体
D.⑤在蒸发液体过程中需垫石棉网加热
2.下列说法正确的是( )
A.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
B.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
C.在未知液中滴加溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中存在或
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
3.在如图所示各个实验中,所选择的装置或实验设计合理的是( )
A.用图甲所示装置除去乙醇中混有的碘单质
B.用图乙所示装置分离乙酸乙酯和饱和的混合溶液
C.用图丙所示装置分离苯和溴苯的混合溶液
D.用图丁所示装置除去二氧化碳中混有的少量氯化氢
4.固体粉末X中可能含有Fe、FeO、CuO、、NaCl和中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物
③用玻璃棒蘸取溶液Z滴于广泛pH试纸上,试纸呈蓝色
④向Z溶液中滴加溶液,生成白色沉淀
分析以上实验现象,下列结论正确的是( )
A.X中一定不存在FeO
B.不溶物Y中一定含有和CuO,Fe和FeO至少含其中一种
C.溶液Z中一定含有
D.向④中所生成的白色沉淀中滴加盐酸,若沉淀不完全溶解,则粉末X中含有NaCl
5.实验室利用反应制取并得到纯净干燥的CO气体,合适的组合装置是( )
A.①④⑦ B.②③⑤ C.②④③⑥ D.①④③⑤
6.化学是以实验为基础的科学。在实验室采用如图装置制备气体(不考虑尾气处理),合理的是( )
选项 制备气体 化学试剂
A 碳酸钙与稀硫酸
B 铜片与稀硝酸
C 铜片与浓硫酸
D 双氧水和
A.A B.B C.C D.D
7.用下列装置进行相应的实验,装置及操作完全正确的是( )
选项 实验装置及操作 实验目的
A 分离甲醇(沸点64.7℃)与水的混合物
B 保存液溴
C 验证稀硝酸的还原产物为NO
D 制备并收集干燥的氨气
A.A B.B C.C D.D
8.某同学欲用下列实验装置完成些物质性质的检验,下列有关说法正确的是( )
A.若在④中验证氯气和铁的反应,③中应放碱石灰
B.欲验证能还原CuO,③中应放浓硫酸
C.若在④中验证氨气能和氧化铁反应,③中应放无水氯化钙
D.欲验证和反应能生成氧气,还需要在⑤后放置一个带火星的木条
9.下列有关实验现象、结论与实验操作相互匹配的是( )
选项 实验操作 实验现象 实验结论
A 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液 溶液先变橙色,后变蓝色 氧化性:
B 将铁锈溶于浓盐酸,再滴入溶液 溶液紫色褪去 铁锈与浓盐酸反应生成亚铁离子
C 室温下,用pH试纸分别测定等物质的量浓度的NaCN溶液和溶液的pH NaCN溶液对应的pH更大 酸性:HCN<
D 两个试管各盛4mL0.1酸性高锰酸钾溶液,分别加入2mL0.1草酸溶液和2mL0.2草酸溶液 加入0.2草酸溶液的试管中溶液褪色更快 其他条件相同,反应物浓度越大,反应速率越快
A.A B.B C.C D.D
10.下列实验仪器或装置的选择正确的是( )
配制50.00mL0.1000溶液 除去中的HCl 制备少量 证明乙炔可使溴水褪色
A B C D
A.A B.B C.C D.D
11.实验室在非水体系中合成[化学名称为三氯三(四氢呋喃)铬Zn(Ⅲ)]的原理为。实验装置及相关物质性质如下:
物质 相对分子质量 熔点/℃ 沸点/℃ 密度/
THF(四氢呋喃) 72 -108 66 0.89
158.5 83 - -
374.5 143 - -
实验步骤如下:
①按图所示组装仪器。
②填装反应物:称取6.340g(0.04 mol)无水和0.20g锌粉放入纸质反应管(用滤纸制作)内,双颈烧瓶中加入100mL无水THF(四氢呋喃,过量)。
③合成:先通入一段时间,然后在球形冷凝管中通入冷却水,加热THF至沸腾,THF蒸气通过联接管进入提取管中,在冷凝管中冷凝回流到纸质反应管中进行反应,当纸质反应管中的液面高于虹吸管最高处时,发生虹吸现象,纸质反应管中的液体流入双颈烧瓶,从而实现THF与的连续反应及产物的连续萃取。
④分离:回流2.5h,再通入冷却至室温。取下双颈烧瓶,在通风橱中蒸发THF至有较多固体析出,冷却、抽滤、干燥称量,得产品6.290g。
(1)步骤①后需进行的实验操作是_______,步骤③中冷却水进水口是_______(填“a”或“b”)。
(2)和在THF中的溶解性分别为_______、为_______(填“溶”或“不溶”)。
(3)步骤③通入的目的可能是_______。
(4)该实验中THF的作用是_______。
(5)该实验过程用电热套加热,不可用明火直接加热的原因是_______。
(6)本实验制得产品的产率为_______(保留3位有效数字)。
12.实验仪器的改进和创新,便于我们更好地进行科学探究和物质制备。
(1)微量实验。如图所示,将浓硫酸滴入装有固体的培养皿一段时间后,a、b、c三个棉球变化如表(气体和试剂均充分反应)。
序号 棉球 棉球上滴加试剂的名称 实验现象 解释或结论
① a _____ 棉球变白,微热后又恢复红色 该气体具有漂白性
② b 含酚酞的NaOH溶液 棉球变为白色 该气体属于_____氧化物(填“酸性”或“碱性”)
③ c 碘与淀粉的混合溶液 棉球变为白色 该气体具有还原性,化学方程式为____
(2)燃烧模拟。用如图装置模拟工业合成盐酸,挤压软塑瓶,向锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。下列试剂选择正确的是______(填序号)。
溶液A 固体B 固体C
① 浓盐酸
② 稀硝酸
③ 浓盐酸
(3)晶体制备。实验室用粗锌(含ZnS杂质)和稀硫酸反应制备后的溶液制备皓矾()。
①制备过程中生成的杂质气体具有臭鸡蛋气味,该气体的化学品标签是_______(填标号)。
②选择合适仪器并组装抽滤装置从溶液中得到皓矾,安装顺序为_______(填标号)。
③抽滤也称减压过滤,下列说法不正确的是______(填标号)。
A.抽滤的原理是利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.抽滤的优点是过滤速度快,可得到较干燥的沉淀
C.抽滤完之后,先关抽气泵,后拔掉抽滤瓶接管
答案以及解析
1.答案:D
解析:A.①酒精灯内酒精过少,则灯壶中酒精蒸气过多,易引起爆燃;酒精过多则受热膨胀,易使酒精溢出,发生事故,故A正确;
B.②③中盛放碱石灰,可用于干燥气体或尾气处理,故B正确;
C.④的名称为坩埚,可用于灼烧固体,故C正确;
D.⑤是蒸发皿,蒸发皿在蒸发液体过程中直接加热,故D错误;
选D。
2.答案:A
解析:氯水中的次氯酸能漂白pH试纸,不能用pH试纸测定新制氯水的pH,B错误;硫酸钡和AgCl均为不溶于酸的白色沉淀,故溶液中还可能含,C错误;氯化钠的溶解度随温度变化不大,硝酸钾的溶解度随温度变化较大,故提纯混有少量硝酸钾的氯化钠,应采用蒸发结晶、趁热过滤的方法,D错误。
3.答案:B
解析:碘易溶于乙醇,不能用过滤法分离,A错误;乙酸乙酯和饱和碳酸钠溶液不互溶,溶液会分层,可用分液法分离,B正确;苯和溴苯的沸点相差较大,可用蒸馏法分离,但图中蒸馏装置缺少温度计,C错误;和HCl都能与碳酸钠溶液反应,应选用饱和碳酸氢钠溶液,D错误。
4.答案:C
解析:实验②中黄绿色气体为氯气,红色不溶物为铜,说明Y中含有CuO、,CuO与酸反应生成,最终又被置换出来生成Cu,则Y中还应含有Fe,可能含有FeO,A错误,B错误;用玻璃棒蘸取溶液Z滴于广泛pH试纸上,试纸呈蓝色,溶液呈碱性,说明溶液中含有,C正确;实验④生成的白色沉淀为,可能含有AgCl,向其中加入盐酸,引入了氯离子,不能确定是否存在NaCl,D错误。
5.答案:C
解析:该反应中有浓硫酸作催化剂,因此气体发生装置只能用②;用浓烧碱液除去混合气体中的,石灰水用于检验是否除尽,⑤⑥⑦均可用于干燥CO气体,其中⑥还可进一步除去,因此合适的组合装置为②④③⑥,C正确。
6.答案:D
解析:碳酸钙与稀硫酸反应生成的硫酸钙是微溶物,会附着在碳酸钙表面,阻止反应继续进行,故一般不用碳酸钙与稀硫酸反应制,而是用碳酸钙与盐酸反应制备,A错误;NO会与发生反应生成,因此不可以用排空气法收集,B错误;铜片与浓硫酸反应需要加热,该装置没有加热装置,C错误;在的催化作用下分解生成水与,的密度比空气大,可用向上排空气法收集,D正确。
7.答案:C
解析:蒸馏时温度计的水银球应处于蒸馏烧瓶的支管口处,A错误;液溴能够腐蚀橡胶塞,故B错误;稀硝酸与碳酸钙反应生成硝酸钙、二氧化碳和水,二氧化碳能够排除装置中的空气,待空气排净后,再将铜丝伸入,若装置内气体颜色无变化,则说明稀硝酸的还原产物为一氧化氮,C正确;氨气的密度比空气小,应采用向下排空气法收集,D错误。
8.答案:D
解析:若在④中验证氯气和铁的反应,则③的作用是净化并干燥氯气,但是氯气能与碱石灰发生反应,故A错误;③中应为固体干燥剂,不能是浓硫酸,B错误;氨气与无水氯化钙可以发生反应,不能用无水氯化钙干燥,C错误;验证和反应能生成氧气,在⑤后放置一个带火星的木条,如果木条复燃,则说明有氧气生成,D正确。
9.答案:C
解析:实验氯水过量,不能证明氧化性:,A错误;浓盐酸中含有氯离子,也能使溶液褪色,B错误;两个试管中均过量,褪色不明显,D错误。
10.答案:B
解析:配制50.00mL0.1000溶液需要50mL容量瓶,A错误;为粉末状固体,不能选用简易启普发生器制取,C错误;电石中除了碳化钙之外,还含有硫化钙和磷化钙等,与水反应还生成硫化氢等杂质,硫化氢也能使溴水褪色,D错误。
11.答案:(1)检查装置的气密性;a
(2)不溶;溶
(3)排尽装置内的空气,防止空气中水蒸气对产物造成影响
(4)反应物和萃取剂
(5)THF易挥发、易燃,遇明火可能发生爆炸
(6)42.0%
解析:(1)实验仪器连接好后,首先需要检查装置气密性;冷却水是下面进上面出,故应该从a口进。
(2)由步骤③中实验原理可知,四氢呋喃在双颈烧瓶和纸质反应管中循环,只有不溶于四氢呋喃、溶于四氢呋喃方能实现四氢呋喃与的连续反应及产物的连续萃取,故和在THF中的溶解性分别为不溶、溶。
(3)根据题意,该实验要在非水体系中合成,因此实验开始之前需先通入一段时间,排除装置内的空气,防止空气中的水蒸气对产物造成影响。
(4)由题目信息可知,THF是反应物之一,另外通过(2)的分析可知,THF是萃取剂。
(5)由题中表格信息可知,THF沸点较低,且可以燃烧,故不可以用明火直接加热。
(6)由题可知四氢呋喃过量,设理论上生成的质量为xg,则根据反应原理有:
则,所以本实验制得产品的产率为。
12.答案:(1)①品红溶液;②酸性;③
(2)③
(3)①AD;②ACEF;③C
解析:(1)①二氧化硫具有漂白性,能使品红溶液褪色,加热后又恢复红色,故棉球a上滴加的为品红溶液。②棉球b变为白色,说明二氧化硫和氢氧化钠反应,该气体属于酸性氧化物。③棉球c变为白色,说明碘单质和二氧化硫反应生成碘化氢、硫酸,反应的化学方程式为。
(2)看到明显的燃烧现象,说明两种气体能够燃烧发生反应;浓盐酸和二氧化锰需要加热才能反应生成氯气;稀硝酸和铁反应生成的一氧化氮气体和氯气不反应;浓盐酸和高锰酸钾反应生成氯气,氯气和氢气点燃燃烧生成氯化氢,故选③。
(3)①制备过程中生成的具有臭鸡蛋气味的气体为硫化氢,硫化氢有毒、易燃,故选AD。②抽滤装置需要布氏漏斗、吸滤瓶、安全瓶、抽气装置,故安装顺序为ACEF。③抽滤完之后,应先拔掉抽滤瓶接管,后关抽气泵,以防止水倒流,C错误
同课章节目录
