题型六 金属及其化合物(2) ——2024届高考化学高频题型专项训练(含解析)
文档属性
| 名称 | 题型六 金属及其化合物(2) ——2024届高考化学高频题型专项训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 678.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 01:01:01 | ||
图片预览




文档简介
题型六 金属及其化合物(2)
——2024届高考化学高频题型专项训练
1.下列关于Na的化合物之间转化反应的离子方程式书写正确的是( )
A.碱转化为酸式盐:
B.碱转化为两种盐:
C.过氧化物转化为碱:
D.盐转化为另一种盐:
2.侯氏制碱法工艺流程如图所示。
下列说法不正确的是( )
A.饱和食盐水“吸氨”的目的是使“碳酸化”时产生更多的
B.煅烧时发生反应
C.“盐析”后溶液pH比“盐析”前溶液pH大
D.母液Ⅱ与母液Ⅰ所含粒子种类相同,但前者的浓度更大
3.部分含铁物质的分类与相应化合价的关系如图所示。下列推断合理的是( )
A.a可与少量反应生成f
B.可用溶液检验c溶液中含有的f
C.在高温条件下,a与水蒸气反应可实现a→b的转化
D.c在溶液中可以和大量共存
4.已知:普通铁+水蒸气铁的氧化物+氢气,铁的氧化物+氢气“引火铁”+水蒸气,“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如图。
关于上述装置和实验,下列分析错误的是( )
A.I中加入普通铁粉,G中可加入碱石灰
B.A中生成磁性氧化铁,E中生成“引火铁”
C.需要加热的仪器只有A、E
D.D用于收集氢气,F处的尾气需处理
5.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融制备金属镁
C.“氯化”过程中发生的反应为
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
6.以锌焙砂(主要成分为ZnO,含少量等离子)为原料制备的工艺流程如下:
下列说法错误的是( )
A.“浸取”过程为增大反应速率应适当加热,但温度不宜过高
B.“除杂”步骤也可选择或为沉淀剂,沉淀杂质离子
C.气体A为
D.“过滤3”所得滤液可循环使用,其主要成分的化学式是
7.一种利用玻璃窑炉替换下的锆废砖(主要成分为、、CaO等)提纯和的工艺流程如下。下列说法错误的是( )
A.“酸化”过程中加入的硫酸、硫酸铵可用硝酸、硝酸铵代替
B.滤渣1主要成分为
C.“中和1”调节pH范围为4~5.5的目的是沉淀锆离子
D.整个工艺过程中,硫酸铵可以实现循环利用
8.有A、B两个完全相同的装置,某学生在A的侧管中装入0.01 mol ,在B的侧管中装入0.01 mol ,并且A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入A、B中,下列叙述正确的是( )
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1
D.最终两试管中的物质的量一定相同
9.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。
(1)以食盐、石灰石、浓硫酸、焦炭为原料,经一系列操作可制得纯碱。
①食盐和浓硫酸加热反应的化学方程式为_______。
②硫酸钠和焦炭、石灰石高温下反应的化学方程式为_______(已知产物之一为CaS)。
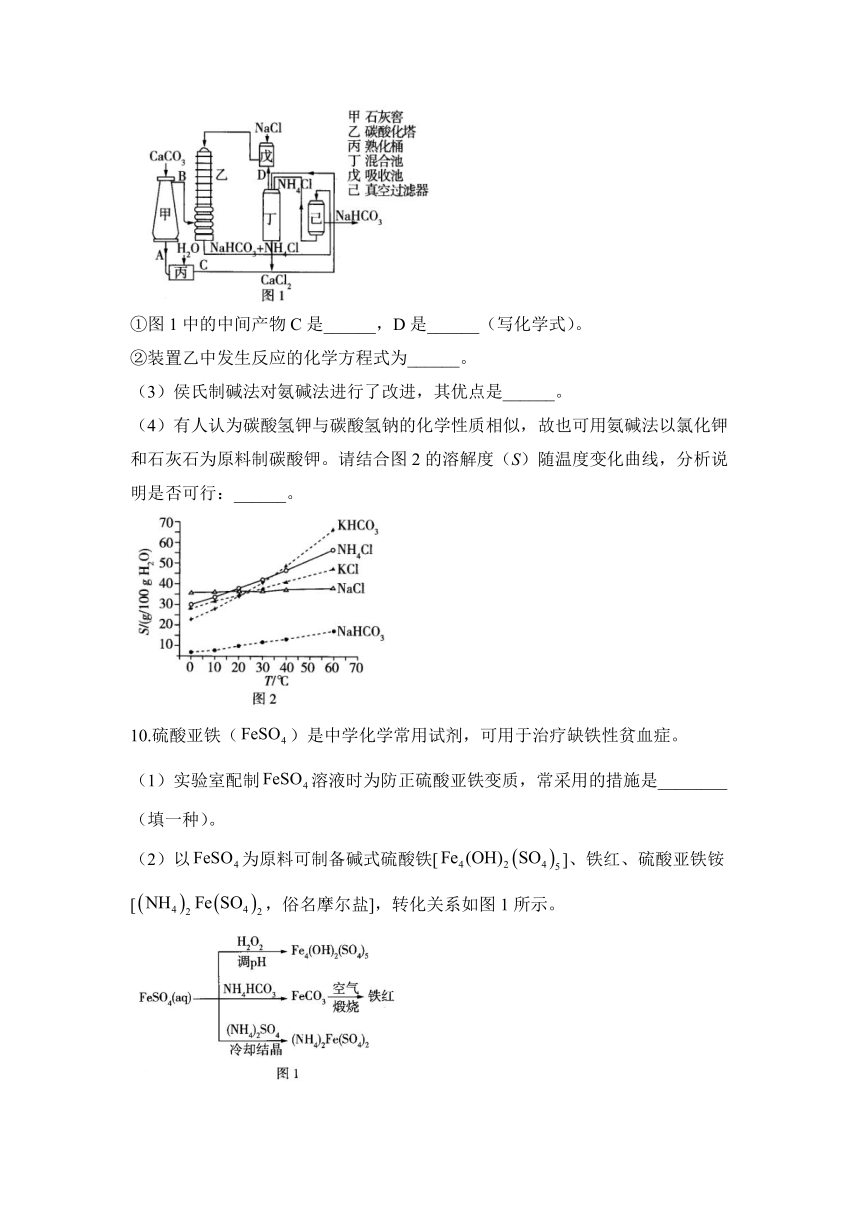
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱。
①图1中的中间产物C是______,D是______(写化学式)。
②装置乙中发生反应的化学方程式为______。
(3)侯氏制碱法对氨碱法进行了改进,其优点是______。
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合图2的溶解度(S)随温度变化曲线,分析说明是否可行:______。
10.硫酸亚铁()是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配制溶液时为防正硫酸亚铁变质,常采用的措施是________(填一种)。
(2)以为原料可制备碱式硫酸铁[]、铁红、硫酸亚铁铵[,俗名摩尔盐],转化关系如图1所示。
①制备时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是_____。
②制备时,向溶液中加入过量的溶液,该反应的离子方程式为_____;铁红的化学式为_____。
③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、_____、洗涤、干燥得到产品。
(3)隔绝空气条件下,分解时的物质转化关系如图2。
①关于M的成分提出三种猜想:
猜想1:M是;
猜想2:M是______;
猜想3:M是和。
②已知三种气体的部分性质如表所示:
物质
熔点/℃ 16.8 -72.4 -210
沸点/℃ 44.8 -10 -195.8
利用图3装置探究硫酸亚铁部分分解产物。能否将低温浴槽A的温度控制在-72.4℃<44.8℃ ______(填“能”或“否”)。C中试剂可能是______。
11.碱式硫酸镁晶须[化学式为]是一种无机阻燃材料,其一种制备流程如图:
(1)“沉淀”是在50~60℃条件下进行的,适合的加热方式为______。
(2)“抽滤”在如图所示的装置中进行,装置X的作用是______。
(3)“洗涤”步骤中用无水乙醇洗涤的目的是______。
(4)以蛇纹石粉末(主要含MgO、FeO、等)为原料制备实验所需的溶液。请补充完整相应的实验方案:取一定量蛇纹石粉末,______,得到溶液。
已知:①该实验中pH=3.2时,完全沉淀;pH=8.5时,开始沉淀。②与溶液反应产生蓝色沉淀。
实验中可选用的试剂:1.0、1.0NaOH、3%粉末、溶液。
(5)通过下列方法测定碱式硫酸镁晶须化学式:
Ⅰ.准确称取1.8560g产品,溶于100.00mL0.5600HCl溶液,将所得溶液配成250.00mL溶液A;
Ⅱ.取25.00mL溶液A,调节溶液pH=10,用0.1000的标准溶液滴定其中的(离子方程式为),消耗EDTA标准溶液24.00mL;
Ⅲ.另取25.00mL溶液A,用0.0800NaOH标准溶液滴定至终点,消耗NaOH标准溶液20.00mL。
计算碱式硫酸镁晶须的化学式______。
12.某实验小组同学探究“氧化剂对KSCN检验的影响”,进行如下实验:
实验 试剂 现象
试管 滴管(各一滴)
2 mL 0.5溶液与1滴0.5KSCN溶液 饱和氯水 Ⅰ.溶液立即变为浅红色
稀硝酸 Ⅱ.溶液立即变为红色
5%溶液 Ⅲ.溶液立即变为深红色,无气体产生
已知:与可在溶液中大量共存;易被氧化为。
(1)向2 mL0.5溶液中滴加1滴0.5KSCN溶液,无明显现象,通入,无明显变化。
①该实验的目的是______。
②用离子方程式表示Ⅰ中出现浅红色的原因:______、______。
(2)对Ⅰ中溶液为浅红色的原因,甲同学提出以下假设。
假设1:加入氯水的量少,生成的浓度低
假设2:氯水氧化性强,氧化了部分
继续以下实验:
ⅰ.取Ⅰ中浅红色溶液,_____(填写实验操作),溶液浅红色消失,从而排除了假设1。
ⅱ.向2mL水中滴加1滴0.5KSCN溶液,滴加1滴饱和氯水,加入_____,产生白色沉淀。
(3)为验证实验Ⅰ、Ⅱ、Ⅲ中硫氰化钾的被氧化程度,进行以下探究实验。
已知:溶解度AgSCN(白色)实验 试管 消耗溶液的体积/mL
Ⅳ 实验Ⅰ中溶液 1.52
Ⅴ 实验Ⅱ中溶液 1.60
Ⅵ 实验Ⅲ中溶液 1.84
Ⅶ 2mL水与1滴溶液和1滴0.5KSCN溶液 2.40
①用化学用语表示滴加后溶液红色褪去的原因________。
②由Ⅳ~Ⅶ可以得出的结论是________。
(4)借助紫外可见分光光度计可以测定浓度。已知:体系的吸光度与浓度呈线性正相关。丙同学利用上述方法测定了实验Ⅰ、Ⅱ、Ⅲ体系的吸光度,数据如图所示。由上述实验可知,Ⅰ、Ⅱ、Ⅲ中溶液颜色分别呈现浅红色、红色和深红色的原因为________。
答案以及解析
1.答案:B
解析:A项题给离子方程式未配平且不是碱转化为酸式盐,A项错误;B项可视为向NaOH溶液中通入,离子方程式正确;过氧化物溶于水的离子方程式中,过氧化物应用化学式表示,C项错误;硅酸钠易溶于水,离子方程式中应用表示,D项错误。
2.答案:D
解析:氨气极易溶于水使溶液显碱性,饱和食盐水“吸氨”的目的是吸收更多二氧化碳,使“碳酸化”时产生更多的,A正确;碳酸氢钠受热分解为碳酸钠、水、二氧化碳,B正确;铵根离子水解生成氢离子使溶液显酸性,加入氯化钠“盐析”后溶液中铵根离子浓度减小,溶液酸性减弱,故“盐析”后溶液pH比“盐析”前溶液pH大,C正确;母液Ⅱ为加入氯化钠晶体,析出氯化铵后得到的,与母液Ⅰ所含粒子种类相同,但母液Ⅱ中碳酸氢根离子的浓度没有变大,故D错误。
3.答案:B
解析:Fe和反应只能生成,A错误;可用溶液检验溶液中含有的,B正确;在高温条件下,Fe与水蒸气反应得到,C错误;和在溶液中会发生相互促进的水解反应,不能大量共存,D错误。
4.答案:C
解析:根据上述分析可知,A正确;Fe和水蒸气反应生成磁性氧化铁,即四氧化三铁,结合上述分析可知,B正确;本实验中仪器B也需要加热,目的是提供水蒸气,C错误;D用于收集氢气,F处的尾气中含有,在室内达到一定浓度可能发生爆炸,所以尾气需要处理,D正确。
5.答案:D
解析:苦卤水中有,沉镁时加入生石灰,CaO与反应生成,与反应生成Mg(OH)2,A正确;是离子化合物,熔点不是很高,电解熔融时发生反应,B正确;煅烧生成MgO,“氯化”时加入C、,反应生成和CO,C正确;加热MgCl溶液会促进水解生成,最终得不到无水,D错误。
6.答案:B
解析:
7.答案:A
解析:若硫酸、硫酸铵用硝酸、硝酸铵代替,则反应过程中硝酸和CaO反应产生,不能使形成沉淀而除去,A错误;根据上述分析可知,滤渣1主要成分为,B正确;“中和1”调节pH范围为4~5.5的目的是使锆离子转化为沉淀,C正确;滤液2含硫酸铵和氨水,用硫酸酸化后可以返回“酸化”循环使用,故D正确。
8.答案:B
解析:碳酸氢钠和盐酸反应产生气体更快,所以A装置的气球膨胀速率小,A项错误;A、B中加入的和均为0.01 mol,根据知,若最终两气球体积相同,则氯化氢的物质的量大于或等于0.02mol,其浓度大于或等于2,若最终两气球体积不同,则其浓度小于2,B项正确、C项错误;和的物质的量相同,所以和中钠离子的物质的量不同,则最终两试管中Na+的物质的量一定不相同,D项错误。
9.答案:(1)①或;②或
(2)①;;②
(3)提高了食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物
(4)不可行;因为的溶解度较大,且在常温下与KCl的溶解度相差较小,当温度高于35℃时,的溶解度大于,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾
解析:(1)①食盐和浓硫酸反应可制取挥发性HCl。②和C在高温下反应,其中一种产物为CaS,说明该反应为氧化还原反应,C被氧化成CO或。
(2)①由图可知,甲中分解产生CaO和,则A为CaO,B为,丙中CaO与反应生成的C为,丁中与反应生成并产生,故D为。②乙中发生的反应为。
10.答案:(1)加适量铁粉
(2)①部分铁离子转化成;②;;③过滤
(3)①;②否;碱石灰
解析:(1)配制溶液时,硫酸亚铁变质的实质是被氧化,加适量铁粉可防止被氧化。
(2)①制备时,若pH过高,则部分铁离子转化为,导致碱式硫酸铁的产率偏低。②与亚铁离子反应生成碳酸亚铁、水和二氧化碳;铁红为。
(3)①分解时生成固体氧化物、和,部分S元素化合价降低,则Fe元素化合价升高,中Fe为+2价,所以固体氧化物可能是、或和。②图3装置设置两个低温浴槽的目的是利用物理方法将和分离,因此不能将低温浴槽A的温度设置在-72.4℃<44.8℃;C是尾气处理装置,可使用碱石灰吸收和。
11.答案:(1)50~60℃水浴加热
(2)安全瓶或防倒吸
(3)洗去晶体表面的水分,有利于后期快速干燥
(4)边搅拌边向其中加入一定量1.0,直至固体不再溶解,过滤;向滤液中滴加3%,直至向取出的少量溶液中滴加溶液不再出现蓝色沉淀时,向原滤液中分批加入粉末,搅拌并测定溶液pH,当测得pH介于3.2~8.5时,过滤
(5)
解析:(1)在50~60℃条件下进行,可选择易控制温度且加热均匀的水浴加热。
(3)乙醇易挥发,用无水乙醇洗去晶体表面的水分,有利于后期快速干燥。
(4)根据已知信息、实验目的及物质性质知,应先边搅拌边向蛇纹石粉末中加入一定量1.0,直至固体不再溶解,过滤(除去),向滤液中滴加3%(将氧化为,便于后续除铁),直至向取出的少量溶液中滴加溶液不再出现蓝色沉淀,向原滤液中分批加入粉末(调pH,沉淀),搅拌并测定溶液pH,当测得pH介于3.2~8.5时(使得全部转化为沉淀),过滤,即可得到硫酸镁溶液。
(5)由Ⅱ知,1.8560g产品中;由Ⅰ、Ⅲ知,1.8560g产品中;根据电荷守恒可知,;根据质量守恒知产品中。则,故碱式硫酸镁晶须的化学式为。
12.答案:(1)①排除在此条件下氧气氧化的可能性;②;
(2)继续滴加饱和氯水稀盐酸和氯化钡溶液
(3)①(或);②以上三种氧化剂都可以氧化,饱和氯水氧化能力最强,5%双氧水氧化能力最弱
(4)由实验Ⅳ、V、Ⅵ可知,氧化后,剩余的SCN-物质的量大小关系为Ⅰ<Ⅱ<Ⅲ;从吸光度图可知,被氧化生成的浓度大小关系为I<Ⅱ<Ⅲ。Ⅰ中浓度和浓度均最小,颜色最浅,Ⅲ中浓度和Fe3+浓度均最大,颜色最深
解析:(1)①与表中数据对比知,该实验是为了排除在此条件下氧气氧化的可能性。②饱和氯水可将氧化为,与结合生成,使溶液变为浅红色。
(2)若是因为生成的浓度低,则继续滴加饱和氯水会使溶液颜色加深,反之则假设1不成立;结合已知信息知,氯水可将氧化为,检验用稀盐酸酸化的氯化钡溶液。
(3)①滴加溶液后发生反应:,溶液红色褪去,生成白色沉淀。②对比实验Ⅳ~Ⅶ的数据知,饱和氯水、稀硝酸、5%溶液都可以氧化,且反应后溶液消耗溶液的体积逐渐升高,故饱和氯水氧化能力最强,5%双氧水氧化能力最弱
——2024届高考化学高频题型专项训练
1.下列关于Na的化合物之间转化反应的离子方程式书写正确的是( )
A.碱转化为酸式盐:
B.碱转化为两种盐:
C.过氧化物转化为碱:
D.盐转化为另一种盐:
2.侯氏制碱法工艺流程如图所示。
下列说法不正确的是( )
A.饱和食盐水“吸氨”的目的是使“碳酸化”时产生更多的
B.煅烧时发生反应
C.“盐析”后溶液pH比“盐析”前溶液pH大
D.母液Ⅱ与母液Ⅰ所含粒子种类相同,但前者的浓度更大
3.部分含铁物质的分类与相应化合价的关系如图所示。下列推断合理的是( )
A.a可与少量反应生成f
B.可用溶液检验c溶液中含有的f
C.在高温条件下,a与水蒸气反应可实现a→b的转化
D.c在溶液中可以和大量共存
4.已知:普通铁+水蒸气铁的氧化物+氢气,铁的氧化物+氢气“引火铁”+水蒸气,“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如图。
关于上述装置和实验,下列分析错误的是( )
A.I中加入普通铁粉,G中可加入碱石灰
B.A中生成磁性氧化铁,E中生成“引火铁”
C.需要加热的仪器只有A、E
D.D用于收集氢气,F处的尾气需处理
5.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融制备金属镁
C.“氯化”过程中发生的反应为
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
6.以锌焙砂(主要成分为ZnO,含少量等离子)为原料制备的工艺流程如下:
下列说法错误的是( )
A.“浸取”过程为增大反应速率应适当加热,但温度不宜过高
B.“除杂”步骤也可选择或为沉淀剂,沉淀杂质离子
C.气体A为
D.“过滤3”所得滤液可循环使用,其主要成分的化学式是
7.一种利用玻璃窑炉替换下的锆废砖(主要成分为、、CaO等)提纯和的工艺流程如下。下列说法错误的是( )
A.“酸化”过程中加入的硫酸、硫酸铵可用硝酸、硝酸铵代替
B.滤渣1主要成分为
C.“中和1”调节pH范围为4~5.5的目的是沉淀锆离子
D.整个工艺过程中,硫酸铵可以实现循环利用
8.有A、B两个完全相同的装置,某学生在A的侧管中装入0.01 mol ,在B的侧管中装入0.01 mol ,并且A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入A、B中,下列叙述正确的是( )
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1
D.最终两试管中的物质的量一定相同
9.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。
(1)以食盐、石灰石、浓硫酸、焦炭为原料,经一系列操作可制得纯碱。
①食盐和浓硫酸加热反应的化学方程式为_______。
②硫酸钠和焦炭、石灰石高温下反应的化学方程式为_______(已知产物之一为CaS)。
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱。
①图1中的中间产物C是______,D是______(写化学式)。
②装置乙中发生反应的化学方程式为______。
(3)侯氏制碱法对氨碱法进行了改进,其优点是______。
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合图2的溶解度(S)随温度变化曲线,分析说明是否可行:______。
10.硫酸亚铁()是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配制溶液时为防正硫酸亚铁变质,常采用的措施是________(填一种)。
(2)以为原料可制备碱式硫酸铁[]、铁红、硫酸亚铁铵[,俗名摩尔盐],转化关系如图1所示。
①制备时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是_____。
②制备时,向溶液中加入过量的溶液,该反应的离子方程式为_____;铁红的化学式为_____。
③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、_____、洗涤、干燥得到产品。
(3)隔绝空气条件下,分解时的物质转化关系如图2。
①关于M的成分提出三种猜想:
猜想1:M是;
猜想2:M是______;
猜想3:M是和。
②已知三种气体的部分性质如表所示:
物质
熔点/℃ 16.8 -72.4 -210
沸点/℃ 44.8 -10 -195.8
利用图3装置探究硫酸亚铁部分分解产物。能否将低温浴槽A的温度控制在-72.4℃<44.8℃ ______(填“能”或“否”)。C中试剂可能是______。
11.碱式硫酸镁晶须[化学式为]是一种无机阻燃材料,其一种制备流程如图:
(1)“沉淀”是在50~60℃条件下进行的,适合的加热方式为______。
(2)“抽滤”在如图所示的装置中进行,装置X的作用是______。
(3)“洗涤”步骤中用无水乙醇洗涤的目的是______。
(4)以蛇纹石粉末(主要含MgO、FeO、等)为原料制备实验所需的溶液。请补充完整相应的实验方案:取一定量蛇纹石粉末,______,得到溶液。
已知:①该实验中pH=3.2时,完全沉淀;pH=8.5时,开始沉淀。②与溶液反应产生蓝色沉淀。
实验中可选用的试剂:1.0、1.0NaOH、3%粉末、溶液。
(5)通过下列方法测定碱式硫酸镁晶须化学式:
Ⅰ.准确称取1.8560g产品,溶于100.00mL0.5600HCl溶液,将所得溶液配成250.00mL溶液A;
Ⅱ.取25.00mL溶液A,调节溶液pH=10,用0.1000的标准溶液滴定其中的(离子方程式为),消耗EDTA标准溶液24.00mL;
Ⅲ.另取25.00mL溶液A,用0.0800NaOH标准溶液滴定至终点,消耗NaOH标准溶液20.00mL。
计算碱式硫酸镁晶须的化学式______。
12.某实验小组同学探究“氧化剂对KSCN检验的影响”,进行如下实验:
实验 试剂 现象
试管 滴管(各一滴)
2 mL 0.5溶液与1滴0.5KSCN溶液 饱和氯水 Ⅰ.溶液立即变为浅红色
稀硝酸 Ⅱ.溶液立即变为红色
5%溶液 Ⅲ.溶液立即变为深红色,无气体产生
已知:与可在溶液中大量共存;易被氧化为。
(1)向2 mL0.5溶液中滴加1滴0.5KSCN溶液,无明显现象,通入,无明显变化。
①该实验的目的是______。
②用离子方程式表示Ⅰ中出现浅红色的原因:______、______。
(2)对Ⅰ中溶液为浅红色的原因,甲同学提出以下假设。
假设1:加入氯水的量少,生成的浓度低
假设2:氯水氧化性强,氧化了部分
继续以下实验:
ⅰ.取Ⅰ中浅红色溶液,_____(填写实验操作),溶液浅红色消失,从而排除了假设1。
ⅱ.向2mL水中滴加1滴0.5KSCN溶液,滴加1滴饱和氯水,加入_____,产生白色沉淀。
(3)为验证实验Ⅰ、Ⅱ、Ⅲ中硫氰化钾的被氧化程度,进行以下探究实验。
已知:溶解度AgSCN(白色)
Ⅳ 实验Ⅰ中溶液 1.52
Ⅴ 实验Ⅱ中溶液 1.60
Ⅵ 实验Ⅲ中溶液 1.84
Ⅶ 2mL水与1滴溶液和1滴0.5KSCN溶液 2.40
①用化学用语表示滴加后溶液红色褪去的原因________。
②由Ⅳ~Ⅶ可以得出的结论是________。
(4)借助紫外可见分光光度计可以测定浓度。已知:体系的吸光度与浓度呈线性正相关。丙同学利用上述方法测定了实验Ⅰ、Ⅱ、Ⅲ体系的吸光度,数据如图所示。由上述实验可知,Ⅰ、Ⅱ、Ⅲ中溶液颜色分别呈现浅红色、红色和深红色的原因为________。
答案以及解析
1.答案:B
解析:A项题给离子方程式未配平且不是碱转化为酸式盐,A项错误;B项可视为向NaOH溶液中通入,离子方程式正确;过氧化物溶于水的离子方程式中,过氧化物应用化学式表示,C项错误;硅酸钠易溶于水,离子方程式中应用表示,D项错误。
2.答案:D
解析:氨气极易溶于水使溶液显碱性,饱和食盐水“吸氨”的目的是吸收更多二氧化碳,使“碳酸化”时产生更多的,A正确;碳酸氢钠受热分解为碳酸钠、水、二氧化碳,B正确;铵根离子水解生成氢离子使溶液显酸性,加入氯化钠“盐析”后溶液中铵根离子浓度减小,溶液酸性减弱,故“盐析”后溶液pH比“盐析”前溶液pH大,C正确;母液Ⅱ为加入氯化钠晶体,析出氯化铵后得到的,与母液Ⅰ所含粒子种类相同,但母液Ⅱ中碳酸氢根离子的浓度没有变大,故D错误。
3.答案:B
解析:Fe和反应只能生成,A错误;可用溶液检验溶液中含有的,B正确;在高温条件下,Fe与水蒸气反应得到,C错误;和在溶液中会发生相互促进的水解反应,不能大量共存,D错误。
4.答案:C
解析:根据上述分析可知,A正确;Fe和水蒸气反应生成磁性氧化铁,即四氧化三铁,结合上述分析可知,B正确;本实验中仪器B也需要加热,目的是提供水蒸气,C错误;D用于收集氢气,F处的尾气中含有,在室内达到一定浓度可能发生爆炸,所以尾气需要处理,D正确。
5.答案:D
解析:苦卤水中有,沉镁时加入生石灰,CaO与反应生成,与反应生成Mg(OH)2,A正确;是离子化合物,熔点不是很高,电解熔融时发生反应,B正确;煅烧生成MgO,“氯化”时加入C、,反应生成和CO,C正确;加热MgCl溶液会促进水解生成,最终得不到无水,D错误。
6.答案:B
解析:
7.答案:A
解析:若硫酸、硫酸铵用硝酸、硝酸铵代替,则反应过程中硝酸和CaO反应产生,不能使形成沉淀而除去,A错误;根据上述分析可知,滤渣1主要成分为,B正确;“中和1”调节pH范围为4~5.5的目的是使锆离子转化为沉淀,C正确;滤液2含硫酸铵和氨水,用硫酸酸化后可以返回“酸化”循环使用,故D正确。
8.答案:B
解析:碳酸氢钠和盐酸反应产生气体更快,所以A装置的气球膨胀速率小,A项错误;A、B中加入的和均为0.01 mol,根据知,若最终两气球体积相同,则氯化氢的物质的量大于或等于0.02mol,其浓度大于或等于2,若最终两气球体积不同,则其浓度小于2,B项正确、C项错误;和的物质的量相同,所以和中钠离子的物质的量不同,则最终两试管中Na+的物质的量一定不相同,D项错误。
9.答案:(1)①或;②或
(2)①;;②
(3)提高了食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物
(4)不可行;因为的溶解度较大,且在常温下与KCl的溶解度相差较小,当温度高于35℃时,的溶解度大于,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾
解析:(1)①食盐和浓硫酸反应可制取挥发性HCl。②和C在高温下反应,其中一种产物为CaS,说明该反应为氧化还原反应,C被氧化成CO或。
(2)①由图可知,甲中分解产生CaO和,则A为CaO,B为,丙中CaO与反应生成的C为,丁中与反应生成并产生,故D为。②乙中发生的反应为。
10.答案:(1)加适量铁粉
(2)①部分铁离子转化成;②;;③过滤
(3)①;②否;碱石灰
解析:(1)配制溶液时,硫酸亚铁变质的实质是被氧化,加适量铁粉可防止被氧化。
(2)①制备时,若pH过高,则部分铁离子转化为,导致碱式硫酸铁的产率偏低。②与亚铁离子反应生成碳酸亚铁、水和二氧化碳;铁红为。
(3)①分解时生成固体氧化物、和,部分S元素化合价降低,则Fe元素化合价升高,中Fe为+2价,所以固体氧化物可能是、或和。②图3装置设置两个低温浴槽的目的是利用物理方法将和分离,因此不能将低温浴槽A的温度设置在-72.4℃<44.8℃;C是尾气处理装置,可使用碱石灰吸收和。
11.答案:(1)50~60℃水浴加热
(2)安全瓶或防倒吸
(3)洗去晶体表面的水分,有利于后期快速干燥
(4)边搅拌边向其中加入一定量1.0,直至固体不再溶解,过滤;向滤液中滴加3%,直至向取出的少量溶液中滴加溶液不再出现蓝色沉淀时,向原滤液中分批加入粉末,搅拌并测定溶液pH,当测得pH介于3.2~8.5时,过滤
(5)
解析:(1)在50~60℃条件下进行,可选择易控制温度且加热均匀的水浴加热。
(3)乙醇易挥发,用无水乙醇洗去晶体表面的水分,有利于后期快速干燥。
(4)根据已知信息、实验目的及物质性质知,应先边搅拌边向蛇纹石粉末中加入一定量1.0,直至固体不再溶解,过滤(除去),向滤液中滴加3%(将氧化为,便于后续除铁),直至向取出的少量溶液中滴加溶液不再出现蓝色沉淀,向原滤液中分批加入粉末(调pH,沉淀),搅拌并测定溶液pH,当测得pH介于3.2~8.5时(使得全部转化为沉淀),过滤,即可得到硫酸镁溶液。
(5)由Ⅱ知,1.8560g产品中;由Ⅰ、Ⅲ知,1.8560g产品中;根据电荷守恒可知,;根据质量守恒知产品中。则,故碱式硫酸镁晶须的化学式为。
12.答案:(1)①排除在此条件下氧气氧化的可能性;②;
(2)继续滴加饱和氯水稀盐酸和氯化钡溶液
(3)①(或);②以上三种氧化剂都可以氧化,饱和氯水氧化能力最强,5%双氧水氧化能力最弱
(4)由实验Ⅳ、V、Ⅵ可知,氧化后,剩余的SCN-物质的量大小关系为Ⅰ<Ⅱ<Ⅲ;从吸光度图可知,被氧化生成的浓度大小关系为I<Ⅱ<Ⅲ。Ⅰ中浓度和浓度均最小,颜色最浅,Ⅲ中浓度和Fe3+浓度均最大,颜色最深
解析:(1)①与表中数据对比知,该实验是为了排除在此条件下氧气氧化的可能性。②饱和氯水可将氧化为,与结合生成,使溶液变为浅红色。
(2)若是因为生成的浓度低,则继续滴加饱和氯水会使溶液颜色加深,反之则假设1不成立;结合已知信息知,氯水可将氧化为,检验用稀盐酸酸化的氯化钡溶液。
(3)①滴加溶液后发生反应:,溶液红色褪去,生成白色沉淀。②对比实验Ⅳ~Ⅶ的数据知,饱和氯水、稀硝酸、5%溶液都可以氧化,且反应后溶液消耗溶液的体积逐渐升高,故饱和氯水氧化能力最强,5%双氧水氧化能力最弱
同课章节目录
