4.3.2 共价键 课件(共24张PPT含图片) 高中化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.2 共价键 课件(共24张PPT含图片) 高中化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 15:37:44 | ||
图片预览






文档简介
(共24张PPT)
第四章 物质结构 元素周期表
第三节 化学键
第2课时 共价键
共价键
环节一 宏微对比,感知共价键的存在
共价键
环节一 宏微对比,感知共价键的存在
共价键
环节二 证据推理,认识共价键的本质
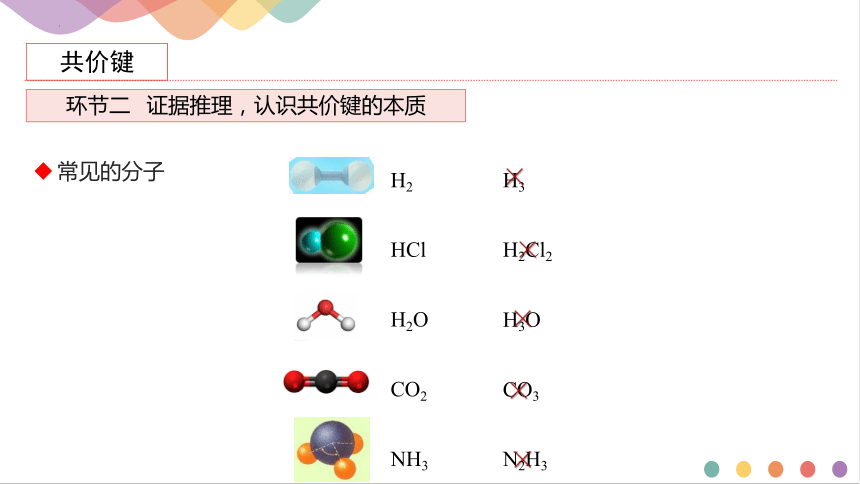
常见的分子
H2Cl2
H3O
H3
N2H3
CO3
×
×
×
×
×
CO2
HCl
NH3
H2
H2O
共价键
环节二 证据推理,认识共价键的本质
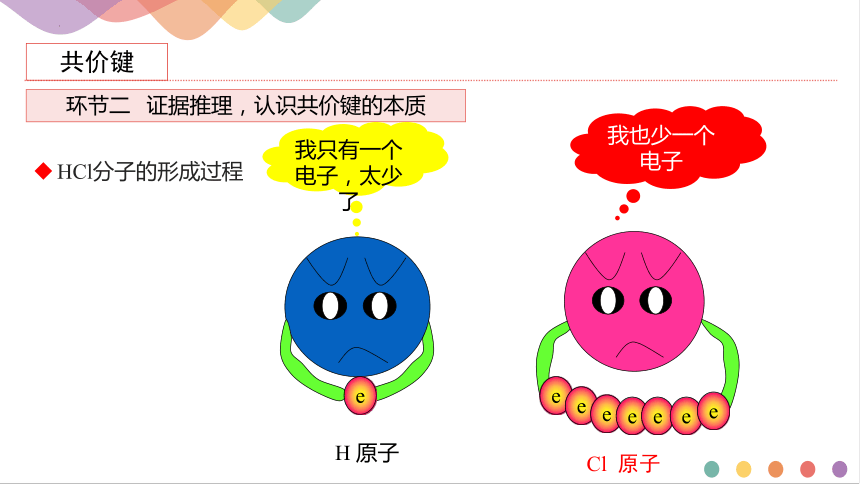
HCl分子的形成过程
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
e
e
e
e
e
e
e
共价键
环节二 证据推理,认识共价键的本质
HCl分子的形成过程
二位好!我有一个好办法.你们每人拿出一个电子共用,就像共同分享快乐一样共同拥有,行吗?
e
好的谢谢
e
e
e
e
e
e
e
好的谢谢
共价键
环节二 证据推理,认识共价键的本质
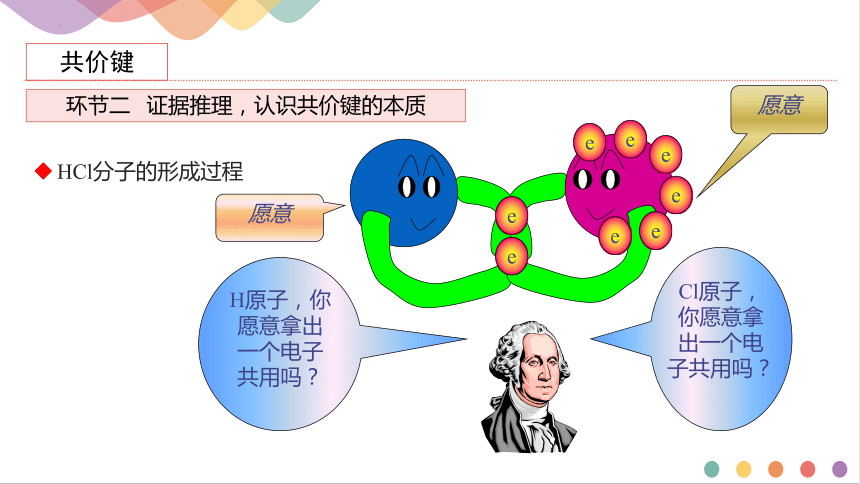
HCl分子的形成过程
愿意
愿意
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
e
e
e
e
e
e
e
e
共价键
环节二 证据推理,认识共价键的本质
共价键
1、定义:原子间通过共用电子对所形成的强烈的相互作用
2、成键粒子:
原子
3、成键作用力:
“共用电子对”与两原子核、内层电子的作用(吸引和排斥)
4、成键规律:
一般同种或不同种非金属元素之间、不活泼的金属与非金属之间
共价键
环节二 证据推理,认识共价键的本质
共价化合物
分子中直接相邻的原子间均以共价键相结合的化合物
(分子内只有共价键)
共价化合物
非金属氧化物、酸、弱碱、非金属氢化物、大多数有机物等。
类别
共价键
环节三 实践研究,感知共价键的破坏与生成
共价键及共价化合物的表征
共用电子对
氯化氢分子的形成:
··
· Cl
··
:
H ·
+
Cl
··
··
H
··
··
H—Cl
结构式
氢分子的形成:
H ·
· H
+
→
H H
··
H—H
→
H
··
H
电子对不偏移
电子对偏向Cl
共价键
环节三 实践研究,感知共价键的破坏与生成
共价键的分类
极性键
成键原子不显电性
一方显正电性,一方显负电性
非极性键
同种
元素
不同种元素
电子对有偏移
电子对没有偏移
共价键
类型
成键元素
成键特征
成键结果
共价键
环节三 实践研究,感知共价键的破坏与生成
单质的电子式与结构
分子 H2 N2 Cl2
电子式
结构式
N
N
—
—
—
N
N
H
H
H
—
H
Cl
Cl
Cl
Cl
—
共价键表征
共价键
化合物的电子式与结构
共价键表征
①NH3:________________________。
②CO2:_____________________________________
③H2O:_____________________________________
环节三 实践研究,感知共价键的破坏与生成
共价键
环节三 实践研究,感知共价键的破坏与生成
共价键表征
共价键
环节四 归纳总结,理解化学键
化学键
定义
相邻电子间强烈的相互作用叫做化学键。
形成类别
(1)原子间价电子的得失——离子键。
(2)原子间价电子的共用——共价键。
化学反应的本质
一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。
共价键
环节四 归纳总结,理解化学键
离子键 共价键 非极性键 极性键
概念 带 离子之间的相互作用 原子间通过 所形成的相互作用 成键粒子 ___________ ______ 成键实质 阴、阳离子的静电作用 共用电子对与成键原子间的静电作用 形成条件 活泼 与活泼 经电子得失形成离子键;或者铵根离子与酸根离子之间形成离子键 元素原子之间成键 元素原子之间成键
相反电荷
共用电子对
阴、阳离子
原子
金属
非金属
同种
不同种
共价键
环节四 归纳总结,理解化学键
离子化合物和共价化合物
项目 离子化合物 共价化合物
定义 含有 的化合物 只含有 的化合物
构成微粒 _________________________________ ___________________
化学键类型 一定含有 ,可能含有______ 只含有_______
离子键
共价键
阴、阳离子
原子
离子键
共价键
共价键
共价键
环节四 归纳总结,理解化学键
化学反应的实质
化学键先破后立的过程
Cl2+2H2 === 2HCl
点燃
化学键破坏
化学键形成
AgNO3 + NaCl = AgCl ↓ + NaNO3
离子键破坏
离子键形成
化学键
物质 原子 新物质
分解
重新组合
新键生成
旧键断裂
共价键
环节五 类比探究,感知分子间作用力的存在
1.在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
H2O(l) H2O(g)
能量
1mol H2O
H + H
O
断裂2mol H-O键,需要436KJ能量
2.将水分子分解为氢气和氧气需2000℃以上的高温,将1 mol H2O拆分为2 mol H和1 mol O需吸收能量436 kJ。
物理变化
化学变化
共价键
环节五 类比探究,感知分子间作用力的存在
分子间作用力
主要特征:
(1)概念:
①分子间作用力比化学键弱得多
②由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定
分子之间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力。
共价键
环节五 类比探究,感知分子间作用力的存在
分子间作用力
共价键
环节五 类比探究,感知分子间作用力的存在
分子间作用力
氢键:一种分子间作用力,比化学键弱,比范德华力强。
特征:使物质的熔点和沸点升高。
本节小结
谢谢观看!
第四章 物质结构 元素周期表
第三节 化学键
第2课时 共价键
共价键
环节一 宏微对比,感知共价键的存在
共价键
环节一 宏微对比,感知共价键的存在
共价键
环节二 证据推理,认识共价键的本质
常见的分子
H2Cl2
H3O
H3
N2H3
CO3
×
×
×
×
×
CO2
HCl
NH3
H2
H2O
共价键
环节二 证据推理,认识共价键的本质
HCl分子的形成过程
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
e
e
e
e
e
e
e
共价键
环节二 证据推理,认识共价键的本质
HCl分子的形成过程
二位好!我有一个好办法.你们每人拿出一个电子共用,就像共同分享快乐一样共同拥有,行吗?
e
好的谢谢
e
e
e
e
e
e
e
好的谢谢
共价键
环节二 证据推理,认识共价键的本质
HCl分子的形成过程
愿意
愿意
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
e
e
e
e
e
e
e
e
共价键
环节二 证据推理,认识共价键的本质
共价键
1、定义:原子间通过共用电子对所形成的强烈的相互作用
2、成键粒子:
原子
3、成键作用力:
“共用电子对”与两原子核、内层电子的作用(吸引和排斥)
4、成键规律:
一般同种或不同种非金属元素之间、不活泼的金属与非金属之间
共价键
环节二 证据推理,认识共价键的本质
共价化合物
分子中直接相邻的原子间均以共价键相结合的化合物
(分子内只有共价键)
共价化合物
非金属氧化物、酸、弱碱、非金属氢化物、大多数有机物等。
类别
共价键
环节三 实践研究,感知共价键的破坏与生成
共价键及共价化合物的表征
共用电子对
氯化氢分子的形成:
··
· Cl
··
:
H ·
+
Cl
··
··
H
··
··
H—Cl
结构式
氢分子的形成:
H ·
· H
+
→
H H
··
H—H
→
H
··
H
电子对不偏移
电子对偏向Cl
共价键
环节三 实践研究,感知共价键的破坏与生成
共价键的分类
极性键
成键原子不显电性
一方显正电性,一方显负电性
非极性键
同种
元素
不同种元素
电子对有偏移
电子对没有偏移
共价键
类型
成键元素
成键特征
成键结果
共价键
环节三 实践研究,感知共价键的破坏与生成
单质的电子式与结构
分子 H2 N2 Cl2
电子式
结构式
N
N
—
—
—
N
N
H
H
H
—
H
Cl
Cl
Cl
Cl
—
共价键表征
共价键
化合物的电子式与结构
共价键表征
①NH3:________________________。
②CO2:_____________________________________
③H2O:_____________________________________
环节三 实践研究,感知共价键的破坏与生成
共价键
环节三 实践研究,感知共价键的破坏与生成
共价键表征
共价键
环节四 归纳总结,理解化学键
化学键
定义
相邻电子间强烈的相互作用叫做化学键。
形成类别
(1)原子间价电子的得失——离子键。
(2)原子间价电子的共用——共价键。
化学反应的本质
一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。
共价键
环节四 归纳总结,理解化学键
离子键 共价键 非极性键 极性键
概念 带 离子之间的相互作用 原子间通过 所形成的相互作用 成键粒子 ___________ ______ 成键实质 阴、阳离子的静电作用 共用电子对与成键原子间的静电作用 形成条件 活泼 与活泼 经电子得失形成离子键;或者铵根离子与酸根离子之间形成离子键 元素原子之间成键 元素原子之间成键
相反电荷
共用电子对
阴、阳离子
原子
金属
非金属
同种
不同种
共价键
环节四 归纳总结,理解化学键
离子化合物和共价化合物
项目 离子化合物 共价化合物
定义 含有 的化合物 只含有 的化合物
构成微粒 _________________________________ ___________________
化学键类型 一定含有 ,可能含有______ 只含有_______
离子键
共价键
阴、阳离子
原子
离子键
共价键
共价键
共价键
环节四 归纳总结,理解化学键
化学反应的实质
化学键先破后立的过程
Cl2+2H2 === 2HCl
点燃
化学键破坏
化学键形成
AgNO3 + NaCl = AgCl ↓ + NaNO3
离子键破坏
离子键形成
化学键
物质 原子 新物质
分解
重新组合
新键生成
旧键断裂
共价键
环节五 类比探究,感知分子间作用力的存在
1.在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
H2O(l) H2O(g)
能量
1mol H2O
H + H
O
断裂2mol H-O键,需要436KJ能量
2.将水分子分解为氢气和氧气需2000℃以上的高温,将1 mol H2O拆分为2 mol H和1 mol O需吸收能量436 kJ。
物理变化
化学变化
共价键
环节五 类比探究,感知分子间作用力的存在
分子间作用力
主要特征:
(1)概念:
①分子间作用力比化学键弱得多
②由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定
分子之间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力。
共价键
环节五 类比探究,感知分子间作用力的存在
分子间作用力
共价键
环节五 类比探究,感知分子间作用力的存在
分子间作用力
氢键:一种分子间作用力,比化学键弱,比范德华力强。
特征:使物质的熔点和沸点升高。
本节小结
谢谢观看!
