化学人教版(2019)必修第一册4.3.2共价键(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.2共价键(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 17:54:41 | ||
图片预览





文档简介
(共19张PPT)
第四章章 物质结构 元素周期律
第三节 化学键
课时2 共价键
课标解读 重点难点
1.结合典型物质实例认识共价键的形成,能用电子式表示共价单质、共价化合物及形成过程,知道分子存在一定空间结构。 2.能从物质的构成微粒及相互作用角度说明物质性质的共性、差异及其原因,解释同类质性质变化的规律。 1.了解共价键、极性键、非极性键的概念,会用电子式表示共价键的形成过程 (重、难点)。
2.会识别判断共价化合物,熟知分子结构的不同表示方法(难点)。
教学目标及重难点分析
贝采里乌斯提出了电化二元学说,为离子键理论的发展奠定了基础。
范霍夫提出了甲烷的四面体假说
路易斯提出了共价键电子对理论
探索微粒间结合方式的百年发展史
19世纪初
19世纪70年代
20世纪20年代
贝采里乌斯(瑞典)
范托夫(荷兰)
路易斯(美国)
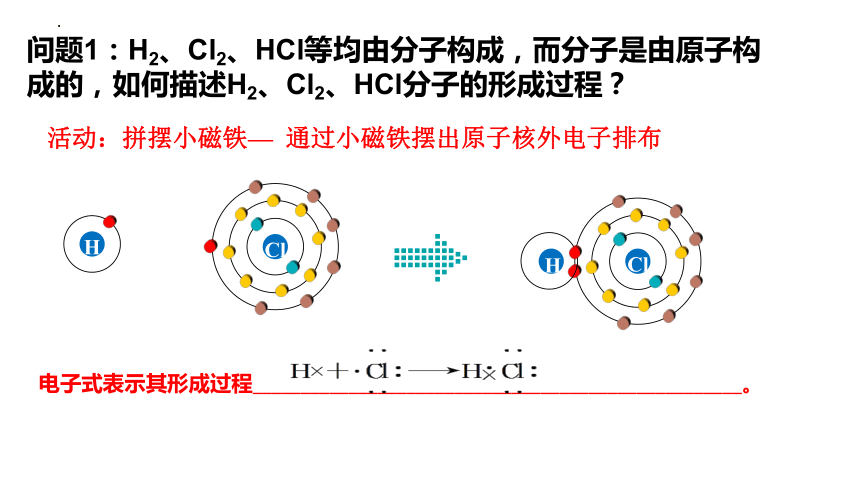
问题1:H2、Cl2、HCl等均由分子构成,而分子是由原子构成的,如何描述H2、Cl2、HCl分子的形成过程?
H
Cl
Cl
H
电子式表示其形成过程___________________________________________________。
活动:拼摆小磁铁— 通过小磁铁摆出原子核外电子排布
问题2 为什么要形成具有稀有气体原子的电子层结构?
路易斯是共价键理论的提出者。1923年在“原子与分子”一文中,他首次提出双中心双电子成键的假设,指出2个或多个原子可以通过共用一对电子或多对电子形成具有稀有气体原子一样的电子层结构,而形成稳定结构的分子。
路易斯(美国)
——传统的共价键理论
1.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
2.成键微粒:原子
3.相互作用:共用电子对(静电作用)
4.成键元素:同种或不同种非金属元素,(稀有气体元素除外)。
(特殊:AlCl3中存在共价键)
环节一、共价键
5.成键原因:通过共用电子对,各原子最外层电子数目达到稳定结构,体系的总能量降低。
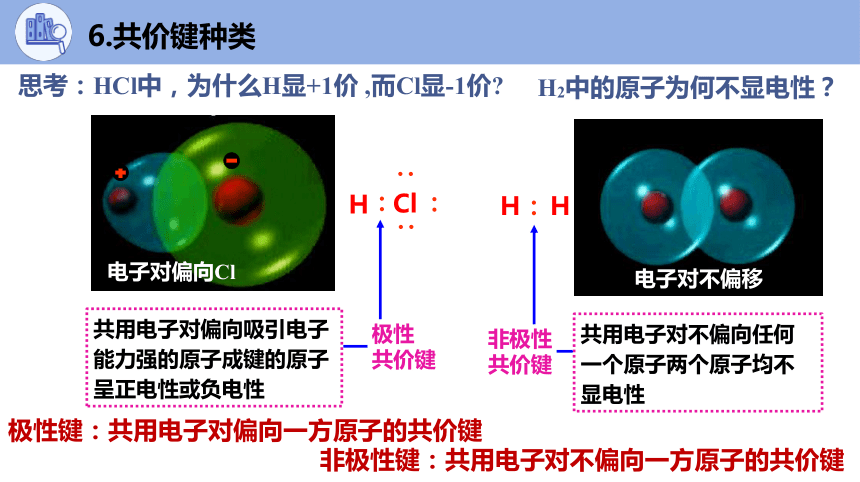
思考:HCl中,为什么H显+1价 ,而Cl显-1价
极性键:共用电子对偏向一方原子的共价键
H2中的原子为何不显电性?
非极性键:共用电子对不偏向一方原子的共价键
6.共价键种类
H H
··
电子对不偏移
共用电子对不偏向任何一个原子两个原子均不显电性
非极性共价键
Cl
··
··
H
··
··
电子对偏向Cl
共用电子对偏向吸引电子能力强的原子成键的原子呈正电性或负电性
极性
共价键
练习1:下列分子中,哪些是以极性键结合的,哪些是以非极性键结合的?
(1)F2 (2)O2 (3)NH3 (4)CH4 (5)SO2
非极性键
非极性键
极性键
极性键
极性键
共价键种类
极性键
成键原子不显电性
一方显正电性,一方显负电性
非极性键
同种元素
不同种元素
电子对有偏移
电子对没有偏移
共价键
类型
成键元素
成键特征
成键结果
7、存在:
①共价化合物:只含有共价键的化合物
②非金属单质(除稀有气体外)。例:H 、N2、O2、F2、Cl2
③含有原子团的离子化合物中。例:NaOH、NHCl4、Na2O2、MgSO4
思考:哪些常见物质中含有共价键?举例说明。
辨 析
1、含有共价键的一定是共价化合物。
2、共价化合物只含有共价键。
3、离子化合物只含有离子键。
4、共价化合物一定是由非金属元素组成的。
5、由非金属元素组成的一定是共价化合物。
NaOH
Cl2
NaOH
AICl3
NHCl4
Cl2
注意:
①共价化合物中一定不含离子键,而离子化合物中可能含有共价键(NaOH)。
②共价化合物中一定只含有共价键。
③金属与非金属也可形成共价化合物(AICI3)。
④均由非金属元素组成的化合物不一定是共价化合物(NHCI4、CI )。
练习2:下列哪些物质是离子化合物?哪些是共价化合物?
(1)MgCl2 (2)HBr
(3)NH4Cl (4)NH3
(5)H2O2 (6)CO2
(7)NaOH (8)Na2O2
(9)Na2CO3 (10)CH4
(11)AlCl3
离子化合物
离子化合物
共价化合物
共价化合物
共价化合物
离子化合物
离子化合物
离子化合物
共价化合物
共价化合物
共价化合物
三步骤
写出原子电子式
关注未成对的电子数
由未成对电子,确定共价键数
原子
价键
据各原子的电子式,组装电子式
不要漏写孤对电子
一价
二价
三价
四价
环节二、共价分子结构的表示方法——电子式
写出下列物质的电子式、结构式,总结电子式书写的方法
Cl2
N2
H2O
CO2
NH3
CH4
需要其他原子几个电子,就拿出几个电子来共用,共用部分放在二者之间
HClO
H2O2
环节二、共价分子结构的表示方法——电子式
共价分子结构的表示方式
分子 电子式 结构式 分子结构模型
H2
HCl
N2
CO2
H2O
CH4
NH3
分别用“-、═、≡”表示一对、二对和三对共用电子对
结构式:在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。
直线型
V形
正四面体
三角锥形
HCl
H2O
H2
NH3
CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
··
··
Cl
H
··
··
··
· O ·
··
H ·
+
· H
+
··
→
O
··
H
H
:
:
··
··
+
· O ·
··
+
:
C
:
· O ·
··
→
C
:
:
O
··
··
O
··
··
:
:
3H ·
+
:
· N
·
·
→
··
N
H
:
:
··
H
H
用电子式表示原子形成共价键
1. 关于共价键的说法正确的是 ( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
B
2. 下列各项中,能证明HCl是共价化合物的是( )
A. HCl极易溶于水 B. 液态HCl不能导电
C. HCl在水溶液中完全电离 D. HCl是无色有刺激性气味的气体
B
3. 写出下列物质的电子式。
①Na2O
②Na2O2
③NaOH
Na O H
[ ]
+
—
×
×
Na O O Na
[ ]
2-
+
+
×
×
Na O Na
[ ]
2-
+
+
×
×
④HClO
⑤H2O2
H O O H
×
×
H O Cl
×
×
×
×
×
×
×
×
②NH3
①CO2
· O ·
··
··
+
· O ·
··
+
C
··
×
×
×
×
3H
+
:
· N
·
·
×
4. 用电子式表示下列分子的形成过程。
5. 在下列物质中:
A.Na2O2 B.NaOH C.甲烷 D.氯化钡 E.氮气 F.NH3 G.CCl4 H.H2O2 I.NH4NO3
(1)只含离子键的物质是_____(填字母,下同);
(2)既有离子键又有共价键的物质是_____;
(3)只含极性键的物质是________;
(4)含非极性键的物质是_____。
D
ABI
CFG
EH
第四章章 物质结构 元素周期律
第三节 化学键
课时2 共价键
课标解读 重点难点
1.结合典型物质实例认识共价键的形成,能用电子式表示共价单质、共价化合物及形成过程,知道分子存在一定空间结构。 2.能从物质的构成微粒及相互作用角度说明物质性质的共性、差异及其原因,解释同类质性质变化的规律。 1.了解共价键、极性键、非极性键的概念,会用电子式表示共价键的形成过程 (重、难点)。
2.会识别判断共价化合物,熟知分子结构的不同表示方法(难点)。
教学目标及重难点分析
贝采里乌斯提出了电化二元学说,为离子键理论的发展奠定了基础。
范霍夫提出了甲烷的四面体假说
路易斯提出了共价键电子对理论
探索微粒间结合方式的百年发展史
19世纪初
19世纪70年代
20世纪20年代
贝采里乌斯(瑞典)
范托夫(荷兰)
路易斯(美国)
问题1:H2、Cl2、HCl等均由分子构成,而分子是由原子构成的,如何描述H2、Cl2、HCl分子的形成过程?
H
Cl
Cl
H
电子式表示其形成过程___________________________________________________。
活动:拼摆小磁铁— 通过小磁铁摆出原子核外电子排布
问题2 为什么要形成具有稀有气体原子的电子层结构?
路易斯是共价键理论的提出者。1923年在“原子与分子”一文中,他首次提出双中心双电子成键的假设,指出2个或多个原子可以通过共用一对电子或多对电子形成具有稀有气体原子一样的电子层结构,而形成稳定结构的分子。
路易斯(美国)
——传统的共价键理论
1.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
2.成键微粒:原子
3.相互作用:共用电子对(静电作用)
4.成键元素:同种或不同种非金属元素,(稀有气体元素除外)。
(特殊:AlCl3中存在共价键)
环节一、共价键
5.成键原因:通过共用电子对,各原子最外层电子数目达到稳定结构,体系的总能量降低。
思考:HCl中,为什么H显+1价 ,而Cl显-1价
极性键:共用电子对偏向一方原子的共价键
H2中的原子为何不显电性?
非极性键:共用电子对不偏向一方原子的共价键
6.共价键种类
H H
··
电子对不偏移
共用电子对不偏向任何一个原子两个原子均不显电性
非极性共价键
Cl
··
··
H
··
··
电子对偏向Cl
共用电子对偏向吸引电子能力强的原子成键的原子呈正电性或负电性
极性
共价键
练习1:下列分子中,哪些是以极性键结合的,哪些是以非极性键结合的?
(1)F2 (2)O2 (3)NH3 (4)CH4 (5)SO2
非极性键
非极性键
极性键
极性键
极性键
共价键种类
极性键
成键原子不显电性
一方显正电性,一方显负电性
非极性键
同种元素
不同种元素
电子对有偏移
电子对没有偏移
共价键
类型
成键元素
成键特征
成键结果
7、存在:
①共价化合物:只含有共价键的化合物
②非金属单质(除稀有气体外)。例:H 、N2、O2、F2、Cl2
③含有原子团的离子化合物中。例:NaOH、NHCl4、Na2O2、MgSO4
思考:哪些常见物质中含有共价键?举例说明。
辨 析
1、含有共价键的一定是共价化合物。
2、共价化合物只含有共价键。
3、离子化合物只含有离子键。
4、共价化合物一定是由非金属元素组成的。
5、由非金属元素组成的一定是共价化合物。
NaOH
Cl2
NaOH
AICl3
NHCl4
Cl2
注意:
①共价化合物中一定不含离子键,而离子化合物中可能含有共价键(NaOH)。
②共价化合物中一定只含有共价键。
③金属与非金属也可形成共价化合物(AICI3)。
④均由非金属元素组成的化合物不一定是共价化合物(NHCI4、CI )。
练习2:下列哪些物质是离子化合物?哪些是共价化合物?
(1)MgCl2 (2)HBr
(3)NH4Cl (4)NH3
(5)H2O2 (6)CO2
(7)NaOH (8)Na2O2
(9)Na2CO3 (10)CH4
(11)AlCl3
离子化合物
离子化合物
共价化合物
共价化合物
共价化合物
离子化合物
离子化合物
离子化合物
共价化合物
共价化合物
共价化合物
三步骤
写出原子电子式
关注未成对的电子数
由未成对电子,确定共价键数
原子
价键
据各原子的电子式,组装电子式
不要漏写孤对电子
一价
二价
三价
四价
环节二、共价分子结构的表示方法——电子式
写出下列物质的电子式、结构式,总结电子式书写的方法
Cl2
N2
H2O
CO2
NH3
CH4
需要其他原子几个电子,就拿出几个电子来共用,共用部分放在二者之间
HClO
H2O2
环节二、共价分子结构的表示方法——电子式
共价分子结构的表示方式
分子 电子式 结构式 分子结构模型
H2
HCl
N2
CO2
H2O
CH4
NH3
分别用“-、═、≡”表示一对、二对和三对共用电子对
结构式:在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。
直线型
V形
正四面体
三角锥形
HCl
H2O
H2
NH3
CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
··
··
Cl
H
··
··
··
· O ·
··
H ·
+
· H
+
··
→
O
··
H
H
:
:
··
··
+
· O ·
··
+
:
C
:
· O ·
··
→
C
:
:
O
··
··
O
··
··
:
:
3H ·
+
:
· N
·
·
→
··
N
H
:
:
··
H
H
用电子式表示原子形成共价键
1. 关于共价键的说法正确的是 ( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
B
2. 下列各项中,能证明HCl是共价化合物的是( )
A. HCl极易溶于水 B. 液态HCl不能导电
C. HCl在水溶液中完全电离 D. HCl是无色有刺激性气味的气体
B
3. 写出下列物质的电子式。
①Na2O
②Na2O2
③NaOH
Na O H
[ ]
+
—
×
×
Na O O Na
[ ]
2-
+
+
×
×
Na O Na
[ ]
2-
+
+
×
×
④HClO
⑤H2O2
H O O H
×
×
H O Cl
×
×
×
×
×
×
×
×
②NH3
①CO2
· O ·
··
··
+
· O ·
··
+
C
··
×
×
×
×
3H
+
:
· N
·
·
×
4. 用电子式表示下列分子的形成过程。
5. 在下列物质中:
A.Na2O2 B.NaOH C.甲烷 D.氯化钡 E.氮气 F.NH3 G.CCl4 H.H2O2 I.NH4NO3
(1)只含离子键的物质是_____(填字母,下同);
(2)既有离子键又有共价键的物质是_____;
(3)只含极性键的物质是________;
(4)含非极性键的物质是_____。
D
ABI
CFG
EH
