专题一化学用语与基本概念 选择题专攻2.氧化还原反应的概念、规律及应用(共43张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题一化学用语与基本概念 选择题专攻2.氧化还原反应的概念、规律及应用(共43张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:17:20 | ||
图片预览











文档简介
(共43张PPT)
2.氧化还原反应的概念、规律及应用
选择题专攻
核心精讲
01
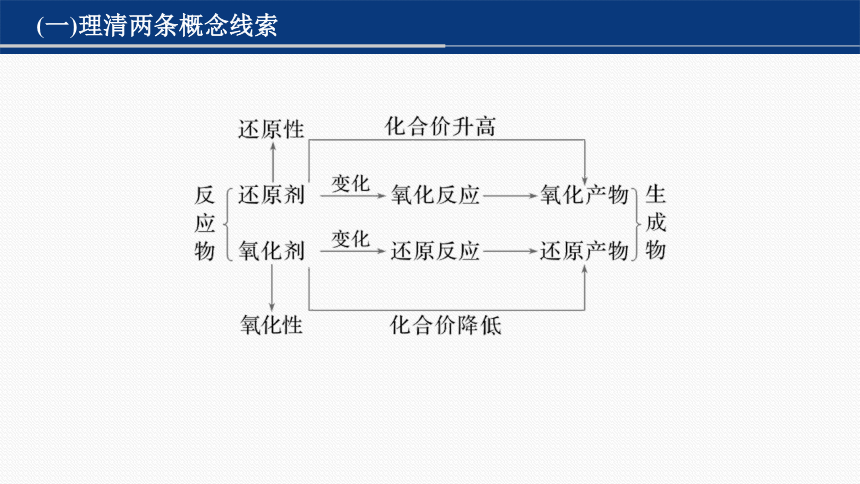
(一)理清两条概念线索
(二)氧化还原反应的规律
1.强弱律
氧化性:氧化剂>氧化产物。
还原性:还原剂>还原产物。
应用示例
(1)已知下列反应:
①Co2O3+6HCl===2CoCl2+Cl2↑+3H2O,
②2FeCl2+Cl2===2FeCl3。
则Co2O3、Fe3+、Cl2的氧化性强弱顺序为__________________。
Co2O3>Cl2>Fe3+
(2)写出证明氧化性、还原性强弱的离子方程式。
①氧化性强弱顺序:KMnO4>Cl2>Br2>Fe3+>Cu2+。
a.KMnO4>Cl2:_____________________________________________。
b.Cl2>Br2:_______________________。
c.Br2>Fe3+:___________________________。
d.Fe3+>Cu2+:__________________________。
+16H++10Cl-===2Mn2++5Cl2↑+8H2O
Cl2+2Br-===2Cl-+Br2
2Fe2++Br2===2Fe3++2Br-
2Fe3++Cu===2Fe2++Cu2+
②还原性强弱顺序:SO2>I->Fe2+>Br->Cl-。
a.SO2>I-:__________________________________。
b.I->Fe2+:________________________。
c.Fe2+>Br-:___________________________。
d.Br->Cl-:________________________。
I2+SO2+2H2O===2I-+4H++
2I-+2Fe3+===I2+2Fe2+
Br2+2Fe2+===2Fe3++2Br-
Cl2+2Br-===Br2+2Cl-
2.价态律
判断氧化还原反应的产物,同种元素不同价态之间发生反应“只靠拢,不交叉”。
应用示例
(1)用“双线桥”标出下列反应的电子转移方向和数目。
H2S+H2SO4(浓)===S↓+SO2↑+2H2O
答案
(2)在KClO3+6HCl===3Cl2↑+KCl+3H2O中氧化产物和还原产物的质量之比为_______。
5∶1
3.先后律
Ⅰ.同时含有几种还原剂 按还原性由强到弱依次反应。
Ⅱ.同时含有几种氧化剂 按氧化性由强到弱依次反应。
应用示例
(1)向FeI2溶液中逐滴滴入氯水,按反应发生的先后顺序,依次写出离子方程式:_______________________________________________。
2I-+Cl2===I2+2Cl-、2Fe2++Cl2===2Fe3++2Cl-
(2)向含有Fe3+、H+的溶液中,逐渐加入铁粉,按反应的先后顺序,依次写出离子方程式:__________________________________________。
2Fe3++Fe===3Fe2+、Fe+2H+===H2↑+Fe2+
4.守恒律
在氧化还原反应中,遵循原子守恒、得失电子守恒及电荷守恒。用于(1)氧化还原反应方程式的配平。(2)氧化还原反应的相关计算。
应用示例
某实验小组测定产品中水合肼(N2H4·H2O)的含量,步骤如下:称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.300 0 mol·L-1的碘标准溶液滴定。实验测得消耗碘标准溶液的平均值为20.00 mL。
回答下列问题:
(1)写出水合肼和I2反应的化学方程式(已知水合肼被氧化为N2):_________________________________。
(2)产品中水合肼的质量分数为_______。
N2H4·H2O+2I2===N2↑+4HI+H2O
25%
真题演练
02
1
2
3
4
5
1.(2022·北京,6)下列物质混合后,因发生氧化还原反应使溶液pH减小的是
A.向NaHSO4溶液中加入少量BaCl2溶液,生成白色沉淀
B.向NaOH和Fe(OH)2的悬浊液中通入空气,生成红褐色沉淀
C.向NaHCO3溶液中加入少量CuSO4溶液,生成蓝绿色沉淀[Cu2(OH)2CO3]
D.向H2S溶液中通入氯气,生成黄色沉淀
√
6
1
2
3
4
5
向NaHSO4溶液中加入少量BaCl2溶液,实际参与反应的只有硫酸根离子和钡离子,忽略体积变化,H+的浓度不变,其pH不变,A不符合题意;
向NaOH和Fe(OH)2的悬浊液中通入空气,氢氧化亚铁被氧化成了红褐色的氢氧化铁,化学方程式为4Fe(OH)2+2H2O+O2===4Fe(OH)3,但该过程中消耗水,增大了氢氧根离子的浓度,pH会变大,B不符合题意;
6
1
2
3
4
5
向NaHCO3溶液中加入少量CuSO4溶液,生成蓝绿色沉淀[Cu2(OH)2CO3],其中元素的化合价没有发生变化,故没有发生氧化还原反应,C不符合题意;
向H2S溶液中通入氯气发生氧化还原反应生成HCl和单质硫沉淀,增大了H+的浓度,pH减小,D符合题意。
6
1
2
3
4
5
2.(2022·辽宁,6)镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是
A.褪色原因为I2被Fe还原
B.液体分层后,上层呈紫红色
C.镀锌铁钉比镀锡铁钉更易生锈
D.溶液恢复棕色的原因为I-被氧化
√
6
1
2
3
4
5
Zn比Fe活泼,更容易失去电子,还原性更强,先与I2发生氧化还原反应,故溶液褪色原因为I2被Zn还原,A项错误;
液体分层后,I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,B项错误;
若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,C项错误;
漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,溶液恢复棕色,D项正确。
6
1
2
3
4
5
3.(2023·浙江1月选考,6)关于反应2NH2OH+4Fe3+===N2O↑+4Fe2++4H++H2O,下列说法正确的是
A.生成1 mol N2O,转移4 mol电子
B.H2O是还原产物
C.NH2OH既是氧化剂又是还原剂
D.若设计成原电池,Fe2+为负极产物
√
6
由方程式可知,反应生成1 mol N2O,转移4 mol电子,故A正确;
由方程式可知,反应中氮元素的化合价升高被氧化,NH2OH是反应的还原剂,铁元素的化合价降低被还原,Fe3+是反应的氧化剂,故C错误;
若设计成原电池,Fe3+在正极得到电子发生还原反应生成Fe2+,Fe2+为正极产物,故D错误。
1
2
3
4
5
6
1
2
3
4
5
4.(2023·北京,12)离子化合物Na2O2和CaH2与水的反应分别为①2Na2O2+2H2O===4NaOH+O2↑;②CaH2+2H2O===Ca(OH)2+2H2↑。下列说法正确的是
A.Na2O2、CaH2中均有非极性共价键
B.①中水发生氧化反应,②中水发生还原反应
C.Na2O2中阴、阳离子个数比为1∶2,CaH2中阴、阳离子个数比为2∶1
D.当反应①和②中转移的电子数相同时,产生的O2和H2的物质的量相同
√
6
1
2
3
4
5
Na2O2中有离子键和非极性键,CaH2中只有离子键而不含非极性键,A错误;
①中水中H、O元素的化合价不发生变化,水不涉及氧化还原反应,②中水发生还原反应,B错误;
Na2O2由Na+和 组成,阴、阳离子个数比为1∶2,CaH2由Ca2+和H-组成,阴、阳离子个数比为2∶1,C正确;
①中每生成1个O2转移2个电子,②中每生成1个H2转移1个电子,转移电子数相同时,生成O2和H2的物质的量之比为1∶2,D错误。
6
1
2
3
4
5
5.(2023·湖南,10)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是
B.反应Ⅰ和Ⅱ中,元素As和S都被氧化
C.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<Ⅱ
D.反应Ⅰ和Ⅱ中,氧化1 mol As2S3转移的电子数之比为3∶7
√
6
1
2
3
4
5
的中心原子S形成的4个σ键的键长不一样,故其空间结构不是正四面体形,A错误;
As2S3中As的化合价为+3价,反应Ⅰ产物As2O3中As的化合价为+3价,故该过程中As没有被氧化,B错误;
6
1
2
3
4
5
由反应Ⅰ和Ⅱ的化学方程式可知,氧化1 mol As2S3时,两反应转移的电子分别为12 mol和28 mol,故转移的电子数之比为3∶7,D正确。
6
1
2
3
4
6.(2022·湖南,9)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的 转化为N2进入大气层,反应过程如图所示。
下列说法正确的是
√
6
5
1
2
3
4
6
5
1
2
3
4
5
6
考向预测
03
1
2
3
4
5
6
1.下列过程不涉及氧化还原反应的是
A.自然固氮 B.纯碱除油污
C.海水提溴 D.电解精炼铜
√
1
2
3
4
5
6
自然固氮是在自然状态下(非人工),使空气中游离态的氮转化为含氮化合物的过程,涉及氧化还原反应,A不符合题意;
纯碱除油污是利用纯碱水解后呈碱性,油污在碱性条件下发生水解反应而被除去,不涉及氧化还原反应,B符合题意;
海水提溴是通过一系列步骤把海水中的Br-氧化生成Br2的过程,涉及氧化还原反应,C不符合题意;
电解精炼铜时,用含Cu2+的溶液作电解质,粗铜作阳极,电极反应式为Cu-2e-===Cu2+,纯铜作阴极,电极反应式为Cu2++2e-===Cu,涉及氧化还原反应,D不符合题意。
1
2
3
4
5
6
2.下列颜色变化与氧化还原反应有关的是
A.无水硫酸铜遇水变为蓝色
B.金属铝放置在空气中失去光泽
C.澄清的石灰水遇到二氧化碳变浑浊
D.棕黄色的氯化铁溶液滴入沸水中变成红褐色
√
1
2
3
4
5
6
无水硫酸铜遇水变为蓝色是CuSO4变为了CuSO4·5H2O,元素化合价没有变化,与氧化还原反应无关,故A不符合题意;
金属铝放置在空气中失去光泽是铝表面生成氧化铝,Al元素化合价升高,是氧化还原反应,故B符合题意;
澄清的石灰水遇到二氧化碳变浑浊,是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,元素化合价没有变化,不是氧化还原反应,故C不符合题意;
棕黄色的氯化铁溶液滴入沸水中变成红褐色是氯化铁变为氢氧化铁,元素化合价没有变化,不是氧化还原反应,故D不符合题意。
1
2
3
4
5
6
3.下列变化中,与氧化还原反应无关的是
A.Na2S溶液滴入AgCl浊液中,沉淀由白色逐渐变为黑色
B.向K2Cr2O7酸性溶液中滴加乙醇,溶液由橙色变为绿色
C.光照新制的氯水,有气泡产生,黄绿色逐渐褪去
D.向FeSO4溶液中滴加NaOH溶液,生成白色沉淀后迅速变为灰绿色,最
后呈红褐色
√
1
2
3
4
5
6
Na2S溶液滴入AgCl浊液中,沉淀由白色逐渐变为黑色,反应原理为2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq),故与氧化还原反应无关,A符合题意;
向K2Cr2O7酸性溶液中滴加乙醇,溶液由橙色变为绿色,是由于K2Cr2O7酸性溶液将乙醇氧化为乙酸,自身变为Cr3+,元素的化合价发生改变,故与氧化还原反应有关,B不符合题意;
1
2
3
4
5
6
光照新制的氯水,有气泡产生,黄绿色逐渐褪去,是由于发生反应:Cl2+H2O HCl+HClO,2HClO 2HCl+O2↑,两反应均为氧化还原反应,C不符合题意;
向FeSO4溶液中滴加NaOH溶液,生成白色沉淀后迅速变为灰绿色,最后呈红褐色,反应原理为FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、4Fe(OH)2+2H2O+O2===4Fe(OH)3,故与氧化还原反应有关,D不符合题意。
1
2
3
4
5
6
4.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol 电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
√
1
2
3
4
5
6
分析反应前后各元素价态变化,可知NF3在反应中既是氧化剂又是还原剂,故A错误;
NF3→HNO3是被氧化的过程,NF3为还原剂,2NF3→2NO是被还原的过程,NF3是氧化剂,所以还原剂与氧化剂的物质的量之比为1∶2,故B错误;
生成1 mol HNO3转移2 mol 电子,所以生成0.2 mol HNO3转移0.4 mol电子,故C错误;
NF3与潮湿的空气中的水反应生成NO,NO与空气中的O2反应生成红棕色的NO2,故D正确。
1
2
3
4
5
6
5.固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图所示。下列叙述正确的是
A.转化过程中所涉及的元素均呈现了两种价态
B.反应①②③均为氧化还原反应
C.Li是催化剂,只有Li3N是中间产物
D.整个过程的总反应可表示为2N2+6H2O
4NH3+3O2
√
1
2
3
4
5
6
根据转化关系可知:在转化过程中H始终为+1
价,A错误;
反应②为Li3N+3H2O===NH3↑+3LiOH,该反
应过程中元素化合价不变,属于非氧化还原反
应,B错误;
Li是催化剂,Li3N和LiOH均是中间产物,C错误;
根据分析,整个过程的总反应为氮气和水反应生成氨气和氧气,可表示为2N2+6H2O 4NH3+3O2,D正确。
1
2
3
4
5
6
6.纯净物状态下的标准电极电势,可用来比较对应氧化剂的氧化性强弱,现有5组标准电极电势数据如表所示:
氧化还原电对(氧化型/还原型) 电极反应式 标准电极电势(φθ/V)
Fe3+/Fe2+ Fe3++e- Fe2+ 0.77
I2/I- I2+2e- 2I- 0.54
+6e-+14H+ 2Cr3++7H2O 1.36
Br2/Br- Br2(l)+2e- 2Br- 1.07
Sn4+/Sn2+ Sn4++2e- Sn2+ 0.151
1
2
3
4
5
6
下列分析不正确的是
A.氧化性: >Br2>Fe3+
B.往淀粉-KI溶液中滴加SnCl4溶液,溶液不变蓝
C.往含有KSCN的FeI2溶液中滴加少量溴水,溶液变红色
D.K2Cr2O7溶液与FeCl2溶液反应的离子方程式为 +6Fe2++14H+
===2Cr3++6Fe3++7H2O
√
1
2
3
4
5
6
标准电极电势越高,其中氧化剂的氧化性越强,氧化性: >
Br2>Fe3+,A项正确;
Sn4+的氧化性弱于I2,不能氧化I-得到I2,因此溶液不变蓝,B项正确;
I-的还原性大于Fe2+,当加入少量溴水时,溴水先氧化I-,溴水量不足,Fe2+不能被氧化为Fe3+,则滴加KSCN溶液不一定变红,C项错误;
本课结束
2.氧化还原反应的概念、规律及应用
选择题专攻
核心精讲
01
(一)理清两条概念线索
(二)氧化还原反应的规律
1.强弱律
氧化性:氧化剂>氧化产物。
还原性:还原剂>还原产物。
应用示例
(1)已知下列反应:
①Co2O3+6HCl===2CoCl2+Cl2↑+3H2O,
②2FeCl2+Cl2===2FeCl3。
则Co2O3、Fe3+、Cl2的氧化性强弱顺序为__________________。
Co2O3>Cl2>Fe3+
(2)写出证明氧化性、还原性强弱的离子方程式。
①氧化性强弱顺序:KMnO4>Cl2>Br2>Fe3+>Cu2+。
a.KMnO4>Cl2:_____________________________________________。
b.Cl2>Br2:_______________________。
c.Br2>Fe3+:___________________________。
d.Fe3+>Cu2+:__________________________。
+16H++10Cl-===2Mn2++5Cl2↑+8H2O
Cl2+2Br-===2Cl-+Br2
2Fe2++Br2===2Fe3++2Br-
2Fe3++Cu===2Fe2++Cu2+
②还原性强弱顺序:SO2>I->Fe2+>Br->Cl-。
a.SO2>I-:__________________________________。
b.I->Fe2+:________________________。
c.Fe2+>Br-:___________________________。
d.Br->Cl-:________________________。
I2+SO2+2H2O===2I-+4H++
2I-+2Fe3+===I2+2Fe2+
Br2+2Fe2+===2Fe3++2Br-
Cl2+2Br-===Br2+2Cl-
2.价态律
判断氧化还原反应的产物,同种元素不同价态之间发生反应“只靠拢,不交叉”。
应用示例
(1)用“双线桥”标出下列反应的电子转移方向和数目。
H2S+H2SO4(浓)===S↓+SO2↑+2H2O
答案
(2)在KClO3+6HCl===3Cl2↑+KCl+3H2O中氧化产物和还原产物的质量之比为_______。
5∶1
3.先后律
Ⅰ.同时含有几种还原剂 按还原性由强到弱依次反应。
Ⅱ.同时含有几种氧化剂 按氧化性由强到弱依次反应。
应用示例
(1)向FeI2溶液中逐滴滴入氯水,按反应发生的先后顺序,依次写出离子方程式:_______________________________________________。
2I-+Cl2===I2+2Cl-、2Fe2++Cl2===2Fe3++2Cl-
(2)向含有Fe3+、H+的溶液中,逐渐加入铁粉,按反应的先后顺序,依次写出离子方程式:__________________________________________。
2Fe3++Fe===3Fe2+、Fe+2H+===H2↑+Fe2+
4.守恒律
在氧化还原反应中,遵循原子守恒、得失电子守恒及电荷守恒。用于(1)氧化还原反应方程式的配平。(2)氧化还原反应的相关计算。
应用示例
某实验小组测定产品中水合肼(N2H4·H2O)的含量,步骤如下:称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.300 0 mol·L-1的碘标准溶液滴定。实验测得消耗碘标准溶液的平均值为20.00 mL。
回答下列问题:
(1)写出水合肼和I2反应的化学方程式(已知水合肼被氧化为N2):_________________________________。
(2)产品中水合肼的质量分数为_______。
N2H4·H2O+2I2===N2↑+4HI+H2O
25%
真题演练
02
1
2
3
4
5
1.(2022·北京,6)下列物质混合后,因发生氧化还原反应使溶液pH减小的是
A.向NaHSO4溶液中加入少量BaCl2溶液,生成白色沉淀
B.向NaOH和Fe(OH)2的悬浊液中通入空气,生成红褐色沉淀
C.向NaHCO3溶液中加入少量CuSO4溶液,生成蓝绿色沉淀[Cu2(OH)2CO3]
D.向H2S溶液中通入氯气,生成黄色沉淀
√
6
1
2
3
4
5
向NaHSO4溶液中加入少量BaCl2溶液,实际参与反应的只有硫酸根离子和钡离子,忽略体积变化,H+的浓度不变,其pH不变,A不符合题意;
向NaOH和Fe(OH)2的悬浊液中通入空气,氢氧化亚铁被氧化成了红褐色的氢氧化铁,化学方程式为4Fe(OH)2+2H2O+O2===4Fe(OH)3,但该过程中消耗水,增大了氢氧根离子的浓度,pH会变大,B不符合题意;
6
1
2
3
4
5
向NaHCO3溶液中加入少量CuSO4溶液,生成蓝绿色沉淀[Cu2(OH)2CO3],其中元素的化合价没有发生变化,故没有发生氧化还原反应,C不符合题意;
向H2S溶液中通入氯气发生氧化还原反应生成HCl和单质硫沉淀,增大了H+的浓度,pH减小,D符合题意。
6
1
2
3
4
5
2.(2022·辽宁,6)镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是
A.褪色原因为I2被Fe还原
B.液体分层后,上层呈紫红色
C.镀锌铁钉比镀锡铁钉更易生锈
D.溶液恢复棕色的原因为I-被氧化
√
6
1
2
3
4
5
Zn比Fe活泼,更容易失去电子,还原性更强,先与I2发生氧化还原反应,故溶液褪色原因为I2被Zn还原,A项错误;
液体分层后,I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,B项错误;
若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,C项错误;
漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,溶液恢复棕色,D项正确。
6
1
2
3
4
5
3.(2023·浙江1月选考,6)关于反应2NH2OH+4Fe3+===N2O↑+4Fe2++4H++H2O,下列说法正确的是
A.生成1 mol N2O,转移4 mol电子
B.H2O是还原产物
C.NH2OH既是氧化剂又是还原剂
D.若设计成原电池,Fe2+为负极产物
√
6
由方程式可知,反应生成1 mol N2O,转移4 mol电子,故A正确;
由方程式可知,反应中氮元素的化合价升高被氧化,NH2OH是反应的还原剂,铁元素的化合价降低被还原,Fe3+是反应的氧化剂,故C错误;
若设计成原电池,Fe3+在正极得到电子发生还原反应生成Fe2+,Fe2+为正极产物,故D错误。
1
2
3
4
5
6
1
2
3
4
5
4.(2023·北京,12)离子化合物Na2O2和CaH2与水的反应分别为①2Na2O2+2H2O===4NaOH+O2↑;②CaH2+2H2O===Ca(OH)2+2H2↑。下列说法正确的是
A.Na2O2、CaH2中均有非极性共价键
B.①中水发生氧化反应,②中水发生还原反应
C.Na2O2中阴、阳离子个数比为1∶2,CaH2中阴、阳离子个数比为2∶1
D.当反应①和②中转移的电子数相同时,产生的O2和H2的物质的量相同
√
6
1
2
3
4
5
Na2O2中有离子键和非极性键,CaH2中只有离子键而不含非极性键,A错误;
①中水中H、O元素的化合价不发生变化,水不涉及氧化还原反应,②中水发生还原反应,B错误;
Na2O2由Na+和 组成,阴、阳离子个数比为1∶2,CaH2由Ca2+和H-组成,阴、阳离子个数比为2∶1,C正确;
①中每生成1个O2转移2个电子,②中每生成1个H2转移1个电子,转移电子数相同时,生成O2和H2的物质的量之比为1∶2,D错误。
6
1
2
3
4
5
5.(2023·湖南,10)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是
B.反应Ⅰ和Ⅱ中,元素As和S都被氧化
C.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<Ⅱ
D.反应Ⅰ和Ⅱ中,氧化1 mol As2S3转移的电子数之比为3∶7
√
6
1
2
3
4
5
的中心原子S形成的4个σ键的键长不一样,故其空间结构不是正四面体形,A错误;
As2S3中As的化合价为+3价,反应Ⅰ产物As2O3中As的化合价为+3价,故该过程中As没有被氧化,B错误;
6
1
2
3
4
5
由反应Ⅰ和Ⅱ的化学方程式可知,氧化1 mol As2S3时,两反应转移的电子分别为12 mol和28 mol,故转移的电子数之比为3∶7,D正确。
6
1
2
3
4
6.(2022·湖南,9)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的 转化为N2进入大气层,反应过程如图所示。
下列说法正确的是
√
6
5
1
2
3
4
6
5
1
2
3
4
5
6
考向预测
03
1
2
3
4
5
6
1.下列过程不涉及氧化还原反应的是
A.自然固氮 B.纯碱除油污
C.海水提溴 D.电解精炼铜
√
1
2
3
4
5
6
自然固氮是在自然状态下(非人工),使空气中游离态的氮转化为含氮化合物的过程,涉及氧化还原反应,A不符合题意;
纯碱除油污是利用纯碱水解后呈碱性,油污在碱性条件下发生水解反应而被除去,不涉及氧化还原反应,B符合题意;
海水提溴是通过一系列步骤把海水中的Br-氧化生成Br2的过程,涉及氧化还原反应,C不符合题意;
电解精炼铜时,用含Cu2+的溶液作电解质,粗铜作阳极,电极反应式为Cu-2e-===Cu2+,纯铜作阴极,电极反应式为Cu2++2e-===Cu,涉及氧化还原反应,D不符合题意。
1
2
3
4
5
6
2.下列颜色变化与氧化还原反应有关的是
A.无水硫酸铜遇水变为蓝色
B.金属铝放置在空气中失去光泽
C.澄清的石灰水遇到二氧化碳变浑浊
D.棕黄色的氯化铁溶液滴入沸水中变成红褐色
√
1
2
3
4
5
6
无水硫酸铜遇水变为蓝色是CuSO4变为了CuSO4·5H2O,元素化合价没有变化,与氧化还原反应无关,故A不符合题意;
金属铝放置在空气中失去光泽是铝表面生成氧化铝,Al元素化合价升高,是氧化还原反应,故B符合题意;
澄清的石灰水遇到二氧化碳变浑浊,是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,元素化合价没有变化,不是氧化还原反应,故C不符合题意;
棕黄色的氯化铁溶液滴入沸水中变成红褐色是氯化铁变为氢氧化铁,元素化合价没有变化,不是氧化还原反应,故D不符合题意。
1
2
3
4
5
6
3.下列变化中,与氧化还原反应无关的是
A.Na2S溶液滴入AgCl浊液中,沉淀由白色逐渐变为黑色
B.向K2Cr2O7酸性溶液中滴加乙醇,溶液由橙色变为绿色
C.光照新制的氯水,有气泡产生,黄绿色逐渐褪去
D.向FeSO4溶液中滴加NaOH溶液,生成白色沉淀后迅速变为灰绿色,最
后呈红褐色
√
1
2
3
4
5
6
Na2S溶液滴入AgCl浊液中,沉淀由白色逐渐变为黑色,反应原理为2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq),故与氧化还原反应无关,A符合题意;
向K2Cr2O7酸性溶液中滴加乙醇,溶液由橙色变为绿色,是由于K2Cr2O7酸性溶液将乙醇氧化为乙酸,自身变为Cr3+,元素的化合价发生改变,故与氧化还原反应有关,B不符合题意;
1
2
3
4
5
6
光照新制的氯水,有气泡产生,黄绿色逐渐褪去,是由于发生反应:Cl2+H2O HCl+HClO,2HClO 2HCl+O2↑,两反应均为氧化还原反应,C不符合题意;
向FeSO4溶液中滴加NaOH溶液,生成白色沉淀后迅速变为灰绿色,最后呈红褐色,反应原理为FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、4Fe(OH)2+2H2O+O2===4Fe(OH)3,故与氧化还原反应有关,D不符合题意。
1
2
3
4
5
6
4.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol 电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
√
1
2
3
4
5
6
分析反应前后各元素价态变化,可知NF3在反应中既是氧化剂又是还原剂,故A错误;
NF3→HNO3是被氧化的过程,NF3为还原剂,2NF3→2NO是被还原的过程,NF3是氧化剂,所以还原剂与氧化剂的物质的量之比为1∶2,故B错误;
生成1 mol HNO3转移2 mol 电子,所以生成0.2 mol HNO3转移0.4 mol电子,故C错误;
NF3与潮湿的空气中的水反应生成NO,NO与空气中的O2反应生成红棕色的NO2,故D正确。
1
2
3
4
5
6
5.固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图所示。下列叙述正确的是
A.转化过程中所涉及的元素均呈现了两种价态
B.反应①②③均为氧化还原反应
C.Li是催化剂,只有Li3N是中间产物
D.整个过程的总反应可表示为2N2+6H2O
4NH3+3O2
√
1
2
3
4
5
6
根据转化关系可知:在转化过程中H始终为+1
价,A错误;
反应②为Li3N+3H2O===NH3↑+3LiOH,该反
应过程中元素化合价不变,属于非氧化还原反
应,B错误;
Li是催化剂,Li3N和LiOH均是中间产物,C错误;
根据分析,整个过程的总反应为氮气和水反应生成氨气和氧气,可表示为2N2+6H2O 4NH3+3O2,D正确。
1
2
3
4
5
6
6.纯净物状态下的标准电极电势,可用来比较对应氧化剂的氧化性强弱,现有5组标准电极电势数据如表所示:
氧化还原电对(氧化型/还原型) 电极反应式 标准电极电势(φθ/V)
Fe3+/Fe2+ Fe3++e- Fe2+ 0.77
I2/I- I2+2e- 2I- 0.54
+6e-+14H+ 2Cr3++7H2O 1.36
Br2/Br- Br2(l)+2e- 2Br- 1.07
Sn4+/Sn2+ Sn4++2e- Sn2+ 0.151
1
2
3
4
5
6
下列分析不正确的是
A.氧化性: >Br2>Fe3+
B.往淀粉-KI溶液中滴加SnCl4溶液,溶液不变蓝
C.往含有KSCN的FeI2溶液中滴加少量溴水,溶液变红色
D.K2Cr2O7溶液与FeCl2溶液反应的离子方程式为 +6Fe2++14H+
===2Cr3++6Fe3++7H2O
√
1
2
3
4
5
6
标准电极电势越高,其中氧化剂的氧化性越强,氧化性: >
Br2>Fe3+,A项正确;
Sn4+的氧化性弱于I2,不能氧化I-得到I2,因此溶液不变蓝,B项正确;
I-的还原性大于Fe2+,当加入少量溴水时,溴水先氧化I-,溴水量不足,Fe2+不能被氧化为Fe3+,则滴加KSCN溶液不一定变红,C项错误;
本课结束
同课章节目录
