专题一化学用语与基本概念 主观题突破 新情景下方程式的书写(共42张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题一化学用语与基本概念 主观题突破 新情景下方程式的书写(共42张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:22:58 | ||
图片预览









文档简介
(共42张PPT)
新情景下方程式的书写
主观题突破
核心精讲
01
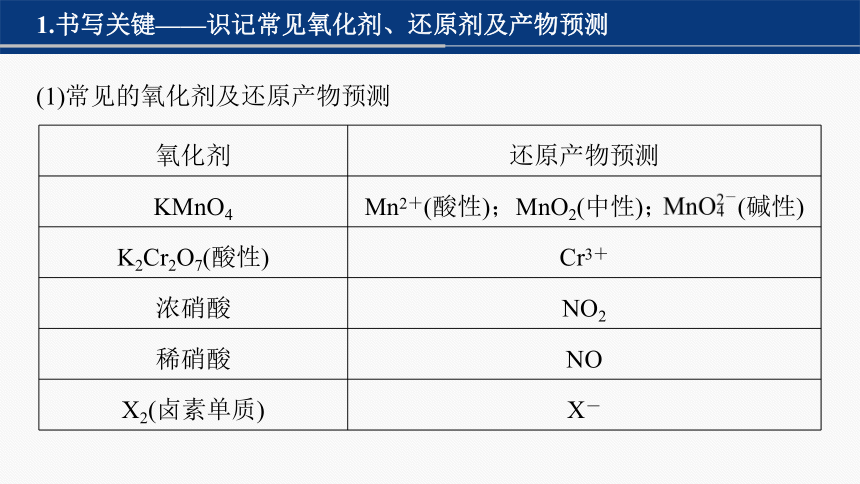
1.书写关键——识记常见氧化剂、还原剂及产物预测
(1)常见的氧化剂及还原产物预测
氧化剂 还原产物预测
KMnO4 Mn2+(酸性);MnO2(中性); (碱性)
K2Cr2O7(酸性) Cr3+
浓硝酸 NO2
稀硝酸 NO
X2(卤素单质) X-
氧化剂 还原产物预测
H2O2 OH-(碱性);H2O(酸性)
Na2O2 NaOH(或Na2CO3)
NaClO(或ClO-) Cl-、Cl2
NaClO3 Cl-、Cl2、ClO2
PbO2 Pb2+
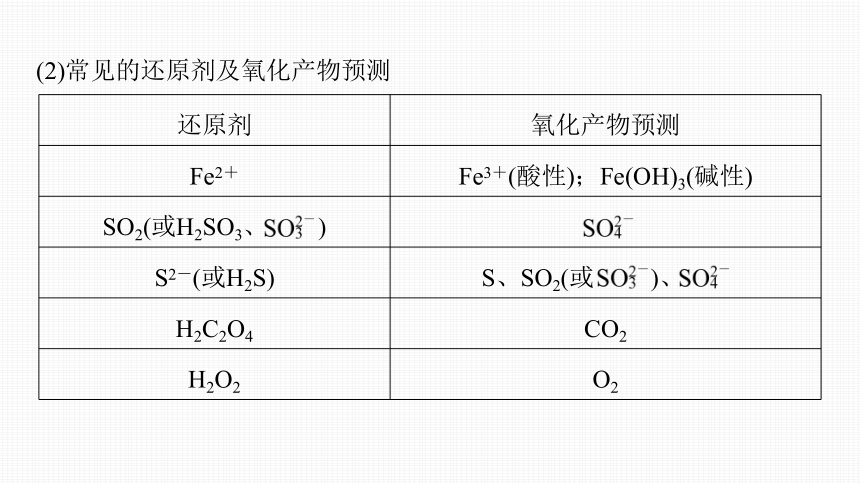
(2)常见的还原剂及氧化产物预测
还原剂 氧化产物预测
Fe2+ Fe3+(酸性);Fe(OH)3(碱性)
SO2(或H2SO3、 )
S2-(或H2S) S、SO2(或 )、
H2C2O4 CO2
H2O2 O2
还原剂 氧化产物预测
I-(或HI)
CO CO2
金属单质(Zn、 Fe、Cu等) Zn2+、Fe2+(与强氧化剂反应生成Fe3+)、Cu2+
2.书写方法
(1)氧化还原反应方程式的书写
(2)非氧化还原反应的书写
结合物质性质和实验反应判断产物。
真题演练
02
1
2
3
1.(1)[2022·全国甲卷,27(1)]工业上常用芒硝(Na2SO4·10H2O)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为______________
______________________________。
Na2SO4·10H2O
1
2
3
(2)[2022·广东,19(1)①]催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体,完成化学方程式:(NH4)2Cr2O7 Cr2O3+______+_______。
N2↑
4H2O
1
2
3
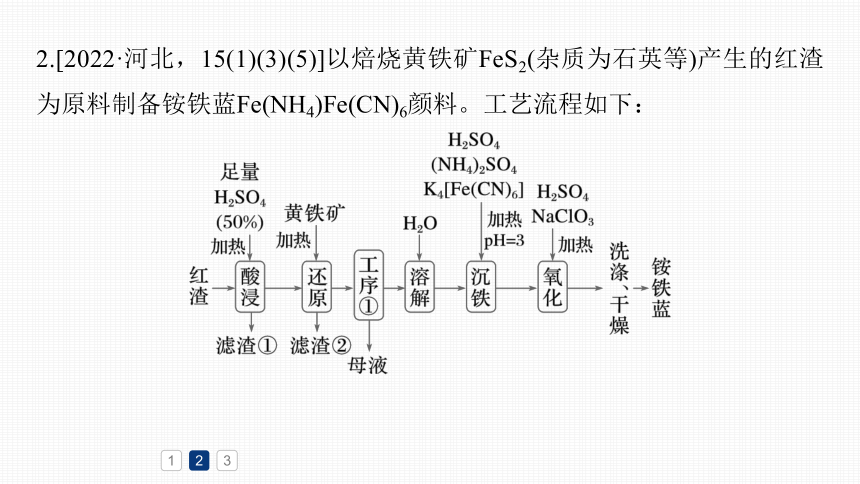
2.[2022·河北,15(1)(3)(5)]以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如下:
1
2
3
回答下列问题:
(1)红渣的主要成分为__________
(填化学式,下同),滤渣①的主
要成分为______。
(3)还原工序中,不生成S单质的
反应的化学方程式为___________
___________________________________。
Fe2O3和SiO2
SiO2
7Fe2(SO4)3
1
2
3
(5)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为_____,氧化工序发生反应的离子方程式为__________________________________
___________________________________。
+2
1
2
3
已知黄铁矿高温煅烧生成Fe2O3,反应为4FeS2+11O2 2Fe2O3+8SO2,故产生的红渣主要成分为Fe2O3和SiO2;
将红渣粉碎后加入足量的50%的H2SO4溶液加热,反应为Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,
过滤出滤渣①,主要成分为SiO2,向滤液中加入黄铁矿进行还原,将Fe3+还原为Fe2+,
1
2
3
然后进行工序①为蒸发浓缩、冷却结晶、过滤,得到FeSO4晶体和母液,
母液中主要含有FeSO4溶液和H2SO4,加水溶解FeSO4晶体,向所得溶液中加入(NH4)2SO4、K4[Fe(CN)6]并用H2SO4调节溶液的pH为3,进行沉铁,反应原理为Fe2++ +[Fe(CN)6]4-===Fe(NH4)2Fe(CN)6↓,
过滤、洗涤、干燥即制得Fe(NH4)Fe(CN)6,据此分析解题。
1
2
3
3.[2023·全国乙卷,27(1)(2)(4)(5)(6)]LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
已知:Ksp[Fe(OH)3]=2.8
×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
1
2
3
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为______________________________
_________。为提高溶矿速率,可采取的措施_______________________
____________(举1例)。
MnCO3+H2SO4===MnSO4+H2O
+CO2↑
粉碎菱锰矿(或搅拌、适当
升高温度等)
1
2
3
(2)加入少量MnO2的作用是__________________。不宜使用H2O2替代MnO2,原因是___________________________________。
将Fe2+氧化为Fe3+
Mn2+和生成的Fe3+可以催化H2O2分解
1
2
3
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有_____________。
BaSO4、NiS
加入少量BaS溶液除去Ni2+,此时溶液中发生反应的离子方程式为Ba2++S2-+Ni2++ ===BaSO4↓+NiS↓。
1
2
3
(5)在电解槽中,发生电解反应的离子方程式为______________________
________________。随着电解反应进行,为保持电解液成分稳定,应不断______。电解废液可在反应器中循环利用。
Mn2++2H2O H2↑
+MnO2↓+2H+
加水
在电解槽中,Mn2+发生反应生成MnO2,反应的离子方程式为Mn2++2H2O H2↑+MnO2↓+2H+;
该反应中消耗水生成H2SO4,需要加入水以保持电解液成分的稳定。
1
2
3
1
2
3
(6)煅烧窑中,生成LiMn2O4反应的化学方程式是______________________
________________________。
2Li2CO3+8MnO2
4LiMn2O4+2CO2↑+O2↑
考向预测
03
1
2
3
4
5
6
7
1.回答下列问题:
(1)将NH4HCO3、NH3·H2O溶液加入FeSO4溶液生成FeCO3沉淀,反应的离子方程式为_____________________________________________。
(2)Na2S2O4固体与过量H2O2溶液反应生成硫酸盐的离子方程式为
___________________________________。
(3)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________________________________。
(4)pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质,反应的离子方程式为___________________________________________。
1
2
3
4
5
6
7
(5)写出葡萄糖、MnO2、H2SO4反应生成MnSO4和CO2的化学方程式:______________________________________________________。
(6)用N2H4·H2O还原H2SeO3,反应生成一种气体单质和Se,该反应的化学方程式为_______________________________________。
(7)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。发生反应的化学方程式为________________________
______________。
C6H12O6+12MnO2+12H2SO4===12MnSO4+18H2O+6CO2↑
N2H4·H2O+H2SeO3===N2↑+Se↓+4H2O
2As2S3+5O2+6H2O===
4H3AsO4+6S
1
2
3
4
5
6
7
(8)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为________________________
_________________________________________________。
2FeS2+30NaClO3+
14H2SO4===30ClO2↑+Fe2(SO4)3+15Na2SO4+14H2O
1
2
3
4
5
6
7
2.以某混合氧化物(由MnO2、ZnO、CuO、Fe2O3组成)为原料制备KMnO4和FeSO4·7H2O的工艺流程如下:
已知:ZnO与Al2O3的化学性质相似。
1
2
3
4
5
6
7
回答下列问题:
(1)写出“酸浸”时,CuO反应的化学方程式:_________________
_____________。
(2)“去铜”时,除了生成CuCl外,
还有 、H+生成,该反应的离
子方程式为_______________________________________________。
CuO+H2SO4===
CuSO4+H2O
1
2
3
4
5
6
7
1
2
3
4
5
6
7
3.液晶显示器生产过程中产生大量的废玻璃粉末(除了含有SiO2外,还有CeO2、Fe2O3等物质),某同学以此粉末为原料回收铈的流程如图所示。已知:铈有+3、+4两种价态,CeO2具有强氧化性,与常见的无机酸不反应。
1
2
3
4
5
6
7
(1)步骤Ⅱ的离子方程式是________________________________________。
2CeO2+H2O2+6H+===2Ce3++4H2O+O2↑
固体A为SiO2、CeO2,稀硫酸、H2O2和CeO2反应生成Ce2(SO4)3、O2和H2O,离子方程式为6H++H2O2+2CeO2===2Ce3++O2↑+4H2O。
1
2
3
4
5
6
7
(2)步骤Ⅳ的化学方程式是________________________________________。
2Ce(OH)3+NaClO+H2O===2Ce(OH)4+NaCl
步骤Ⅳ加入NaClO将Ce从+3价氧化为+4价,得到Ce(OH)4,反应的化学方程式是2Ce(OH)3+NaClO+H2O===2Ce(OH)4+NaCl。
1
2
3
4
5
6
7
4.在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如图所示。290~500 ℃,发生反应的化学方程式为
________________________________。
1
2
3
4
5
6
7
从图中信息可知,加热前的反应物为Co(OH)2(0.930 g),其物质的量为0.01 mol,依据钴元素的质量不变可知:n(Co)=0.01 mol,m(Co)=0.590 g,
1
2
3
4
5
6
7
所以290~500 ℃过程中,Co2O3转化为Co3O4,反应过程中Co元素化合价降低,氧元素化合价升高并转化为O2,
1
2
3
4
5
6
7
5.草酸钙晶体(CaC2O4·H2O)在氮气氛围中的热重曲线示意图如下:
分别写出在①100~226 ℃、②346~420 ℃、③660~840 ℃的化学方程式。
1
2
3
4
5
6
7
①热重曲线中第一个平台在100 ℃以前为CaC2O4·H2O;
②在100~226 ℃之间第一次出现失重,失去质量占试样总质量的12.3%,相当于1 mol CaC2O4·H2O失去1 mol H2O,即第二个平台固体组成为CaC2O4;
③在346~420 ℃之间再次出现失重,失去的质量占试样总质量的19.2%,相当于1 mol CaC2O4分解出1 mol CO,即第三个平台固体的组成为CaCO3;
④在660~840 ℃之间出现第三次失重,失去的质量占试样总质量的30.1%,相当于1 mol CaCO3分解出1 mol CO2,即第四个平台固体组成为CaO。
1
2
3
4
5
6
7
6.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示。
则上述历程的总反应为___________________________________。
1
2
3
4
5
6
7
7.铑的配合物离子[Rh(CO)2I2]-
可催化甲醇羰基化,反应过程
如图所示。
回答下列问题:
(1)甲醇羰基化反应为_______
__________________。
(2)CH3OH+HI===__________。
CH3OH
+CO===CH3CO2H
CH3I+H2O
思维建模
对于“环式”反应过程图像,位于“环上”的物质一般是催化剂或中间体,如⑤、⑥、⑦和⑧,“入环”的物质为反应物,如①和④,“出环”的物质为生成物,如②和③。
本课结束
新情景下方程式的书写
主观题突破
核心精讲
01
1.书写关键——识记常见氧化剂、还原剂及产物预测
(1)常见的氧化剂及还原产物预测
氧化剂 还原产物预测
KMnO4 Mn2+(酸性);MnO2(中性); (碱性)
K2Cr2O7(酸性) Cr3+
浓硝酸 NO2
稀硝酸 NO
X2(卤素单质) X-
氧化剂 还原产物预测
H2O2 OH-(碱性);H2O(酸性)
Na2O2 NaOH(或Na2CO3)
NaClO(或ClO-) Cl-、Cl2
NaClO3 Cl-、Cl2、ClO2
PbO2 Pb2+
(2)常见的还原剂及氧化产物预测
还原剂 氧化产物预测
Fe2+ Fe3+(酸性);Fe(OH)3(碱性)
SO2(或H2SO3、 )
S2-(或H2S) S、SO2(或 )、
H2C2O4 CO2
H2O2 O2
还原剂 氧化产物预测
I-(或HI)
CO CO2
金属单质(Zn、 Fe、Cu等) Zn2+、Fe2+(与强氧化剂反应生成Fe3+)、Cu2+
2.书写方法
(1)氧化还原反应方程式的书写
(2)非氧化还原反应的书写
结合物质性质和实验反应判断产物。
真题演练
02
1
2
3
1.(1)[2022·全国甲卷,27(1)]工业上常用芒硝(Na2SO4·10H2O)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为______________
______________________________。
Na2SO4·10H2O
1
2
3
(2)[2022·广东,19(1)①]催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体,完成化学方程式:(NH4)2Cr2O7 Cr2O3+______+_______。
N2↑
4H2O
1
2
3
2.[2022·河北,15(1)(3)(5)]以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如下:
1
2
3
回答下列问题:
(1)红渣的主要成分为__________
(填化学式,下同),滤渣①的主
要成分为______。
(3)还原工序中,不生成S单质的
反应的化学方程式为___________
___________________________________。
Fe2O3和SiO2
SiO2
7Fe2(SO4)3
1
2
3
(5)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为_____,氧化工序发生反应的离子方程式为__________________________________
___________________________________。
+2
1
2
3
已知黄铁矿高温煅烧生成Fe2O3,反应为4FeS2+11O2 2Fe2O3+8SO2,故产生的红渣主要成分为Fe2O3和SiO2;
将红渣粉碎后加入足量的50%的H2SO4溶液加热,反应为Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,
过滤出滤渣①,主要成分为SiO2,向滤液中加入黄铁矿进行还原,将Fe3+还原为Fe2+,
1
2
3
然后进行工序①为蒸发浓缩、冷却结晶、过滤,得到FeSO4晶体和母液,
母液中主要含有FeSO4溶液和H2SO4,加水溶解FeSO4晶体,向所得溶液中加入(NH4)2SO4、K4[Fe(CN)6]并用H2SO4调节溶液的pH为3,进行沉铁,反应原理为Fe2++ +[Fe(CN)6]4-===Fe(NH4)2Fe(CN)6↓,
过滤、洗涤、干燥即制得Fe(NH4)Fe(CN)6,据此分析解题。
1
2
3
3.[2023·全国乙卷,27(1)(2)(4)(5)(6)]LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
已知:Ksp[Fe(OH)3]=2.8
×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
1
2
3
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为______________________________
_________。为提高溶矿速率,可采取的措施_______________________
____________(举1例)。
MnCO3+H2SO4===MnSO4+H2O
+CO2↑
粉碎菱锰矿(或搅拌、适当
升高温度等)
1
2
3
(2)加入少量MnO2的作用是__________________。不宜使用H2O2替代MnO2,原因是___________________________________。
将Fe2+氧化为Fe3+
Mn2+和生成的Fe3+可以催化H2O2分解
1
2
3
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有_____________。
BaSO4、NiS
加入少量BaS溶液除去Ni2+,此时溶液中发生反应的离子方程式为Ba2++S2-+Ni2++ ===BaSO4↓+NiS↓。
1
2
3
(5)在电解槽中,发生电解反应的离子方程式为______________________
________________。随着电解反应进行,为保持电解液成分稳定,应不断______。电解废液可在反应器中循环利用。
Mn2++2H2O H2↑
+MnO2↓+2H+
加水
在电解槽中,Mn2+发生反应生成MnO2,反应的离子方程式为Mn2++2H2O H2↑+MnO2↓+2H+;
该反应中消耗水生成H2SO4,需要加入水以保持电解液成分的稳定。
1
2
3
1
2
3
(6)煅烧窑中,生成LiMn2O4反应的化学方程式是______________________
________________________。
2Li2CO3+8MnO2
4LiMn2O4+2CO2↑+O2↑
考向预测
03
1
2
3
4
5
6
7
1.回答下列问题:
(1)将NH4HCO3、NH3·H2O溶液加入FeSO4溶液生成FeCO3沉淀,反应的离子方程式为_____________________________________________。
(2)Na2S2O4固体与过量H2O2溶液反应生成硫酸盐的离子方程式为
___________________________________。
(3)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________________________________。
(4)pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质,反应的离子方程式为___________________________________________。
1
2
3
4
5
6
7
(5)写出葡萄糖、MnO2、H2SO4反应生成MnSO4和CO2的化学方程式:______________________________________________________。
(6)用N2H4·H2O还原H2SeO3,反应生成一种气体单质和Se,该反应的化学方程式为_______________________________________。
(7)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。发生反应的化学方程式为________________________
______________。
C6H12O6+12MnO2+12H2SO4===12MnSO4+18H2O+6CO2↑
N2H4·H2O+H2SeO3===N2↑+Se↓+4H2O
2As2S3+5O2+6H2O===
4H3AsO4+6S
1
2
3
4
5
6
7
(8)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为________________________
_________________________________________________。
2FeS2+30NaClO3+
14H2SO4===30ClO2↑+Fe2(SO4)3+15Na2SO4+14H2O
1
2
3
4
5
6
7
2.以某混合氧化物(由MnO2、ZnO、CuO、Fe2O3组成)为原料制备KMnO4和FeSO4·7H2O的工艺流程如下:
已知:ZnO与Al2O3的化学性质相似。
1
2
3
4
5
6
7
回答下列问题:
(1)写出“酸浸”时,CuO反应的化学方程式:_________________
_____________。
(2)“去铜”时,除了生成CuCl外,
还有 、H+生成,该反应的离
子方程式为_______________________________________________。
CuO+H2SO4===
CuSO4+H2O
1
2
3
4
5
6
7
1
2
3
4
5
6
7
3.液晶显示器生产过程中产生大量的废玻璃粉末(除了含有SiO2外,还有CeO2、Fe2O3等物质),某同学以此粉末为原料回收铈的流程如图所示。已知:铈有+3、+4两种价态,CeO2具有强氧化性,与常见的无机酸不反应。
1
2
3
4
5
6
7
(1)步骤Ⅱ的离子方程式是________________________________________。
2CeO2+H2O2+6H+===2Ce3++4H2O+O2↑
固体A为SiO2、CeO2,稀硫酸、H2O2和CeO2反应生成Ce2(SO4)3、O2和H2O,离子方程式为6H++H2O2+2CeO2===2Ce3++O2↑+4H2O。
1
2
3
4
5
6
7
(2)步骤Ⅳ的化学方程式是________________________________________。
2Ce(OH)3+NaClO+H2O===2Ce(OH)4+NaCl
步骤Ⅳ加入NaClO将Ce从+3价氧化为+4价,得到Ce(OH)4,反应的化学方程式是2Ce(OH)3+NaClO+H2O===2Ce(OH)4+NaCl。
1
2
3
4
5
6
7
4.在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如图所示。290~500 ℃,发生反应的化学方程式为
________________________________。
1
2
3
4
5
6
7
从图中信息可知,加热前的反应物为Co(OH)2(0.930 g),其物质的量为0.01 mol,依据钴元素的质量不变可知:n(Co)=0.01 mol,m(Co)=0.590 g,
1
2
3
4
5
6
7
所以290~500 ℃过程中,Co2O3转化为Co3O4,反应过程中Co元素化合价降低,氧元素化合价升高并转化为O2,
1
2
3
4
5
6
7
5.草酸钙晶体(CaC2O4·H2O)在氮气氛围中的热重曲线示意图如下:
分别写出在①100~226 ℃、②346~420 ℃、③660~840 ℃的化学方程式。
1
2
3
4
5
6
7
①热重曲线中第一个平台在100 ℃以前为CaC2O4·H2O;
②在100~226 ℃之间第一次出现失重,失去质量占试样总质量的12.3%,相当于1 mol CaC2O4·H2O失去1 mol H2O,即第二个平台固体组成为CaC2O4;
③在346~420 ℃之间再次出现失重,失去的质量占试样总质量的19.2%,相当于1 mol CaC2O4分解出1 mol CO,即第三个平台固体的组成为CaCO3;
④在660~840 ℃之间出现第三次失重,失去的质量占试样总质量的30.1%,相当于1 mol CaCO3分解出1 mol CO2,即第四个平台固体组成为CaO。
1
2
3
4
5
6
7
6.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示。
则上述历程的总反应为___________________________________。
1
2
3
4
5
6
7
7.铑的配合物离子[Rh(CO)2I2]-
可催化甲醇羰基化,反应过程
如图所示。
回答下列问题:
(1)甲醇羰基化反应为_______
__________________。
(2)CH3OH+HI===__________。
CH3OH
+CO===CH3CO2H
CH3I+H2O
思维建模
对于“环式”反应过程图像,位于“环上”的物质一般是催化剂或中间体,如⑤、⑥、⑦和⑧,“入环”的物质为反应物,如①和④,“出环”的物质为生成物,如②和③。
本课结束
同课章节目录
